Conocer los cambios epidemiológicos y de abordaje diagnóstico y terapéutico de la infección urinaria neonatal en los últimos años.
Pacientes y métodosEstudio descriptivo retrospectivo de las infecciones del tracto urinario (ITU) en pacientes ingresados durante 11 años en nuestra unidad neonatal. Se realiza una comparación temporal, por grupo de microorganismos y por resultados en cistouretrografía miccional seriada (CUMS).
ResultadosSe estudiaron 106 casos (5 casos por cada 1.000 recién nacidos vivos [RNV]). Los microorganismos más frecuentemente aislados fueron Escherichia coli (81,1 %), Enterococcus faecalis (6,6 %) y Enterobacter cloacae (4,7 %). La gentamicina tuvo una sensibilidad global del 93,2%, seguida de la cefotaxima con el 91,3 % y de la amoxicilina-ácido clavulánico con el 89,5 %. No encontramos diferencias temporales por microorganismos ni por sensibilidades. Hemos encontrado diferencias en la proteína C reactiva (PCR), en la nitrituria y en la leucocituria en las ITU causadas por E. coli frente a no causadas por este microorganismo, así como en los patrones de sensibilidad antibiótica, ya que las infecciones por microorganismos que no eran E. coli eran más resistentes. No se encontraron diferencias por microorganismos en pacientes con CUMS normal y patológica. Encontramos alteraciones en la ecografía y en la CUMS en el 35,2 y en el 21,4 % de la serie, respectivamente.
ConclusionesLa ITU es un problema frecuente en nuestro medio. E. coli es el microorganismo más frecuentemente aislado. En las ITU no causadas por E. coli se produce una mayor resistencia a los tratamientos habituales, aunque en ellas no se detectan más datos patológicos en las pruebas de imagen. No encontramos aumento alguno de resistencias antibióticas a lo largo del estudio.
To find out the epidemiological and management changes of urinary tract infection over the last years.
Patients and methodsDescriptive retrospective review of patients with urinary tract infections (UTIs) admitted to our neonatal unit over an 11 year period. A temporal, microorganism group and voiding cystourethrography (VCUG) group comparison.
ResultsWe studied 106 cases (5 cases/1,000 alive newborns). The most commonly isolated microorganisms were Escherichia coli (81.1%), Enterococcus faecalis (6.6 %) and Enterobacter cloacae (4.7 %). Gentamicin had an overall sensitivity of 93.2 %, followed by cefotaxime 91.3 % and amoxicillin-clavulanic acid 89.5 %. We did not found temporal differences in microorganisms or sensitivities. We found differences in C reactive protein, nitrate and leucocyte values in E. coli versus non-E. coli UTIs, as well as patterns of antibiotic sensitivity with more resistances by non-E. coli microorganisms. No differences were found in patients with normal and pathological VCUG. We found ultrasound and VCGU disturbances in 35.2% and 21.4%, respectively.
ConclusionsUTI is a common problem in our area. The most frequently isolated microorganism is E. coli. Non-E. coli UTIs have more resistances to usual therapies, although these did not show any increase in disease in the imaging tests. We found no increase in resistances throughout the study.
La infección del tracto urinario (ITU) es un problema frecuente de la práctica clínica pediátrica y se encuentra actualmente en un momento de profunda revisión de algunos conceptos que hasta hace pocos años se suponían incontestables. La comunidad científica ha tomado conciencia de que muchas de las ideas adquiridas no se sustentaban en bases firmes y que era necesario efectuar cambios en ellas1–3.
En el período neonatal esta entidad tiene aún una mayor importancia porque se trata de una enfermedad potencialmente grave y que, por otra parte, puede relacionarse con la presencia de posibles malformaciones urológicas subyacentes4.
La distribución de la ITU neonatal por grupos de riesgo, las claves para su diagnóstico y los posibles estudios de seguimiento son temas muy controvertidos que no tienen todavía el consenso deseado5–8. Además de estas incertidumbres, los cambios en los microorganismos y en su sensibilidad a lo largo del tiempo, y las características del neonato como paciente, hacen que su tratamiento también genere discusiones y requiera un planteamiento diferente al de otros grupos de edad.
Por todos estos motivos, nos pareció interesante realizar un estudio retrospectivo y descriptivo de todos los pacientes con ITU ingresados en nuestra unidad neonatal en los últimos años con el fin de revisar los aspectos epidemiológicos, clínicos, diagnósticos y terapéuticos, y poder valorar los cambios aparecidos en la bacteriología y en la sensibilidad frente a los antibacterianos de los microorganismos implicados.
PACIENTES Y MÉTODOSSe realizó un estudio observacional, descriptivo y retrospectivo de todos los casos diagnosticados de ITU neonatal ingresados en el Servicio de Pediatría (Sección de Neonatología) del Hospital de Cabueñes durante el período comprendido entre 1996 y 2006.
El hospital en el que se realizó el trabajo es el único centro hospitalario con partos y atención pediátrica de la red sanitaria pública en el Área Sanitaria V del Servicio de Salud del Principado de Asturias (concejos de Gijón, Carreño y Villaviciosa). Dicha zona tiene una población aproximada de 300.000 habitantes, de los que 25.000 son niños menores de 14 años, con aproximadamente 2.000 recién nacidos al año. Dentro del servicio de pediatría, la unidad neonatal tiene 15 puestos, tres de ellos de cuidados intensivos médicos, sin puestos quirúrgicos.
El servicio de codificación del hospital realizó una búsqueda activa de casos con diagnóstico en el momento del alta de ITU en el período neonatal. Una vez obtenidos los listados se consideraron casos los pacientes recién nacidos de edades cronológicas posnatales comprendidas entre 0 y 30 días, o los niños prematuros con una edad corregida en dicho rango de edad que hubiesen presentado una ITU con cultivo bacteriano positivo (cualquier crecimiento bacteriano por punción vesical de más de 10.000 ufc/ml por sondaje vesical y más de 100.000 ufc/ml en bolsa (“recién lavado”)8 en el período 1996-2006.
Tras la selección de los casos se diseñó un protocolo de recogida de datos específicamente para el estudio en el que se incluyeron variables epidemiológicas, clínicas, diagnósticas, microbiológicas y de seguimiento. Se respetaron las recomendaciones éticas y de confidencialidad de los datos recomendadas en este tipo de estudios.
Para el análisis estadístico de los datos se utilizó el paquete estadístico SPSS con licencia de uso en nuestro centro. Se realizó un análisis descriptivo de todas las variables de la serie y posteriormente se llevaron a cabo comparaciones por grupos: dos grupos temporales (casos en el período 1-1-1996 a 30-6-2001 frente a casos en el período 1-7-2001 a 31-12-2006); dos grupos bacteriológicos (ITU por Escherichia coli frente a ITU por no E. coli), y dos grupos según la patología en estudios de imagen (cistouretrografía miccional seriada [CUMS) normal frente a CUMS patológica).
RESULTADOSDescripción de la serieDurante los 11 años del período de estudio nacieron en nuestro hospital 22.404 recién nacidos vivos (RNV) e ingresaron 5.400 recién nacidos en nuestra unidad neonatal por cualquier tipo de enfermedad. El número de casos ingresados y diagnosticados al alta como afectados por ITU fue de 106, lo que supone una frecuencia de 5 casos por cada 1.000 RNV y de 13,2 casos por cada 1.000 RNV de 36 semanas de edad gestacional o menos. Este número de casos supuso el 1,96 % de los ingresos en dicha franja de edad por cualquier enfermedad en nuestra unidad neonatal. En la tabla 1 se exponen las características epidemiológicas y clínicas de la serie. La edad media en el momento del diagnóstico fue de 15 días (intervalo de confianza [IC] del 95 %, 13-16), y 16 casos comenzaron en la primera semana de vida (cuatro en los primeros 3 días y uno en las primeras 24h). La demora media calculada entre el inicio de los síntomas y la instauración del tratamiento fue de 40h (IC 95 %, 31-49).
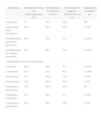
Características epidemiológicas y clínicas de la serie estudiada
| N.o de casos | 106 (100 %) |
| Sexo | |
| Varón (%) | 79,2 |
| Mujer (%) | 20,8 |
| Edad gestacional media (semanas) | 37 |
| Menores de 36 semanas (%) | 19,8 |
| Peso neonatal medio (g) | 2.980 |
| Menos de 1.500g (%) | 6 |
| De 1.500 a 2.000g (%) | 6 |
| De 2.000 a 2.500g (%) | 9 |
| De 2.500 a 4.000g (%) | 76 |
| Más de 4.000g (%) | 3 |
| Enfermedad renal detectada por ecografía intraútero (%) | 5,7 |
| Síntomas | |
| Fiebre (%) | 30,2 |
| Estancamiento ponderal (%) | 13,2 |
| Ictericia y vómitos (%) | 8,5 |
| Disminución de la ingestión (%) | 6,6 |
| Síntomas inespecíficos (%) | 33 |
Se realizó un hemograma en el momento del diagnóstico en 104 casos, en el que se detectó una cifra de leucocitos superior a 15.000μl en el 37,5 % y una cifra de neutrófilos superior a 10.000/03BCl en el 20,2 % de los casos. Entre los reactantes de fase aguda, la proteína C reactiva (PCR) fue medida en el momento del diagnóstico en 100 casos, con una media de 68,6mg/l, y un 41 % de ellos con cifras iniciales superiores a 30mg/dl.
La orina se recogió para realizar sistemático y sedimento en 91 casos (85,8 %). La nitrituria fue positiva en el 32,9 % de los casos analizados y la leucocituria fue positiva (dos o más cruces) en el 69,7 % de los casos valorados.
El método de recogida de orina para realizar urocultivo fue punción vesical en 90 casos, sondaje vesical en 12 casos y por bolsa (“recién lavado”) en 4 casos. En la tabla 2 se exponen los microorganismos aislados con mayor frecuencia: E. coli (81,1 %), seguido de Enterococcus faecalis (6,6 %) y de Enterobacter cloacae (4,7 %).
Distribución de los microorganismos aislados en los urinocultivos de la serie
| Total serie* (N = 111) n (%) | Primer período** (1996-2001) (N = 40) n (%) | Segundo período** (2001-2006) (N = 71) n (%) | |
| Escherichia coli | 86 (81,1) | 30 (75) | 56 (78,8) |
| Enterococcus faecalis | 7 (6,6) | 2 (5) | 5 (7,1) |
| Enterobacter cloacae | 5 (4,7) | 4 (10) | 1 (1,4) |
| Klebsiella pneumoniae | 3 (2,8) | 0 (0) | 3 (4,2) |
| Klebsiella oxytoca | 2 (1,9) | 0 (0) | 2 (2,8) |
| EGB | 2 (1,9) | 2 (5) | 0 (0) |
| Pseudomonas | 2 (1,9) | 1 (2,5) | 1 (1,4) |
| Enterococcus faecium | 1 (0,9) | 0 (0) | 1 (1,4) |
| Enterobacter spp. | 1 (0,9) | 1 (2,5) | 0 (0) |
| Serratia marcescens | 1 (0,9) | 0 (0) | 1 (1,4) |
| Staphylococcus epidermidis | 1 (0,9) | 0 (0) | 1 (1,4) |
EGB: Streptococcus agalactiae betahemolítico del grupo B.
En la valoración del antibiograma de los uropatógenos detectados se halló una sensibilidad global del 93,2 % a la gentamicina, del 91,3 % a la cefotaxima y del 89,5 % a amoxicilina-ácido clavulánico. El fármaco que presentó mayor resistencia fue la ampicilina, con una sensibilidad global del 41 %. En la tabla 3 se expone el espectro de sensibilidades antibióticas globales y por grupo de microorganismos.
Sensibilidades antibióticas de los distintos grupos de microorganismos
| Antibiótico | Sensibilidad a todos los microorganismos (%) | Sensibilidad a Escherichia coli (%) | Sensibilidad al grupo no Escherichia coli (%) | Significación estadística (p) |
| Ampicilina | 41 | 43,9 | 30,4 | NS |
| Amoxicilina-ácido clavulánico | 89,5 | 98,8 | 56,5 | < 0,05 |
| Cefalosporinas de primera generación | 69,3 | 78,8 | 33,3 | < 0,001 |
| Cefalosporinas de segunda generación | 84,5 | 96,3 | 38,1 | < 0,001 |
| Cefalosporinas de tercera generación | ||||
| Cefixima | 90,3 | 98,8 | 57,1 | < 0,001 |
| Cefotaxima | 91,3 | 97,6 | 66,7 | < 0,002 |
| Gentamicina | 93,2 | 97,6 | 76,2 | < 0,01 |
| Cotrimoxazol | 76,2 | 80,5 | 57,9 | < 0,03 |
| Ampicilina + gentamicina | 98,1 | 98,8 | 95,2 | NS |
| Ampicilina + cefotaxima | 96,1 | 98,8 | 85,7 | < 0,02 |
| Cefotaxima + gentamicina | 94,2 | 98,8 | 76,2 | < 0,01 |
NS: no significativo.
Se realizó punción lumbar en 75 casos (70,8 %), obteniéndose citoquímica patológica en 25 casos (el 23,6 % de las punciones realizadas). El cultivo de líquido cefalorraquídeo fue negativo en el 100 % de los casos estudiados.
El hemocultivo fue positivo en 18 de los 104 casos en los que se practicó. Los microorganismos aislados fueron E. coli en 12 casos (11,5 %), E. faecalis en 2 casos (1,9 %), Streptococcus agalactiae betahemolítico del grupo B (EGB) en 2 casos (1,9 %), Staphylococcus epidermidis en un caso (0,9 %) y E. cloacae en un caso (0,9 %). El microorganismo que creció en orina coincidió con el de sangre en 15 de los casos (el 83,3 % de los hemocultivos positivos), siendo en 12 casos E. coli y un caso de E. cloacae, EGB y E. faecalis, respectivamente.
El tratamiento empleado fue intravenoso en 102 casos, y se optó por administrar dos antibióticos asociados en 94 casos. La combinación más usada fue la ampicilina más cefotaxima, que se utilizó en 42 casos. Tras recibir el antibiograma fue preciso modificar el tratamiento totalmente en 14 casos, mientras que en 37 casos se modificó al menos uno de los fármacos empleados. La duración media del tratamiento fue de 9 días y la duración media del ingreso de 14 días.
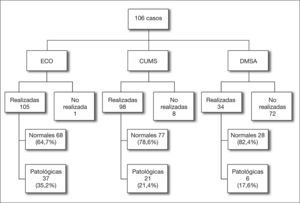
Las pruebas complementarias de imagen realizadas y los resultados obtenidos se exponen en la figura 1. La ecografía posnatal fue patológica en 37 casos y la CUMS detectó RVU en 21 casos, siendo siete reflujos de alto grado (IV y V). De los 21 casos con CUMS patológica, 14 tenían la ecografía alterada (seis correspondían a reflujos de alto grado) y en siete era normal.
De los 106 casos diagnosticados, 92 recibieron profilaxis posteriormente (82 con cotrimoxazol y 10 con trimetoprima). Diez casos fueron remitidos para su valoración quirúrgica, y dos de ellos fueron intervenidos.
Comparación por gruposComparación temporalEn el estudio se realizó una comparación temporal entre la primera mitad del estudio y la segunda parte de éste (5 años y medio cada uno). No encontramos diferencias en los microorganismos aislados en ambos períodos; E. coli es el más frecuente en cada uno de ellos (el 74,4 y el 80,6 % en el primer y en el segundo períodos), seguido por E. cloacae en el primer período y por E. faecalis en el segundo (tabla 2).
No encontramos diferencias en el espectro de sensibilidades y resistencias antibióticas; el fármaco más activo es la gentamicina (sensibilidades del 91,7 y del 94 %), seguida de cefotaxima (el 91,7 y el 91 %) y de amoxicilina-ácido clavulánico (el 84,2 y el 92,5 %). Las mayores resistencias registradas en ambos períodos fueron para la ampicilina (el 44,7 y el 38,8 %). La combinación farmacológica más activa en ambos períodos fue la de ampicilina más gentamicina (tabla 4). No se encontraron diferencias significativas en los signos patológicos hallados en las pruebas de imagen.
Comparación porcentual de las sensibilidades en ambos períodos del estudio
| Primer período (%) | Segundo período (%) | Significación estadística (p) | |
| Ampicilina | 44,7 | 38,8 | NS |
| Amoxicilina-ácido clavulánico | 84,2 | 92,5 | NS |
| Cefalosporinas | |||
| Primera generación | 58,3 | 75,4 | NS |
| Segunda generación | 83,3 | 85,5 | NS |
| Cefixima | 88,9 | 91 | NS |
| Cefotaxima | 91,7 | 91 | NS |
| Gentamicina | 91,7 | 94 | NS |
| Cotrimoxazol | 80 | 74,2 | NS |
| Ampicilina + gentamicina | 97,2 | 98,5 | NS |
| Ampicilina + cefotaxima | 97,2 | 95,5 | NS |
| Cefotaxima + gentamicina | 94,4 | 94 | NS |
Se establecieron dos grupos comparativos en función del microorganismo aislado: un grupo con todos los casos de E. coli (el 78,3 % de la serie) y otro con todos los microorganismos que no fueran E. coli (el 21,6 % de la serie).
No se encontraron diferencias significativas en los aspectos epidemiológicos clínicos ni en pruebas de imagen o de laboratorio en ambos grupos. Sólo se encontraron diferencias en la determinación de la PCR en el momento del diagnóstico (grupo E. coli 43mg/dl, frente a grupo no infectados por E. coli 15mg/dl; p < 0,001), la nitrituria (el 39,7 % positivos en infectados por E. coli frente al 5,9 % positivos en el grupo de no infectados por E. coli; p < 0,02) y presencia de leucocitos en orina (el 78,2 % en el grupo de infectados por E. coli frente al 35,2 % en el grupo de no infectados por E. coli; p < 0,01).
Analizando el espectro de sensibilidades de los fármacos, se comprobó que los microorganismos que no pertenecían al grupo de E. coli son más resistentes a todos los antibióticos analizados, salvo para la ampicilina, que presentó una alta resistencia en ambos grupos, así como para la combinación más activa de ampicilina más gentamicina (tabla 3).
Comparación según patología detectada en la CUMSDe los 98 casos en los que se realizó la CUMS se encontraron signos patológicos en 21 casos (siete con reflujo de alto grado); así, se establecieron dos grupos comparativos: CUMS patológica frente a CUMS no patológica.
No se encontraron diferencias en la edad media en el momento del diagnóstico, en el sexo o en la forma de presentación clínica. Asimismo, no encontramos diferencias estadísticamente significativas en los parámetros sanguíneos de laboratorio, ni en la nitrituria ni en la leucocituria.
No encontramos asociación alguna entre signos patológicos detectados en la CUMS y grupo bacteriológico (el 79,2 % de las CUMS normales y el 81 % de las CUMS patológicas se debían a infecciones por E. coli), ni globalmente ni al excluir los casos diagnosticados antes de los 7 días de vida.
DISCUSIÓNEste trabajo, retrospectivo y descriptivo, tiene las limitaciones propias de este tipo de diseño; no obstante, se beneficia de algunos aspectos, como son un largo tiempo de estudio (11 años), una población básica no seleccionada previamente, unos criterios más o menos homogéneos de tratamiento y del importante hecho de haberse realizado en un hospital de segundo nivel, sin que la selección de los microorganismos pueda deberse al ecosistema particular de los grandes centros de referencia.
Con estas premisas, las conclusiones más importantes del estudio que presentamos en esta publicación son la relativa alta frecuencia de la ITU neonatal en una población no seleccionada (5 casos por cada 1.000 RNV); la preponderancia de E. coli en todo el estudio (más del 80 % de los casos); la baja sensibilidad in vitro en el antibiograma de los microorganismos a la ampicilina aislada (41 %), pero su alta eficacia cuando se une a la gentamicina (98,1 %); la posibilidad de encontrar signos patológicos en la CUMS realizada después de la infección (el 21,4 % de cualquier tipo de reflujo, pero sólo el 7 % de reflujos de alto grado), y la falta de asociación de un microorganismo que no fuera E. coli en el urocultivo de un primer episodio de ITU neonatal con una CUMS patológica.
En nuestro estudio, la tasa de incidencia de ITU alcanzó 5 casos por 1.000 RNV, cifra intermedia entre las descritas por algunos autores (0,1-1 %)4,5,9. Esta cifra fue mucho mayor en nuestro grupo de recién nacidos prematuros (13,2 %), probablemente a causa de la inmadurez del sistema de defensa y por una posible iatrogenia inducida en su tratamiento.
Un aspecto que creemos interesante de nuestra serie fue la edad de los pacientes. Su edad media fue de 15 días, lo que concuerda con los datos descritos en la bibliografía médica, en la que se señala que la ITU es una enfermedad frecuente entre la segunda y la tercera semanas de vida5,9. No obstante, en nuestra casuística encontramos un hecho infrecuente, la presencia de 16 recién nacidos con ITU en la primera semana de vida, tres de 72h o menos y uno de 24h de vida. Estos hallazgos nos llevan a plantearnos la necesidad de realizar un urocultivo en todos los recién nacidos de menos de 72h de vida con características de sepsis, como parte del chequeo de infección neonatal9.
Uno de los temas más controvertidos en la ITU pediátrica es el método de recogida de la orina para cultivo10. En el período neonatal se considera que la punción vesical es la técnica de elección, debido a su esterilidad, y se considera significativo cualquier crecimiento bacteriano7. El sondaje o cateterismo vesical sería la segunda opción, porque con él se ha detectado un mayor riesgo de siembra infecciosa8. En nuestra serie se utilizó la punción en 90 casos, seguida de sondaje en 12 y de la bolsa en 4 casos. Estos últimos no fueron desechados de la serie por tratarse de bolsas recién puestas con paciente recién lavado, y con datos clínicos y analíticos altamente indicativos de ITU.
El agente etiológico aislado con mayor frecuencia fue E. coli (81,1 %), dato común a la totalidad de las publicaciones revisadas, aunque con tasas muy variables de unas a otras5,11–16. A E. coli le siguió en frecuencia E. faecalis, hecho a tener en cuenta dada la sensibilidad antibiótica peculiar de este último microorganismo, que le hace ser sensible a la ampicilina pero resistente a la gran mayoría del resto de los antibióticos intravenosos usados como primera línea de tratamiento en neonatología.
De los datos de sensibilidad y resistencias antibióticas de nuestra serie destacan algunos aspectos que merece la pena comentar. En general, la gentamicina fue el antibiótico que por sí solo obtuvo una mayor eficacia in vitro (el 93,2 % de forma global, el 97,6 % para E. coli y el 76,2 % para los microorganismos que no eran E. coli), seguido de la cefotaxima y de la cefixima. Sin embargo, la combinación de ampicilina más gentamicina fue la más eficaz tanto globalmente como para el grupo de sólo E. coli y para el grupo de microorganismos que no eran E. coli. Estos datos, además, se mantuvieron más o menos constantes en el tiempo, ya que aparecieron tanto en el primer período de tiempo estudiado como en el segundo, lo que los hace ser muy importantes a la hora de extraer conclusiones.
Otro tema controvertido en el tratamiento de las ITU neonatales es la necesidad de realizar pruebas de imagen, así como establecer qué pruebas deben hacerse y en qué pacientes5,7,17–21. En nuestro centro la ecografía fue el método más utilizado; en ella se observaron alteraciones en 37 casos (35,2 %) de los 105 casos realizados; le siguió la CUMS, que fue patológica en 21 casos (21,4 %) de los 98 realizados, aunque sólo siete presentaron RVU de alto grado (en seis de ellos ya se había visualizado una alteración por ecografía). Con estos datos, y dada la inocuidad de la ecografía, seguimos apoyando su utilidad. Éste no es el caso de la CUMS, con la que no existe consenso; así algunos autores21 hablan de su utilidad en niños con ITU neonatal, mientras que otros2, poniendo en entredicho el denominado paradigma reflujocéntrico, no recomiendan su uso como prueba de primer nivel. En la misma línea se encuentra una de las últimas propuestas de actuación en la que se habla de restringir el uso de pruebas de imagen a pacientes de riesgo, y que las pruebas a realizar sean elegidas en función de la edad y de los hallazgos ecográficos22,23.
Por otra parte, la idea de que existe una mayor frecuencia de signos patológicos encontrados en la CUMS entre los niños con ITU neonatal por microorganismos diferentes a E. coli4,17,24–26 no se corrobora en nuestros resultados. No hemos encontrado diferencias en cuanto a la frecuencia de afecciones subyacentes entre el grupo de infectados por E. coli y el grupo de infectados por otros mircroorganismos que no fueran E. coli, ni encontramos relativamente más microorganismos que no fueran E. coli entre las ITU de los niños en quienes se detectaron signos patológicos posteriores en la CUMS que entre los niños que presentaban CUMS normales.
En cuanto a la necesidad de realizar seguimientos con urocultivos de control a estos niños, debe comentarse que algunos autores ya lo descartan por ser traumático para los niños y sus padres, y por la escasa o nula importancia que se da actualmente a las bacteriurias asintomáticas 27. Así, por ejemplo, Dayan et al28 consideran innecesario realizar urocultivos en menores de 2 meses que hayan tenido una ITU gramnegativas con buena respuesta al tratamiento antibiótico. En nuestra serie no pudimos analizar este aspecto al ser un estudio retrospectivo y resultar imposible analizar caso por caso para comprobar cuántas reinfecciones eran verdaderas y cuántas bacteriurias eran asintomáticas.
Para terminar, resulta también controvertida en la comunidad médica la necesidad de instaurar tratamiento profiláctico después de un episodio de ITU neonatal. Las pautas clásicas recomendaban su administración en infecciones neonatales, infecciones recurrentes, uropatías de tipo obstructivo, o tras detectar un reflujo vesicoureteral de grado II o superior29. Sin embargo, en revisiones recientes se indica que la profilaxis sólo debe mantenerse hasta la realización de pruebas de imagen que descarten estas anomalías, y se cuestiona su utilidad3,30–32. En nuestro centro, siguiendo las pautas más clásicas, se instauró la profilaxis en el 86,8 % de los casos de la serie.
Las conclusiones de nuestro trabajo, descriptivo y retrospectivo, son que la ITU neonatal es un proceso importante por su incidencia, que la comparación temporal realizada no ha podido encontrar grandes diferencias en los últimos años en cuanto a los microorganismos ni a las sensibilidades de éstos, y que el tipo de microorganismo (E. coli frente a no E. coli) en el período neonatal no ayuda a tomar decisiones sobre los estudios de imagen en el tratamiento posterior de la infección.