El objetivo del estudio fue comparar la efectividad y seguridad del polietilenglicol con y sin electrolitos (EL) en el estreñimiento funcional pediátrico a lo largo de 12 semanas.
Material y métodosEstudio observacional, prospectivo, longitudinal, de grupos paralelos, que incluye a 62 niños diagnosticados de estreñimiento funcional según los criterios de ROMA III con antecedente de impactación fecal. De ellos, 30 niños recibieron polietilenglicol sin EL (PEG) y 32 PEG con EL (PEG+EL) durante al menos 12 semanas. Los resultados principales fueron determinar el número de deposiciones por semana a las 6 y 12 semanas de tratamiento y la presencia de alteraciones hidroelectrolíticas a las 6 semanas.
ResultadosLa media de deposiciones por semana fue similar en ambos grupos a las 6 y a las 12 semanas, siendo en la semana 12 de 5,4 y 4,6 deposiciones por semana en los grupos PEG+EL y PEG respectivamente. Después de 6 semanas de tratamiento, el 83% (25 de 30) del grupo PEG tuvo al menos un parámetro alterado en la analítica, comparado con el 56% (18 de 32) en el grupo PEG + EL (p = 0,02). Se reportó una hiponatremia hasta en un 15% (5 de 32) y un 36% (11 de 30) del grupo PEG + EL y el grupo PEG (p=0,05). Ninguna de las alteraciones analíticas fue clínicamente relevante.
ConclusionesLas formulaciones PEG con o sin EL tienen una efectividad, seguridad y aceptabilidad similar. PEG sin EL presentó un mayor número de alteraciones electrolíticas, pero ninguna fue sintomática.
To compare the effectiveness and safety of polyethylene glycol with and without electrolytes (EL) over a 12 week period in treatment of chronic constipation in paediatrics.
Material and methodsThis was an observational, prospective, longitudinal, parallel group study, including 62 children with chronic constipation according to ROME III criteria and a history of faecal impaction. The children were divided into groups, one group of 30 received polyethylene glycol without EL (PEG) and 32 PEG with EL (PEG+EL) for at least 12 weeks. The main outcomes were the number of bowel movements at 6 and 12 weeks, and the presence of electrolyte disturbances at 6 weeks.
ResultsThe mean weekly stool frequencies were similar in both groups at 6 and 12 weeks, with 5.4 and 4.6 stools per week in the PEG+EL and PEG groups, respectively at 12 weeks. After 6 weeks of treatment, 83% (25 of 30) of the PEG group had at least one electrolyte disturbance compared with 56% (18 of 32) in the PEG+EL group (P=.02). Hyponatraemia was found in 15% (5 of 32) vs. 36% (11 of 30) of PEG+EL and PEG groups, respectively (P=.05). None of the laboratory abnormalities were clinically relevant.
ConclusionsPEG formulations with or without EL have a quite similar effectiveness, safety and acceptability. PEG without EL produced more electrolyte abnormalities, but none of them were symptomatic.
El estreñimiento funcional infantil es un problema común en todo el mundo. Muchos pacientes no buscan tratamiento médico, y su prevalencia es difícil de estimar pero se calcula que sea entre 0,7 y 29,6%1. En España hay reportes en población adulta de hasta un 14-20%2,3. El estreñimiento tiene un impacto significativo en la calidad de vida que afecta a aspectos tanto físicos como emocionales4. Su diagnóstico se ha establecido con los criterios ROMA III5 que son muy similares a los del grupo PACCT6. El manejo del estreñimiento funcional incluye varios pasos como educación, cambios de hábitos, desimpactación y tratamiento de mantenimiento7. Entre los laxantes recomendados para su tratamiento tenemos el hidróxido de magnesio, lactulosa, parafina y el polietilenglicol (PEG). En comparación com sus antecesores que llevan décadas de uso, el PEG se ha convertido en el tratamiento de elección para muchos médicos8. A pesar de que solo está aprobado por la FDA en adultos, y de que es administrado sin prescripción, su uso en pediatría se ha incrementado en varios países9,10. Su efectividad y seguridad a corto plazo ha sido demostrada en varios estudios, de modo que, 2 recientes metaánalisis11,12 concluyen que el PEG podría ser superior que la lactulosa y el hidróxido de magnesio. Actualmente existen 2 formulaciones de PEG en el mercado, con y sin electrolitos, y a pesar de su amplio uso no existen estudios hasta el momento, en población infantil, que comparen la efectividad y evalúen la seguridad a largo plazo de estas formulaciones. El presente estudio compara PEG con electrolitos (PEG+EL) y sin electrolitos (PEG) en términos de efectividad y seguridad con relación a la función renal y valores de electrolitos como marcadores biológicos de absorción a lo largo de 12 semanas.
Pacientes y métodosDiseño del estudioEs un estudio observacional, prospectivo, de grupos paralelos que compara la seguridad y eficacia de un laxante PEG con o sin electrolitos para el tratamiento del estreñimiento crónico.
Los investigadores obtuvieron consentimiento de los padres antes de iniciar el período observacional.
Productos en estudioPEG sin electrolitos (Casenlax® polvo de solución oral, sobres de 4 g y 10 g).
Impactación fecal: 1,5-2 g/kg/día dividido en 2 dosis hasta su resolución por un máximo de 6 días (dosis fija).
Estreñimiento: 0,4-1 g/kg/día dividido en 2 dosis hasta un máximo de 20 g/día. La duración del tratamiento fue de un mínimo de 12 semanas.
PEG con electrolitos (Movicol®, polvo de solución oral, sobres de 6,9 y 13,9 g).
Impactación fecal: 1,5-2 g/kg/día dividido en 2 dosis hasta su resolución por un máximo de 6 días (dosis fija).
Estreñimiento: 0,4-1 g/kg/día dividido en 2 dosis hasta un máximo de 27,6 g día. La duración del tratamiento fue de un mínimo de 12 semanas.
PacientesSe incluyó a los pacientes derivados al Departamento de Gastroenterología Pediátrica del Hospital Sant Joan de Déu, entre noviembre de 2011 y marzo de 2013. Los criterios de inclusión fueron: edad entre uno y 17 años, fracaso de las medidas educacionales y dietéticas aplicadas durante un mínimo de un mes, historia de impactación fecal durante su evolución y que cumplieran los criterios de estreñimiento crónico funcional según los criterios ROMA III: presencia de al menos 2 de los siguientes criterios antes del diagnóstico (por lo menos un mes para los niños menores de 4 años13, o 2 meses para los niños mayores de 4 años5); 2 deposiciones o menos por semana; al menos un episodio por semana de incontinencia fecal; historia de posturas de retención (niños mayores de 4 años); dolor abdominal; presencia de masas fecales grandes en el recto; e historia de heces de gran tamaño que obstruyan el lavabo.
Los criterios de exclusión incluyen a los pacientes con uso previo de medicación que influya en la motilidad intestinal como laxantes, probióticos o prebióticos en las 4 semanas previas a la primera visita; pacientes con problemas de defecación de causa orgánica como enfermedad de Hirschprung, espina bífida (oculta), hipotiroidismo, enfermedad celiaca, desórdenes metabólicos o renales y pacientes con sospecha de obstrucción o estenosis gastrointestinal.
Todos los pacientes incluidos recibieron un tratamiento u otro de forma alterna para obtener un número similar de pacientes. La dosis administrada se determinó según presentara o no impactación fecal (descrito anteriormente). Se consideró un cambio de dosis si no se obtenía respuesta al tratamiento al cabo de 3 días, o si presentaba algún efecto adverso como diarreas o dolor abdominal.
Para mejorar la aceptación de ambos productos, se permitió que fueran diluidos en zumo de frutas o leche.
Durante el seguimiento de estos pacientes, se indicó a los padres que llevaran un diario, en el que reportaban la frecuencia de las deposiciones por semana, forma y consistencia según la escala Bristol, que evalúa la consistencia de las heces en una escala de 1 a 714. Se realizaron visitas a la 1, 4 y 12 semanas de iniciar el tratamiento y posteriormente cada 8 semanas hasta cuando era posible retirar la medicación. En cada visita se realizaba una anamnesis y examen clínico completo incluyendo un examen rectal. También se registraron los posibles efectos adversos del tratamiento: dolor abdominal, diarrea, flatulencia, náuseas y aceptación del producto. En cada visita se evaluaba la necesidad de aumentar o disminuir la dosis del tratamiento en función de la evolución clínica y de las deposiciones registradas en el diario.
Como variable principal se determinó, a las semanas 6 y 12 de tratamiento, la frecuencia de las deposiciones por semana y a la semana 6 la presencia de alteraciones hidroelectrolíticas. Como variables secundarias se evaluaron el tiempo necesario para obtener una desimpactación, cambio en la consistencia de las heces, uso de laxantes y tolerancia (episodios de náuseas o dolor abdominal).
Se extrajo una analítica sanguínea al inicio del estudio, a la sexta semana de tratamiento y cuando creyese necesario el clínico durante las visitas de seguimiento. Todas las extracciones se realizaron en el laboratorio de nuestro hospital y en ayunas. Los parámetros incluidos fueron hemograma, ionograma, osmolaridad plasmática, glucosa, urea, creatinina, proteínas totales, albúmina, así como también la primera muestra de orina donde se analizaba su ionograma y osmolaridad. Los valores rango se muestran en la tabla 1.
Parámetros biológicos
| Rango | PEG+EL | PEG | ||
|---|---|---|---|---|
| N | % | N | % | |
| Na mmol/l (136-145) | ||||
| < ILN | 5 | 15,6 | 11 | 36,6 |
| >SLN | 0 | 0 | 0 | 0 |
| RN | 27 | 84,4 | 19 | 63,4 |
| K mmol/l (3,8-5,2) | ||||
| < ILN | 1 | 3 | 2 | 6 |
| >SLN | 0 | 0 | ||
| RN | 31 | 96 | 28 | 93 |
| Cl mmol/l (97-110) | ||||
| < ILN | 0 | 0 | ||
| >SLN | 0 | 0 | ||
| RN | 32 | 100 | 30 | 100 |
| Ca iónico mmol/l (2,27-2,66) | ||||
| < ILN | 3 | 4 | 13 | |
| >SLN | 0 | 2 | 6 | |
| RN | 29 | 90 | 24 | 80 |
| Glucosa (mg/dl) 70-109 | ||||
| < ILN | 2 | 6 | 0 | |
| >SLN | 0 | 0 | ||
| RN | 30 | 93 | 30 | 100 |
| Urea (mg/dl) 18-45 | ||||
| < ILN | 0 | 0 | ||
| >SLN | 0 | 0 | ||
| RN | 32 | 100 | 30 | 100 |
| Creatinina (mg/dl)<0,64 | ||||
| < ILN | 0 | 0 | ||
| >SLN | 2 | 6 | 0 | |
| RN | 30 | 93 | 28 | 100 |
| Osmolaridad plasmática (278-298) | ||||
| < ILN | 0 | 1 | 3 | |
| >SLN | 1 | 3 | 0 | |
| RN | 31 | 96 | 29 | 96 |
| Osmolaridad de orina (513-1110) | ||||
| < ILN | 2 | 9 | 8 | 18 |
| >SLN | 2 | 9 | 0 | |
| RN | 19 | 82 | 20 | 71 |
| Na orina mmol/l (34-214) | ||||
| < ILN | 2 | 9 | 2 | 7 |
| >SLN | 1 | 4 | 1 | 3 |
| RN | 20 | 86 | 25 | 89 |
| K orina mmol/l (27-93) | ||||
| < ILN | 2 | 8 | 3 | 10 |
| >SLN | 3 | 13 | 6 | 21 |
| RN | 18 | 78 | 19 | 67 |
| Cl mmol/l (42-218) | ||||
| < ILN | 2 | 9 | 0 | |
| >SLN | 1 | 5 | 1 | 4 |
| RN | 18 | 85 | 23 | 95 |
ILN: inferior al límite normal; SLN: superior al límite normal; RN: rango normal.
Durante todo el estudio no se realizaron cambios en la ingesta habitual del paciente.
Análisis estadísticoBasados en estudios anteriores15,16, una diferencia mayor de 30% entre ambos tratamientos sería considerada como clínicamente relevante. Asumiendo una frecuencia de deposiciones por semana de 7 con una desviación estándar de 3,5, una muestra de 60 (30 en cada grupo) fue calculada para detectar una diferencia de 30% en frecuencia de deposiciones por semana entre ambos grupos con un poder de 80% (α = 0,05).
El análisis de la eficacia y de la seguridad biológica y clínica se realizó bajo el método de intención por tratar, incluyendo todos los datos de los pacientes reclutados que hubieran recibido al menos una dosis del fármaco estudiado y que hubieran proveído datos de seguimiento para una o más de las variables analizadas.
Las comparaciones entre ambos grupos de tratamiento o entre cada grupo (antes y después del tratamiento) se realizaron con los tests apropiados. Se aplicó el test de normalidad de Kolmogorov-Smirnov para determinar la normalidad de los parámetros. Para los parámetros cuantitativos, se realizó el test de Wilcoxon en las muestras apareadas, el test de U Mann-Whitney en las muestras independientes y los datos fueron descritos en media y mediana. Para los parámetros cualitativos, los datos fueron descritos en números y porcentajes y se realizó el test de chi-cuadrado o el test exacto de Fisher. El análisis estadístico se realizó con el programa SPSS versión 21. Se utilizó un nivel de 5% de significación; los valores de p<0,05 fueron considerados significativos.
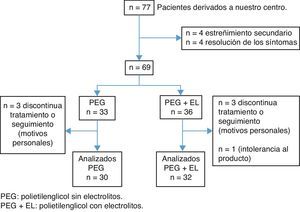
ResultadosEntre noviembre de 2011 y marzo de 2013 obtuvimos un total de 77 pacientes con estreñimiento, de los cuales 4 fueron excluidos por estreñimiento secundario (3 celiacos y una enfermedad de Hirschsprung) y otros 4 pacientes mejoraron solo con medidas higiénicas como parte del tratamiento habitual del estreñimiento funcional. Posteriormente los pacientes fueron asignados en ambos grupos de tratamiento. Durante el seguimiento se perdieron 7 pacientes y un paciente interrumpió el tratamiento por intolerancia al producto. Obtuvimos un total de 62 pacientes que completaron las 12 semanas de seguimiento, 30 pacientes en el grupo PEG y 32 en el grupo PEG+EL (fig. 1). La edad promedio fue de 5 años, con un 53% de varones. No hubo diferencias clínicas relevantes ni diferencias demográficas entre ambos grupos de tratamiento al inicio (tabla 2).
Características demográficas de los pacientes
| Parámetros | PEG+EL (N = 32) | PEG (N = 30) | p |
|---|---|---|---|
| Edad, media±DE, en años | 62,3 (50,63) | 57,2 (41,34) | 0,75 |
| 1-3 años | 15 | 15 | |
| años | 7 | 4 | |
| >5 años | 10 | 11 | |
| Varones, n (%) | 18 (56) | 15 (50) | 0,62 |
| Altura en cm, media±DE | 106 (24) | 102 (22) | 0,5 |
| Peso en kg, media±DE | 20 (11) | 18 (10) | 0,39 |
| Tiempo de evolución de estreñimiento, en meses (media) | 34 (28) | 33 (31) | 0,77 |
| Número de deposiciones/semana | 1,66 | 1,63 | 0,69 |
| Consistencia fecal (escala Bristol) media±DE | 1,53 (0,50) | 1,57 (0,56) | 0,87 |
| Defecación dolorosa, n (%) | 29 (90) | 28(93) | 0,69 |
| Maniobras de retención, n (%) | 10 (31) | 17(56) | 0,04 |
| Incontinencia fecal, n (%) | 7 (21) | 13 (43) | 0,07 |
| Sangrado rectal, n (%) | 13 (40) | 8 (26) | 0,24 |
| Impactación fecal, n (%) | 12 (37) | 9 (30) | 0,53 |
El número de deposiciones por semana fue similar en ambos grupos a las semanas 6 y 12. La media (DE) de las deposiciones por semana en el grupo PEG+EL y PEG fueron de 6,0 (2,7) y 6,1 (2,5) a las 6 semanas, y de 5,4 (1,8) y 4,6 (2,2) a las 12 semanas, respectivamente. El número promedio de días necesarios para iniciar deposiciones blandas fue similar en ambos grupos: 2,7 (1-10) días en el grupo PEG y 2 (1-7) días en el grupo PEG+EL, sin diferencias estadísticas significativas (tabla 3).
La proporción de pacientes con deposiciones duras (Bristol ≤ 3) disminuyó considerablemente en el grupo PEG sin electrolitos y en menor medida en el grupo PEG+EL, sin alcanzar diferencias estadísticas. A las 6 semanas el 21% (7 de 32) presentaban deposiciones duras vs. 6% (2 de 30) respectivamente; pero posteriormente, estas diferencias se igualaron a las 12 semanas 9% (9 de 30) vs. 5% (5 de 18) respectivamente (tabla 4).
La impactación fecal, en el momento de ingreso en el estudio, fue diagnosticada en el 37% (12 de 32) del grupo PEG+EL y en el 30% (9 de 30) del grupo PEG. A las 6 semanas de tratamiento hubo mayor proporción de pacientes con persistencia de este signo en el grupo PEG+EL (21% [7 de 32]) que en el grupo PEG (10% [3 de 30]), sin alcanzar significación estadística. A las 12 semanas estas diferencias desaparecen, con solo 6% (3 de 31) vs. 9% (2 de 30), respectivamente. El día de inicio de deposiciones blandas en estos pacientes fue muy similar: fue de 2 días en promedio en el grupo PEG y de 2,3 días en el grupo PEG + EL.
La dosis media a las 6 semanas fue de 0,61 g/kg/día (PEG) y de 0,63 g/kg/día (PEG+EL) (p=0,8), y a las 12 semanas la dosis media fue de 0,56 g/kg/día (PEG) y de 0,61 (PEG+EL) (p= 0,49), ambos sin diferencia estadística.
Tolerancia biológicaDespués de 6 semanas de tratamiento, el 56% (18 de 32) y el 83% (25 de 30) tuvieron al menos un parámetro alterado en la analítica en el grupo PEG+EL y en el grupo PEG respectivamente, con una diferencia estadísticamente significativa (p=0,02). Esta diferencia persiste al analizar a los pacientes con más de 2 parámetros alterados, siendo de 28% (9 de 32) y de 50% (15 de 30) respectivamente, sin alcanzar significación estadística (tabla 5).
No se encontraron alteraciones en el hemograma, proteínas, albúmina ni transaminasas.
Entre los valores analizados (tabla 1), el sodio sérico es el que más frecuentemente se altera con el tratamiento, encontrando una hiponatremia (sodio ≤ 135) hasta en un 15% (5 de 32) y un 36% (11 de 30) del grupo PEG + EL y el grupo PEG, respectivamente, que alcanza una diferencia estadística (p=0,05). Posteriormente el K en orina es el segundo parámetro mayormente alterado, encontrado en un 21% (5 de 23) y en un 32% (9 de 28) en ambos grupos, respectivamente. Por último, la osmolaridad en orina se alteró en un 17% (4 de 23) y en un 28% (8 de 28), respectivamente. No hubo diferencias estadísticamente significativas entre los valores basales de ambos grupos.
Tolerancia clínicaSolo 3 pacientes reportaron efectos adversos que no mejoraron al disminuir la dosis habitual. Los efectos reportados fueron diarrea (un paciente del grupo PEG) y dolor abdominal y flatulencia (2 pacientes del grupo PEG+EL) y en todos ellos llevó a la retirada y cambio de tratamiento. Solo un paciente del grupo PEG+EL reportó mal sabor del producto lo cual llevó a un cambio en el tratamiento. Con respecto a las alteraciones analíticas ninguna fue clínicamente relevante. El 100% de las hiponatremias reportadas fueron leves, con una media de 134 mEq/l (133-135 mEq/l).
DiscusiónEste es el primer estudio en la literatura, hasta el momento, que compara la efectividad y las alteraciones hidroelectrolíticas que puede producir PEG con o sin electrolitos en niños. Se confirma que PEG sin electrolitos produce un mayor número de hiponatremias leves en comparación con el PEG+EL. Estos resultados son similares a los reportados por Seinela et al. en adultos seniles institucionalizados, en los que el único parámetro alterado fue el sodio plasmático, pero no evaluaron otras alteraciones en orina. Si bien todas estas alteraciones hidroelectrolíticas fueron asintomáticas, debe tomarse en cuenta que el estudio se llevó a cabo en pacientes sin otras enfermedades crónicas, renales, pancreáticas o cardiacas, en los cuales posiblemente estas alteraciones podrían ser más relevantes.
Los estudios que evalúan la seguridad de PEG sin electrolitos en niños, de forma aislada o en comparación con otros laxantes, solo reportan ninguna o alguna alteración electrolítica en casos aislados. Sin embargo, todos estos estudios, tienen algunas características a tomar en cuenta para poder interpretar sus resultados: la mayoría no estaban diseñados ni tienen la suficiente muestra para poder detectar diferencias, como por ejemplo 2 estudios que evalúan su seguridad a los 3-4 días de tratamiento17,18. Otros no refieren el rango normal utilizado por su laboratorio19, o que fuera opcional en su diseño realizar una analítica de control a los pacientes, de modo que, solo obtuvieron 17 pacientes con analítica disponible a los 3 meses de tratamiento20. El estudio de Dupont21 reportó que no había alteraciones hidroelectrolíticas, quizás influido por tener un rango de sodio plasmático normal más amplio que otros laboratorios (RN 132-145).
La seguridad de PEG+EL ha sido reportada en varios estudios en adultos16, en cambio en pediatría solo hay 2 estudios22,23 que evalúan si hay alteraciones analíticas durante el tratamiento, y en ninguno de ellos se encontraron alteraciones, de manera similar a los hallazgos de nuestro estudio.
Con respecto a la eficacia de ambos evacuantes, el único estudio en la literatura, hasta el momento, que compara estos laxantes en niños es el estudio de Savino et al.24. Este estudio concluye que PEG sin electrolitos fue mejor tolerado y que obtuvo mayor número de deposiciones por semana que PEG+EL. Sin embargo, solo compara ambas medicaciones hasta las 4 semanas de tratamiento. En nuestro estudio, también encontramos que PEG sin electrolitos muestra mayor cantidad de pacientes con deposiciones blandas a las 6 semanas pero que posteriormente, a las 12 semanas, estas diferencias desaparecen. Igualmente existe una ligera diferencia sobre la resolución de la impactación fecal, que se resolvió a las 6 semanas con mayor frecuencia en el grupo PEG, y que a las 12 semanas estas diferencias desaparecen.
Se podría concluir que PEG+EL tardaría un poco más en actuar, pero al ser el mismo compuesto activo, solo se podría explicar por una menor dosis ingerida, probablemente por su sabor. Dos estudios en adultos16,25 y uno en niños24 demuestran la mejor tolerancia o sabor de PEG sin electrolitos. El estudio de Savino demuestra que un 26% refirió un mal o pésimo sabor con PEG+EL en comparación con solo un 2% con PEG. Al igual que un estudio en 100 voluntarios adultos, en el que 84 prefirieron PEG y solo 7 prefirieron PEG+EL25.
El estudio de Savino et al.24 no indica si permitió al grupo PEG+EL disolver el fármaco en bebidas diferentes al agua. En el prospecto de fábrica de Movicol®, se indica que debe ser disuelto solo en agua. De ahí quizás que su aceptabilidad y palatibilidad sea menor que Casenlax®.
En nuestro estudio se permitió que ambos productos fueran disueltos en diferentes bebidas para mejorar su aceptación, lo cual podría explicar que, hasta que no se encuentre la bebida con la cual mejora la aceptabilidad de PEG+EL, se administre menos dosis en las primeras semanas y posteriormente se mejore su administración.
Además, esta eficacia similar entre ambos productos, también se demuestra en 2 estudios en adultos que no demuestran diferencias con respecto a la efectividad de PEG con o sin electrolitos16,26.
Los efectos adversos en nuestro estudio fueron escasos: ocurrieron solo en 3 de los 62 pacientes evaluados, lo cual reafirma, al igual que otros estudios, la buena seguridad de este fármaco en comparación con otras medicaciones, tipo laxantes estimulantes o salinos y los agentes hiperosmolares tipo lactulosa o lactitol, que presentan en general mayor diarrea transitoria (10%), flatulencia (6%) y dolor abdominal (2%).
En conclusión, ambas formulaciones PEG con o sin electrolitos tienen una efectividad, seguridad y aceptabilidad similares. Las alteraciones hidroelectrolíticas presentes con mayor frecuencia en el grupo PEG sin electrolitos fueron totalmente discretas y asintomáticas. A diferencia de otros estudios, es posible que PEG+EL mejore su aceptabilidad al disolverlo en diferentes bebidas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.