La gentamicina es uno de los antibióticos más utilizado en el tratamiento de las infecciones bacterianas graves del recién nacido y diferentes pautas de dosificación de gentamicina han sido recomendadas en este grupo poblacional.
ObjetivoComparar las concentraciones séricas, la eficacia y la toxicidad de dos pautas de dosificación de gentamicina en recién nacidos a término y pretérmino.
Material y métodosSe evaluó prospectivamente a 200 recién nacidos que recibieron tratamiento con gentamicina. En el grupo A (n=100) se administró según una pauta de múltiples dosis diarias (2,5-3,5mg/kg/dosis cada 12-18h), dependiendo de la edad posnatal y las concentraciones séricas de creatinina. En el grupo B (n=100) se administró en pauta de única dosis diaria (4-5 mg/kg/dosis cada 24-48h), según la edad posnatal y posconcepcional. Entre ambos grupos se compararon las concentraciones pico y valle séricas de gentamicina, los datos generales y la prevalencia de nefrotoxicidad y ototoxicidad.
ResultadosLas concentraciones pico de gentamicina fueron significativamente superiores (8,2 ± 0,22μg/ml frente a 5,9±0,13μg/ml; p≤0,001) y las concentraciones valle fueron significativamente inferiores (0,9±0,06μg/ml frente a 1,7±0,08μg/ml; p≤0,001) en el grupo B. No hubo diferencias significativas entre ambos grupos respecto a la eficacia clínica, o a la prevalencia de nefrotoxicidad u ototoxicidad.
ConclusionesLa pauta de gentamicina en única dosis diaria es efectiva,segura y disminuye el riesgo de concentraciones séricas fuera de rango terapéutico en recién nacidos pretérmino y a término.
Gentamicin is widely used in full-term neonates as empirical therapy for early-onset suspected or proven sepsis. Several dosing schedules for gentamicin have been recommended for this neonatal population.
ObjectiveTo compare gentamicin serum levels, efficacy and toxicity of two dosing schedules in term and preterm newborns.
Material and methodsThe study included 200 newborns who were started on gentamicin therapy. Group A (N=100) was prescribed a multiple-daily dosing regimen and Group B (N=100) on a once-daily dosing regimen. Newborns in Group A received gentamicin at 2.5-3.5mg/kg/dose q12-18h depending on postnatal age and serum creatinine levels, and newborns in Group B received 4-5mg/kg/dose q24-48h depending on postconceptional and postnatal age. All peak and trough serum drug levels, demographic data, and markers of potential nephrotoxicity and ototoxicity were compared.
ResultsPeak serum gentamicin levels were significantly higher (8.2±0.22μg/ml vs. 5.9±0.13μg/ml; p≤0.001) andtrough levels were significantly lower (0.9±0.06μg/ml vs. 1.7±0.08μg/ml; p≤0.001) in Group B than in Group A. There was no significant difference between the groups either in the clinical failure rate or in the nephrotoxicity or ototoxicity outcomes.
ConclusionsOnce-daily dosing regimen of gentamicin in preterm and term newborns is safe and effective, with a reduced risk of serum drug concentrations falling outside the therapeutic range.
La gentamicina, en asociación con los betalactámicos, constituye uno de los antibióticos fundamentales en el tratamiento de las infecciones graves del recién nacido, originadas por patógenos como Streptococcus agalactiae, Escherichia coli, Lysteria monocytogenes y bacilos gramnegativos1,2. La gentamicina presenta un estrecho margen terapéutico, y es necesaria la monitorización periódica de sus concentraciones plasmáticas, para evitar el riesgo de toxicidad renal y acústica1–3.
En los últimos años se ha comparado la eficacia y seguridad de nuevas pautas de dosificación de gentamicina en única dosis diaria (UDD), frente a las pautas tradicionales, en múltiples dosis diarias (MDD) en el recién nacido4–11. Estas nuevas pautas consiguen unas concentraciones plasmáticas óptimas, con eficacia y seguridad similares a las de las pautas tradicionales12–14. Sin embargo, los estudios realizados en los recién nacidos más prematuros siguen siendo limitados15–17.
El objetivo principal del presente estudio ha sido comparar las concentraciones séricas pico y valle obtenidas con dos pautas distintas de dosificación de gentamicina, en una población de recién nacidos pretérmino (RNPT) y a término (RNT). Adicionalmente, se ha intentado evaluar la eficacia clínica del tratamiento, así como la prevalencia de nefrotoxicidad y ototoxicidad en cada grupo de tratamiento.
MATERIAL Y MÉTODOSSe incluyeron en el estudio los recién nacidos de entre 23 y 42 semanas de edad gestacional ingresados en la Sección de Neonatología del Hospital General Universitario de Alicante, desde marzo de 2004 hasta septiembre de 2005, que recibieron tratamiento con gentamicina por sospecha de sepsis, sepsis confirmadas, bronconeumonías, infecciones urinarias o enterocolitis necrotizante, entre otras patologías. Se excluyeron del estudio los recién nacidos con anomalías congénitas graves o cuando faltó alguna determinación en las concentraciones séricas del fármaco.
En el año 2004 se revisó exhaustivamente la literatura científica al respecto, y la Sección de Neonatología y el Servicio de Farmacia de nuestro hospital consensuaron el cambio a partir de enero de 2005 de la pauta de administración de gentamicina, a la vista de las evidencias científicas publicadas. La pauta tradicional en MDD utilizada estaba basaba en un estudio realizado en nuestra sección a inicio de la década de 199018,19. En este grupo las dosis de gentamicina se determinaron en función de sus características farmacocinéticas, la edad gestacional, los días de vida y la función renal de los niños del estudio. Como nueva pauta de administración se siguió la propuesta en el Neofax®2004, manual farmacológico neonatal de referencia20. Ambas pautas se comparan en la tabla 1. Por tanto, desde marzo hasta diciembre de 2004 los niños recibieron las dosis según el protocolo tradicional, y nos referiremos a ellos en adelante como grupo A (n = 100) y, desde enero hasta septiembre de 2005, recibieron las dosis según el nuevo protocolo, en adelante grupo B (n = 100).
Pautas de dosificación de gentamicina utilizadas en cada grupo del presente estudio
| Edad posconcepcional (semanas) | Posnatal (días) | Dosis (mg/kg) | Frecuencia | |
| Grupo A | < 37 | <7 | 3,5 | 3,5 mg/12 h |
| >7 | 5 | 2,5 mg/12 h | ||
| > 37 | <7 | 4,5 | 3,5 mg/18 h | |
| >7 | 7 | 3,5 mg/12 h | ||
| Grupo B | ≤ 29 | 0-7 | 5 | 48 h |
| 8-28 | 4 | 36 h | ||
| > 29 | 4 | 24 h | ||
| 30-34 | 0-7 | 4,5 | 36 h | |
| >8 | 4 | 24 h | ||
| ≥ 35 | Todos | 4 | 24 h |
En ambos grupos los datos fueron recogidos de manera prospectiva, como parte del estudio farmacocinético habitual. Al tratarse de un cambio en el protocolo que se iba a seguir de manera regular en la sección y, de modo similar a trabajos previamente publicados7,8,10,11,16, no se solicitaron el consentimiento informado ni la evaluación del comité de ética. Para el análisis pormenorizado de las concentraciones de gentamicina, se dividió la muestra global en subgrupos dependiendo de la edad posconcepcional: subgrupo 1, 23–29 semanas (n = 33); subgrupo 2, 30–34 semanas (n = 54); subgrupo 3, 35–36 semanas (n = 32); subgrupo 4, 37–42 semanas (n = 81).
En ambos grupos la gentamicina sulfato (Laboratorios Normon SA) fue administrada mediante bomba de infusión intravenosa durante 30 min. Las concentraciones pico fueron determinadas en 30 min tras la administración del fármaco y las valle en 30 min antes de la dosis siguiente, en los momentos indicados en cada protocolo18–20. Las concentraciones séricas fueron determinadas mediante una técnica turbidimétrica de inmunoinhibición (Dimensión®, Dade Behring), procedimiento con un rango de cuantificación de 0,0-12,0 μg/ml, sensibilidad de 0,2 μg/ml, y desviación estándar (DE) de entre 0,03 y 0,07 μg/ml.
Se aceptaron concentraciones pico óptimas de entre 5 y 12 μg/ml8–11,15,20,21 y concentraciones valle seguras de hasta 2 μg/ml1,6–11,15–17,21,22. Se comparó la eficacia de cada pauta a la hora de obtener concentraciones pico de gentamicina dentro de rango terapéutico y las concentraciones valle dentro del rango seguro. Se realizaron nuevas determinaciones en el curso del tratamiento cuando las concentraciones estuvieron fuera de los rangos establecidos. Además, se recogieron diferentes variables generales, como la edad gestacional, el peso al nacer, el sexo, la edad posconcepcional, el peso al inicio del tratamiento, la puntuación Apgar al minuto y a los 5 min, los días de tratamiento y los días de estancia hospitalaria. La edad gestacional se determinó bien mediante la última fecha menstrual de la madre, bien por estudio ecográfico, y fue confirmada posteriormente con el Ballard Score. La edad posconcepcional se determinó con la edad posnatal sumada a la edad gestacional.
La eficacia clínica se determinó a partir de la resolución del proceso infeccioso, atendiendo a la mejoría del estado general, y a la normalización de los parámetros analíticos de patología infecciosa a las 48 h del inicio del tratamiento. Para evaluar la nefrotoxicidad primaria asociada al tratamiento, se valoró la función renal en los niños ingresados en la unidad de cuidados intensivos neonatales, cuantificándose la diuresis diaria y analizándose las concentraciones séricas de creatinina al inicio y durante el tratamiento. También se registró el uso concurrente de medicaciones nefrotóxicas como furosemida, vancomicina e indometacina. Se definió insuficiencia renal como la presencia de diuresis inferior a 1 ml/kg/h, y/o la presencia de concentraciones de creatinina superiores a la media ± 2 DE para la edad gestacional y días de vida del RNT y RNPT23. Para evaluar la ototoxicidad, antes del alta hospitalaria, se realizaron otoemisiones acústicas, con el sistema ECHOCHECK® de Otodynamics Ltd24,25. Los recién nacidos que presentaron alteraciones en éstas fueron remitidos para la realización de potenciales evocados auditivos de troncoencéfalo al servicio de neurofisiología.
El análisis estadístico se realizó con los programas estadísticos SPSS y Sigmastat. El estudio descriptivo de las variables se realizó inicialmente para la población total y, posteriormente, se dividieron los recién nacidos de ambas pautas en cuatro subgrupos. Se empleó el test de la t de Student en la comparación de medias, cuando los datos tuvieron una distribución normal, y el test de Kruskal-Wallis cuando no la siguieron. Se utilizó el test de la chi al cuadrado para el análisis de las variables cualitativas, aplicando la corrección de Yates y/o la prueba exacta de Fischer cuando fueron necesarias. Se consideró estadísticamente significativo un valor de p < 0,05. Los datos de las tablas están expresados como media ± error estándar de la media cuando son variables cuantitativas y en porcentajes en variables cualitativas.
RESULTADOSNo se encontraron diferencias significativas entre los dos grupos de tratamiento respecto a la edad gestacional, peso al nacer, edad posconcepcional, peso al inicio del tratamiento, sexo, puntuación Apgar a los 5 min, días de tratamiento antibiótico y días de estancia. De los 200 recién nacidos incluidos en el estudio, el 59,5 % (119) eran RNPT y, de ellos, 42 (21 %) pesaban menos de 1.500 g. Su distribución entre los dos grupos de tratamiento fue similar. La tabla 2 resume las características generales de ambos grupos.
Características generales de la muestra global a estudio y por subgrupos
| Muestra total | Subgrupo 1 (23–29 semanas) | Subgrupo 2 (30–34 semanas) | Subgrupo 3 (35–36 semanas) | Subgrupo 4 (37–42 semanas) | ||||||
| A(n = 100) | B(n = 100) | A(n = 17) | B(n = 16) | A(n = 31) | B(n = 23) | A(n = 13) | B(n = 19) | A(n = 39) | B(n = 42) | |
| EG | 34,1 ± 0,48 | 34,8 ± 0,47 | 26,5 ± 0,34 | 27,2 ± 0,38 | 31,8 ± 0,28 | 31,6 ± 0,56 | 34,9 ± 0,68 | 35,6 ± 0,11 | 39,0 ± 0,23 | 39,2 ± 0,23 |
| EPOST | 34,5 ± 0,49 | 35,0 ± 0,46 | 26,5 ± 0,34 | 27,2 ± 0,38 | 32,0 ± 0,25 | 32,2 ± 0,29 | 35,7 ± 0,13 | 35,5 ± 0,11 | 39,5 ± 0,17 | 39,4 ± 0,24 |
| Pesoi tto | 2.286 ± 95 | 2.441 ± 92 | 843 ± 53 | 1.032 ± 48** | 1.842 ± 71 | 1.903 ± 95 | 2.587 ± 119 | 2.640 ± 126 | 3.191 ± 72 | 3.181 ± 80 |
| Varón/mujer | 58/42 | 61/39 | 12/5 | 8/8 | 17/14 | 12/11 | 6/7 | 12/7 | 23/16 | 29/13 |
| Apgar 1 min | 6,6 ± 0,21 | 7,3 ± 0,18* | 4,7 ± 0,49 | 5,9 ± 0,44 | 7,2 ± 0,23 | 6,1 ± 0,30* | 6,8 ± 0,73 | 8,1 ± 0,29 | 6,8 ± 0,35 | 8,1 ± 0,26* |
| Apgar 5 min | 8,2 ± 0,15 | 8,5 ± 0,13 | 6,5 ± 0,39 | 7,5 ± 0,27* | 8,4 ± 0,15 | 7,6 ± 0,23* | 8,3 ± 0,43 | 9,0 ± 0,21 | 8,7 ± 0,23 | 9,2 ± 0,20** |
| Días con antibióticos | 6,0 ± 0,19 | 5,9 ± 0,22 | 7,1 ± 0,40 | 6,6 ± 0,48 | 5,3 ± 0,32 | 5,7 ± 0,58 | 5,1 ± 0,50 | 5,7 ± 0,48 | 6,3 ±0,33 | 5,7 ± 0,32 |
| Días de estancia | 29,8 ± 3,35 | 23,4 ± 2,57 | 80,7 ± 11,5 | 62,8 ± 6,07 | 24,2 ± 2,75 | 27,0 ± 3,94 | 20,0 ± 5,51 | 16,1 ± 6,10 | 15,2 ± 2,44 | 9,7 ± 0,90 |
Los resultados están expresados como media ± error estándar de la media.
El resto de variables no presentaron diferencias significativas.
EG: edad gestacional (semanas); EPOST: edad posconcepcional (semanas); n: tamaño muestral; Pesoi tto: peso al inicio del tratamiento con gentamicina expresado en gramos; tto: tratamiento.
En el 93,5 % (187/200) el tratamiento fue iniciado en la primera semana de vida. La principal indicación fue la patología respiratoria (bronconeumonía, síndrome de aspiración meconial) en el 51,5 % de los recién nacidos. Otras indicaciones fueron: sospecha de sepsis bacteriana en el 37 %, patología gastrointestinal (enterocolitis necrotizante) en el 7,5 % e infecciones del tracto urinario en el 4 %. El 98,5 % recibió tratamiento concurrente con ampicilina, mientras que el 1,5 % recibió otro antibiótico (metronizadol y cloxacilina). La combinación de antibióticos se basó en el juicio clínico y en los resultados de los hemocultivos. El 21 % requirió administración de dopamina como soporte hemodinámico. Ningún recién nacido recibió medicaciones potencialmente nefrotóxicas u ototóxicas durante la terapia con gentamicina.
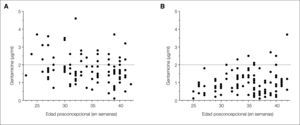
El 44 % de los niños del grupo A requirieron al menos un cambio en la pauta de dosificación inicial, bien por concentraciones pico infraterapéuticas, bien por concentraciones valle tóxicas, en comparación con el 13 % del B (p ≤ 0,001). En el grupo B se alcanzaron niveles pico significativamente mayores (8,2 ± 0,22 μg/ml frente a 5,9 ± 0,13 μg/ml; p ≤ 0,001), y niveles valle significativamente menores (0,9 ± 0,06 μg/ml frente a 1,7 ± 0,08 μg/ml; p ≤ 0,001) que en el A (fig. 1). Además, en el grupo B se redujo significativamente el porcentaje de concentraciones pico subterapéuticas (el 19 frente al 7 %; p < 0,05) y de valle tóxicas (el 25 frente al 6 %; p ≤ 0,001) (fig. 2). Dos RNPT del grupo B presentaron concentraciones pico superiores al rango establecido, uno de 12,5 μg/ml y otro de 13,6 μg/ml. En ninguno de estos niños se detectaron alteraciones en la función renal o en la detección auditiva. El 57,8 % de los recién nacidos del grupo A con concentraciones pico subterapéuticas eran RNT y el 72 % de los recién nacidos del grupo A con valle tóxicas eran RNPT. De estos últimos niños, ninguno presentó alteraciones en la función renal o en la detección auditiva.
Distribución de las concentraciones pico en función de la edad posconcepcional en el grupo A (A) y en el grupo B (B). Las líneas discontinuas definen el intervalo de niveles terapéuticos. Se aprecia que en el grupo B las concentraciones pico estuvieron dentro del intervalo terapéutico en mayor proporción que en el caso del grapo A y que, de promedio, fueron significativamente mayores.
Distribución de las concentraciones valle en función de la edad posconcepcional en el grupo A (A) y en el grupo B (B). Las líneas discontinuas marcan la concentración valle tóxica. Se aprecia que en el grupo B las concentraciones valle estuvieron por debajo de la concentración tóxica en una mayor proporción que en el caso del grupo A, y que, en promedio, fueron significativamente menores.
En los subgrupos B1, B2 y B4 se alcanzaron concentraciones pico significativamente mayores en comparación con los subgrupos A1, A2, A4. Por el contrario, en el subgrupo B3 no se observaron diferencias estadísticamente significativas respecto al A3, aunque la tendencia fue alcanzar concentraciones pico medias superiores (7,0 ± 0,3 frente a 6,0 ± 0,5; no significativas). Lo más destacable resulta el descenso en el porcentaje de picos subterapéuticos en los subgrupos B1 frente al A1 (el 6,5 frente al 29,4 %; no significativas) y en el subgrupo B4 frente al A4 (el 4,7 frente al 28,2 %; p = 0,01). Respecto a las concentraciones valle, en todos los subgrupos B se alcanzaron concentraciones significativamente inferiores que en los A, aunque en alguno de ellos no se alcanzó significación estadística probablemente por la disminución del tamaño muestral. Los resultados obtenidos se resumen en la tabla 3.
Descripción de los resultados obtenidos con las diferentes pautas de dosificación en la muestra global y por subgrupos
| Muestra total | Subgrupo 1 | Subgrupo 2 | Subgrupo 3 | Subgrupo 4 | ||||||
| A(n = 100) | B(n = 100) | A(n = 17) | B(n = 16) | A(n = 31) | B(n = 23) | A(n = 13) | B(n = 19) | A(n = 39) | B(n = 42) | |
| Concentraciones pico (μg/ml) | 5,9 ± 0,13 | 8,2 ± 0,22a | 6,0 ± 0,36 | 9,0 ± 0,59a | 6,3 ± 0,29 | 8,7 ± 0,60a | 6,0 ± 0,50 | 7,0 ± 0,37 | 5,6 ± 0,21 | 8,2 ± 0,28a |
| Concentraciones valle (μg/ml) | 1,7 ± 0,08 | 0,9 ± 0,06a | 2,1 ± 0,21 | 0,7 ± 0,10a | 1,8 ± 0,16 | 1,1 ± 0,11b | 1,6 ± 0,17 | 1,1 ± 0,15e | 1,5 ± 0,11 | 0,9 ± 0,11a |
| Porcentaje pico | 19/100 | 7/100e | 5/17 | 1/16 | 1/31 | 2/23 | 2/13 | 2/19d | 11/39 | 2/42d |
| subterapéuticos | (19 %) | (7 %) | (29,4 %) | (6,2 %) | (3,2 %) | (8,6 %) | (15,3 %) | (10,5 %) | (28,2 %) | (4,7 %) |
| Porcentaje valle | 25/100 | 6/100a | 7/17 | 0c | 8/31 | 1/23 | 3/13 | 2/19 | 7/39 | 3/42 |
| tóxicos | (25 %) | (6 %) | (41,1 %) | (0 %) | (25,8 %) | (4,3 %) | (23,0 %) | (10,5 %) | (17,9 %) | (7,1 %) |
| Hipoacusia | 4/95 | 0/96 | 1/12 | 0/16 | 0/31 | 0/23 | 0/13 | 0/19 | 3/39 | 0/42 |
| (4,2 %) | (0 %) | (8,3 %) | (0 %) | (0 %) | (0 %) | (0 %) | (0 %) | (7,6 %) | (0 %) | |
| Insuficiencia renal | 1/100 | 4/100 | 0/17 | 0/16 | 0/31 | 0/23 | 0/13 | 0/19 | 1/39 | 4/42 |
| (1 %) | (4 %) | (0 %) | (0 %) | (0 %) | (0 %) | (0 %) | (0 %) | (2,5 %) | (9,5 %) | |
Los resultados están expresados como media ± error estándar de la media y en porcentajes.
El resto de variables no presentaron diferencias significativas.
Respecto a la eficacia clínica, no se observaron diferencias significativas entre ambas pautas. El 97 % de los niños presentó una evolución favorable. La mortalidad de la muestra fue del 3 %: 4 niños en el grupo A y 2 en el B; 3 de los niños fallecieron en la primera semana de vida a consecuencia de la extrema prematuridad y patologías como enterocolitis necrotizante e insuficiencia respiratoria grave. Otros 3 niños fallecieron a los 90, 150 y 165 días, respectivamente, por patologías gastrointestinales y respiratorias, secuelas de su prematuridad.
De todos los recién nacidos, 5 (2,5 %) presentaron alteraciones en la función renal durante el tratamiento: 1 en el A y 4 en el B. Todos eran RNT, 2 habían recibido tratamiento por sospecha de sepsis y los otros 3 presentaban una encefalopatía hipóxico-isquémica. De los 5, sólo uno, del grupo B, presentó concentraciones valle superiores a 2 μg/ml. En todos hubo una mejoría de la función renal y una normalización posterior de los parámetros analíticos.
Se realizaron otoemisiones a 190 niños, de los cuales 179 (94,2 %) fueron normales, mientras que 11 (5,7 %) presentaron alteraciones. Estos últimos fueron remitidos a la realización de potenciales evocados auditivos y, sólo 4 (2,1 %) fueron diagnosticados finalmente de hipoacusia neurosensorial, todos en el grupo A. Uno tenía antecedentes de primer grado de hipoacusia familiar, otro presentaba una encefalopatía hipóxico-isquémica de grado IV; otro era un RNPT de muy bajo peso que precisó ventilación mecánica oscilatoria durante más de 30 días, y el último era un recién nacido con enfermedad de Hirschsprung, con varias sepsis de origen intestinal. La detección auditiva no fue realizada en 10 recién nacidos (6 fallecieron y 4 no fueron localizados durante el seguimiento).
DISCUSIÓNLos aminoglucósidos son antibióticos con una serie de propiedades farmacológicas comunes, como son una acción bactericida dependiente de la concentración, excreción por filtración glomerular y una potencial ototoxicidad y nefrotoxicidad, que hacen necesaria su monitorización y la restricción de su uso al ámbito hospitalario1–3. La farmacocinética de la gentamicina en los recién nacidos presenta una considerable variabilidad interpaciente26–28, debido a los altos volúmenes de distribución y la prolongada semivida de eliminación en estos niños, especialmente en RNPT menores de 1.500 g, cuya semivida de eliminación es de 14 h2,4,5,27,29,30.
Los regímenes tradicionales de dosificación de gentamicina en recién nacidos utilizan dosis de 2,5 mg/kg cada 8–12 h2. Sin embargo, se ha observado que su empleo origina un aumento de las concentraciones pico séricas subóptimas, y de concentraciones valle tóxicas, principalmente en los más prematuros30,31. A consecuencia de esto, nuevas pautas, basadas en la farmacocinética de la gentamicina, están siendo utilizadas. Estas nuevas pautas utilizan dosis de 4–5 mg/kg, a intervalos variables cada 24, 36 o 48 h, dependiendo de la edad gestacional4–6,8–11,15–17,29. Los estudios comparativos entre ambas pautas han demostrado que los nuevos regímenes en UDD son más efectivos que los tradicionales para conseguir concentraciones pico superiores y valle menos tóxicas en estos niños10–17,29.
El conseguir concentraciones pico mayores de 5 μg/ml y valle inferiores a 2 μg/ml es esencial para considerar un régimen de dosificación farmacológicamente eficaz y seguro12–14. Moore et al32 demostraron que el principal determinante del resultado clínico del paciente no sólo era alcanzar concentraciones pico terapéuticas en las primeras 24–48 h, sino que además el efecto bactericida dependía de la ratio pico/cantidad mínima inhibitoria (CMI), consiguiéndose el 90 % de respuesta clínica cuando la ratio era superior o igual a 8:1. Además de este efecto bactericida, los aminoglucósidos poseen un fenómeno llamado “efecto postantibiótico”, dependiendo de la concentración, que consiste en la persistencia de la supresión del crecimiento bacteriano después del cese de la administración del fármaco5. Los estudios comparativos han demostrado que con la administración en UDD, se logra alcanzar mayores concentraciones pico terapéuticas en las primeras 24–48 h, se aumenta la ratio pico/CMI, mejorando así el efecto bactericida, además de lograr un mayor efecto postantibiótico, y evitan el desarrollo de resistencias adaptativas4,12,32.
Respecto a la eficacia clínica, nuestros resultados son consistentes con varios metaanálisis en los que no se observan diferencias significativas entre ambos grupos de tratamiento12–14. Con el protocolo tradicional de gentamicina empleado en nuestra sección, se usaban dosis de entre 2,5 y 3,5 mg/kg, cada 12–18 h18,19. Con esta pauta se obtenían concentraciones séricas pico óptimas en los niños de 30–36 semanas, población en la que se había realizado dicho estudio18,19. Sin embargo, en los menores de 29 y mayores de 37 semanas, estas concentraciones eran con frecuencia infraterapéuticas. Se obtenía, asimismo, un porcentaje elevado de valles tóxicos en todos los subgrupos, sobre todo en los RNPT entre 23 y 34 semanas (v. tabla 2). Con el nuevo protocolo, se usan dosis 4–5 mg/kg, a intervalos dependiendo de los días de vida y la edad posconcepcional. Con esta pauta se consigue alcanzar concentraciones pico óptimas en el 90 % de los niños, y se han reducido significativamente los valles tóxicos, en especial en los recién nacidos más prematuros.
El efecto secundario más limitante del uso clínico de la gentamicina es la nefrotoxicidad13,33, cuya lesión más importante se produce en las células de túbulo proximal renal3. Esta toxicidad es transitoria y reversible13,33, a menudo difícil de distinguir de las secuelas secundarias a la sepsis y/o de la enfermedad de base del paciente, detectándose en aproximadamente el 2 % de los recién nacidos4,34.
Existe correlación entre el aclaramiento de creatinina y el de los aminoglucósidos, de manera que en pacientes con función renal alterada, la semivida de eliminación está prolongada, aumentan las concentraciones plasmáticas y existe un mayor riesgo de toxicidad dependiente de la dosis. Existen, además, otros factores asociados con un mayor riesgo de nefrotoxicidad, unos relacionados con la condición clínica del recién nacido (edad, depleción de sodio y volumen, etc.) y otros con la administración del fármaco (duración, régimen de dosificación, tratamiento previo con aminoglucósidos, fármacos utilizados conjuntamente, etc.)1,3.
La acumulación cortical de la gentamicina muestra una cinética saturable, de manera que diferentes pautas podrían influir sobre la misma4. Sin embargo, en los estudios en los que se comparan dosificaciones en MDD frente a UDD no se encuentran diferencias significativas4,5,9,13. La prevalencia de insuficiencia renal en la población a estudio fue del 2,5 %. De éstos, sólo uno presentó concentraciones valle tóxicas y, al igual que lo descrito en otros trabajos, la función renal se normalizó en todos ellos4,33,34. Cuando comparamos el riesgo de nefrotoxicidad, no encontramos diferencias significativas entre ambas pautas.
El efecto secundario más grave de la gentamicina es una ototoxicidad irreversible, producida por la destrucción de las células sensitivas vestibulares y cocleares3. La toxicidad acústica es detectable en el 0,5-5 % de los recién nacidos12,13. La afectación es bilateral, con una gravedad dependiente de la dosis, de la prolongación y/o repetición del tratamiento3 y de la alteración en la función renal, que conlleva un aumento de las concentraciones valle, que es un riesgo reconocido de ototoxicidad3,4.
Parecería, pues, que la administración de gentamicina en UDD produciría menos ototoxicidad que las pautas en MDD. Sin embargo, los estudios realizados no muestran diferencias significativas entre ambos tratamientos3,6,9,14. En nuestro estudio obtuvimos datos similares a los reseñados anteriormente, tanto respecto a la prevalencia como a la comparación por grupos. La prevalencia de hipoacusia en la población a estudio fue del 2 %. De estos recién nacidos, ninguno presentó concentraciones valle tóxicas y sólo en uno se puede suponer que la lesión fuera atribuible al antibiótico. No se encontraron diferencias significativas entre ambos grupos. Estos datos son consistentes con otros estudios en los que no se identifica el tratamiento con gentamicina como causa mayor de sordera12.
Aunque algunos autores han sugerido que con las nuevas pautas de dosificación sería innecesaria la monitorización sistemática de las concentraciones séricas de gentamicina16, en RNPT, en recién nacidos sépticos, con encefalopatía hipóxico isquémica o afectación renal en los que el perfil farmacocinético es diferente según la gran variabilidad en la función renal y la variabilidad impredictible interpaciente, tales recomendaciones no serían prudentes1,2,8,15,26,35. En cualquier caso, sería deseable poder prescindir en un futuro de esta monitorización, al menos en subgrupos identificados de recién nacidos, gracias al mejor conocimiento de la farmacocinética y farmacodinamia del fármaco.
En conclusión, aunque actualmente hay insuficiente evidencia para afirmar que una de las dos pautas es superior a la otra en el tratamiento de los recién nacidos con sepsis14, este trabajo apoya el empleo de la gentamicina en UDD en RNT y RNPT, ya que las propiedades farmacocinéticas de las nuevas pautas sí son superiores en conseguir mayores concentraciones pico y valle menos tóxicas, presentando además, una administración más cómoda, con menores posibilidades de errores de administración y manteniendo la eficacia clínica3,12–14.