La anestesia en prematuros es susceptible de tener múltiples complicaciones. Aunque la aplicación del láser diodo es menos dolorosa que la crioterapia, se debe conseguir una correcta inmovilización del paciente para un enfoque y una aplicación adecuados del mismo. Desde 1999 está protocolizada en el Hospital Infantil de Zaragoza una técnica anestésica que utiliza sedación con agentes inhalatorios asociada a anestesia tópica. Analizamos los resultados obtenidos en la utilización de dicha técnica.
Material y métodoSe incluyen 72 prematuros consecutivos tratados con láser por retinopatía del prematuro (ROP) utilizando la técnica anestésica de sedación inhalatoria y anestesia tópica. Se han recogido datos de los pacientes (edad gestacional, peso al nacer, edad posconcepcional en el momento del tratamiento inicial, patología sistémica asociada) y del acto quirúrgico (tiempo de duración y complicaciones intraoperatorias y postoperatorias).
ResultadosSe produjeron complicaciones intraoperatorias en 12 casos (16,66 %). En 9 casos fueron autolimitadas y sólo 3 precisaron intubación orotraqueal (4,16 %). En 4 casos (5,55 %) se produjeron complicaciones postoperatorias en las 48 h posteriores al tratamiento. No se encontró relación estadísticamente significativa entre la presencia de complicaciones intraoperatorias y la media de edad gestacional y peso al nacer o la presencia de apneas, hemorragia intraventricular o ductus permeable. Se encontró relación estadísticamente significativa entre la presencia de complicaciones postoperatorias y la presencia de hemorragia intraventricular significativa.
ConclusionesLa técnica anestésica con gases inhalatorios asociada a anestesia tópica es segura, con escasa proporción de complicaciones y cómoda para el cirujano.
Anaesthesia in premature infants can have many complications. Although the application of diode laser is less painful than cryotherapy, there has to be adequate immobilization of the patient to provide a correct focus of the spot. At Hospital Infantil de Zaragoza, the same standard anaesthestic technique has been applied since 1999, obtaining sedation with inhaled anaesthetic agents combined with topical anaesthesia. We analyse the results obtained on the application of this technique.
Material and methodThe study included 72 consecutive premature infants treated with diode laser for retinopathy of prematurity (ROP), using an anaesthestic technique combining inhalatory sedation and topical anaesthesia. The personal data of each patient was collected (gestational age, birth weight, postconceptional age at the time of initial treatment, associated systemic disorders) together with information related to the surgical intervention (duration, intraoperative and postoperative complications).
ResultsIntraoperative complications occurred in 12 cases (16.66 %). These were self-limited in 9 cases and only 3 cases required orotracheal intubation (4.16 %). Postoperative complications occurred in 4 cases (5.55 %) during the 48 h following treatment. No statistically significant relationship was found between the presence of intraoperative complications and the mean gestational age and birth weight, and the presence of apnoea, intraventricular haemorrhage or a permeable ductus. A statistically significant relationship was found between the presence of postoperative complications and significant intraventricular haemorrhage.
ConclusionsThis anaesthestic technique combining inhalatory gases and topical anaesthesia is safe, with few complications and comfortable for the surgeon.
La incidencia de la retinopatía del prematuro (ROP) ha aumentado significativamente en los niños de peso inferior a 1.000g. El aumento de supervivencia de los niños con muy bajo peso, y sobre todo de los de extremado bajo peso al nacimiento, está directamente relacionado con el desarrollo de ROP grave. Por ello precisan tratamiento por ROP prematuros más inestables desde el punto de vista sistémico1.
El prematuro es un paciente problemático desde el punto de vista anestésico, pues presenta patología multisistémica, con respuesta pobre o difícilmente controlable a los agentes anestésicos y con mayor riesgo de efectos secundarios y toxicidad2.
La técnica anestésica para el tratamiento de la ROP debe incluir tanto seguridad desde el punto de vista anestésico para el niño, como condiciones óptimas para que el cirujano pueda aplicar el tratamiento con comodidad y seguridad, lo que implica fundamentalmente que esté despejada la cabecera del paciente y la mayor inmovilidad posible del mismo.
Hay pocas publicaciones sobre la técnica anestésica utilizada para el tratamiento de la ROP o sobre qué técnica resulta más idónea, y no hay ningún estudio longitudinal aleatorizado. Los únicos trabajos que se encuentran en la literatura específicos sobre anestesia en el tratamiento de la ROP se refieren, además, al tratamiento con crioterapia3–6.
En nuestro hospital, desde el año 1999 está protocolizada una técnica con sedación anestésica inhalatoria con gases combinada con anestesia tópica. No hemos encontrado en la literatura médica ningún autor que la utilice, por lo que hemos realizado un estudio retrospectivo para valorar sus resultados.
MATERIAL Y MÉTODODesde abril de 1999 hasta agosto de 2005 se trataron 77 prematuros con ROP utilizando el láser diodo. Se han descartado 5 casos porque estaban ya intubados en el momento de indicar el tratamiento. Así que se han estudiado retrospectivamente 72 prematuros consecutivos tratados con la misma técnica anestésica: sedación inhalatoria con sevofluorane sin intubación orotraqueal (IOT) asociada a anestésico tópico para mejor tolerancia del blefarostato y de la pinza o el identador.
En el tratamiento de la ROP realizamos una sesión inicial de tratamiento, con fotocoagulación de toda la retina avascular (que denominaremos sesión I), y una o varias sesiones posteriores para comprobación de respuesta completa al tratamiento o necesidad de retratamiento en determinadas zonas (que denominaremos sesión P). En todas estas sesiones se ha utilizado la misma técnica anestésica.
El tratamiento se realizó en quirófano y con un anestesista especializado en pediatría. Incluyó en todos los casos:
- –
Vía periférica con suero de mantenimiento preparada por si fuera necesario utilizar medicación intravenosa (i.v.).
- –
Monitorización con: pulsioximetría, capnografía, presión arterial no invasiva cada 5min, observación continua del paciente y control del electrocardiograma según las recomendaciones de la Sociedad Americana de Anestesiología7.
- –
Mantenimiento de temperatura adecuada para evitar hipotermia mediante aumento de la temperatura del quirófano y utilización de calentadores por aire o manta eléctrica para el paciente.
- –
El agente de elección para la anestesia inhalatoria fue el sevofluorane. Se administra en concentraciones inspiratorias crecientes (2, 4 y 6 %) o en una única alta concentración 6–8 % con mascarilla facial para conseguir una inducción anestésica con hipnosis profunda con buena estabilidad cardiovascular y respiratoria, y posterior mantenimiento con cánulas nasales de presión positiva continua en vía aérea (CPAP) alojadas en orofaringe, con la mínima dosis necesaria para conseguir la inmovilidad del paciente (habitualmente entre 0,4 y el 4 %). Esto permite tener libre la cabecera del paciente.
- –
Instilación de una o dos gotas de colirio anestésico y al minuto colocación del blefarostato con inicio del tratamiento. La dosis de anestésico tópico se puede repetir a los 30 y los 45min.
Se han recogido los siguientes datos en cada paciente:
- –
Edad gestacional (EG) y peso al nacer (PN).
- –
Edad posconcepcional en el momento de la sesión I.
- –
Número de sesiones de tratamiento en cada paciente (sea tratamiento inicial, retratamiento o revisiones).
- –
Tiempo de duración de las sesiones de tratamiento desde el inicio de la inducción hasta la finalización del tratamiento.
- –
Factores de riesgo asociados: displasia broncopulmonar, persistencia de conducto arterial, apneas del prematuro y hemorragia intraventricular (HIV) significativa (grado III-IV).
- –
Complicaciones intraoperatorias y postoperatorias (en las 48h posteriores) tanto en la sesión inicial (sesión I), como en las sesiones posteriores (sesión P).
Para el estudio estadístico descriptivo se ha utilizado la media, desviación estándar y rango en las variables cuantitativas y la proporción en las variables cuantitativas. Se ha utilizado la t de Student para la comparación de medias y la prueba de chi al cuadrado, con corrección de Yates o test exacto de Fisher según los casos, para la comparación de proporciones.
RESULTADOSSe han incluido 72 pacientes consecutivos tratados con láser diodo por ROP desde abril de 1999 hasta agosto de 2005 en el Hospital Infantil de Zaragoza utilizando la técnica anestésica de sedación anestésica inhalatoria combinada con anestesia tópica.
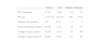
En la tabla 1 se exponen los principales datos de: edad gestacional (EG), peso al nacer (PN), número de sesiones quirúrgicas realizadas por paciente, edad posconcepcional en la sesión I y duración de sesión I y de sesiones P.
Datos clínicos de los pacientes
| Media | DE | Mínimo | Máximo | |
| EG (semanas) | 27,61 | 1,954 | 24 | 32 |
| PN (g) | 1.015,72 | 251,82 | 500 | 1.710 |
| Número de sesiones | 2,5 | 0,91 | 2 | 4 |
| Edad (semanas) sesión I | 34,09 | 1,44 | 32 | 38 |
| Tiempo (min) sesión I | 54,58 | 14,72 | 30 | 90 |
| Tiempo (min) sesión P | 20,48 | 5,88 | 15 | 50 |
DE: desviación estándar; EG: edad gestacional en semanas; PN: peso al nacimiento en gramos; Número de sesiones: número de sesiones quirúrgicas por paciente; edad sesión I: edad posconcepcional en semanas en la sesión I; tiempo sesión I: tiempo de duración en minutos de la sesión I; tiempo sesión P: tiempo de duración en minutos de las sesiones posteriores.
El 100 % de los 72 pacientes presentaba algún grado de displasia broncopulmonar, por lo que se eliminó este dato del estudio. Presentaban apneas del prematuro 31 niños (43,05 %); persistencia de conducto arterial, 41 niños (56,94 %), y hemorragia intraventricular significativa, 18 niños (14,28 %).
Al estudiar los datos de la sesión I encontramos complicaciones intraoperatorias en 12 casos (16 %) en forma de: desaturación (5), considerada como saturación de O2 igual o por debajo del 90 %, apnea prolongada (3) considerada como cese de ventilación espontánea igual o inferior a 10min, bradicardia (3) considerada como frecuencia cardíaca de hasta 100/s y cianosis (1) considerada como coloración azulada en piel y mucosas (fundamentalmente peribucal) significativa, pero sólo 3/12 casos (4,1 %) precisaron intubación. El resto se solucionaron con: técnicas de estimulación, aumento de la FiO2 y disminución transitoria de la proporción del sevofluorane a proporciones por debajo del 1,5 %. De 9 casos, 2 precisaron atropina i.v. (2,77 %) en dosis de 0,015mg/kg. En todos los casos se pudo continuar y completar el tratamiento. No se ha encontrado relación estadísticamente significativa entre la aparición de complicaciones y la media de EG (p = 0,1731), la media de PN (p = 0,4645), los antecedentes de apneas (p = 0,1605), persistencia de conducto arterial (p > 0,9999) o hemorragia intraventricular (p = 0,173). El 100 % de los casos presentaban displasia broncopulmonar, por lo que este dato se desestimó para el estudio. En cuanto a la evolución en las 48h posteriores, aparecieron complicaciones postoperatorias en 4 casos (5,55 %) en forma de cianosis (1), estridor (1) y apneas (2). Ningún caso precisó intubación o medidas especiales. Los tres casos intubados intraoperatoriamente pudieron ser extubados en las 24h posteriores al tratamiento. No se ha encontrado relación estadísticamente significativa entre la presencia de complicaciones posoperatorias y la media de EG (p = 0,1459), la media de PN (p = 0,4475), los antecedentes de apneas (p = 0,5738) o persistencia de conducto arterial (p > 0,9999). Se encontró relación estadísticamente significativa entre la presencia de complicaciones posoperatorias y la presencia de hemorragia intraventricular significativa (p = 0,046).
El número total de sesiones quirúrgicas posteriores después de la sesión inicial fue de 119. Se han encontrado complicaciones intraoperatorias en 4 casos (3,36 %), en forma de: desaturación (2) y bradicardia (2), pero ningún caso precisó intubación. En 2/4 casos se necesitó atropina por vía intravenosa. Se han encontrado 5 casos (4,2 %) de complicaciones posoperatorias en las siguientes 48h, en forma de: cianosis (2), apneas (2) y distensión abdominal (1).
DISCUSIÓNSe ha publicado muy poco sobre técnicas anestésicas en el tratamiento de la ROP. Cuando se usaba la crioterapia, la mayor parte de los autores recomendaban anestesia general con IOT3,5,6. En el Estudio Multicéntrico de Crioterapia para el Tratamiento de la ROP8 se deja a elección de los centros participantes el tipo de anestesia que utilizar, y la forma más habitual de anestesia general es la con IOT. En el Reino Unido se usa este tipo de anestesia con relajación muscular y/o sedación intravenosa en el 77 % de los centros3.
En las publicaciones sobre el láser diodo en el tratamiento de la ROP tampoco se especifica en muchos casos la técnica anestésica utilizada, incluidos los estudios multicéntricos9,10. Algunos autores utilizan sólo anestesia tópica11,12. Otros utilizan sedación intravenosa13–15 e incluso anestesia general con IOT16,17. En ninguna publicación se utiliza una técnica como la que realizamos en nuestro hospital.
Las bases anatómicas y fisiológicas propioceptivas están presentes incluso en neonatos muy prematuros. Los prematuros parecen tener, además, mayor sensibilidad a estímulos dolorosos y respuestas intensificadas a estímulos repetidos18,19 y son más susceptibles a episodios de apneas o bradicardia. El reflejo oculomotor está bien desarrollado en los neonatos, incluidos los prematuros. Esto, junto con la inestabilidad cardiorrespiratoria, hace a estos pacientes especialmente vulnerables cuando se realiza tratamiento para la ROP20, pues se necesita mover con pinza el globo ocular para tratar los 360° de retina o se tiene que utilizar un identador que hace compresión en el globo ocular, maniobras que favorecen la estimulación del reflejo oculocardíaco.
Aunque el láser es menos doloroso que la crioterapia, precisa algún tipo de anestesia, pues puede inducir dolor y estrés al realizar identación escleral, en tratamientos inadvertidos sobre retina profunda o márgenes pupilares en iris rígidos y poco dilatados. Por otro lado, los movimientos del paciente resultan incómodos para el cirujano y los movimientos oculares inadvertidos aumentan el riesgo de daño visual por tratamiento accidental de zonas que no precisan tratamiento y que deben ser preservadas, como el área macular.
La utilización exclusiva de anestesia tópica tiene serias desventajas. No elimina suficientemente los estímulos dolorosos, y llega a asociarse con mayor número de complicaciones durante y después del tratamiento cuando se utilizaba en la crioterapia3. Se puede desencadenar el reflejo oculocardíaco al movilizar el globo ocular para el tratamiento de las diferentes zonas. Por otro lado, debido al tamaño del prematuro, es fácil excederse en el máximo de dosis recomendada cuando se utiliza de forma aislada, pues se deben repetir con frecuencia las instilaciones, con efectos sistémicos por la rápida absorción de estos agentes21. Por último, los movimientos del niño hacen incómodo el acto quirúrgico para el cirujano y los movimientos oculares involuntarios pueden causar fotocoagulación de zonas no deseadas.
La sedación intravenosa disminuye significativamente los estímulos dolorosos y aporta mayor comodidad al cirujano, pero tiene la desventaja fundamental de la dificultad del cálculo de dosis en los prematuros, ya que debido a su inmadurez en el metabolismo de fármacos por las alteraciones hepáticas y la alteración en el aclaramiento renal, hay mayor riesgo de efectos secundarios y toxicidad2, y una mayor dificultad en el tratamiento de las mismas, pues la vida media de los agentes intravenosos es mayor que la de los inhalatorios.
La anestesia general es arriesgada en estos niños. Precisa intubación orotraqueal en un momento en que habitualmente el prematuro ya está extubado y a punto de salir de la unidad de cuidados intensivos, y puede originar nueva dependencia de la oxigenoterapia con problemas importantes en muchos casos para su extubación posterior. Hay, además, más riesgo de infecciones pulmonares, neumotórax y otras complicaciones respiratorias.
La utilización de sedación con agentes inhalatorios halogenados puede tener problemas, pues la profundidad de la sedación con los mismos es proporcional al riesgo de aparición de apneas. El aumento de la fracción inspiratoria (Fi) de estos agentes inhalatorios produce una depresión de la ventilación dependiente de la dosis, con un margen de seguridad más estrecho en los neonatos y los lactantes, pero aun así, el uso racional de estos agentes inhalatorios es seguro, teniendo en cuenta las diferencias fisiológicas y la farmacocinética. En nuestra técnica sólo se utilizan dosis altas en la inducción, pero el mantenimiento con la CPAP precisa dosis mucho menores, con lo que disminuye el riesgo de apneas. Por otro lado, los nuevos agentes halogenados, como el sevofluorane, tienen menos efectos secundarios que los anteriores con menor irritación de la vía aérea, y la ventaja fundamental de que al ser la vía de administración inhalatoria la semivida es muy corta y puede revertirse de forma casi inmediata su acción simplemente bajando la concentración.
La combinación utilizada en nuestro hospital de sedación con agentes inhalatorios mediante cánulas nasales y una mínima cantidad de anestesia tópica tiene resultados aceptables. La proporción de complicaciones intraoperatorias en la sesión inicial es del 16 %, lo que indica que uno de cada 6 o 7 casos lo presentan. Pero sólo el 4% ha derivado en una intubación orotraqueal, que es el objetivo fundamental que hay que evitar con este tipo de anestesia. Por otro lado, en ningún caso las complicaciones impidieron continuar con el procedimiento. Al valorar el tipo de complicaciones y las causas que pueden dar lugar a la aparición de las mismas, se aprecia que fundamentalmente aparecen apneas y desaturaciones. Consideramos que, por una parte, debe tenerse en cuenta la inestabilidad de estos pacientes, hecho que podría mejorarse intentando por todos los medios aumentar su comodidad (p. ej., haciéndolo en las propias unidades de neonatología, lo que evitaría el traslado con las consiguientes incidencias en cambios de temperatura, oscilaciones en FiO2 y saturación de oxígeno. Sin embargo, el espacio físico o la iluminación (pues el láser debe aplicarse en oscuridad) y otros factores no siempre lo permiten y, por otro lado, deben seguirse estrictamente las normas de control de temperatura ambiente, aporte de oxígeno, vigilancia de constantes vitales y, sobre todo, la aplicación de la mínima cantidad de gases que permitan la correcta realización del procedimiento. Consideramos que estos dos aspectos son fundamentales: por un lado, si la sedación es excesiva, es fácil que puedan aparecer apneas, pues la inmadurez del centro respiratorio favorece que una sedación excesiva derive en apnea prolongada, tal como se ha comentado en el párrafo anterior. Por otro lado, si la sedación es escasa, el paciente puede notar dolor que en muchos casos deriva en la aparición de apneas, favorece la aparición de reflejo oculocardíaco o la realización de movimientos que dificulten la aplicación del láser o la aplicación accidental en zonas no deseadas. La proporción de complicaciones tanto en las sesiones posteriores como posoperatoriamente es aún menor. Esto indica que con menor tiempo quirúrgico mejora la situación general del paciente y las consecuencias del procedimiento no tienen una incidencia excesivamente negativa en la evolución del paciente, como puede ocurrir tras otras actuaciones quirúrgicas. Consideramos que esta técnica cumple de forma adecuada el doble requisito de disminuir el estrés y el dolor en el paciente con respecto a otras técnicas y proporcionar comodidad al cirujano, por lo que recomendamos su utilización.