Comparar las variaciones de los ácidos grasos poliinsaturados de cadena larga (LCPUFA) al nacer y al año de edad en niños alimentados con lactancia materna prolongada, lactancia materna de duración media y fórmula artificial.
PacientesUn total de 77 niños sanos a término con alimentación conocida fueron divididos en grupos: el grupo A (n=25) había recibido lactancia prolongada (más de 6 meses); el B (n=26), lactancia media (más de 3 meses y menos de 5), y el C (n=26), cuyos sujetos fueron alimentados únicamente con fórmula artificial. Se midió la proporción de ácidos grasos plasmáticos al nacer y al primer año de vida.
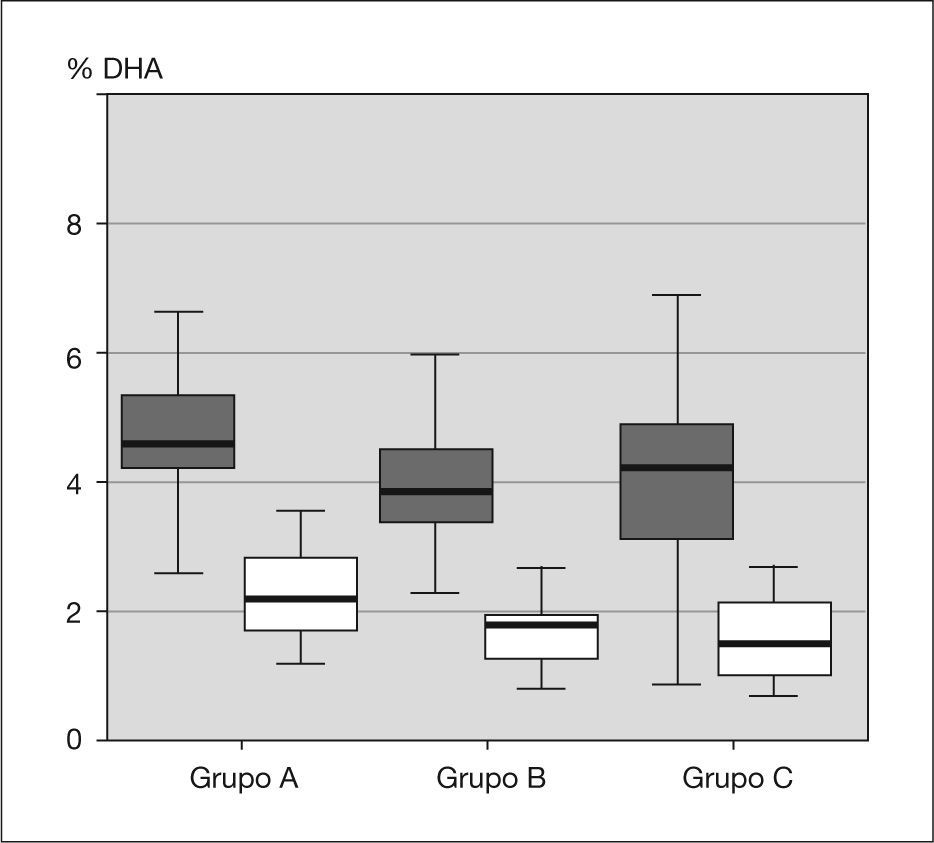
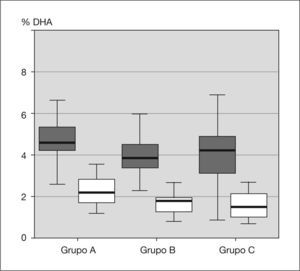
ResultadosNo existen diferencias en el momento del nacimiento. Sin embargo, hay una disminución significativa de la proporción de los principales LCPUFA, ácido docosahexaenoico (DHA) y ácido araquidónico (AA), entre el nacimiento y el primer año de vida. Al año, el porcentaje de DHA varía significativamente entre el grupo A y los otros dos: 2,46±0,84 frente a 1,80±0,48 y 1,89±0,75 (p<0,01).
Conclusiones1. Al nacer no existen diferencias en el contenido de LCPUFA. 2. Se observa una disminución significativa de los principales LCPUFA con la edad. 3. El grupo con lactancia materna prolongada posee mayores proporciones de DHA que los otros dos. Por consiguiente, la lactancia durante más de 6 meses es necesaria para obtener valores más elevados de DHA.
Compare the variations of long-chain polyunsaturated fatty acids (LCPUFA) levels at birth and at the first year of age in children on extended breast-feeding, medium term breast-feeding and formula feeding.
Patients77 healthy term infants divided in three groups: A (N=25): extended breast-feeding (more than 6 months), B (N=26): medium term breast-feeding (more than 3 and less than 5 months) and C (N=26): exclusive formula feeding. Fatty acids in plasma were measured at birth and at the first year of age.
ResultsThere were no differences in the levels at birth. However, there is a significant decrease in the proportion of the main LCPUFA, docosahexaenoic acid (DHA) and arachidonic acid (AA), between birth and the first year of age. At one year of age, the percentage of DHA in Group A differs significantly between the other two: 2.46±0.84 vs. 1.80±0.48 and 1.89±0.75 (p<0.01).
Conclusions1. At birth, there are no differences in LCPUFA. 2. A significant decrease in the main LCPUFA is observed with age. 3. The extended breast-feeding group shows higher DHA levels than the other two. Therefore, breast-feeding for more than 6 months is required to achieve higher plasma DHA values.
La importancia de los ácidos grasos poliinsaturados de larga cadena (LCPUFA) en la nutrición infantil no sólo se debe al progresivo enriquecimiento del sistema nervioso central en estos ácidos1,2, sino también de la función bioactiva de los eicosanoides, derivados de la familia n-3 y n-6 de los ácidos grasos poliinsaturados de cadena larga (LCPUFA)3,4. La controversia nutricional sobre si se debe añadir o no LCPUFA n-3 y n-6 a la dieta del lactante se está inclinando hacia la primera opción. Esto no sólo se debe al hecho de que la leche materna los contiene5, sino a que la adición de precursores exclusivos en la fórmula artificial acarrea unos patrones bioquímicos de membrana (incluyendo el cerebro) diferentes de los de la lactancia materna3, y también diferencias favorables en su uso en algunos estudios funcionales6–14. La conclusión podría ser que existen diferencias entre una nutrición posiblemente inadecuada (uso exclusivo de precursores), nutrición adecuada (uso de fórmula suplementada con LCPUFA) y nutrición óptima (lactancia materna).
La biodisponibilidad de los LCPUFA durante el segundo semestre de vida puede estar comprometida, ya que es común la combinación indeseada de que muchos lactantes son alimentados con leche materna durante solamente durante un corto período de tiempo, e inician la alimentación complementaria con alimentos que contengan LCPUFA preformado (huevos, vísceras, pescado graso) muy tarde. Esto da lugar a una brecha entre los 3 meses y el año de vida de ingesta directa de LCPUFA.
En este sentido, sólo se han publicado dos estudios bioquímicos9,11. El primero, realizado en niños normales tras 6 semanas de lactancia materna exclusiva, se aleatorizó en dos grupos con diferente alimentación hasta el primer año de vida: fórmula suplementada con LCPUFA y fórmula convencional. Se encontraron diferencias bioquímicas entre los grupos a las 17 y 52 semanas de edad, con valores de ácido docosahexaenoico (DHA) más elevados en el grupo alimentado con fórmula suplementada. Además, se encontraron diferencias funcionales, como la agudeza visual a las 17 semanas, pero no a las 52 semanas de edad. El segundo estudio se llevó a cabo en recién nacidos a término que se alimentaron con lactancia materna hasta los 4–6 meses de edad, y posteriormente se aleatorizó a alimentación con fórmula convencional o suplementada con LCPUFA hasta el año de edad. El resultado mostró una reducción del 50 % del contenido de DHA en eritrocitos de los niños alimentados con fórmula convencional.
El presente trabajo es un estudio bioquímico nuevo, ya que realizamos los análisis al nacer y al año de edad, y se conoce el tipo de alimentación seguida. El objetivo es realizar un estudio sobre la relación entre la lactancia y las estructuras que contienen LCPUFA en este período en que la nutrición es tan importante y, sin embargo, se encuentra poco estudiada, es decir, el estado de los LCPUFA en el primer año de edad y la correlación individual con los valores al nacimiento. Este trabajo trata también de conocer si la lactancia materna prolongada es decisiva en los valores plasmáticos de LCPUFA al año de edad, teniendo en cuenta que la toma de otros alimentos que contienen LCPUFA, como pescado, huevos y vísceras, se ha trasladado más allá del año de edad, según las recomendaciones de la Sociedad Pediatrica Europea de Gastroenterología y Nutrición (ESPGAN)15.
MATERIALES Y MÉTODOSSujetosLa declaración de Helsinki no permite la obtención de muestras de niños sanos, de ahí la dificultad de obtenerlas para este tipo de estudios. Nuestras muestras fueron obtenidas merced a la existencia de una seroteca creada para el “estudio de la etiología de la diabetes mellitus y el tipo de lactancia” para el que se obtuvieron los permisos y el consentimiento ético necesarios16. Este banco contenía muestras de 300 niños al nacer y al año de vida, y su perfil nutricional era conocido; sin embargo, no se conocen los datos auxológicos. Se eligieron 77 muestras que correspondían a niños sanos con historia de gestación normal y un peso adecuado, que puede representar nuestra población media. Así, se establecieron tres grupos. El grupo A (n = 25) había recibido lactancia materna prolongada (más de 6 meses); el grupo B, lactancia media (más de 3 y menos de 5 meses), y el grupo C alimentación con fórmula artificial convencional. Este estudio fue aprobado por el comité ético del hospital, y se obtuvo consentimiento informado por escrito de los padres o tutores.
MétodosLa extracción de los lípidos de las muestras se llevó a cabo con el método de Folch et al17. La reacción para la formación de ésteres metílicos de los ácidos grasos se realizó según el método de Lepage y Roy18, utilizando ácido tridecanoico como patrón interno. Los ésteres metílicos se separaron por medio de un cromatógrafo de gases HP 5890 serie II (Palo Alto, California, EE.UU.), utilizando una columna capilar de sílice fundida SP 2330 (Supelco Inc, Bellefonte, EE.UU.) de 30m de longitud, 0,25mm de diámetro interno y 0,20μm de espesor de película. El tipo de detección utilizada fue ionización de llama (FID). La rampa de temperaturas comenzaba manteniendo el horno a 80°C durante 1min, aumentando a 50°C/min hasta 140°C, a 5°C/min hasta 190°C; esta temperatura se mantenía durante 5min. Finalmente, se aumentaba la temperatura hasta 215°C a 5°C/min, y se mantenía durante 15min. La temperatura del inyector y del detector era de 250°C. Se utilizó helio como gas portador a una presión de 0,5 bares. La identificación de los ácidos grasos se efectuó por comparación de los tiempos de retención con un patrón comercial (NuCheck, Elysian, EE.UU.). La cuantificación se realizó mediante integración manual. Los resultados se expresaron en valores porcentuales con respecto a la suma total de ácidos grasos.
Análisis estadísticoEl análisis estadístico se realizó mediante análisis de varianza univariante (ANOVA), con el test de Scheffé para las poblaciones normales. Las poblaciones con distribución no normal para el test Kolmogorov-Smirnov se estudiaron mediante el test de Willcoxon y Mann-Whitney.
Estudio estadísticoLas diferencias de DHA entre grupos se estudiaron utilizando un modelo general lineal. La homogeneidad de la varianza y la normalidad se establecieron mediante los test de Levene y de Shaphiro-Wilk, respectivamente. Para comparaciones post-hoc se utilizó el test de Sidak. El análisis ANOVA univariante se utilizó para comparar grupos al nacimiento. Se consideró un valor de p de 0,05 o menor como estadísticamente significativo. Los análisis se realizaron con el programa SPSS, versión 10.0 para Windows.
RESULTADOSLas tablas 1–3 muestran los valores basales y finales del perfil de ácidos grasos para los tres grupos. Como se esperaba, no existen diferencias en la situación basal de los ácidos grasos en los tres grupos, ya que todos fueron obtenidos de neonatos sanos al nacimiento. Sin embargo, el grupo A muestra valores de DHA (fig. 1) significativamente mayores que los otros dos grupos al año de vida (2,46 ± 0,84 frente a 1,80 ± 0,48 y 1,89 ± 0,75; p < 0,01). El tipo de alimentación explicaba el 14 % de la variabilidad de DHA.
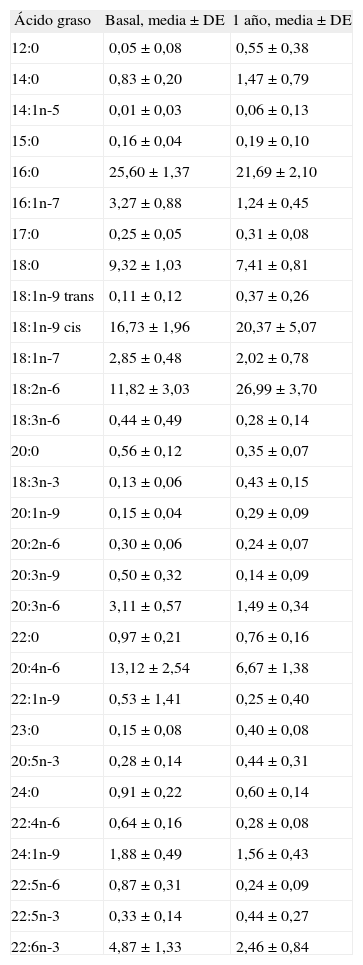
Porcentaje en peso de los ácidos grasos al nacer (basal) y al año de vida en los sujetos del grupo A (lactancia prolongada más de 6 meses)
| Ácido graso | Basal, media ± DE | 1 año, media ± DE |
| 12:0 | 0,05 ± 0,08 | 0,55 ± 0,38 |
| 14:0 | 0,83 ± 0,20 | 1,47 ± 0,79 |
| 14:1n-5 | 0,01 ± 0,03 | 0,06 ± 0,13 |
| 15:0 | 0,16 ± 0,04 | 0,19 ± 0,10 |
| 16:0 | 25,60 ± 1,37 | 21,69 ± 2,10 |
| 16:1n-7 | 3,27 ± 0,88 | 1,24 ± 0,45 |
| 17:0 | 0,25 ± 0,05 | 0,31 ± 0,08 |
| 18:0 | 9,32 ± 1,03 | 7,41 ± 0,81 |
| 18:1n-9 trans | 0,11 ± 0,12 | 0,37 ± 0,26 |
| 18:1n-9 cis | 16,73 ± 1,96 | 20,37 ± 5,07 |
| 18:1n-7 | 2,85 ± 0,48 | 2,02 ± 0,78 |
| 18:2n-6 | 11,82 ± 3,03 | 26,99 ± 3,70 |
| 18:3n-6 | 0,44 ± 0,49 | 0,28 ± 0,14 |
| 20:0 | 0,56 ± 0,12 | 0,35 ± 0,07 |
| 18:3n-3 | 0,13 ± 0,06 | 0,43 ± 0,15 |
| 20:1n-9 | 0,15 ± 0,04 | 0,29 ± 0,09 |
| 20:2n-6 | 0,30 ± 0,06 | 0,24 ± 0,07 |
| 20:3n-9 | 0,50 ± 0,32 | 0,14 ± 0,09 |
| 20:3n-6 | 3,11 ± 0,57 | 1,49 ± 0,34 |
| 22:0 | 0,97 ± 0,21 | 0,76 ± 0,16 |
| 20:4n-6 | 13,12 ± 2,54 | 6,67 ± 1,38 |
| 22:1n-9 | 0,53 ± 1,41 | 0,25 ± 0,40 |
| 23:0 | 0,15 ± 0,08 | 0,40 ± 0,08 |
| 20:5n-3 | 0,28 ± 0,14 | 0,44 ± 0,31 |
| 24:0 | 0,91 ± 0,22 | 0,60 ± 0,14 |
| 22:4n-6 | 0,64 ± 0,16 | 0,28 ± 0,08 |
| 24:1n-9 | 1,88 ± 0,49 | 1,56 ± 0,43 |
| 22:5n-6 | 0,87 ± 0,31 | 0,24 ± 0,09 |
| 22:5n-3 | 0,33 ± 0,14 | 0,44 ± 0,27 |
| 22:6n-3 | 4,87 ± 1,33 | 2,46 ± 0,84 |
DE: desviación estándar.
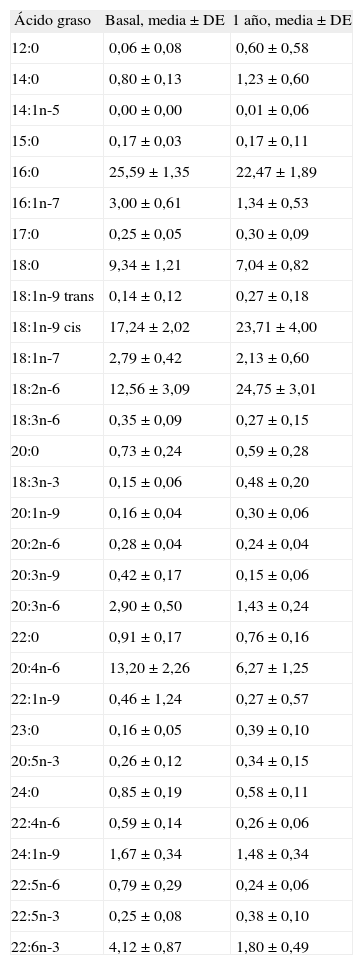
Porcentaje en peso de los ácidos grasos al nacer (basal) y al año de vida en los sujetos del grupo B (lactancia media entre 3 y 5 meses)
| Ácido graso | Basal, media ± DE | 1 año, media ± DE |
| 12:0 | 0,06 ± 0,08 | 0,60 ± 0,58 |
| 14:0 | 0,80 ± 0,13 | 1,23 ± 0,60 |
| 14:1n-5 | 0,00 ± 0,00 | 0,01 ± 0,06 |
| 15:0 | 0,17 ± 0,03 | 0,17 ± 0,11 |
| 16:0 | 25,59 ± 1,35 | 22,47 ± 1,89 |
| 16:1n-7 | 3,00 ± 0,61 | 1,34 ± 0,53 |
| 17:0 | 0,25 ± 0,05 | 0,30 ± 0,09 |
| 18:0 | 9,34 ± 1,21 | 7,04 ± 0,82 |
| 18:1n-9 trans | 0,14 ± 0,12 | 0,27 ± 0,18 |
| 18:1n-9 cis | 17,24 ± 2,02 | 23,71 ± 4,00 |
| 18:1n-7 | 2,79 ± 0,42 | 2,13 ± 0,60 |
| 18:2n-6 | 12,56 ± 3,09 | 24,75 ± 3,01 |
| 18:3n-6 | 0,35 ± 0,09 | 0,27 ± 0,15 |
| 20:0 | 0,73 ± 0,24 | 0,59 ± 0,28 |
| 18:3n-3 | 0,15 ± 0,06 | 0,48 ± 0,20 |
| 20:1n-9 | 0,16 ± 0,04 | 0,30 ± 0,06 |
| 20:2n-6 | 0,28 ± 0,04 | 0,24 ± 0,04 |
| 20:3n-9 | 0,42 ± 0,17 | 0,15 ± 0,06 |
| 20:3n-6 | 2,90 ± 0,50 | 1,43 ± 0,24 |
| 22:0 | 0,91 ± 0,17 | 0,76 ± 0,16 |
| 20:4n-6 | 13,20 ± 2,26 | 6,27 ± 1,25 |
| 22:1n-9 | 0,46 ± 1,24 | 0,27 ± 0,57 |
| 23:0 | 0,16 ± 0,05 | 0,39 ± 0,10 |
| 20:5n-3 | 0,26 ± 0,12 | 0,34 ± 0,15 |
| 24:0 | 0,85 ± 0,19 | 0,58 ± 0,11 |
| 22:4n-6 | 0,59 ± 0,14 | 0,26 ± 0,06 |
| 24:1n-9 | 1,67 ± 0,34 | 1,48 ± 0,34 |
| 22:5n-6 | 0,79 ± 0,29 | 0,24 ± 0,06 |
| 22:5n-3 | 0,25 ± 0,08 | 0,38 ± 0,10 |
| 22:6n-3 | 4,12 ± 0,87 | 1,80 ± 0,49 |
DE: desviación estándar.
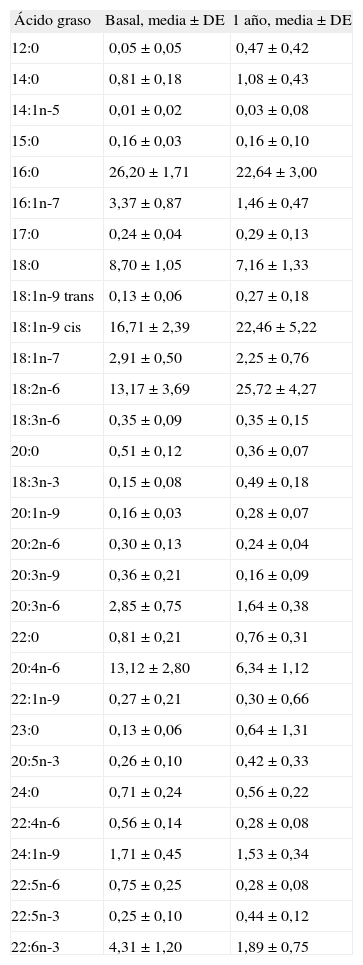
Porcentaje en peso de los ácidos grasos al nacer (basal) y al año de vida en los sujetos del grupo C (alimentación por fórmula)
| Ácido graso | Basal, media ± DE | 1 año, media ± DE |
| 12:0 | 0,05 ± 0,05 | 0,47 ± 0,42 |
| 14:0 | 0,81 ± 0,18 | 1,08 ± 0,43 |
| 14:1n-5 | 0,01 ± 0,02 | 0,03 ± 0,08 |
| 15:0 | 0,16 ± 0,03 | 0,16 ± 0,10 |
| 16:0 | 26,20 ± 1,71 | 22,64 ± 3,00 |
| 16:1n-7 | 3,37 ± 0,87 | 1,46 ± 0,47 |
| 17:0 | 0,24 ± 0,04 | 0,29 ± 0,13 |
| 18:0 | 8,70 ± 1,05 | 7,16 ± 1,33 |
| 18:1n-9 trans | 0,13 ± 0,06 | 0,27 ± 0,18 |
| 18:1n-9 cis | 16,71 ± 2,39 | 22,46 ± 5,22 |
| 18:1n-7 | 2,91 ± 0,50 | 2,25 ± 0,76 |
| 18:2n-6 | 13,17 ± 3,69 | 25,72 ± 4,27 |
| 18:3n-6 | 0,35 ± 0,09 | 0,35 ± 0,15 |
| 20:0 | 0,51 ± 0,12 | 0,36 ± 0,07 |
| 18:3n-3 | 0,15 ± 0,08 | 0,49 ± 0,18 |
| 20:1n-9 | 0,16 ± 0,03 | 0,28 ± 0,07 |
| 20:2n-6 | 0,30 ± 0,13 | 0,24 ± 0,04 |
| 20:3n-9 | 0,36 ± 0,21 | 0,16 ± 0,09 |
| 20:3n-6 | 2,85 ± 0,75 | 1,64 ± 0,38 |
| 22:0 | 0,81 ± 0,21 | 0,76 ± 0,31 |
| 20:4n-6 | 13,12 ± 2,80 | 6,34 ± 1,12 |
| 22:1n-9 | 0,27 ± 0,21 | 0,30 ± 0,66 |
| 23:0 | 0,13 ± 0,06 | 0,64 ± 1,31 |
| 20:5n-3 | 0,26 ± 0,10 | 0,42 ± 0,33 |
| 24:0 | 0,71 ± 0,24 | 0,56 ± 0,22 |
| 22:4n-6 | 0,56 ± 0,14 | 0,28 ± 0,08 |
| 24:1n-9 | 1,71 ± 0,45 | 1,53 ± 0,34 |
| 22:5n-6 | 0,75 ± 0,25 | 0,28 ± 0,08 |
| 22:5n-3 | 0,25 ± 0,10 | 0,44 ± 0,12 |
| 22:6n-3 | 4,31 ± 1,20 | 1,89 ± 0,75 |
DE: desviación estándar.
También podemos observar una reducción notable de la concentración de DHA y ácido araquidónico (AA) entre los neonatos y el primer año de vida en los tres grupos. Por lo tanto, el porcentaje de AA y DHA de 0 a 1 año de vida desciende de 13,12 ± 2,54 a 6,67 ± 1,38 (p < 0,001); y de 4,87 ± 1,33 a 2,46 ± 0,84 (p < 0,001) en el grupo A. En el grupo B, de 13,20 ± 2,26 a 6,27 ± 1,25 (p < 0,001) y de 4,12 ± 0,87 a 1,80 ± 0,49 (p < 0,001). Finalmente, el grupo C desde 13,12 ± 2,80 a 6,34 ± 1,12 (p < 0,001) y desde 4,31 ± 1,20 a 1,89 ± 0,75 (p < 0,001). No existía correlación positiva entre los valores individuales al nacimiento y al primer año de vida en ninguno de los grupos estudiados.
DISCUSIÓNEste trabajo se trata de un estudio bioquímico basado en la existencia de una seroteca que contiene muestras pareadas (0–1 años de edad) y datos nutricionales, pero no existe un seguimiento directo de la población estudiada. Por esta razón, desafortunadamente no poseemos datos auxológicos que es la limitación más importante de este estudio.
Nuestros resultados muestran que los tres grupos estudiados (lactancia materna prolongada, media y alimentación con fórmula artificial), como se esperaba, comienzan con unos valores de DHA y AA similares (sangre del cordón umbilical), y que al año de edad, el grupo que siguió lactancia materna durante más de 6 meses presentaba una proporción mayor de DHA que los otros dos, cuyos valores no son significativamente diferentes. Además, la disminución de la proporción de ambos ácidos grasos desde el nacimiento hasta el primer año de edad puede ser considerada fisiológica.
Tomando las tres poblaciones como una sola, no existe correlación entre los valores individuales iniciales en el cordón umbilical y al año de edad, lo que indica que los factores ambientales tienen un papel decisivo en el establecimiento de los valores al año de edad. Es sorprendente el hecho de que la toma de LCPUFA preformado en la leche materna durante 3–5 meses no tiene ninguna proyección en los valores al año de edad cuando éstos son comparados con los valores de los niños alimentados con fórmula convencional. Este hallazgo se encuentra en aparente controversia con el estudio llevado a cabo en Francia sobre niños sanos19 en los que se encontró una proyección entre los valores de los ácidos grasos al nacer y los que presentaban a los dos meses de edad (tiempo medio del destete en Francia). Es posible que el estado de los LCPUFA en el neonato no se proyecte más allá del primer trimestre de vida y que, más tarde, los factores ambientales (la toma de LCPUFA preformado o no) no parecen ser importantes, como muestra nuestro estudio.
En cualquier caso, el uso exclusivo de los precursores (ácido linoleico y ácido α-linolénico) presentes en fórmula convencional está aparentemente adaptado para mantener la concentración de n-6 LCPUFA (ya que no existe ninguna diferencia en la concentración de AA entre los grupos a cualquier edad) pero no mantienen los niveles de n-3 LCPUFA, ya que se encuentran diferencias en los niveles de DHA al año de edad en el grupo con lactancia prolongada.
Es difícil comparar nuestros resultados con los únicos estudios funcionales y bioquímicos encontrados en la bibliografía durante este período de vida9,11,14 ya que el diseño es diferente. Estos trabajos incluyen valores de DHA y AA al año de edad, pero no al nacer, ya que la aleatorización de los grupos (fórmula suplementada con LCPUFA o fórmula convencional) comienza a las 6 semanas en el primer estudio, y entre los 4 y los 6 meses de edad en el segundo, después de un período de lactancia inicial en todos los casos. Además, el primer estudio bioquímico tiene lugar a las 17 semanas, y sus resultados se expresan como concentraciones, mientras que los nuestros lo hacen en porcentaje. Otros estudios, que se ocupan en la evaluación de la agudeza visual o de otros parámetros en niños, incluyen la alimentación con fórmula artificial suplementada con DHA y AA, pero no incluyen valores al nacer, y por tanto, tampoco son comparables7,20,21.
Nuestros resultados señalan la necesidad de mantener la toma de DHA preformado durante el primer año de vida si deseamos obtener valores más elevados al año de edad. Dado que es lo que se obtiene con la lactancia materna, debe ser considerado óptimo. A la vista de los resultados, los pediatras tenemos una razón más para recomendar la lactancia materna prolongada tanto tiempo como sea posible. La lactancia media de entre 3 a 5 meses, no garantiza el adecuado estatdo de DHA al primer año de vida (similar a los valores obtenidos tras lactancia artificial), probablemente debido a tres causas: 1. la toma de DHA preformado cesa al interrumpirse la lactancia; 2. es difícil sintetizar DHA a partir de su precursor, el ácido α-linolénico, tanto en animales como en humanos22–26, y 3. la toma de DHA de la dieta está restringida, ya que las guías recientes de la ESPGAN recomiendan la supresión del huevo y del pescado durante el primer año de vida debido a problemas alérgicos.
Por consiguiente, si el destete tiene lugar hacia el quinto mes de vida, la dieta infantil idealmente debe incluir DHA, y puesto que su aporte no es posible por medio del beikost, al estar retardada por las recomendaciones de la ESPGAN, sería necesaria la disponibilidad de DHA mediante una formula suplementada tipo 2 (para el segundo semestre de vida).
Este trabajo ha sido parcialmente financiado por los proyectos RGDM (G03/212) y RCMN (G03/08) del Instituto de Salud Carlos III, Ministerio de Sanidad.