El objetivo de este estudio fue evaluar el impacto de un conjunto de 5 intervenciones sobre la incidencia de infecciones relacionadas con la asistencia sanitaria en una unidad de Neonatología de nivel iii.
Material y métodosEstudio cuasiexperimental pre-postintervención. Se incluyó a aquellos prematuros con peso al nacimiento<1.500 g o edad gestacional<32 semanas que ingresaron en los 12 meses previos y posteriores a la implantación de las medidas (enero del 2014). Las intervenciones consistieron en optimizar la higiene de manos, protocolizar la inserción y la manipulación de catéteres intravenosos centrales, fomentar la alimentación con leche materna, implantar una política de uso racional de antibióticos y establecer un sistema de vigilancia epidemiológica de gérmenes multirresistentes. Como variable principal se analizó la densidad de incidencia de infecciones relacionadas con la asistencia sanitaria antes y después de implementar las medidas.
ResultadosFueron incluidos 33 pacientes en cada período, homogéneos en edad gestacional, peso y otras variables demográficas. Se constató una densidad de incidencia de 8,7 y 2,7 infecciones/1.000 días de estancia en los períodos pre y postintervención respectivamente (p<0,05). También se halló una disminución estadísticamente significativa en el porcentaje de días en ventilación mecánica, así como de pacientes que recibieron hemoderivados y fármacos vasoactivos.
ConclusionesEsta estrategia, basada en la puesta en marcha de 5 medidas concretas, fue efectiva en la disminución de infecciones relacionadas con la asistencia sanitaria en una unidad con tasas elevadas de dichas infecciones. Esta reducción pudo contribuir a una menor tasa de empleo de ventilación mecánica, hemoderivados y fármacos vasoactivos en el período postintervención.
An evaluation is made of the impact of a series of five interventions on the incidence of hospital-related infections in a level iii neonatal unit.
Material and methodsQuasi-experimental, pre-post intervention study, which included preterm infants weighing 1,500g at birth or delivered at <32 weeks gestation, admitted in the 12 months before and after the measures were implemented (January 2014). The measures consisted of: optimising hand washing, following a protocol for insertion and handling of central intravenous catheters, encouraging breastfeeding; applying a protocol for rational antibiotic use, and establishing a surveillance system for multi-resistant bacteria. The primary endpoint was to assess the incidence of hospital-acquired infections before and after implementing the interventions.
ResultsThirty-three matched patients were included in each period. There was an incidence of 8.7 and 2.7 hospital-related infections/1,000 hospital stay days in the pre- and post-intervention periods, respectively (P<.05). Additionally, patients in the treatment group showed a statistically-significant decrease in days on mechanical ventilation, use of blood products, and vasoactive drugs.
ConclusionsThe strategy, based on implementing five specific measures in a unit with a high rate of hospital-related infections, proved effective in reducing their incidence. This reduction could contribute to lowering the use of mechanical ventilation, blood products, and vasoactive drugs.
Las infecciones relacionadas con la asistencia sanitaria (IRAS) son uno de los problemas más importantes a los que nos enfrentamos en el manejo del gran inmaduro en las Unidades de Cuidados Intensivos Neonatales (UCIN), siendo una de las causas fundamentales de mortalidad y morbilidad en esta población. La Organización Mundial de la Salud estima que ocurren 4 millones de muertes neonatales al año, de las cuales un tercio están relacionadas con infecciones severas1.
La incidencia de IRAS es superior en los pacientes con peso al nacimiento < 1.500 g y en ellos la mortalidad es mayor2. Por otro lado, el uso indiscriminado de antibióticos puede favorecer la infección por patógenos resistentes, que se asocian con tasas más altas de mortalidad3. Es necesario implantar estrategias efectivas en las UCIN que prevengan la aparición de IRAS4.
Entre los factores que predisponen al desarrollo de IRAS encontramos aquellos intrínsecos del paciente, como son la edad gestacional y peso al nacimiento, predisposición genética, permeabilidad de las barreras cutáneo-mucosas, el sexo masculino y la inmunodepresión5, y los extrínsecos derivados de las intervenciones llevadas a cabo en las UCIN.
De los factores extrínsecos destacan el uso de dispositivos externos, como son los de soporte ventilatorio y especialmente el uso de catéteres intravenosos centrales5,6 y la administración de nutrición parenteral7. El otro factor clave es el humano. La pobre adherencia a las medidas de higiene de manos y las ratios enfermera-paciente inapropiadas se asocian a un aumento en la incidencia de IRAS y de brotes epidémicos por gérmenes multirresistentes8.
Otros factores extrínsecos que se han asociado con un aumento en la incidencia de IRAS son el retraso en el inicio de la alimentación enteral, la administración de ranitidina, la exposición prolongada a terapia antibiótica y el uso de esteroides posnatales5,9.
La bibliografía respecto a la prevención de las IRAS es amplia. Dentro de las medidas propuestas se incluyen la higiene de manos10, manipular de forma aséptica los catéteres intravenosos11, fomentar la alimentación con lactancia materna12, limitar el uso de antibióticos13 y vigilar la colonización por gérmenes multirresistentes8.
Presentamos un estudio basado en un protocolo que incorpora 5 medidas para disminuir las IRAS en prematuros grandes inmaduros.
Material y métodosEl objetivo principal del estudio es evaluar el impacto de un paquete de 5 intervenciones, aplicadas durante un período de 12 meses, sobre la incidencia de IRAS en la población de prematuros grandes inmaduros.
Población y métodoDiseño del estudioEstudio cuasiexperimental pre-postintervención llevado a cabo en una UCIN de nivel IIIB.
Sujetos del estudioFueron incluidos en este estudio aquellos prematuros con peso al nacimiento < 1.500 gr o edad gestacional < 32 semanas que ingresaron en la UCIN en el período comprendido entre enero del 2013 y enero del 2014 (período preintervención) y de enero del 2014 a enero del 2015 (período postintervención). Se excluyó a aquellos casos con fallecimiento en las primeras 72 h de vida.
DefinicionesInfecciones relacionadas con la asistencia sanitariaFueron consideradas como IRAS los episodios de sepsis neonatal tardía (SNT), neumonías asociadas a ventilación (NAV) y episodios de enterocolitis necrosante (NEC).
Se consideró como SNT la presencia, en pacientes con edad posnatal>72 h, de 2 criterios clínicos indicativos de infección sistémica y 2 criterios analíticos de los referidos en la tabla 1. Definimos como SNT confirmada aquellos casos en los que se aisló el germen causal en el hemocultivo y SNT probable aquellos casos con hemocultivo negativo.
Criterios clínicos y analíticos en la definición de SNT
| Criterios clínicos | Criterios analíticos |
|---|---|
| Alteración de la temperatura corporal Temperatura central>38°C o<36°C y/o alteración del gradiente térmico | Recuento leucocitario < 4.000×109 células/l o > 20.000×109 células/l |
| Inestabilidad cardiovascular Bradicardia o taquicardia Ritmo inestable Oligoanuria (< 1ml/kg/h) Hipotensión Cutis reticular o mala perfusión periférica | Recuento de plaquetas < 100.000 células/l |
| Proteína C reactiva > 1,5mg/dl | |
| Procalcitonina ≥ 2ng/ml | |
| Lesiones cutáneas y subcutáneas Rash petequial o esclerema | |
| Inestabilidad respiratoria Episodios de apnea o taquipnea y/o aumento de la necesidad de oxígeno y/o aumento del soporte ventilatorio | Intolerancia a la glucosa (recibiendo aporte adecuado y confirmada en 2 determinaciones) Hiperglucemia (> 180mg/dl) o hipoglucemia (< 45mg/dl) |
| Gastrointestinales Intolerancia a alimentación, distensión abdominal o deterioro de la succión | Acidosis metabólica Exceso de bases<–10 mEq/l o lactato sérico>2mmol/l |
| Neurológicos Irritabilidad, letargia o hipotonía |
Modificada de Rossi y Botgros29.
Se consideró sepsis relacionada con el catéter (SRC) aquellos casos de SNT con hemocultivo periférico positivo junto con el aislamiento del mismo germen (mismo tipo y antibiograma) en la punta del catéter. También fueron catalogadas como SRC aquellas bacteriemias no atribuibles a otro foco infeccioso desarrolladas en presencia de catéter intravascular14.
Los casos de NAV fueron definidos sobre la base del cumplimiento de los siguientes 3 criterios (33): 1) imagen radiológica compatible; 2) compromiso del intercambio gaseoso, y 3) al menos 4 de los siguientes signos y síntomas: inestabilidad térmica, bradicardia, taquicardia, apnea, taquipnea, distrés respiratorio, secreciones respiratorias, proteína C reactiva>2mg/dl, ratio neutrófilos inmaduros/totales>0,2.
Se consideraron como episodios de NEC aquellos casos que presentaron al menos 2 signos clínicos indicativos con al menos uno de los siguientes criterios: neumoperitoneo, neumatosis intestinal, asas de intestino delgado inmóviles de forma persistente15.
Se definió como brote por germen multirresistente al aislamiento de la misma bacteria en 2 o más pacientes en un plazo inferior a 2 semanas. Dicha bacteria debió mostrar resistencia a 3 o más familias de antibióticos, a los que habitualmente es sensible, incluyendo betalactámicos, carbapenems, aminoglucósidos y quinolonas16,17.
Variables de estudioVariable principalEl impacto de las intervenciones se evaluó comparando la densidad de incidencia, definida como número de episodios de IRAS por 1.000 días de estancia en Neonatología. Se contrastó igualmente la proporción de grandes inmaduros con al menos un episodio de IRAS durante su ingreso en Neonatología.
Se describió la proporción, respecto al total de IRAS, de SRC, SNT de origen distinto del catéter, NAV y NEC en cada período. Se comparó de forma independiente la densidad de incidencia de SRC (definida como número de SRC por 1.000 días de catéter central) en ambos períodos.
Otras variables de interésEl uso de antibioticoterapia se cuantificó mediante el porcentaje de días de estancia recibiendo alguna pauta de antibióticos sistémicos. Se analizaron de forma independiente los días de antibioticoterapia global y empírica. Como empírica se consideraron los días de antibiótico sin proceso infeccioso documentado. El uso de leche materna se evaluó cuantificando el porcentaje de pacientes que recibían leche materna de forma exclusiva o parcial en los días 14 y 28 de vida.
Se recogieron otros datos de interés para el estudio a partir de la historia clínica del paciente, como datos demográficos generales y otros relacionados con su curso clínico.
Procedimiento y recogida de datosDescripción de las intervencionesDurante el período comprendido entre septiembre del 2013 y diciembre del 2013 se llevaron a cabo una revisión bibliográfica y una selección de las intervenciones. Se elaboró un cronograma que recogió los plazos para el diseño de las estrategias, elaboración de protocolos y grabación de videos. En enero del 2014 se llevó a cabo la difusión entre el personal y el proceso de implantación.
- 1.
Política de higiene y lavado de manos. Se realizaron sesiones formativas para la totalidad del personal en las que se revisaron los «5 momentos para el lavado de manos» propuestos por la Organización Mundial de la Salud, la técnica de los «6 pasos para la correcta higiene de manos» y el uso de solución hidroalcólica18,19.
- 2.
Protocolo de asepsia durante la inserción y manipulación del catéter central. Se consensuó un protocolo resumiendo los aspectos relacionados con la inserción del catéter central, el mantenimiento del apósito y la vigilancia del sitio de inserción, preparación de medicación de forma aséptica, manipulación y mantenimiento de los sistemas de infusión y conexiones y retirada del catéter central. Se grabaron y distribuyeron 3 vídeos resumiendo los procedimientos de inserción del catéter central de acceso periférico y la manipulación del mismo. Se elaboraron e implantaron listados de verificación a cumplimentar por la enfermera responsable del paciente. Se establecieron políticas de retirada precoz de catéteres centrales.
- 3.
Iniciativas para fomentar la lactancia materna. Se implantó un conjunto de intervenciones encaminadas a incrementar las tasas de lactancia materna (tabla 2)20. Durante 2014 se realizaron talleres formativos revisando diferentes aspectos relacionados con la lactancia.
Tabla 2.Intervenciones para incrementar las tasas de lactancia materna
Visita antenatal (en los casos posibles) de los nacimientos de prematuros grandes inmaduros
Visita a la madre lo antes posible tras el parto para discutir y asesorar sobre las opciones de alimentación del bebé
Supervisión inicial de la técnica de extracción
Apoyo y vigilancia de la producción de leche durante las 2 primeras semanas y en lo sucesivo en los casos necesariosAdministración de calostro recién extraído tan pronto esté disponible durante los primeros días
Limitar las situaciones en que se interrumpe la alimentación trófica con leche materna
Fomentar e incrementar los períodos de método canguroModificada de Smith y Embleton20.
- 4.
Política de uso racional de antibióticos. Se elaboró un protocolo para minimizar la exposición a antibióticos que tuvo como ejes fundamentales: 1) selección más estricta de circunstancias en las que se inicia antibioticoterapia, omitiéndola en grandes inmaduros con bajo riesgo de infección y asintomáticos, portadores de catéter central como única justificación e ingresos por elevación de reactantes de fase aguda sin clínica asociada; 2) retirada precoz de antibióticos iniciados de forma empírica o ante sospecha de infección, en caso de resultado negativo del hemocultivo a las 48 h de siembra y ausencia de datos clínicos, y 3) ajustar la pauta antibiótica empleando el mínimo número de antibióticos y de espectro más reducido según el resultado del antibiograma21.
- 5.
Vigilancia epidemiológica de gérmenes multirresistentes. En colaboración estrecha con la unidad de control de infecciones nosocomiales de nuestro centro se estableció un sistema de vigilancia, realizando mensualmente cribado universal de los pacientes ingresados en la Unidad de Neonatología mediante cultivo de exudado rectal. Se redactó un protocolo de actuación para aislamiento de pacientes colonizados o con infección activa por gérmenes multirresistentes y para el control de brotes epidémicos.
Para el análisis estadístico de los datos se empleó el programa estadístico SPSS versión 17. Las variables cuantitativas se expresan como mediana y las variables categóricas como número absoluto y proporción. Para la comparación de grupos se utilizó el método no paramétrico U-Mann-Whitney, para variables cuantitativas, y la prueba de la chi al cuadrado de Pearson para variables cualitativas. Se consideró como estadísticamente significativo un valor bilateral de p<0,05. Aquellas variables cuantificadas en días fueron truncadas al valor entero superior.
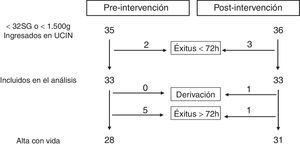
ResultadosFueron incluidos un total de 33 pacientes en cada uno de los períodos de estudio. La figura 1 muestra el diagrama de inclusión. Los pacientes de ambos grupos fueron homogéneos respecto a las distintas variables demográficas analizadas (tabla 3).
Variables demográficas y análisis comparativo entre los períodos previo y posterior a las intervenciones
| Variable | Previo | Posterior | p |
|---|---|---|---|
| Varones, n (%) | 17 (51,5) | 17 (51,5) | NS |
| Edad gestacional (semanas), media (DE) | 28,9 (2,5) | 29,8 (2,7) | NS |
| Peso al nacer (g), media (DE) | 1.180 (306) | 1.288 (370) | NS |
| Pequeño para la edad gestacional, n (%) | 7 (21,2) | 6 (18,2) | NS |
| Nacimiento por cesárea, n (%) | 20 (60,6) | 24 (72,7) | NS |
| Esteroides prenatales, n (%) | 29 (87,9) | 30 (90,9) | NS |
| Sulfato de magnesio, n (%) | 22 (66,7) | 19 (57,6) | NS |
| Apgar 1 min, mediana (RIC) | 7 (5-8) | 7 (5-8) | NS |
| Apgar 5 min, mediana (RIC) | 8 (7-9) | 9 (8-9) | NS |
| pH de cordón, n, mediana (RIC) | 29, 7, 31 (7,24-7,35) | 24, 7, 30 (7,20-7,35) | NS |
| Intubación en paritorio, n (%) | 7 (21,2) | 3 (9,1) | NS |
| Índice CRIB, mediana (RIC) | 1 (1-4) | 1 (0-3) | NS |
| Corioamnionitis, n (%) | 9 (27,3) | 8 (24,2) | NS |
| Sepsis vertical, n (%) | 2 (6,1) | 0 (0) | NS |
| Surfactante ≥ 1 dosis, n (%) | 13 (39,4) | 11 (33,3) | NS |
| Fluconazol profiláctico, n (%) | 3 (27,3%) | 3 (33,3%) | NS |
| Ibuprofeno/cirugía del CAP, n (%) | 7 (21,2) | 4 (12,1) | NS |
CAP: conducto arterioso persistente; RIC: rango intercuartil.
Se diagnosticaron un total de 18 episodios de IRAS, 14 en el período preintervención y 4 en el post. La distribución por tipos fue: SRC 7 (50%) en el pre y 3 (75,0%) en el post; sepsis de origen distinto del catéter 3 (28,6%) en el pre y 0 en el post; NEC 2 (14,3%) en el pre y 1 (25,0%) en el post; NAV 1 (7,1%) y 0 en el post. De los 18 episodios se obtuvo un resultado positivo para el hemocultivo en 15 (83,3%). Los gérmenes aislados fueron Staphylococcus epidermidis (S. epidermidis) en 8 (53,3%), Klebsiella pneumoniae (K. pneumoniae) en 3 (20,0%), Enterococcus faecalis en 2 (13,3%), Candida albicans en 3 (20,0%) y Enterobacter cloacae en 1 (6,6%). En 2 episodios se aisló más de un germen en el hemocultivo. Los 3 episodios en los que no se aisló germen consistieron en 2 episodios de NEC y una sepsis probable no relacionada con el catéter.
Se observó una reducción estadísticamente significativa en la densidad de incidencia de IRAS entre ambos períodos, siendo de 8,7 IRAS/1.000 días de estancia en el pre y de 2,7 IRAS/1.000 días de estancia en el post (p<0,05). El porcentaje de pacientes con ≥ 1 episodio de IRAS durante su estancia fue de 10 (30,3%) y 4 (12,1%) en los períodos pre y postintervención respectivamente, con tendencia a la significación estadística (p=0,07).
El número de días de catéter central por paciente mostró una reducción estadísticamente significativa con valores medianos de 13,0 (8,0-17,5) y 9,0 (0-15,0) en los períodos pre y postintervención respectivamente (p<0,05). De los 10 episodios de SRC, 6 (54,5%) mostraron aislamiento idéntico en el hemocultivo y cultivo de la punta de catéter (S. epidermidis en 3 ocasiones, Candida parasilopsis y K. pneumoniae). En 4 (45,5%) episodios la sepsis fue atribuida al catéter sin identificarse el mismo germen en el cultivo de la punta. Se constató una reducción en el número de SRC/1.000 días de catéter central de 14,4 en el período preintervención a 9,6 en el período postintervención, aunque esta diferencia no alcanzó la significación estadística (p=0,54).
El resto de las variables secundarias analizadas se resumen en la tabla 4. Destaca una reducción estadísticamente significativa en la proporción de días de estancia bajo ventilación mecánica (tanto invasiva como no invasiva), así como en la proporción de pacientes que recibieron fármacos vasoactivos y hemoderivados. Los días de estancia hospitalaria, los días de nutrición parenteral y la proporción de pacientes que fallecieron o presentaron lesiones graves en la neuroimagen mostraron una disminución en el segundo período con tendencia a la significación estadística.
Variables de resultado y análisis comparativo entre los períodos previo y posterior a las intervenciones
| Variable | Previo | Posterior | p |
|---|---|---|---|
| Pacientes ≥ 1 IRAS, n (%) | 10 (30,3) | 4 (12,1) | 0,07 |
| Número IRAS/1.000 días de estancia | 8,7 | 2,7 | < 0,05 |
| Días de catéter central, mediana (RIC) | 13,0 (8,0-17,5) | 9,0 (0-15,0) | < 0,05 |
| Número SRC/1.000 días de catéter | 14,4 | 9,6 | NS |
| Enterocolitis necrosante, n (%) | 2 (6,1) | 1 (3,0) | NS |
| Días de estancia en ventilación invasiva, (%) | 8,0 | 5,0 | < 0,01 |
| Días de estancia en ventilación no invasiva (%) | 17,7 | 13,1 | < 0,01 |
| Días de nutrición parenteral, mediana (RIC) | 11,0 (8,0-18,0) | 9,0 (5,5-12,5) | 0,08 |
| Días de estancia con antibiótico (efectiva), (%) | 24,6 | 13,5 | < 0,01 |
| Días de estancia con antibiótico (empírica), (%) | 16,7 | 11,6 | < 0,01 |
| Pacientes con hemoderivados, n (%) | 16 (48,5) | 7 (21,2) | < 0,05 |
| Pacientes con drogas vasoactivas, n (%) | 11 (33,3) | 4 (12,1) | < 0,05 |
| Retinopatía tratada con láser, n (%)a | 1 (3,3) | 1 (3,3) | NS |
| Displasia broncopulmonar, n (%)b | 6 (20,0) | 7 (21,9) | NS |
| Pacientes con HIV III/IV o LPV, n (%)c | 5 (15,2) | 1 (3,1) | 0,09 |
| Estancia hospitalaria, mediana (RIC) | 48 (35-71) | 36 (27-54) | 0,08 |
| Fallecimiento después de las 72h, n (%) | 5 (15,2) | 1 (3,0) | 0,09 |
| Lactancia materna en el día 14 de vida, n (%) | 17 (51,5) | 25 (75,8) | < 0,05 |
| Lactancia materna en el día 28 de vida, n (%) | 17 (51,5) | 20 (60,6) | NS |
HIV: hemorragia intraventricular; IRAS: infecciones relacionadas con la asistencia sanitaria; LPV: leucomalacia periventricular; RIC: rango intercuartil; SRC: sepsis relacionadas con el catéter.
En el período postintervención se observó una reducción estadísticamente significativa en la proporción de días de ingreso bajo antibioticoterapia (tabla 4). Esta reducción se mantuvo en el análisis independiente de los días de antibioticoterapia empírica. La proporción de pacientes que recibieron leche materna en el día 14 y 28 de vida fue superior en el período postintervención, siendo esta diferencia estadísticamente significativa en el día 14 de vida.
En el período preintervención tuvieron lugar 3 brotes por gérmenes multirresistentes (K. pneumoniae productora de betalactamasa tipo OXA1 y Serratia marcescens en 2 ocasiones). Estos brotes desencadenaron 3 sepsis y 10 infecciones locales (9 conjuntivitis y una infección de herida quirúrgica). En el período postintervención no se produjeron infecciones sistémicas por gérmenes multirresistentes. En el cribado de febrero del 2016 se detectaron 2 pacientes portadores asintomáticos de K. pneumoniae productora de betalactamasa de espectro extendido. Se procedió al aislamiento de estos pacientes y no se detectaron nuevas colonizaciones. El resto de cribados durante el período postintervención resultaron negativos.
DiscusiónA pesar de las numerosas intervenciones que han demostrado utilidad en la prevención de las IRAS, estas siguen constituyendo uno de los principales problemas en las Unidades de Neonatología7,22. La variabilidad en la tasa de IRAS entre distintos hospitales es amplia5 y es necesario que cada centro desarrolle estrategias de prevención adaptadas a su situación22.
En enero del 2013 el nivel asistencial de nuestra unidad pasó a ser IIIB (previamente IIIA). Después de los 12 primeros meses de incluir la atención a prematuros extremos revisamos distintos indicadores de calidad de nuestra asistencia. La desviación en la incidencia de IRAS respecto a los datos publicados23 (8,7 vs. 6,4 IRAS/1.000 días de estancia) nos animó a diseñar un ciclo de mejora. La intervención incluyó 5 estrategias, basadas en la evidencia y adaptadas a nuestras necesidades. La implementación de estas medidas consiguió en los 12 meses siguientes una tasa dentro de los estándares de calidad (2,7 IRAS/1.000 días de estancia).
La SRC fue el tipo más frecuente de sepsis en los 2 períodos de estudio. La instauración de protocolos específicos para la inserción y el mantenimiento de los catéteres centrales reduce la incidencia de SRC11. Distintas instituciones y autores han publicado revisiones y guías de práctica clínica basadas en la evidencia científica con esta finalidad4. Nuestros resultados reflejaban una densidad de incidencia superior a la descrita en otras series23 (14,4 vs. 11,1 SRC/1.000 días de catéter). El nuevo protocolo de inserción y manipulación de catéteres centrales consiguió reducir esta tasa en casi un 25% (9,6 SRC/1.000 días de catéter).
Son muchos los trabajos que evidencian el efecto protector de la leche materna frente a la NEC y las sepsis neonatales tardías12. Se ha demostrado una relación dosis-respuesta de este efecto entre los días 1 y 28 de vida24,25. La alimentación con lactancia materna también se ha propuesto como factor protector contra la colonización por bacterias multirresistentes26. El porcentaje de pacientes que recibían leche de su madre era mejorable y los esfuerzos realizados aumentaron esa tasa en más de un 50%. En el único caso de NEC diagnosticado en el período postintervención no fue posible la alimentación con leche materna, ya que la madre padecía una enfermedad transmisible a través de la leche, y tampoco fue posible proporcionar leche materna donada, ya que no disponíamos banco de leche ni proyecto de colaboración con alguno.
De entre las estrategias publicadas, la higiene de manos constituye otro pilar básico en la prevención de las IRAS, ya que evita la colonización de la piel, la vía respiratoria y el aparato digestivo por gérmenes potencialmente patógenos. Estos gérmenes son diseminados de paciente a paciente a través de las manos del personal4,8. Las campañas de formación y sensibilización del personal en el correcto lavado de manos y la adherencia al uso de solución hidroalcohólica disminuye las colonizaciones por gérmenes multirresistentes4,27. Esta medida previene la aparición de brotes de IRAS por este tipo de patógenos, que han llegado a provocar el cierre de algunas unidades de neonatología16. En el período preintervención tuvieron lugar 3 brotes por dichas bacterias, situación que no se volvió a producir merced a las intervenciones aplicadas.
El uso de antibióticos está muy extendido en las UCIN, recibiéndolos durante su estancia un 47% de los pacientes que ingresan en ellas21. Los prematuros que reciben un curso prolongado (superior a 5 días) de antibióticos administrados de forma empírica, con hemocultivo estéril, presentan un riesgo mayor de sepsis, enterocolitis y muerte, así como un aumento de secuelas neurológicas13. Gracias al protocolo de uso racional de antibióticos, en el período postintervención el porcentaje de días bajo antibioticoterapia empírica se redujo un 30%. Este resultado debió de influir en la disminución de IRAS y colonizaciones por gérmenes multirresistentes.
En el segundo período, la reducción en la incidencia de IRAS vino acompañada de una menor mortalidad, con tendencia a la significación estadística. También se observó una disminución en otras morbilidades (uso de hemoderivados, fármacos vasoactivos y días bajo ventilación mecánica). Además, la proporción de pacientes con lesiones en la neuroimagen fue 5 veces inferior. Por tanto, estas estrategias y los resultados derivados de ellas podrían traducirse en beneficios en el desarrollo psicomotor en etapas posteriores de la vida.
La reducción de las IRAS y de otras comorbilidades asociadas lleva implícita una reducción de los costes sanitarios. Se ha estimado que aquellos grandes inmaduros que presentan algún episodio de SNT suponen un incremento en el coste de su atención de un 15%28. En el período postintervención se objetivó una reducción de la estancia hospitalaria mediana de un 25%, que mostró tendencia a la significación estadística.
Las debilidades de este estudio vienen dadas por el reducido tamaño de la muestra. El número de pacientes incluido por período permitió apreciar diferencias con significación estadística en la variable principal; sin embargo, el análisis de las variables secundarias mostró limitaciones por este motivo.
A modo de conclusión, las estrategias implantadas en nuestro centro demostraron ser eficaces en la reducción de la incidencia de IRAS. Nuestra experiencia puede ser de utilidad a unidades que, como era nuestro caso, presenten tasas superiores a los estándares de calidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado en el XXV Congreso de Neonatología celebrado en Sevilla con fecha 20-22 mayo del 2015.