Estudiar la incidencia del fallo multiorgánico (FMO) y el valor pronóstico de las puntuaciones de FMO en los niños que se han recuperado de una parada cardiaca (PC) intrahospitalaria
Pacientes y métodosEstudio unicéntrico, observacional, retrospectivo, en niños menores de 16 años, que presentaron una PC intrahospitalaria y alcanzaron la recuperación de la circulación espontánea (RCE). Se registraron las puntuaciones de las escalas de gravedad (PRISM y PIM II) y FMO (PELOD y P-MODS), la mortalidad y la causa del fallecimiento.
ResultadosSe estudió a 41 niños (70,7% varones), con una mediana de edad de 38 meses. Durante el ingreso falleció el 41,5% (el 14,6% en las primeras 48h y un 7,3% en los siguientes 5 días). En las primeras 48 h, las puntuaciones de gravedad clínica y de FMO fueron más altas en los fallecidos que en los supervivientes (PRISM 29 frente a 21), p=0,125, PIM II (26,8% frente a 9,2%), p=0,021, PELOD (21 frente a 12), p=0,005, y P-MODS (9 frente a 6), p=0,001. Entre el 5.° y el 7.° día las puntuaciones de las 4 escalas fueron también mayores en los fallecidos, pero solo las escalas PELOD (20,5 frente a 11), p=0,002, y P-MODS (6,5 frente a 3), p=0,003, alcanzaron significación estadística.
ConclusionesLa mortalidad de los niños que se recuperan de una PC es elevada. El FMO tras la RCE de una PC en el niño se asocia a una mayor mortalidad.
To assess the frequency of the multiple organ failure and the prognostic value of multiple organ failure scores in children who have recovered from an in-hospital cardiac arrest.
Patients and methodsA single centre, observational, and retrospective study was conducted on children between 1 month and 16 years old who suffered an in-hospital cardiac arrest and achieved return of spontaneous circulation (ROSC). In the first 24-48hours and between the fifth and the seventh day after ROSC, a record was made of the scores on paediatric severity (PRISM and PIM II) and multiple organ failure scales (PELOD and P-MODS), along with the clinical and analytical data, and including monitoring and treatment, mortality and cause of death.
ResultsOf the total of 41 children studied, 70.7% male were male, and the median age was 38 months. The overall mortality during admission was 41.5%, with 14.6% dying in the first 48hours, and 7.6% in the following 3 to 5 days. In the first 48hours, clinical severity and multiple organ failure scores were higher in the patients that died than in survivors (PRISM 29 vs. 21) P=.125, PIM II (26.8% vs. 9.2%) P=.02, PELOD (21 vs. 12) P=.005, and P-MODS (9 vs. 6) P=.001. Between the fifth and seventh day, the scores on the four scales were also higher in patients who died, but only those of the PELOD (20.5 vs. 11) p=.002 and P-MODS (6.5 vs. 3) P=.003 reached statistical significance.
ConclusionsMortality in children after return of spontaneous circulation after cardiac arrest is high. The multiple organ failure after return of spontaneous circulation after cardiac arrest in children is associated with increased mortality.
La parada cardiaca (PC) se define como la interrupción brusca, inesperada y potencialmente reversible de la circulación y la respiración espontánea1. La incidencia de PC intrahospitalaria en niños varía de 0,19 al 2,45 por cada 1.000 ingresos hospitalarios2.
La reanimación cardiopulmonar (RCP) tiene como objetivo la recuperación de la circulación espontánea (RCE). En adultos, más de la mitad de los pacientes que logran la RCE no sobreviven al alta, siendo las causas de muerte más frecuentes la muerte cerebral y el fallo multiorgánico (FMO)3.
El FMO se define como el fallo de 2 o más sistemas orgánicos que no pueden mantener de forma espontánea su actividad. El FMO constituye la causa principal de muerte en unidades de cuidados intensivos, tanto en niños como en adultos4.
Tras una PC todos los órganos se ven afectados por un fenómeno de isquemia-reperfusión, que predispone al desarrollo de un FMO. Diversos estudios en adultos han referido que la aparición de fallo renal agudo5, insuficiencia suprarrenal aguda6,7, coagulación intravascular diseminada, mayor puntuación en las escalas de valoración de gravedad, como el APACHE II8,9, o de FMO se asocian a una mayor mortalidad10. Sin embargo, solo existe un estudio en adultos en el que se observó que el FMO es frecuente tras una PC y se asocia a una mayor mortalidad, que parece estar relacionada con la disfunción hemodinámica y el déficit de oxigenación3.
En niños, no existen estudios que hayan analizado la prevalencia de FMO tras la PC ni si el desarrollo de FMO tras una PC se asocia a un peor pronóstico.
El objetivo de nuestro estudio ha sido analizar la evolución de los niños que recuperan la circulación espontánea tras una PC, estudiar la incidencia de FMO y analizar la capacidad pronóstica de las escalas de gravedad clínica Pediatric Risk of Mortality (PRISM)11 y Pediatric Index of Mortality II (PIM II) y de FMO pediátrico, Pediatric Multi Organ Dysfunction Score (P-MODS)12 y Pediatric Logistic Organ Dysfunction (PELOD)13 y otros parámetros de monitorización y analíticos que pueden estar alterados tras la RCE14-24, y las causas de fallecimiento25.
Pacientes y métodosSe realizó un análisis retrospectivo, observacional, unicéntrico en el que se incluyó a los niños que presentaron una PC intrahospitalaria y alcanzaron la RCE entre diciembre del 2007 y junio del 2013.
Los criterios de inclusión en el estudio fueron: edad entre un mes y 16 años, y haber presentado una PC intrahospitalaria con RCE tras la RCP. Se excluyó a los niños con PC extrahospitalaria y a aquellos que no lograron la RCE tras la RCP.
Se recogieron las siguientes variables: edad, sexo, peso, antecedentes personales de prematuridad, cardiopatía, patología respiratoria, neurológica, digestiva, renal, oncológica, hematológica, malformaciones congénitas e intervenciones quirúrgicas. Se registró la existencia de una PC anterior, si el paciente precisaba tratamiento previo con inhibidores de la enzima conversora de angiotensina (IECA), la presencia de fracaso orgánico previo a la PC, la causa y el tipo de PC (cardiaca o respiratoria), el ritmo electrocardiográfico, el lugar donde se diagnosticó (UCI pediátrica, planta de hospitalización, quirófano, urgencias u otros), el tiempo de parada antes de iniciar RCP y la duración de la misma.
Durante las primeras 24-48 h y entre el 5.° y el 7.° días tras la PC, se recogieron los siguientes datos: ritmo electrocardiográfico predominante, ecocardiografía en caso de haberse procedido a su realización, presión arterial (PA), frecuencia cardiaca (FC), frecuencia respiratoria, temperatura, diuresis, tratamiento y dosis de inotrópicos, sedantes, insulina, antibióticos, tipo de nutrición, ventilación mecánica, pico de presión máximo, FiO2 y la presión espiratoria final, técnicas de depuración extrarrenal continua (TDEC), asistencia ventricular y oxigenación extracorpórea (ECMO), presencia de infección y su localización, hemorragia y/o neumotórax.
También se registraron los siguientes datos analíticos: gasometría arterial y/o venosa (PO2, PCO2, saturación de O2, pH, bicarbonato y exceso de bases), bioquímica (glucemia, iones, transaminasas, bilirrubina total, bicarbonato, láctico, creatinina, urea, proteína C reactiva, procalcitonina, BNP, troponina, CPK-MB, cortisol hematológicos (hemoglobina, leucocitos, plaquetas) y coagulación (INR, TTPA, fibrinógeno, dímero D). De la evolución neurológica se registró la existencia de convulsiones, reacción pupilar, monitorización con registro electroencefalográfico continuo, índice biespectral (BIS), saturación cerebral, los datos de la tomografía axial computarizada o resonancia magnética cerebral, y de la inducción de hipotermia, el tiempo de inicio con respecto a la PC y la duración. En caso de fallecimiento, se recogió el motivo del mismo y la fecha con respecto a la PC.
Se calcularon las puntuaciones pronósticas en las primeras 24-48 h tras la RCE y entre el 5.° y 7.° día, según las escalas pediátricas PRISM11, PELOD13, P-MODS12 y PIM II.
El estudio estadístico se llevó a cabo con el sistema SPSS, versión 21. Las variables se expresan en mediana y rango intercuartil (RIQ), debido a que la muestra no sigue una distribución normal. Se analizó la relación de la puntuación de PRISM, PELOD, P-MODS y PIM II con la mortalidad comparando a los pacientes fallecidos y los supervivientes mediante las pruebas no paramétricas de Wilcoxon y Mann-Whitney. Se consideró significativa una p<0,05. Se analizó la supervivencia mediante curvas de Kaplan-Meier. El análisis multivariante se realizó por medio de la regresión de Cox con exclusión de las variables de confusión del modelo reducido seleccionado.
ResultadosSe estudió a 41 pacientes con mediana de edad de 38 meses (RIQ 5,5-94 meses), y mediana de peso de 12kg (RIQ 5-22kg) (70% varones).
AntecedentesEl 90% de los niños presentaban antecedentes patológicos (el 75% cardiopatía, el 15% prematuridad, el 7,5% patología respiratoria, el 5% neurológica, el 10% digestiva, el 5% renal, el 2,5% oncológica; el 17,1% presentaba malformaciones congénitas, el 10% había presentado infecciones de repetición, el 46,3% había presentado múltiples intervenciones quirúrgicas y un 9,6% presentaba desnutrición). El 17,5% tenía antecedentes de una PC previa al episodio actual. El 27,5% estaba en tratamiento con fármacos IECA. El 47,5% presentaba FMO antes de la PC.
Características de la parada cardiaca y la reanimación cardiopulmonarLa causa de la PC fue cardiaca en el 62,5% de los pacientes, respiratoria en el 27,5%, sepsis en el 5%, neurológica en el 2,5% y por otras causas en el 2,5% restante. En el 74,4% de los niños la parada fue inicialmente cardiaca y en el 25,6% respiratoria.
En el 69,2% de los casos la PC se produjo en la UCI pediátrica, en el 12,8% en el quirófano, en el 2,6% en el Servicio de Urgencias y en el 15,4% en otros lugares del hospital.
En el 97,4% de los niños las maniobras de RCP se iniciaron antes de un minuto tras ocurrir la PC y en el 2,6% entre los 4-10 min.
El ritmo de inicio en el momento de la parada fue asistolia o bradicardia severa en un 65% de los pacientes, actividad eléctrica sin pulso en el 22,5% y fibrilación ventricular o taquicardia ventricular sin pulso en el 12,5%. En el 69,7% de los pacientes, la duración de la PC fue menor de 10 min, con una mediana de duración de 4 min (RIQ 1,5-15 minutos).
Evolución tras la recuperación de la circulación espontáneaDiecisiete niños (un 41,5%) fallecieron durante el ingreso. El tiempo desde la RCE hasta el fallecimiento fue 9,5 días (RIQ 2-19,7 días).
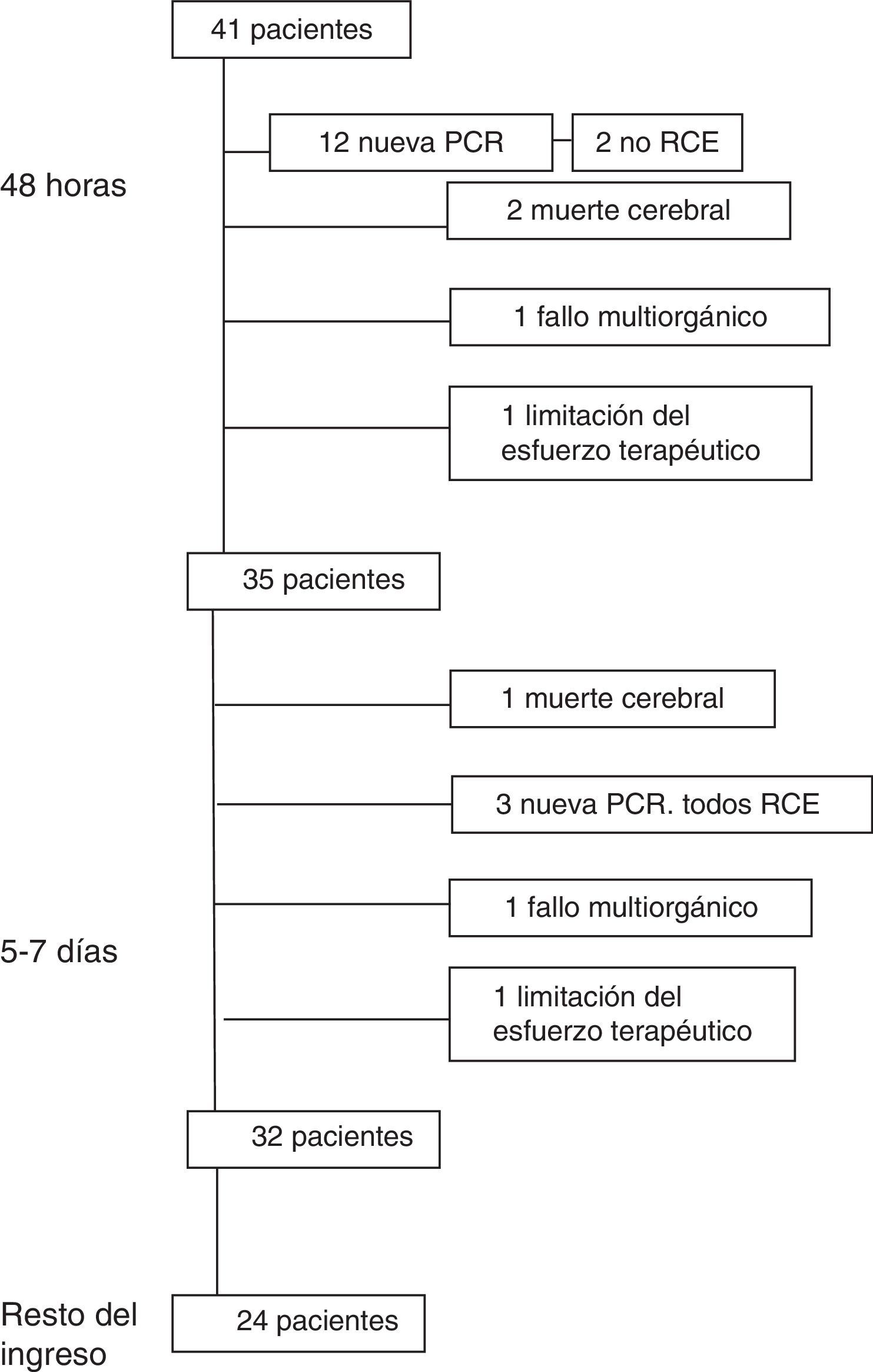
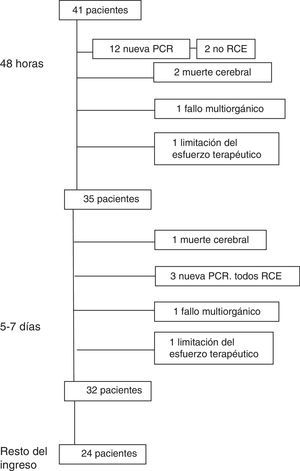
Evolución en las primeras 24-48 hLa evolución de los pacientes se muestra en la figura 1.
En las primeras 24-48h tras la RCE, 12 pacientes (29,3%) presentaron una nueva PC. Seis pacientes (14,6%) fallecieron en las primeras 24-48 h después de la RCE (2 por una nueva PC sin RCE, 2 por muerte cerebral, uno por FMO y otro por limitación del esfuerzo terapéutico).
Las puntuaciones PIM II, PELOD y P-MODS de los niños que fallecieron fueron significativamente más altas que las de los supervivientes. La puntuación PRISM también fue más elevada en los niños que fallecieron que en los supervivientes pero las diferencias no alcanzaron significación estadística (tabla 1).
Comparación de las puntuaciones de gravedad y fallo multiorgánico entre los pacientes que fallecieron y los supervivientes
| 24-48 h | |||||||
|---|---|---|---|---|---|---|---|
| Variable | Global | Fallecidos | Supervivientes | p | |||
| Mediana | RIQ | Mediana | RIQ | Mediana | RIQ | ||
| PRISM | 22 | 16-31 | 29 | 16,5-35,5 | 21 | 15-27 | 0,125 |
| PIM II | 14,9 | 5,3-36,4 | 26,8 | 14,9-44,3 | 9,2 | 4,6-28,3 | 0,021 |
| PELOD | 20 | 12-22 | 21 | 16,5-30,5 | 12 | 11-21 | 0,005 |
| P-MODS | 7 | 5-9 | 9 | 7,5-10 | 6 | 4-7 | 0,001 |
| 5-7 días | |||||||
|---|---|---|---|---|---|---|---|
| Variable | Global | Fallecidos | Supervivientes | p | |||
| Mediana | RIQ | Mediana | RIQ | Mediana | RIQ | ||
| PRISM | 14 | 8,5-18,5 | 17 | 13,5-20,2 | 11 | 8-18 | 0,114 |
| PIM II | 6,9 | 2,7-19,4 | 14 | 4,8-31,6 | 6,5 | 2,1-16,9 | 0,103 |
| PELOD | 11 | 11-20 | 20,5 | 13,2-21,7 | 11 | 10-11 | 0,002 |
| P-MODS | 4 | 3-6 | 6,5 | 4,5-10 | 3 | 2-4,2 | 0,003 |
El 97,6% de los pacientes recibieron sedación, tratamiento inotrópico y ventilación mecánica Se observaron pupilas dilatadas bilateralmente en el 5,4% de los pacientes, y medias y poco reactivas en el 16,2%. El 4,9% de los pacientes presentaron convulsiones.
Los valores del índice inotrópico fueron mayores en los pacientes que fallecieron (mediana 50) que en los supervivientes (mediana 41), aunque la diferencia no fue estadísticamente significativa (p=0,2). Tampoco existieron diferencias en el aclaramiento de láctico (0,85 en supervivientes frente a 0,75 en los fallecidos, p=0,11).
Evolución a los 5-7 díasEntre el 5.° y 7.° día tras la RCE, 3 pacientes (7,3%) presentaron una nueva PC, recuperándose todos de la misma.
Tres pacientes (7,3% del total) fallecieron entre el 5.° y 7.° día (uno por FMO, otro por muerte cerebral y el tercero por limitación del esfuerzo terapéutico). Después de los 7 días fallecieron 8 pacientes (4 por FMO, 2 de una nueva PC de la que no se recuperaron, otro de una hemorragia cerebral y el cuarto de una hemorragia pulmonar).
Las puntuaciones PELOD y P-MODS en los niños que fallecieron fueron significativamente más altas que en los supervivientes. Las puntuaciones PRISM y PIM II también fueron más altas en los pacientes fallecidos pero las diferencias no alcanzaron significación estadística (tabla 1).
Los niños que fallecieron presentaron un índice inotrópico a los 5-7 días significativamente más elevado (43,5, RIQ 40-65) que los supervivientes (25, RIQ 18,2-30,2) (p=0,001). No existieron diferencias en el aclaramiento de láctico entre los supervivientes (0,36) y los fallecidos (0,28) (p=0,122).
Existían pupilas medias y poco reactivas en el 3,7% de los pacientes, siendo normales en el resto. En este momento precisaba sedación el 89,3% de los pacientes, el 92,9% tratamiento inotrópico y el 75% ventilación mecánica.
Comparación de parámetros durante la evoluciónEn la tabla 1 se recogen las puntuaciones de las escalas pediátricas de gravedad PRISM y PIM II, y de FMO PELOD y P-MODS. Existió un descenso en las puntuaciones de las 4 escalas entre el 24-48h y el 5.°-7.° día (PRISM p<0,001, PIM II p=0,011, PELOD p=0,004 y PMODS p=0,001).
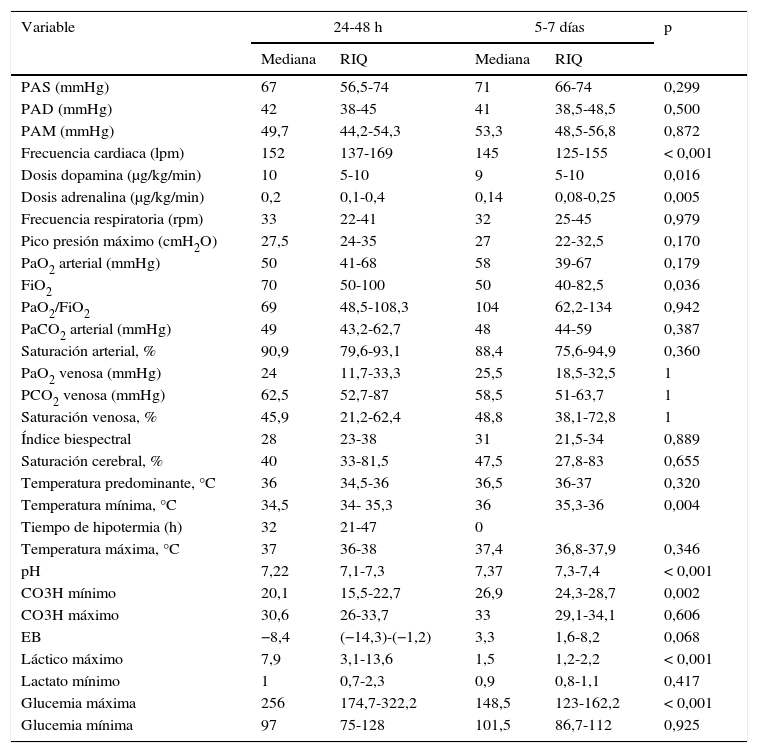
En la tabla 2 se muestran la mediana y el RIQ de los principales parámetros a las 24-48h y entre el 5.° y 7.° día tras la RCE.
Evolución de los parámetros hemodinámicos, respiratorios, neurológicos y analíticos
| Variable | 24-48 h | 5-7 días | p | ||
|---|---|---|---|---|---|
| Mediana | RIQ | Mediana | RIQ | ||
| PAS (mmHg) | 67 | 56,5-74 | 71 | 66-74 | 0,299 |
| PAD (mmHg) | 42 | 38-45 | 41 | 38,5-48,5 | 0,500 |
| PAM (mmHg) | 49,7 | 44,2-54,3 | 53,3 | 48,5-56,8 | 0,872 |
| Frecuencia cardiaca (lpm) | 152 | 137-169 | 145 | 125-155 | < 0,001 |
| Dosis dopamina (μg/kg/min) | 10 | 5-10 | 9 | 5-10 | 0,016 |
| Dosis adrenalina (μg/kg/min) | 0,2 | 0,1-0,4 | 0,14 | 0,08-0,25 | 0,005 |
| Frecuencia respiratoria (rpm) | 33 | 22-41 | 32 | 25-45 | 0,979 |
| Pico presión máximo (cmH2O) | 27,5 | 24-35 | 27 | 22-32,5 | 0,170 |
| PaO2 arterial (mmHg) | 50 | 41-68 | 58 | 39-67 | 0,179 |
| FiO2 | 70 | 50-100 | 50 | 40-82,5 | 0,036 |
| PaO2/FiO2 | 69 | 48,5-108,3 | 104 | 62,2-134 | 0,942 |
| PaCO2 arterial (mmHg) | 49 | 43,2-62,7 | 48 | 44-59 | 0,387 |
| Saturación arterial, % | 90,9 | 79,6-93,1 | 88,4 | 75,6-94,9 | 0,360 |
| PaO2 venosa (mmHg) | 24 | 11,7-33,3 | 25,5 | 18,5-32,5 | 1 |
| PCO2 venosa (mmHg) | 62,5 | 52,7-87 | 58,5 | 51-63,7 | 1 |
| Saturación venosa, % | 45,9 | 21,2-62,4 | 48,8 | 38,1-72,8 | 1 |
| Índice biespectral | 28 | 23-38 | 31 | 21,5-34 | 0,889 |
| Saturación cerebral, % | 40 | 33-81,5 | 47,5 | 27,8-83 | 0,655 |
| Temperatura predominante, °C | 36 | 34,5-36 | 36,5 | 36-37 | 0,320 |
| Temperatura mínima, °C | 34,5 | 34- 35,3 | 36 | 35,3-36 | 0,004 |
| Tiempo de hipotermia (h) | 32 | 21-47 | 0 | ||
| Temperatura máxima, °C | 37 | 36-38 | 37,4 | 36,8-37,9 | 0,346 |
| pH | 7,22 | 7,1-7,3 | 7,37 | 7,3-7,4 | < 0,001 |
| CO3H mínimo | 20,1 | 15,5-22,7 | 26,9 | 24,3-28,7 | 0,002 |
| CO3H máximo | 30,6 | 26-33,7 | 33 | 29,1-34,1 | 0,606 |
| EB | −8,4 | (−14,3)-(−1,2) | 3,3 | 1,6-8,2 | 0,068 |
| Láctico máximo | 7,9 | 3,1-13,6 | 1,5 | 1,2-2,2 | < 0,001 |
| Lactato mínimo | 1 | 0,7-2,3 | 0,9 | 0,8-1,1 | 0,417 |
| Glucemia máxima | 256 | 174,7-322,2 | 148,5 | 123-162,2 | < 0,001 |
| Glucemia mínima | 97 | 75-128 | 101,5 | 86,7-112 | 0,925 |
FiO2: fracción inspirada de oxígeno; PAD: presión arterial diastólica; PAM: presión arterial media; PaO2: presión arterial de oxígeno; PaO2/FiO2: relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno; PaCO2: presión arterial de anhídrido carbónico; PAS: presión arterial sistólica; PCO2: presión de anhídrido carbónico.
No existieron diferencias significativas en las constantes hemodinámicas (PA y FC) y la dosis de los fármacos inotrópicos administrados entre ambos momentos. La FiO2 fue más elevada en las primeras 48 h que a los 5-7 días (p=0,036). Ninguno del resto de parámetros respiratorios mostró diferencias estadísticamente significativas. En 19 pacientes se realizó hipotermia en las primeras 48 h. Los parámetros del BIS y de la saturación cerebral no mostraron diferencias estadísticamente significativas entre ambos períodos. A los 5-7 días el fibrinógeno era mayor (p=0,025) y el INR menor (p=0,037). La diuresis era mayor en las primeras 48 h (p=0,005). En cuanto a la función hepática, la GOT era mayor (p=0,035) y la GGT era menor (p<0,001) en las primeras 48 h. Los valores del ionograma y la gasometría, el pH (p<0,001) y el bicarbonato (p=0,002) eran menores en las primeras 48 h, siendo mayores los valores de láctico y de glucemia (p<0,001 para ambos).
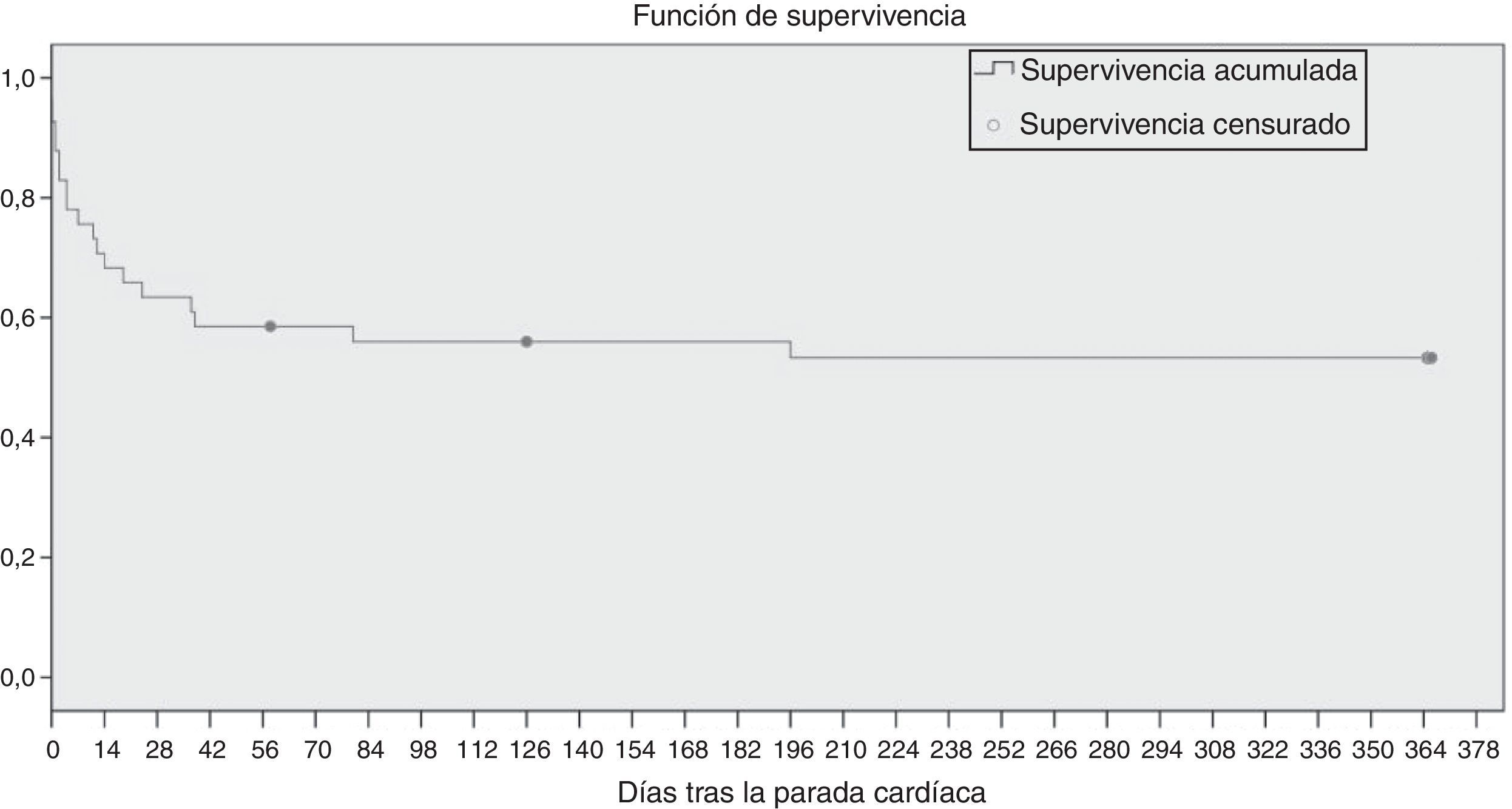
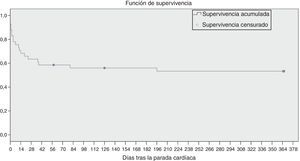
Análisis de la supervivenciaEl análisis de la supervivencia mediante la estimación de Kaplan-Meier mostró una supervivencia del 82,9% de los sujetos en los 7 días tras la PC. La media de supervivencia fue de 207 días (IC 154-260). La figura 2 muestra la función de supervivencia.
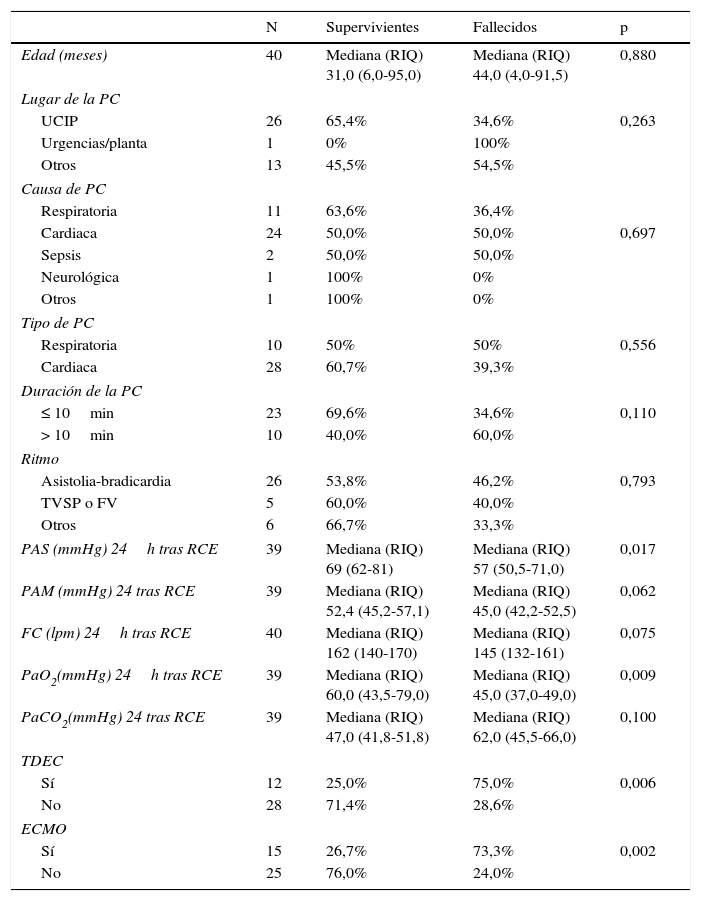
La tabla 3 resume las diferencias más importantes en los parámetros entre los pacientes fallecidos y supervivientes. En los niños que fallecieron la PA sistólica y la PaO2 a las 24 h fueron significativamente inferiores y la necesidad de ECMO y TDEC mayores.
Diferencias más relevantes entre fallecidos y supervivientes
| N | Supervivientes | Fallecidos | p | |
|---|---|---|---|---|
| Edad (meses) | 40 | Mediana (RIQ) 31,0 (6,0-95,0) | Mediana (RIQ) 44,0 (4,0-91,5) | 0,880 |
| Lugar de la PC | ||||
| UCIP | 26 | 65,4% | 34,6% | 0,263 |
| Urgencias/planta | 1 | 0% | 100% | |
| Otros | 13 | 45,5% | 54,5% | |
| Causa de PC | ||||
| Respiratoria | 11 | 63,6% | 36,4% | |
| Cardiaca | 24 | 50,0% | 50,0% | 0,697 |
| Sepsis | 2 | 50,0% | 50,0% | |
| Neurológica | 1 | 100% | 0% | |
| Otros | 1 | 100% | 0% | |
| Tipo de PC | ||||
| Respiratoria | 10 | 50% | 50% | 0,556 |
| Cardiaca | 28 | 60,7% | 39,3% | |
| Duración de la PC | ||||
| ≤ 10min | 23 | 69,6% | 34,6% | 0,110 |
| > 10min | 10 | 40,0% | 60,0% | |
| Ritmo | ||||
| Asistolia-bradicardia | 26 | 53,8% | 46,2% | 0,793 |
| TVSP o FV | 5 | 60,0% | 40,0% | |
| Otros | 6 | 66,7% | 33,3% | |
| PAS (mmHg) 24h tras RCE | 39 | Mediana (RIQ) 69 (62-81) | Mediana (RIQ) 57 (50,5-71,0) | 0,017 |
| PAM (mmHg) 24 tras RCE | 39 | Mediana (RIQ) 52,4 (45,2-57,1) | Mediana (RIQ) 45,0 (42,2-52,5) | 0,062 |
| FC (lpm) 24h tras RCE | 40 | Mediana (RIQ) 162 (140-170) | Mediana (RIQ) 145 (132-161) | 0,075 |
| PaO2(mmHg) 24h tras RCE | 39 | Mediana (RIQ) 60,0 (43,5-79,0) | Mediana (RIQ) 45,0 (37,0-49,0) | 0,009 |
| PaCO2(mmHg) 24 tras RCE | 39 | Mediana (RIQ) 47,0 (41,8-51,8) | Mediana (RIQ) 62,0 (45,5-66,0) | 0,100 |
| TDEC | ||||
| Sí | 12 | 25,0% | 75,0% | 0,006 |
| No | 28 | 71,4% | 28,6% | |
| ECMO | ||||
| Sí | 15 | 26,7% | 73,3% | 0,002 |
| No | 25 | 76,0% | 24,0% | |
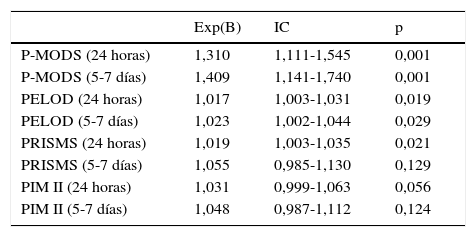
La tabla 4 muestra la influencia de los índices de valoración de la gravedad y FMO sobre la supervivencia. El P-MODS fue el índice que presentó mayor relación con la supervivencia. En las primeras 24 h, el incremento de una unidad en el valor de dicho índice incrementa la probabilidad de fallecer por 30,9% (p=0,001) frente al 2% por unidad del PELOD (p=0,019) y del PRISM (p=0,021). El análisis del PIM II no mostró diferencias estadísticamente significativas.
Análisis de la supervivencia
| Exp(B) | IC | p | |
|---|---|---|---|
| P-MODS (24 horas) | 1,310 | 1,111-1,545 | 0,001 |
| P-MODS (5-7 días) | 1,409 | 1,141-1,740 | 0,001 |
| PELOD (24 horas) | 1,017 | 1,003-1,031 | 0,019 |
| PELOD (5-7 días) | 1,023 | 1,002-1,044 | 0,029 |
| PRISMS (24 horas) | 1,019 | 1,003-1,035 | 0,021 |
| PRISMS (5-7 días) | 1,055 | 0,985-1,130 | 0,129 |
| PIM II (24 horas) | 1,031 | 0,999-1,063 | 0,056 |
| PIM II (5-7 días) | 1,048 | 0,987-1,112 | 0,124 |
IC: intervalo de confianza.
Entre el 5.° y el 7.° día, el incremento en la probabilidad de defunción para el P-MODS fue del 40,9% por unidad (p=0,001) frente al 2,3% del PELOD (p=0,029), no siendo estadísticamente significativo para el PRISM y el PIM II.
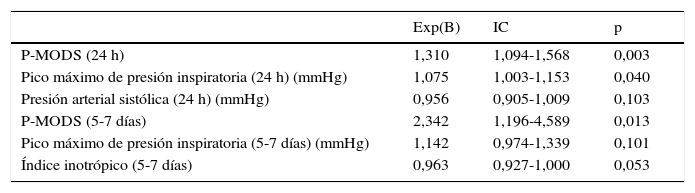
El análisis multivariante en ambos períodos queda recogido en la tabla 5.
Análisis multivariante de la supervivencia
| Exp(B) | IC | p | |
|---|---|---|---|
| P-MODS (24 h) | 1,310 | 1,094-1,568 | 0,003 |
| Pico máximo de presión inspiratoria (24 h) (mmHg) | 1,075 | 1,003-1,153 | 0,040 |
| Presión arterial sistólica (24 h) (mmHg) | 0,956 | 0,905-1,009 | 0,103 |
| P-MODS (5-7 días) | 2,342 | 1,196-4,589 | 0,013 |
| Pico máximo de presión inspiratoria (5-7 días) (mmHg) | 1,142 | 0,974-1,339 | 0,101 |
| Índice inotrópico (5-7 días) | 0,963 | 0,927-1,000 | 0,053 |
IC: intervalo de confianza.
En las primeras 24 h, solo el pico máximo de presión del respirador se relacionó con la supervivencia, aumentando la probabilidad de fallecer en un 7,5% por cada unidad de incremento del mismo (IC: 1,003-1,153; p=0,04). Ninguna de las variables analizadas a los 5-7 días obtuvo significación estadística.
DiscusiónLa parada cardiorrespiratoria intrahospitalaria en la edad pediátrica tiene una elevada mortalidad. El porcentaje de niños que sobreviven a una PC es muy variable1,26-30. Un porcentaje importante no se recupera de la PC y otros recuperan la circulación espontánea pero fallecen en los días o semanas posteriores.
La supervivencia de los niños que recuperan la circulación espontánea tras una PC en nuestro estudio fue del 58,5%, que es similar a la de otros estudios pediátricos recientes26-30.
Este es el primer estudio que analiza la importancia pronóstica del FMO tras la RCE en la PC pediátrica. El FMO fue la causa principal de fallecimiento en el 35,3% de los pacientes de nuestro estudio. Las puntuaciones de las escalas de FMO PELOD y P-MODS a las 24-48h y a los 5-7 días se relacionaron de manera significativa con la mortalidad, lo que confirma la importancia del FMO en el pronóstico de los niños que recuperan la circulación espontánea después de una PC.
Los valores de las 4 escalas fueron mayores a las 24-48 h del ingreso que a los 5-7 días. Esto probablemente refleje la mayor gravedad inicial tras la RCE de una PC. Pero por otra parte también hay que tener en cuenta que algunos de los pacientes más graves y por tanto con puntuaciones más elevadas inicialmente fallecieron los primeros días y no fueron valorados a los 5-7 días.
En un estudio realizado en adultos se encontró que el 66% de los pacientes presentaron FMO tras la RCE de una PC intrahospitalaria y que los fallos orgánicos más comunes y con peor pronóstico eran el cardiovascular y respiratorio3.
En nuestro estudio, los valores de presión inspiratoria máxima en el ventilador a las 24-48h de la PC fueron mayores en los pacientes que fallecieron. Sin embargo, a los 5-7 días no se halló ningún factor que se relacionase con mayor mortalidad.
Limitaciones del estudioNuestro estudio tiene algunas limitaciones. Es un análisis retrospectivo, unicéntrico, con un tamaño muestral relativamente pequeño y, por tanto, son necesario estudios multicéntricos prospectivos que confirmen estos hallazgos. Por otra parte, en nuestro estudio solo se valoró a los pacientes en 2 momentos, en las primeras 24-48h y a los 5-7 días de la PC. Sin embargo, el mayor porcentaje de los niños que fallecieron lo hicieron después de los 7 días, y en ellos el 50% lo hicieron por FMO. Por ello, en estudios futuros sería necesario realizar controles después de los 7 días de la PC para valorar mejor la evolución de estos pacientes.
ConclusionesLa mortalidad de los niños que se recuperan de una PC es elevada. El desarrollo de FMO tras la recuperación de la PC intrahospitalaria en el niño se asocia a una mayor mortalidad.
Son necesarios estudios que identifiquen los sistemas orgánicos que se afectan más frecuentemente tras la RCE, para desarrollar nuevas estrategias terapéuticas que disminuyan el daño multiorgánico y mejoren el pronóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.