Aunque las neoplasias malignas pediátricas son una enfermedad rara, con una incidencia de 15 nuevos casos al año/100.000 niños menores de 14años, representan la segunda causa de muerte en niños y la primera por enfermedad. Dentro de la rareza que supone el diagnóstico de un tumor maligno en los niños, es todavía más excepcional en los primeros años de vida. En este número de Anales de Pediatría se recoge una interesante revisión de 72 pacientes menores de 18 meses diagnosticados de tumor maligno en un único centro hospitalario español durante los últimos 12años y en la que se analizan los rasgos diferenciales del cáncer en esta temprana edad1.
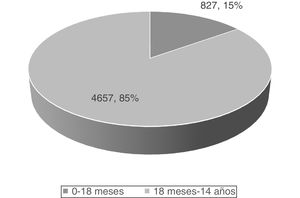
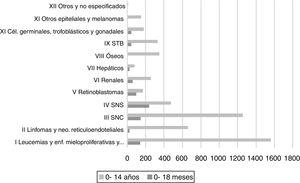
En línea con otros registros de tumores pediátricos internacionales, de acuerdo con los datos de los últimos 5 años del Registro Español de Tumores Infantiles (RETI-SEHOP), los pacientes menores de 18 meses constituyen el 15% del total de pacientes menores de 14años con un tumor maligno (fig. 1)2. Mientras que los tumores malignos pediátricos más frecuentes son las leucemias (30%), los tumores del sistema nervioso central (SNC) (20%), los linfomas (15%) y los tumores de cresta neural (10%), por debajo de los 18 meses las leucemias son el tercer tumor más frecuente, superadas por el grupo de los tumores embrionarios como los tumores de cresta neural (29%), los tumores del sistema nervioso central (SNC) (17,4%) o el retinoblastoma (11%)2. De tal forma que hasta el 50% de los tumores de la cresta neural, cerca del 60% de los retinoblastomas, más del 30% de los hepatoblastomas y más del 20% de los tumores renales pediátricos se diagnostican durante los primeros 18 meses de vida (fig. 2)2.
Casos registrados en el RETI-SEHOP. Periodo de incidencia: 2015-20192.
Casos registrados en el RETI-SEHOP por grupo diagnóstico: 0-18 meses y ≤14años. Periodo de incidencia: 2015-20192.
Alrededor del 5-10% de los tumores pediátricos son hereditarios. Este carácter hereditario adquiere especial relevancia en los primeros años de vida en los pacientes con retinoblastoma, tumor de Wilms o en los síndromes neuroectodérmicos (neurofibromatosis, esclerosis tuberosa...).
El diagnóstico precoz permite la detección de la enfermedad neoplásica en estadios iniciales y con mejores posibilidades de curación. Teniendo en cuenta que la clínica de presentación de las neoplasias malignas puede ser similar a otras patologías más o menos banales de la infancia, el reconocimiento de los síntomas y signos de sospecha puede conllevar una especial complejidad en los pacientes más pequeños. Así, se debe prestar especial atención a signos y síntomas como fiebre prolongada, fallo de medro, irritabilidad, palidez, equimosis, aumento del perímetro cefálico, leucocoria, distensión abdominal, hepatomegalia, esplenomegalia, focalidad neurológica, diarrea, estreñimiento, lesiones cutáneas o adenopatías persistentes, entre otros. Son la gravedad de estos signos y síntomas, su persistencia o progresión o su evolución desfavorable, a pesar de un tratamiento inicial, los factores determinantes que deben hacer saltar las alarmas. La leucocoria es, sin duda, uno de los pocos signos de alarma cuya simple observación obliga a la derivación sin demora para valoración oftalmológica. Por este motivo la exploración del reflejo pupilar desde el nacimiento y en las sucesivas revisiones del niño sano es fundamental para el diagnóstico precoz del retinoblastoma y posibilitar así la preservación visual y ocular.
Como en el cáncer del adulto y de los niños más mayores, actualmente el tratamiento de las neoplasias malignas pediátricas se basa en 4 herramientas: cirugía, quimioterapia, radioterapia y la inmunoterapia. Dependiendo de la localización y el subtipo tumoral se establecerá la estrategia terapéutica más adecuada. En los últimos años, la mayoría de los pacientes son tratados dentro de ensayos clínicos o de acuerdo con recomendaciones terapéuticas internacionales reconocidas. Una de las mayores dificultades del tratamiento de los niños más pequeños radica en la adecuada dosificación de los citostáticos. A pesar de la falta de datos, la modificación empírica de las dosis es la regla en lactantes y niños pequeños basada en la mejoría objetivada tanto en la seguridad como en la tolerabilidad a los tratamientos. El impacto de esta dosificación heterogénea en lactantes y niños más pequeños sobre la toxicidad y eficacia de los distintos citostáticos no está bien estudiado. La mayoría de los protocolos incluyen modificaciones de las dosis de los citostáticos habituales basadas en la edad, peso o en superficie corporal con fórmulas (p.ej., regla 30kg=1m2), pero una vez que el paciente supera el límite establecido (p.ej., más de 12 meses) continúa el tratamiento con la dosificación estándar basada en la superficie corporal, con el consiguiente incremento sustancial de la dosis a administrar. Hasta que se pueda desarrollar un método de dosificación más racional, teniendo en cuenta biomarcadores de excreción de los distintos fármacos, algunos grupos de trabajo están trabajando en el diseño de tablas de dosificación, basadas en la superficie corporal, para un ajuste de dosis más preciso3.
Para minimizar las complicaciones agudas y a largo plazo derivadas del proceso oncológico, en los niños más pequeños es crucial el tratamiento de soporte y la atención integral por parte de un equipo multidisciplinar, con especial atención a los accesos vasculares permanentes, el control del dolor y la anestesia para procedimientos diagnósticos y terapéuticos, el soporte nutricional, el control y tratamiento de las infecciones y el desarrollo neurocognitivo.
Con una supervivencia actual del cáncer infantil en España del 80% a los 5 años2, similar a la de otros países desarrollados, algunos de los tumores que se diagnostican en los primeros años de la vida alcanzan supervivencias superiores al 90% (retinoblastoma, nefroblastoma, neuroblastoma localizado). Tanto la cirugía, la radioterapia, la quimioterapia o la inmunoterapia, la necesidad de anestesias reiteradas para procedimientos diagnósticos y terapéuticos, así como las complicaciones agudas del tratamiento, pueden condicionar secuelas a largo plazo, especialmente en los primeros años de vida. Por eso el objetivo ya no es solo curar, sino curar mejor teniendo muy presente la prevención, el diagnóstico y el seguimiento de los efectos secundarios a largo plazo. En este sentido cobra especial relevancia comprender y anticipar la forma en que el cáncer y su tratamiento afectan al desarrollo neurocognitivo de los niños más pequeños y establecer una evaluación especializada periódica para poder realizar la intervención y el seguimiento oportunos a través de las unidades de atención temprana4. Abordar las necesidades psicosociales de los niños pequeños con cáncer constituye un desafío único ya que este grupo de pacientes experimenta un cambio rápido en muchos hitos del desarrollo4.
Por último, se debe recordar el impacto psicológico que el diagnóstico de cáncer en los lactantes y niños más pequeños supone para sus familias (padres, hermanos, abuelos, cuidadores) y la importancia del apoyo y seguimiento por parte de los servicios de salud mental5.
El cáncer en los dieciocho primeros meses de vida constituye todo un reto para el que es imprescindible una atención multidisciplinar que ofrezca a los pequeños pacientes no solamente las mejores oportunidades de curación y el seguimiento estrecho de los efectos secundarios del tratamiento, sino que además facilite las intervenciones adecuadas para intentar garantizar la mejor integración social en las etapas posteriores de la vida.