En las últimas décadas, las enfermedades alérgicas han aumentado de forma exponencial y, aunque parece que la prevalencia del asma en pediatría se está estabilizando (en España se estima en torno al 10%) no ocurre lo mismo con la alergia alimentaria y la anafilaxia que están en claro incremento, constituyendo un problema de salud pública de primera magnitud. Considerando las tendencias epidemiológicas, las predicciones de la Academia Europa de Alergología e Inmunología Clínica (EAACI) estiman que, en menos de 15 años, más de la mitad de la población europea padecerá algún tipo de alergia.
Los avances en los métodos diagnósticos en alergia alimentaria, sobre todo el diagnóstico molecular, nos permiten conocer el perfil de sensibilización y explicar el fenómeno de la reactividad cruzada, prever el potencial riesgo de las transgresiones alimentarias, e indicar adecuadamente la dieta de evitación en estos pacientes. Así, el desarrollo de la biología molecular y la nanotecnología han llevado a la aparición de nuevas tecnologías (microarrays) que facilitan el estudio, sobre todo de los pacientes polisensibilizados, permitiendo una inmunoterapia específica a alérgenos (ITA) más personalizada. Los últimos avances en tratamientos con biológicos implican un impacto, no solo en la evolución de la enfermedad, sino también en la calidad de vida de los pacientes.
In the last decades, allergic diseases have increased exponentially and although pediatric asthma prevalence is stabilizing, in Spain is estimated around 10%. Not the same with food allergy and anaphylaxis which are clearly increasing, becoming a public health problem of the first magnitude. Considering epidemiological trends, the European Academy of Allergy and Clinical Immunology (EAACI) estimates that in less than 15 years more than half of European population will suffer from some type of allergy.
The advances in diagnostic methods in food allergy, especially component resolved diagnosis, allow us to know the patient's sensitization profile and explain the possible cross reactivity, anticipate potential risk of food transgressions, and prescribe the correct avoidance diet in each patient. Thus, the development of molecular biology and nanotechnology have led to the appearance of new technologies (microarrays) which facilitate the study, specially of the polysensitized patients, allowing allergen immunotherapy (AIT) to be more personalized. The latest advances in the use of biologics are having an impact, not only in disease evolution, but also in patients quality of life.
El aumento en las patologías alérgicas puede tener relación con múltiples aspectos como el avance en las técnicas diagnósticas, el descubrimiento de nuevos alérgenos, la mayor concienciación de la población, la contaminación ambiental, modificaciones en los hábitos dietéticos y la teoría higienista, entre otros. Dicho incremento en la prevalencia ha ido en paralelo con un progreso en los métodos diagnósticos y terapéuticos.
Según datos del estudio Alergológica 2015, en España, la alergia respiratoria sigue siendo la patología alérgica más frecuente, con un aumento en el diagnóstico de rinitis alérgica (RA) y una tendencia a la estabilización en el asma. El asma bronquial supuso, según Alergológica 2015, un 30,2% de las consultas, frente al 34,6%. La prevalencia en España se estima en un 10% (el 85% de etiología alérgica) y el 9% de ellos presenta asma grave. Además, se registra un aumento en la frecuencia de alergia alimentaria en comparación al año 2005. Un 8,3% consulta por reacción adversa a fármacos. Un porcentaje muy pequeño de la población por reacciones al látex o hipersensibilidad al veneno de himenópteros1.
La RA es la enfermedad crónica más frecuente en la edad pediátrica2. Afecta al 25% de la población general en Europa Occidental, iniciándose hasta en un 80% antes de los 20 años. Representa el primer motivo de consulta en alergología pediátrica y uno de los diez primeros en atención primaria. En España, según los distintos estudios del International Study of Asthma and Allergies in Childhood (ISAAC), la prevalencia de RA es del 8,5% entre los seis a siete años y del 16,3% entre los 13 a 14 años, existiendo gran variabilidad entre zonas geográficas, debido a diferencias en los factores ambientales3. Esto supone un alto coste económico, sobre todo por las comorbilidades asociadas, especialmente el asma.
En las últimas décadas, se registra un aumento notorio en la alergia alimentaria, más manifiesto en los países industrializados. El pico de prevalencia se presenta al año, siendo de 6 a 8%, posteriormente, va disminuyendo hasta el final de la niñez donde alcanza valores del 3 al 4%, que se mantendrán estables a lo largo de los años. La prevalencia de la alergia alimentaria primaria parece permanecer estable, pero se observa un aumento en la prevalencia de reacciones por reactividad cruzada4.
Aunque la mayoría de los estudios de prevalencia se basan en resultados sobre sensibilización alimentaria, la prevalencia publicada de alergia puede estar sobreestimada. Los alimentos implicados suelen ser los más consumidos5 (fig. 1).
Frecuencia de los 5 alimentos más comúnmente implicados en alergia alimentaria según estudio pediátrico Alergológica1 y su cambio de 2005 (en azul) al 2015 (en rojo) en nuestro medio.
En cuanto a la hipersensibilidad a fármacos, un 10% de padres refieren que su hijo/a ha tenido al menos una reacción, constatándose en pocos casos tras un estudio alergológico. Los fármacos implicados con mayor frecuencia son los antibióticos betalactámicos, seguidos de los antiinflamatorios no esteroideos y los antibióticos no betalactámicos6.
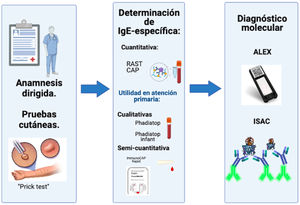
Evolución en métodos diagnósticosSe ha avanzado en la caracterización y reconocimiento de los síntomas alérgicos, lo que ha permitido mejoras en la precisión diagnóstica y terapéutica. Una correcta anamnesis y las pruebas cutáneas diagnósticas de primera línea (Prick test) siguen siendo la piedra angular en el abordaje diagnóstico. Los avances en otros métodos permiten determinar la presencia de inmunoglobulina E (IgE) específica frente a alérgenos con positividad en el prick o de alta presunción diagnóstica por historia clínica.
Actualmente, desde la atención primaria7, se dispone de técnicas de cribado, como Phadiatop® y Phadiatop® Infant, métodos cualitativos que permiten confirmar la presencia de IgE ante determinados alérgenos (respiratorios en el primer caso y respiratorios y alimentarios en el segundo) en una muestra de sangre venosa. Posteriormente, pueden cuantificarse por medio de IgE específica. Desde 2005, se dispone de otra prueba de diagnóstico rápido (20 min), InmunoCap® Rapid, que permite la obtención de resultados de fácil interpretación, a partir de una muestra de sangre capilar obtenida por punción del pulpejo del dedo. Esta técnica es cualitativa y semicuantitativa, detectando de forma rápida IgE específica frente a un panel de diez alérgenos inhalados y alimentarios8. Sin embargo, y a pesar de que estas técnicas suponen un avance en el diagnóstico del paciente alérgico para el pediatra, siempre se debe relacionar la positividad de las pruebas (sensibilización) con la clínica que presenta (alergia). Es muy importante no retirar alimentos de la dieta en un paciente que pueda estar sensibilizado y que, sin embargo, los tolere.
Para el pediatra alergólogo, un paso más allá en el diagnóstico in vitro del paciente alérgico son las técnicas de diagnóstico molecular o estudio por componentes. El alérgeno natural es una partícula compleja con varios tipos de componentes, algunos de los cuales son moléculas alergénicas, cuya sensibilización puede ser analizada de manera independiente al resto. Cuantificar los niveles de anticuerpos IgE específicos para una determinada molécula o alérgeno individual puede aportar una serie de ventajas con respecto al estudio de la IgE específica frente a la fuente completa. En pacientes polisensibilizados, ayuda a distinguir entre sensibilización verdadera y aquella producida a consecuencia de fenómenos de reactividad cruzada9. Por otro lado, identifica la presencia de IgE específica frente a moléculas asociadas a mayor gravedad clínica, pudiendo predecir posibles riesgos ante la exposición al alérgeno. También permiten identificar los alérgenos más relevantes, lo cual resulta de gran ayuda para instaurar un tratamiento con inmunoterapia en el infante alérgico10.
En los últimos años, en la atención especializada, han aparecido las pruebas de microarray como Immuno Solid-Phase Allergen Chip (ISAC®) o macroarra y Allergy Explorer (ALEX®). Son herramientas de diagnóstico molecular que, con volúmenes muy pequeños de suero, detectan la sensibilización frente a un gran número de componentes alergénicos. Permiten hacer diagnósticos más completos, aunque su interpretación requiere de experiencia dado el peligro, de nuevo, de confundir sensibilización con alergia11 (fig. 2).
Avances relevantes en el abordaje diagnóstico de la alergia. La anamnesis y las pruebas cutáneas han sido las herramientas fundamentales para el diagnóstico de alergia, desde un inicio. En los últimos años, se han desarrollado nuevas metodologías diagnósticas; en la figura se muestran ejemplos de pruebas comerciales que permiten la detección cualitativa y cuantitativa de la IgE específica, así como también herramientas más recientes de diagnóstico molecular (ALEX, ISAC) para explorar un gran número de componentes alergénicos.
Las pruebas de exposición o provocación alimentaria son las pruebas definitivas o patrón oro. Consisten en la administración controlada y gradual de la sustancia sospechosa de ser la causa de la reacción alérgica, para confirmar o descartar el diagnóstico o para comprobar la adquisición de tolerancia.
En el campo de la alergia respiratoria, existen las pruebas de provocación conjuntival y nasal que consisten en la aplicación del alérgeno de forma local, valorando posteriormente por distintos métodos (rinometría acústica, rinomanometría anterior activa, rinomanometría posterior activa, rinomanometría anterior pasiva, pico de flujo inspiratorio nasal y toma de biopsia para calificar la respuesta celular) la reacción de cada órgano.
La principal exploración de la función respiratoria se hace a través de la espirometría forzada. Una prueba broncodilatadora positiva apoya el diagnóstico de asma. En varios estudios, se ha confirmado que el número de eosinófilos en sangre es mayor en los pacientes asmáticos, aunque su empleo como medida de la inflamación bronquial es controvertido. Por otro lado, el óxido nítrico exhalado (FeNO) es un marcador de inflamación eosinofílica de las vías respiratorias y puede medirse en una única espiración mediante dispositivos portátiles.
Si hay dudas respecto a los alérgenos causantes de la patología bronquial, se realizan provocaciones bronquiales específicas, que miden la respuesta bronquial tras inhalar el alérgeno sospechoso. Últimamente, se están usando también las cámaras de exposición a alérgenos en algunos centros dedicados a la investigación.
Cambios en el tratamiento de la patología alérgicaTratamiento de la alergia alimentariaEn la actualidad, el estándar terapéutico de la alergia alimentaria implica una dieta de evitación estricta12,13, con el potencial riesgo de experimentar reacciones accidentales, siendo necesario un tratamiento etiológico efectivo y seguro. Ha habido avances significativos en el abordaje de la anafilaxia, como disponibilidad de auto-inyectores de adrenalina desde los años 80, que ha facilitado su tratamiento inmediato en el ámbito extrahospitalario (por ejemplo, escuela, domicilio y restaurantes).
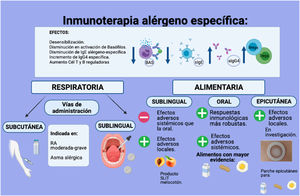
En 1908, se reportó por primera vez el éxito de la administración de dosis crecientes de huevo a un adolescente con antecedente de anafilaxia. Desde entonces, la inmunoterapia específica a alérgenos (ITA) ha sido el centro de atención de las iniciativas de investigación. Si bien, su mecanismo de acción no se comprende en su totalidad, se ha demostrado su capacidad de inmuno-modulación, disminuyendo la activación de basófilos y mastocitos, el incremento de IgG4 específica, la disminución de IgE alérgeno-específica y la generación de células T y B reguladoras14,15. En general, tanto para alérgenos alimentarios como para los respiratorios, la ITA consiste en el incremento gradual de dosis del alérgeno implicado (alimento o extractos estandarizados de calidad) durante la inducción hasta alcanzar una determinada dosis de mantenimiento16.
Uno de los objetivos de la ITA en la alergia alimentaria mediada por IgE es la desensibilización12, lo que supone un incremento en el umbral de reactividad a un alérgeno, siendo posible en el 60 a 90% de los casos13,17,18. Un objetivo más deseable, lo representa la ausencia de reactividad tras la descontinuación del tratamiento, lo que se conoce como arreactividad mantenida. La arreactividad mantenida reporta en el 27,5 a 50% después de dos a cuatro años en tratamiento17.
La vía de administración oral es la más estudiada, principalmente en leche, huevo y cacahuete19 y menos frecuentemente para pescado, avellana, melocotón20 y otros13,16,17. Esta vía se asocia a una mejor respuesta inmunológica y al desarrollo de remisión17. Se reportan efectos adversos como: reacciones alérgicas leves, anafilaxia (6,7 a 30,8%)15 y esofagitis eosinofílica (2,7%)15,17.
La ITA sublingual (claro ejemplo es la inmunoterapia para melocotón) y epicutánea representan potenciales vías alternativas de administración, con efectos adversos principalmente locales16,19. Sin embargo, el perfil de seguridad y efectividad en la edad pediátrica se encuentra en investigación (fig. 3).
Inmunoterapia alérgeno específica. En la figura se enumeran los principales efectos clínicos e inmunológicos de la inmunoterapia alérgeno específica. Se muestran también las diversas vías de administración para el tratamiento con inmunoterapia específica tanto de la alergia respiratoria como de la alimentaria.
En el 2017, la Academia Europea de Alergia e Inmunología Clínica (EAACI) publicó las guías de práctica de ITA a alimentos, recomendándose desde los cuatro a cinco años para el tratamiento de alergia mediada por IgE persistente a huevo, leche y cacahuete21. A su vez, otras sociedades científicas han elaborado guías clínicas para la práctica homogénea y segura de la ITA15,22.
En los últimos años, el interés médico y farmacéutico se ha centrado en innovar el ámbito terapéutico de la alergia alimentaria con resultados prometedores23, utilizando formas modificadas del alimento (polvo, altas temperaturas, «efecto matriz» y vehículos), consiguiendo mejorar la seguridad y la adherencia. Un avance importante ha sido la autorización por las agencias reguladoras Food and Drug Administration y European Medicines Agency (FDA y EMA) del primer producto estandarizado para el tratamiento de la alergia al cacahuete (Palforzia®, AR101®)24,25. Asimismo, se ha formulado un parche epicutáneo con cacahuete, leche y huevo (Viaskin®), pendiente de aprobación para su uso comercial12,17. Existen otras estrategias en investigación (modificación alergénica, vacunas con ADN bacteriano, péptidos, vías alternativas de administración, probióticos, biológicos), cada una en diferentes etapas de desarrollo17,26,27.
Tratamiento de la alergia respiratoriaEl tratamiento de la alergia respiratoria se ha fundamentado en las medidas de evitación del alérgeno y el uso de farmacoterapia para el control sintomático y de la inflamación14,28. Sin embargo, un número significativo de pacientes persisten sintomáticos a pesar de la terapia estandarizada28,29.
La ITA a inhalantes fue una terapia pionera realizada empíricamente, por primera vez, por Noon hace más de 100 años. Desde su primera descripción, se han conseguido tratamientos específicos, siendo la ITA a inhalantes la única estrategia capaz de modificar el curso de la alergia respiratoria14,29,30. Existe evidencia significativa de su capacidad para mejorar la RA y el asma alérgica en pacientes mayores de cinco años14,30,31. Resulta en la desensibilización al alérgeno, lo que se traduce en disminución de la sintomatología y de la necesidad de terapia de rescate.
Su utilización está avalada actualmente por las guías internacionales en RA moderada- severa y también en leve, para modificar el curso de la enfermedad (por ejemplo, progresión a asma)28 y para el tratamiento del asma por ácaros del polvo32,33 durante al menos tres años23,28,30,32,34,35. La vía de administración subcutánea y sublingual son las más utilizadas, con adecuada efectividad y seguridad (fig. 3).
Como resultado de los últimos avances, se realizan intervenciones para la mejora de la adherencia, el perfil de efectividad y seguridad, a través de la modificación alergénica (alergoides e hipoalérgenos recombinantes), la fusión de alérgenos con modificadores de la inmunidad y la creación de proteínas transportadores de péptidos. Otra estrategia de interés ha sido el potenciar la inmunogenicidad con la utilización de adyuvantes, siendo hasta el momento el más empleado el hidróxido de aluminio, además de otros más novedosos (monofosforil Lípido A, tirosina microcristalina)14,36. También se investigan otras rutas de administración aún sin suficiente evidencia (intra-linfática y epicutánea)30.
Si bien, aún quedan muchos interrogantes por responder, la ITA ha resultado ser una herramienta muy eficaz.
Fármacos biológicos en el tratamiento de la patología alérgicaLos avances en el conocimiento fisiopatológico, la caracterización fenotípica y endotípica de las patologías alérgicas han permitido el desarrollo de nuevas opciones terapéuticas.
Los biológicos representan una innovadora rama terapéutica37, principalmente en contexto de pobre respuesta a la terapia convencional. En un inicio, la utilidad de los agentes biológicos se centró en el tratamiento adyuvante del asma refractaria, dado que hasta un 4,5% de los niños asmáticos desarrollan asma grave37. Cada vez más, se demuestra su eficacia en otras patologías alérgicas.
Estas terapias representan agentes de alto peso molecular que se unen a determinantes específicos (citosinas y receptores) y actúan modificando las vías de activación y señalización de las diferentes proteínas involucradas en las patologías alérgicas.
Debido a esta selectividad propia de los tratamientos biológicos, resultan ideales en el manejo de la medicina personalizada y de precisión38. Es imprescindible un amplio conocimiento de la fisiopatología involucrada en la enfermedad a tratar para obtener el mayor beneficio de estos tratamientos38.
Uno de los más utilizados, Omalizumab, ha demostrado un adecuado perfil de efectividad y seguridad resultando costo-efectivo comparado con el uso aislado de medicación convencional38. Fue aprobado por primera vez por la FDA en el 2003 y en el 2005 por la EMA para el uso en adultos y adolescentes mayores de 12 años con asma alérgica grave persistente. La indicación pediátrica (infantes ≥ 6 años), fue aprobada por la EMA (2009) y por la FDA (2016).
Múltiples estudios de calidad han demostrado la disminución tanto del uso de corticoides inhalados como en la medicación de rescate, visitas a urgencias y hospitalizaciones, además de la mejora en la calidad de vida de los pacientes asmáticos graves38. Se ha utilizado también en combinación con ITA, mejorando su perfil de seguridad, principalmente en situaciones de alto riesgo.
Además, recientemente ha demostrado ser útil como adyuvante en pacientes con alergia alimentaria grave que realizan ITA, alcanzándose la desensibilización38. Ha evidenciado un rol en la actividad de la urticaria crónica espontánea o inducible moderada a grave, refractaria al tratamiento estandarizado de primera línea, por lo que se recomienda su uso en guías internacionales como tercera línea en esta entidad.
Los primeros tratamientos biológicos aprobados en niños y niñas mayores de seis años fueron omalizumab y mepolizumab37. Recientemente, también se aprobó el uso de dupilumab en dermatitis atópica.
En la tabla 1 se encuentran enumerados los fármacos biológicos con sus aplicaciones terapéuticas en el ámbito de la alergia.
Agentes biológicos y su indicación en alergia pediátrica
| Biológico | Mecanismo de acción: | Indicación: |
|---|---|---|
| Omalizumab | Anti-IgE, se une a IgE libre37. | Niños > 6 años con asma alérgica grave persistente (cuarto escalón de tratamiento).Urticaria crónica espontánea o inducible moderada grave (tercera línea). |
| Mepolizumab | Anti-IL-5, se une a la cadena α del receptor de IL-539. | Niños > 6 años, con asma eosinofílica grave, caracterizada por exacerbaciones frecuentes y persistentes, además de una eosinofilia resistente a corticoesteroides y que no responden a omalizumab40,41. |
| Dupilumab | Actúa en la subunidad α del receptor de la IL-4 (anti IL-4R?), bloqueando ambas vías de señalización para ambas la IL-4 e IL-1342. | Dermatitis atópica moderada-grave en adultos y adolescentes mayores de 12 años (EMA)En niños > 6 años con las mismas condiciones que no se controlan con la medicación tópica (FDA)42.Asma grave con eosinofilia periférica en >12 años. |
EMA: European Medicines Agency; FDA: Food and drug administration; IgE: inmunoglobulina E; IL: interleucina.
Se encuentra en investigación mepolizumab en el tratamiento de la dermatitis atópica, que ha demostrado mínima mejoría hasta el momento, por lo que su uso debe reservarse para pacientes refractarios al tratamiento convencional. También se han obtenido resultados prometedores con el uso de dupilumab en asma alérgica, demostrándose en estudios randomizados controlados, la eficacia en la reducción de exacerbaciones graves, mejoría en la función pulmonar y el control del asma en pacientes asmáticos con moderadas o altas dosis de corticoides inhalados.
Es indiscutible que las terapias con biológicos han innovado el manejo de las patologías alérgicas, con un impacto no solo en la evolución de la enfermedad sino también en la calidad de vida de los pacientes.
Con cada avance se confirma que, en un futuro, la indicación de un biológico dependerá también de biomarcadores, endotipos y características genéticas. La integración de estos elementos a la caracterización clínica de los pacientes resultará en el incremento en la utilización de biológicos con la potencial modificación de los algoritmos de tratamiento tradicionales38. Se encuentran también en investigación otras terapias dirigidas a modificar las diferentes vías Th2 del sistema inmune.
ConclusionesEl aumento en la prevalencia de las enfermedades alérgicas ha ido en paralelo con un avance en técnicas diagnósticas y terapéuticas. La búsqueda continua de biomarcadores y la constante optimización en las pruebas diagnósticas permitirán un diagnóstico y tratamiento cada vez más preciso e individualizado. La mejora en la comprensión de los mecanismos inmunológicos en alergia y tolerancia resultarán en la optimización, desarrollo e identificación de nuevos tratamientos dirigidos. Por todo esto, el futuro práctico de la alergología es esperanzador.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.