El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza anualmente el calendario de vacunaciones teniendo en cuenta tanto aspectos epidemiológicos como de seguridad, efectividad y eficiencia de las vacunas.
El presente calendario incluye grados de recomendación. Se consideran vacunas sistemáticas aquellas que el CAV-AEP estima que todos los niños deberían recibir; recomendadas, las que presentan un perfil de vacuna sistemática en la edad pediátrica y que es deseable que los niños reciban, pero que pueden ser priorizadas en función de los recursos para su financiación pública; y dirigidas a grupos de riesgo, aquellas con indicación preferente para personas en ciertas situaciones especiales.
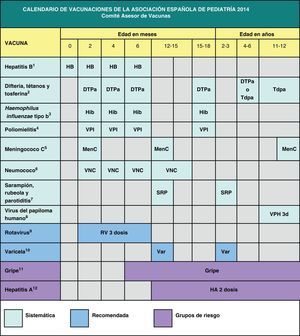
Los calendarios de vacunaciones tienen que ser dinámicos y adaptarse a los cambios epidemiológicos que vayan surgiendo. Teniendo en cuenta los últimos cambios en la epidemiología de las enfermedades, el CAV-AEP recomienda la administración de la 1.a dosis de las vacunas triple vírica y varicela a los 12 meses y la 2.a dosis a los 2-3 años; la administración de la vacuna DTPa o Tdpa a los 4-6 años, siempre acompañada de otra dosis de Tdpa a los 11-12 años; y el paso a un esquema 2 meses, 12 meses y 12 años de la vacunación frente al meningococo C.
Se reafirma en la recomendación de incluir la vacunación frente al neumococo en el calendario de vacunación sistemático. El CAV-AEP estima que deben incrementarse las coberturas de vacunación frente al papilomavirus humano en las niñas a los 11-12 años. La vacunación universal frente a la varicela iniciada en el segundo año de vida es una estrategia efectiva, y se solicita la inmediata disponibilidad pública de la vacuna, reclamando el derecho a la prescripción y el derecho de los niños sanos a poder ser vacunados. La vacunación frente al rotavirus, dadas la morbilidad y la elevada carga sanitaria, es recomendable en todos los lactantes. Se insiste en la necesidad de vacunar frente a la gripe y a la hepatitis A a todos los que presenten factores de riesgo para dichas enfermedades. La vacuna frente al meningococo B, recientemente autorizada, abre un capítulo de esperanza en la prevención de esta enfermedad. En espera de próximos estudios nacionales e internacionales se recomienda, por el momento, para el control de brotes epidémicos y se insiste en el deseo de que sea comercializada libremente en las oficinas de farmacia.
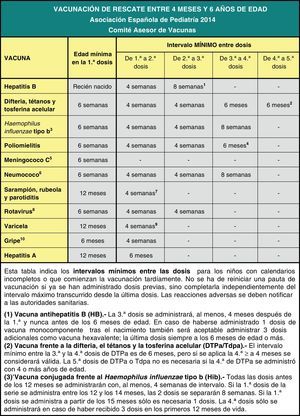
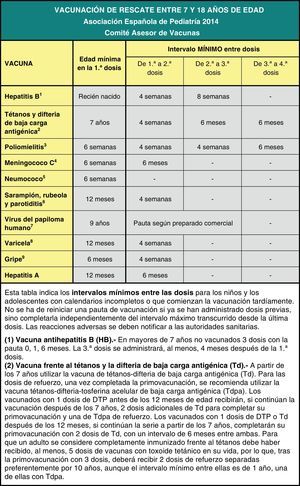
Por último, se insiste en la necesidad de actualizar las vacunaciones incompletas con las pautas de vacunación acelerada.
The Advisory Committee on Vaccines of the Spanish Association of Paediatrics (CAV-AEP) updates the immunisation schedule every year, taking into account epidemiological data as well as evidence on safety, effectiveness and efficiency of vaccines.
The present schedule includes levels of recommendation. We have graded, as routine vaccinations, those that the CAV-AEP consider all children should receive; as recommended those that fit the profile for universal childhood immunisation and would ideally be given to all children, but that can be prioritised according to the resources available for their public funding; and as risk group vaccinations those that specifically target individuals in special situations.
Immunisation schedules tend to be dynamic and adaptable to ongoing epidemiological changes. Based on the latest epidemiological trends, CAV-AEP recommends the administration of the first dose of MMR and varicella vaccines at age 12 months, with the second dose at age 2-3 years; the administration of DTaP or Tdap vaccine at age 4-6 years, always followed by another Tdap dose at 11-12 years; and the three meningococcal C scheme at 2 months, 12 months and 12 years of age.
It reasserts its recommendation to include vaccination against pneumococcal disease in the routine immunisation schedule. The CAV-AEP believes that the coverage of vaccination against human papillomavirus in girls aged 11-12 years must be increased. Universal vaccination against varicella in the second year of life is an effective strategy, and the immediate public availability of the vaccine is requested in order to guarantee the right of healthy children to be vaccinated. Vaccination against rotavirus is recommended in all infants due to the morbidity and elevated healthcare burden of the virus. The Committee stresses the need to vaccinate population groups considered at risk against influenza and hepatitis A. The recently authorised meningococcal B vaccine has opened a chapter of hope in the prevention of this disease. In anticipation of upcoming national and international studies, the Committee recommends the vaccine for the control of disease outbreaks, and insists on the need to be available in pharmacies.
Finally, it emphasises the need to bring incomplete vaccinations up to date following the catch-up immunisation schedule.
Como en años anteriores, el Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza el calendario de vacunaciones teniendo en cuenta la evidencia disponible sobre la seguridad, la efectividad y la eficiencia de las vacunas infantiles, así como la epidemiología de las enfermedades inmunoprevenibles en nuestro medio.
Estas recomendaciones van dirigidas a pediatras, médicos de familia, personal de enfermería, matronas, familiares de los niños y, en general, a todas aquellas personas interesadas en disponer de una información actualizada sobre la vacunación en la edad pediátrica.
Teniendo en cuenta que en España los calendarios oficiales de vacunación son sufragados en su totalidad por los servicios públicos de salud, desde 2010 el calendario de este comité incluye grados de recomendación para las diferentes vacunas, con el objeto de establecer niveles de prioridad en la financiación pública de las mismas, considerando no solo su efectividad y seguridad, sino también la carga de enfermedad en nuestro medio y, cuando es posible, también criterios de eficiencia. Este mismo criterio pretende orientar al pediatra sobre las recomendaciones dirigidas a los padres acerca de las vacunas contempladas en este calendario, pero no incluidas en los calendarios oficiales. En la figura 1 se muestra el calendario de vacunaciones recomendado por el CAV-AEP para 2014, clasificando las vacunas en sistemáticas, recomendadas y las dirigidas a grupos de riesgo. Se han considerado como vacunas sistemáticas aquellas que el CAV-AEP estima que todos los niños en España deberían recibir de forma universal; como recomendadas, las que presentan un perfil de vacuna sistemática en la edad pediátrica y que el CAV-AEP considera deseable que todos los niños reciban, pero que, por razones de coste-efectividad, su prioridad se establece en función de las posibilidades económicas de su financiación pública; y dirigidas a grupos de riesgo, aquellas que se consideran indicadas para individuos en situaciones ambientales o personales que incrementen la probabilidad de presentar las enfermedades para las que van dirigidas o de sufrir formas más graves si las padeciesen, o porque tengan una enfermedad de base que pueda agravarse o desestabilizarse si contraen la enfermedad infecciosa.
Se sigue haciendo hincapié en la necesidad de que las inmunizaciones sistemáticas alcancen por igual a todos los niños, eliminando las disparidades étnicas, territoriales, sociales y económicas. Se considera un objetivo primordial poner al día el calendario de vacunación en los niños inmigrantes y en aquellos cuyo calendario de vacunación esté incompleto, no solo para lograr su protección individual ante las enfermedades inmunoprevenibles, sino también para evitar la formación de grupos de población susceptible que puedan dar lugar a la aparición de brotes epidémicos, como los de sarampión o parotiditis que han sucedido muy recientemente en España.
Los contactos esporádicos que algunos niños tienen con los servicios de salud (urgencias, ingreso hospitalario, pediatra, médico de cabecera o enfermera) deben ser aprovechados para la actualización de su calendario de vacunación y también conviene recordar la necesidad de un adecuado registro de las vacunas en los documentos de salud infantil de los niños y en las historias clínicas de los mismos.
Siguiendo la iniciativa puesta en marcha el año pasado, se han incluido al inicio de cada apartado los puntos clave de actuación con cada una de las vacunas. Dentro de los mismos, se insiste en los cambios propuestos en los dos años anteriores1,2 y se añaden otros nuevos, destacando:
- -
La 1.a dosis de las vacunas triple vírica (TV) y de la varicela se recomienda a los 12 meses.
- -
La 2.a dosis de las vacunas TV y de la varicela se recomienda entre los 2 y 3 años, con preferencia a los 2 años.
- -
Se cambia la pauta de vacunación frente al meningococo C (MenC) pasando de un esquema 2+1 a un esquema 1+1+1: una dosis a los 2 meses, otra a los 12 meses y una 3.a, en la adolescencia, a los 12 años de edad.
- -
Dada la duración limitada de la inmunidad frente a la tosferina se vuelve a recomendar la vacuna difteria, tétanos, tosferina (DTPa) o la vacuna combinada de baja carga antigénica frente al tétanos, la difteria y la tosferina (Tdpa) a los 4-6 años y la Tdpa a los 11-12 años. Ya que la mayoría de las comunidades autónomas (CC. AA.) utilizan la Tdpa a los 4-6 años, se recomienda que vaya obligatoriamente seguida de otra dosis de Tdpa a los 11-12 años.
- -
La vacuna frente al meningococo B se recomienda actualmente para el control de brotes epidémicos y se insiste en la necesidad de que sea comercializada libremente en las oficinas de farmacia.
Desde hace más de 4 años mantenemos abierta la posibilidad en la página web del CAV-AEP (www.vacunasaep.org) de que el profesional pueda realizar preguntas sobre dudas que le surgen a la hora de aplicar las vacunas infantiles, de una forma sencilla y con una respuesta en el plazo máximo de 72h, accediendo desde http://vacunasaep.org/profesionales/pregunta-al-cav/envia-tu-pregunta.
Los calendarios de vacunaciones tienen que ser dinámicos y adaptarse a los cambios epidemiológicos que vayan surgiendo, así como a la incorporación de nuevas vacunas o novedades relacionadas con las vacunas ya existentes. Algunas modificaciones propuestas en este nuevo calendario ya están siendo aplicadas en algunas comunidades españolas. El CAV-AEP sigue considerando un objetivo primordial la consecución de un calendario único de vacunación, de forma que se mantenga el principio de igualdad en la prevención de las enfermedades y el principio de racionalidad que faciliten el cumplimento de las inmunizaciones en los niños que cambien de comunidad autónoma como lugar de residencia.
En la actualidad, no hay diferencias epidemiológicas en las enfermedades inmunoprevenibles entre las diferentes CC. AA., con la posible excepción de la hepatitis A en Ceuta y Melilla, que justifiquen la existencia de calendarios de vacunaciones distintos3. El CAV-AEP estima que es necesario un esfuerzo colectivo de todos los agentes sanitarios y políticos implicados en la toma de decisiones sobre el diseño y la financiación del calendario de vacunaciones para los niños residentes en España y sigue ofreciendo su colaboración para la consecución de este sensato objetivo; en este sentido hemos manifestado nuestra oposición al nuevo calendario común propuesto por el Consejo Interterritorial en marzo de 20134 por considerarlo una propuesta que ahonda en los problemas de implantación de un calendario único en las CC. AA. y porque es insuficiente para conseguir la mejor y mayor protección de todos los niños españoles, al no contemplar la incorporación de nuevas vacunas sistemáticas, ni siquiera con un plan de futuro cuando mejoren las circunstancias económicas. Por tanto, sería deseable que se hiciera un esfuerzo económico colectivo por parte de las CC. AA. y por el Ministerio que permitiera la financiación de un calendario sistemático completo, y no de mínimos, para los niños españoles (ver editorial sobre el calendario único publicado en este mismo número de Anales de Pediatría).
Se puede ampliar la información sobre todas las vacunas infantiles y las situaciones especiales de su administración en el Manual de vacunas en línea de la AEP que está en permanente actualización, accediendo a él en nuestra página web www.vacunasaep.org.
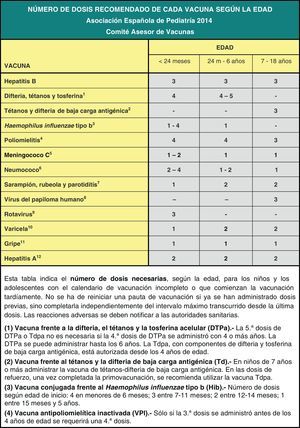
Vacunación frente a la hepatitis BRecomendación CAV-AEP 2014: el comité recomienda que la vacunación frente a la hepatitis B se realice en el primer año de vida con 3 o 4 dosis, en forma de vacuna monocomponente o hexavalente. En niños mayores se aplicarán 3 dosis de vacuna monocomponente, con la pauta 0, 1 y 6 meses.
La vacunación frente a la hepatitis B requiere 3 dosis que pueden administrarse según las siguientes pautas equivalentes: 0, 1 y 6 meses; 0, 2 y 6 meses; y 2, 4 y 6 meses.
Los 3 esquemas son adecuados para hijos de madres seronegativas (HBsAg [del inglés, hepatitis B surface antigen] negativo). Las 2 primeras pautas son también correctas para hijos de madres portadoras del virus de la hepatitis B (HBsAg positivo). Estos últimos deben recibir, además, 0,5ml de inmunoglobulina específica antihepatitis B, por vía intramuscular, preferiblemente en las primeras 12h de vida y en un lugar anatómico diferente del de la vacuna. Si la serología materna es desconocida debe administrarse al recién nacido la 1.a dosis de vacuna en las primeras 12h de vida e investigar la serología inmediatamente y, si resultara positiva, administrar 0,5ml de inmunoglobulina antihepatitis B dentro de la 1.a semana de vida, preferentemente en las primeras 72h.
En el caso de la vacunación sistemática neonatal, siempre con preparado monocomponente, la pauta más habitual es continuar con la administración alternante de vacuna combinada hexavalente (DTPa-vacuna antipoliomielítica inactivada-Haemophilus influenzae tipo b-hepatitis B [DTPa-VPI-Hib-HB]) a los 2 y 6 meses, intercalando el preparado pentavalente (DTPa-VPI-Hib) a los 4 meses de edad5,6. La vacunación frente a la hepatitis B en el primer año con 4 dosis es también aceptable en aquellas CC. AA. donde se vacuna al nacimiento y además se utiliza la vacuna hexavalente a los 2, 4 y 6 meses de vida3.
El intervalo mínimo recomendado entre la 1.a y la 2.a dosis es de 4 semanas, y entre la 2.a y la 3.a, de 8 semanas. La dosis final de la serie debe administrarse no antes de las 24 semanas de edad (aproximadamente 6 meses) y, al menos, 16 semanas (aproximadamente 4 meses) después de la 1.a dosis7. Las dosis administradas que no respeten estos intervalos mínimos recomendados deben considerarse no válidas.
En los prematuros de menos de 2.000g de peso al nacimiento, que sean hijos de madres HBsAg negativas y que vivan en CC. AA. donde esté establecida la vacunación universal neonatal frente a la hepatitis B, se recomienda posponer la 1.a dosis de la vacuna hasta que hayan alcanzado un mes de edad cronológica o al alta hospitalaria. En el caso de prematuros de menos de 2.000g de peso al nacimiento, hijos de madres HBsAg positivas o de serología desconocida deberán recibir la vacuna en las primeras 12h de vida, si bien, debe considerarse como dosis no contabilizable y repetirse al mes de edad, por lo que han de recibir un total de 4 dosis, además de recibir la inmunoglobulina antihepatitis B e investigar la serología en la madre8.
La vacunación de rescate frente a la hepatitis B en niños mayores y adolescentes no vacunados con anterioridad se realizará siguiendo la pauta 0, 1 y 6 meses6.
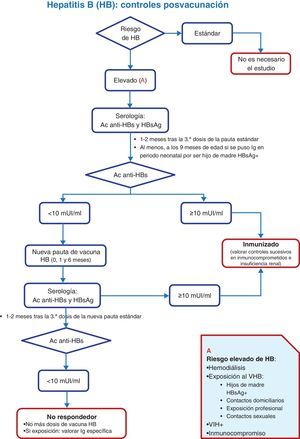
En sujetos no incluidos en grupos de riesgo no es preciso realizar controles serológicos posvacunación (anticuerpos anti-HBs) tras completar la serie frente a la hepatitis B8. Por otro lado, en todas las personas de riesgo, que es en quienes está indicada esta determinación analítica, solo se considerará fiable el resultado si se efectúa 1-2 meses después de la dosis final de la pauta (en hijos de madres HBsAg positivas no se hará antes de los 9 meses de edad, debido a la posibilidad de confusión con anticuerpos anti-HBs procedentes de la dosis neonatal de inmunoglobulina específica, y también se solicitará HBsAg). Si la determinación de anti-HBs se realiza posteriormente a estos 2 meses y resultara negativa, no implicará necesariamente falta de respuesta a la vacunación, porque entre el 15 y el 50% de las personas vacunadas negativizan los anticuerpos anti-HBs y siguen protegidos por la memoria inmunológica inducida por esta vacuna6,7. En la figura 2 se expone un algoritmo que explica cómo se debe actuar en estos casos.
Vacunación frente a la difteria, el tétanos, la tosferina, la poliomielitis y el Haemophilus influenzae tipo bRecomendación CAV-AEP 2014: el CAV-AEP recomienda la primovacunación de DTPa-VPI-Hib-HB a los 2, 4 y 6 meses, siendo aceptable el empleo de la vacuna hexavalente o de la pentavalente más la vacuna monocomponente de hepatitis B. Se puede valorar adelantar la 1.adosis a las 6 semanas de vida. El refuerzo con DTPa-VPI-Hib debe realizarse a los 15-18 meses, con un refuerzo posterior con DTPa o Tdpa a los 4-6 años y con Tdpa a los 11-12 años. Se recomienda la vacunación con Tdpa a la embarazada a partir de la 27 semana de gestación, y a los miembros del entorno familiar de los recién nacidos (especialmente de la madre, no previamente vacunada en el embarazo, en el puerperio inmediato).
Epidemiología actual de la tosferina. Uso de vacunas antitosferina acelularesLa tasa de tosferina en España fue de 7,43 casos por 100.000 habitantes en el año 20129. El incremento de casos de tosferina afecta especialmente a lactantes menores de 3 meses, que todavía no han recibido la vacuna o están incompletamente vacunados, así como a adolescentes y adultos mayores de 15 años. El 40% de los casos se dan en menores de un año, que es el grupo más vulnerable por la frecuencia de complicaciones y por la alta letalidad (1,41 por 100)10; todo ello a pesar de una cobertura de vacunación elevada11. Por esto, las acciones preventivas deben dirigirse fundamental y prioritariamente a proteger a este grupo y a tratar de disminuir la incidencia en los adolescentes y adultos que actúan como reservorio y fuente de infección12.
Desde hace tiempo existen dudas sobre la duración de la inmunidad y con ello de la protección frente a la Bordetella pertussis (B. pertussis). Tanto la infección natural como la vacunación confieren una protección limitada; se estima en 4-20 años para la infección natural y en 4-7 años para la adquirida mediante la vacunación13. Según una reciente revisión de la Cochrane, la eficacia de las vacunas acelulares con ≥3 componentes se estima en un 84-85% para prevenir la tosferina típica y en 71-78% para la tosferina leve14.
Estudios iniciales de eficacia vacunal pusieron de manifiesto la no inferioridad de las vacunas tipo Tdpa (de baja carga antigénica frente a la difteria y la tosferina) frente a las DTPa (de carga antigénica estándar frente a la difteria y la tosferina), en términos de inmunoprotección, no encontrándose diferencias entre los niños receptores de Tdpa y DTPa a los 4-6 años de edad15. Los brotes epidémicos acontecidos en California en 2010-2011 y en Washington en 2012 han aportado importantes datos sobre la efectividad de estas vacunas. Se ha apreciado una disminución de la inmunidad con el paso del tiempo16. También se ha documentado una mayor protección en aquellos niños que recibieron la serie primaria de vacunación con vacunas de célula entera, frente a los que recibieron la serie con preparados acelulares. Sin embargo, no parece razonable recomendar de nuevo su utilización, en tanto no se disponga de vacunas de célula entera modificadas para disminuir su reactogenicidad. La mejor opción sería disponer de vacunas acelulares más potentes17.
La efectividad vacunal a largo plazo ha sido menor de la esperada. En niños de 4-10 años que habían recibido 5 dosis de vacunas con preparados acelulares de carga estándar, se estimó en un 88,7%18. En niños de 11 o más años, que habían recibido Tdpa, fue aproximadamente de un 60%19.
El uso de preparados de célula entera tuvo que ser sustituido por las acelulares debido al mayor riesgo de reacciones adversas tras la administración. Deberían emplearse nuevas estrategias de vacunación, como se ha comentado anteriormente, antes de volver a este tipo de preparados.
Quinta dosis a los 4-6 años: DTPa/TdpaEn España, la administración de la 5.a dosis de DTPa (refuerzo) correspondiente a los 4-6 años se ha llevado a cabo hasta el año 2010 con DTPa (Infanrix®). La mayoría de los países occidentales utilizan para esta 5.a dosis preparados de carga antigénica estándar, con el componente de tosferina acelular (DTPa). Las vacunas acelulares de baja carga antigénica están autorizadas en EE. UU. a partir de los 10-11 años5; sin embargo, en Europa, este tipo de vacunas están autorizadas a partir de los 4 años de edad. Actualmente, en España existen 2 preparados comerciales disponibles de Tdpa, Boostrix® (GlaxoSmithKline) y Triaxis® (Sanofi Pasteur MSD), autorizados para su uso en niños a partir de los 4 años de edad (no en primovacunación), y ambos con escasa reactogenicidad y buena inmunogenicidad. Son los preparados idóneos para estas estrategias20,21. Muy pocos países las utilizan como refuerzo de los 4-6 años (Alemania, Reino Unido y España), destacando que Alemania incluye otro refuerzo a los 9-11 años y a partir de los 18 años22. En el Reino Unido, desde junio de 2013, se considera aceptable para la administración del refuerzo (4.a dosis) a los 3 años y 4 meses el uso indistinto de DTPa/Tdpa23.
En España, la tendencia ha sido la sustitución de la 5.a dosis con carga antigénica estándar por la vacuna Tdpa y así se ha realizado ya en 13 CC. AA., además de Ceuta y Melilla3, basándose en las recomendaciones de algunas publicaciones científicas y especialmente en la recomendación de la Ponencia del Programa y Registro de Vacunaciones que propuso, a la Comisión de Salud Pública, la sustitución de la DTPa administrada como 5.a dosis, en el calendario del Consejo Interterritorial del Sistema Nacional de Salud (CISNS), por la vacuna Tdpa24. La justificación de este cambio se consensuó por el menor coste y por la menor frecuencia de reacciones adversas que las observadas con DTPa.
En la actualidad el CAV-AEP considera aceptable, para el refuerzo de los 4-6 años, el uso de preparados DTPa o Tdpa, según disponibilidad. Para ello se han tenido en cuenta razones epidemiológicas y estudios de efectividad de las vacunas.
Tras los brotes recientes de tosferina en EE. UU. se han realizado estudios de efectividad vacunal. Con vacunas acelulares de carga antigénica estándar se ha estimado, a los 12 meses de la 5.a dosis, una efectividad del 98,1% (IC del 95%: 96,1-99,1) mientras que por encima de los 5 años disminuye al 71,2% (IC del 95%: 45,8-84,4)18. Asimismo, en los adolescentes vacunados con preparados de baja carga antigénica, se observó un descenso del título de anticuerpos a partir del 5.o año tras la vacunación25. Por ello, el uso de refuerzos repetidos parece una estrategia razonable para mantener la protección frente a B. pertussis, independientemente del tipo de vacuna empleada.
El CAV-AEP compartió la recomendación de aplicar Tdpa en la 5.a dosis en los años 2012 y 2013, siempre que se acompañara de una 6.a dosis de Tdpa. En la actualidad se inclina por recomendar preparados de carga antigénica estándar o de baja carga indistintamente. Además, considera que esta 5.a dosis debería ser complementada forzosamente con una 6.a dosis de Tdpa en la adolescencia, estrategia que actualmente realizan diversos países en los continentes americano y oceánico, y 17 países europeos22,26. En España, la comunidad de Madrid y las ciudades autónomas de Ceuta y Melilla también han implantado esta pauta3, dada la disminución de la inmunidad frente a la tosferina que se produce con el paso de los años. El CAV-AEP estima que la edad óptima para esta dosis se sitúa entre los 11 y los 12 años.
En otros países se recomienda posteriormente una dosis de refuerzo cada 10 años (Td y de elección una de ellas con Tdpa)22.
En España, las recomendaciones oficiales del Ministerio consideran que los individuos que completan su calendario de vacunación en la adolescencia no precisarán otra dosis hasta los 60-65 años de edad y que un adulto está bien vacunado con 5 dosis de tétanos recibidas a lo largo de su vida27.
Estrategias complementarias frente a la tosferinaLas estrategias para controlar el resurgimiento de la tosferina deben centrarse sobre todo en la protección de los más vulnerables (niños menores de 3 meses), sin olvidar que son los adolescentes y los adultos los que transmiten la infección28,29.
La primovacunación con DTPa se ha venido recomendando rutinariamente desde los 2 meses de edad. Sin embargo, organismos como la American Academy of Pediatrics y el Advisory Committee on Immunization Practices (ACIP) consideran que la edad mínima se puede adelantar a las 6 semanas5.
La vacunación del recién nacido es controvertida y aún no se recomienda por ningún organismo oficial. No se dispone de preparados monocomponente de tosferina y además se ha descrito interferencia con otras vacunas del calendario, como hepatitis B y Hib30.
La estrategia del nido (cocooning)31 está diseñada para proteger al recién nacido y al lactante menor de 3 meses mediante la vacunación de los padres (especialmente de la madre) y otros convivientes que vayan a tener contacto con el niño. La madre debería ser inmunizada antes del alta hospitalaria, en el puerperio inmediato. Sin embargo, en la actualidad, sin dejar de practicar la estrategia del nido en el padre y otros convivientes del recién nacido, se prefiere la vacunación de la madre durante la gestación, mejor que en el posparto inmediato, por su mayor impacto en la reducción de casos, hospitalizaciones y muertes32.
En 2011, EE. UU. y Argentina propusieron la estrategia de vacunación de las embarazadas. Recientemente, Reino Unido ha recomendado la vacunación contra la tosferina en todas las embarazadas entre las semanas 28 y 38 de gestación, práctica que ya se realiza en dicho país en más del 50% de las gestaciones33. Esta estrategia permite el paso transplacentario de anticuerpos protectores al recién nacido y, al proteger a la madre, disminuye también la probabilidad de exposición a la infección y se considera el modo más efectivo de prevención, sin evidencia de riesgo para la madre ni el niño. Se estima que el momento que parece más adecuado para administrar Tdpa a la madre es entre las 27 y las 36 semanas de gestación. En las últimas recomendaciones del ACIP y del Reino Unido, se indica la vacunación con Tdpa en cada embarazo, independientemente de las dosis previas recibidas33,34.
La vacunación del adolescente permite proteger a los receptores de la vacuna y secundariamente disminuir las fuentes de infección a la comunidad.
Otras medidas adicionales que deben valorarse son: la vacunación de los profesionales de la salud, es decir, cualquier sanitario cuya actividad implique contacto directo con los niños (obstetricia, pediatría, neonatología, urgencias y unidades de cuidados intensivos pediátricos), para reducir la morbilidad asociada a la transmisión de la tosferina en los centros sanitarios35,36; la administración de un refuerzo sistemático para todos los adultos, incluidos los mayores de 65 años, y el refuerzo rutinario con Tdpa a todos los adultos en caso de heridas tetanígenas, en vez de la administración de Td37,38.
Haemophilus influenzae tipo b (Hib)En cuanto a la vacunación frente al Hib, en España se dispone de una presentación conjugada en forma monocomponente, en la que el polisacárido capsular se conjuga con la proteína del toxoide tetánico (PRP-T), que le sirve como transportador, como así sucede en los preparados combinados pentavalentes (DTPa-VPI-Hib) y hexavalentes (DTPa-VPI-Hib-HB). La pauta de vacunación sistemática recomendada por el CAV-AEP no difiere de la propuesta en años anteriores, pudiéndose iniciar la primovacunación desde las 6 semanas de edad.
Se recomiendan 3 dosis en el primer año de vida, con intervalos de 4-8 semanas entre ellas (2, 4 y 6 meses de edad); en las vacunas Hib monocomponentes, para niños entre 6 y 12 meses son suficientes 2 dosis con el mismo intervalo. A los 15-18 meses de edad es obligada la dosis de refuerzo, quedando el sujeto inmunizado con niveles de eficacia próximos al 100%39. En los niños de entre 12 y 14 meses, no vacunados previamente, se recomiendan 2 dosis y a partir de los 15 meses una dosis, no siendo necesaria la vacunación en niños mayores de 59 meses inmunocompetentes5.
Por encima de esta edad, la indicación de una dosis de vacuna se llevaría a cabo en individuos sin antecedentes de vacunación y con factores de riesgo de infección invasiva por Hib: asplenia anatómica o funcional (en los casos de esplenectomía programada, 2 meses antes de la intervención y en caso de urgencia, 2 semanas después de la intervención), leucemia, anemia de células falciformes, inmunodeficiencias adquiridas y trasplante de células madre hematopoyéticas5.
Para aquellos niños que hayan presentado la enfermedad invasiva antes de los 24 meses edad y no estuviesen vacunados, se recomienda que reciban las dosis de vacuna de acuerdo con la edad, como si no estuvieran vacunados, iniciando la vacunación un mes después de haber pasado la enfermedad.
PoliomielitisLa VPI forma parte de las vacunas hexavalentes y de las pentavalentes. La pauta de administración, en la primovacunación durante la primera infancia, es de 3 dosis en los meses 2, 4 y 6, y una 4.a de refuerzo a los 15-18 meses de edad, que debe administrarse con un intervalo mínimo de 6 meses respecto a la dosis previa. Esta última dosis no es necesaria en el caso de que la 3.a de VPI haya sido administrada después de que el niño haya cumplido los 4 años5. Por otro lado, existe un preparado monocomponente, con una formulación frente a la poliomielitis de virus inactivados de potencia aumentada (VPIa, tipo Salk), pero actualmente solo es accesible como «medicación extranjera», por lo que se reserva especialmente para personas no inmunizadas que vayan a viajar a zonas endémicas de poliomielitis (Nigeria, Afganistán, Pakistán) o epidémicas, como Somalia, Kenia y Etiopía, por orden de número de casos en 2013. En estos casos, es necesario haber recibido, al menos, 3 o más dosis de vacuna VPI y es conveniente ofrecer otra dosis antes de iniciar el viaje. Las personas que viajan frecuentemente, por periodos cortos, a zonas de polio endémica normalmente necesitan una sola dosis de vacuna después de recibir la serie primaria40.
Vacunas combinadas (DTPa-VPI-Hib/HB)Como en ediciones precedentes, el CAV-AEP recomienda el uso de vacunas combinadas porque facilita la administración conjunta de varias vacunas en el mismo momento, al tiempo que reduce el número de inyecciones y las molestias al niño, evita errores, acorta los tiempos de administración, mejora las coberturas y simplifica el calendario de vacunación. Por todas estas razones, el CAV-AEP continúa recomendando el uso de vacunas hexavalentes (DTPa-VPI-Hib-HB) durante la primovacunación a los 2, 4 y 6 meses. Por cuestiones económicas o por problemas de abastecimiento de las vacunas hexavalentes, se puede recurrir a los preparados pentavalentes (DTPa-VPI-Hib), completándose el calendario sistemático con una o varias dosis frente a la hepatitis B (monocomponente), según el esquema recomendado para esta vacunación. La evidencia científica adquirida a través de amplios ensayos clínicos apoya el uso de estas vacunas combinadas, sin que exista incompatibilidad con otras inmunizaciones, ni interferencias antigénicas reseñables41.
Es importante señalar que la vacuna pentavalente es la idónea como dosis de refuerzo a los 15-18 meses (4.a dosis de DTPa, VPI y Hib). Para minimizar las posibles reacciones locales algunos autores aconsejan la administración intramuscular en el muslo, por debajo de los 3 años de edad, cuando se utilizan vacunas acelulares DTPa42.
Vacunación frente al meningococo CRecomendación CAV-AEP 2014: el CAV-AEP recomienda que la vacunación frente al MenC se realice con 3 dosis de vacuna conjugada monovalente (esquema 1+1+1), con la siguiente pauta: una dosis a los 2 meses de edad, la 2.adosis a los 12 meses de edad y la 3.aa los 12 años.
Epidemiología actualLa incidencia de la enfermedad meningocócica ha ido descendiendo paulatinamente en España desde la introducción, en el calendario de vacunación infantil, de la vacuna conjugada frente al MenC en el año 2000. Esto ha sido un hecho determinante en el control de la enfermedad meningocócica del grupo C, que ha experimentado un descenso respecto a la época prevacunal de hasta el 88%.
En la temporada 2009-2010 se notificaron 440 casos confirmados de enfermedad meningocócica, que fue la tasa más baja registrada en los anteriores 11 años: 0,96 casos/100.000 habitantes, de los que 0,12/100.000 correspondieron al serogrupo C43. Este descenso se mantuvo en la temporada 2011-2012 (semana 41/2011-semana 35/2012, datos provisionales), en la que se registraron 54 casos de enfermedad meningocócica C, con una tasa de 0,12/100.000 y una letalidad del 16,6%, y en la temporada 2012-2013 (semana 41/2012-semana 35/2013, datos provisionales), en la que se han registrado 27 casos de enfermedad meningocócica por serogrupo C, con una tasa de 0,06/100.000 y con una letalidad del 11,1%. El serogrupo C ha presentado un descenso medio anual del 15,6% en el periodo 1996-201144.
Los 2 picos de mayor incidencia de enfermedad ocurren en menores de un año, y en adolescentes y adultos jóvenes, que además presentan la mayor letalidad.
En España, actualmente, el principal serogrupo productor de enfermedad meningocócica circulante es el meningococo B, responsable del 71,4% de los casos (año 2011), que supone el 51% de los casos de enfermedad meningocócica en niños menores de 5 años, seguido del serogrupo C44. La presencia de otros serogrupos sólo supone un 3% del total de aislados; en 2011, de 425 casos confirmados de enfermedad meningocócica se identificaron 8 casos de serogrupo W135, 4 de serogrupo Y y 2 de serogrupo A (estudios de seroprevalencia)44. La letalidad por MenC fue del 25% en la temporada 2009-2010, subiendo al 40,3% en 2010-2011, relacionada con un brote en Andalucía45.
Esquemas de vacunación frente al meningococo CEstos resultados clínicos y epidemiológicos se han logrado a partir de la implementación de los programas de vacunación sistemática infantil. La introducción de la vacuna MenC en el calendario infantil en el año 2000 se hizo inicialmente con una pauta de 3 dosis (2, 4 y 6 meses de edad). Se modificó en 2005, basándose en la evolución de la enfermedad y en la evidencia disponible de la efectividad de las vacunas, manteniendo 3 dosis con el siguiente esquema: 2 meses, 4-6 meses y una dosis de refuerzo en el segundo año de vida, entre los 12-15 meses, calendario vigente en 20132.
Las vacunas anti-MenC monovalentes administradas en los calendarios españoles son de 2 tipos: MenC conjugada con toxoide tetánico (MenC-TT) y las conjugadas con proteína de difteria CRM197 (MenC-CRM).
Las coberturas de vacunación alcanzadas han sido elevadas desde la implementación de las vacunas en el calendario infantil (mayores del 95% desde 2002), alcanzando en 2012 en primovacunación coberturas del 96,6% (rango entre CC. AA. del 89,6-103,4%) y del 94,8% en la dosis de refuerzo (rango entre CC. AA. del 87,1-117,9%)11,45.
A lo largo del tiempo, además, las CC. AA. han implantado campañas de rescate en niños y adolescentes, aplicadas de forma heterogénea en cuanto al momento de aplicación de las mismas, edad de vacunación y vacunas utilizadas, lo que dificulta tener datos de seroprevalencia para el MenC a nivel nacional.
A pesar del éxito que ha supuesto la vacunación antimeningocócica C, los estudios de vigilancia epidemiológica y de seroprevalencia, realizados tanto en España46 como en Holanda y Reino Unido47,48, han puesto de manifiesto algunos puntos débiles de la estrategia de vacunación actualmente vigente, lo que obliga a replantear nuevas pautas de vacunación infantil buscando la optimización del calendario. Los principales puntos a solventar son la pérdida progresiva de anticuerpos tras la vacunación de lactantes en el primer año de vida, el descenso de coberturas vacunales en niños a los 12 meses con el aumento de población susceptible, la aparición de casos (fallos vacunales) y el aumento de casos de enfermedad en adolescentes y adultos jóvenes que quedan como población especialmente susceptible.
Las nuevas recomendaciones de vacunación se basan en estudios de seroprevalencia realizados en España, EE. UU., Reino Unido y Holanda, que serán comentados más adelante. Estos estudios han demostrado la elevada inmunogenicidad de las vacunas MenC en el primer año de vida (incluso tras una única dosis de vacuna a los 2 o 3 meses de vida); que existe una pérdida progresiva de anticuerpos a lo largo del tiempo, más rápida en los niños vacunados más precozmente (en el primer año), y que los anticuerpos persisten durante más tiempo en los niños que han recibido dosis de rescate en la adolescencia o preadolescencia.
Así, en el estudio de seroprevalencia realizado en el País Vasco en 201149, el nivel de seroprotección (títulos ≥1/8) fue del 45,8% en niños de 2-5 años y del 36,1% en el grupo de 6-9 años, el grupo con menor nivel de anticuerpos. De los 10 a los 24 años la tasa iba subiendo: 60% en niños de 10 a 14 años; 86,5% de 15 a 19 años y 73,9% de 20 a 24 años. Este estudio demostró la caída de anticuerpos protectores a lo largo del tiempo y que está relacionada con la edad de primovacunación, de forma que los vacunados a partir de los 7 años de edad (campañas de rescate) conservan durante más tiempo anticuerpos protectores que los vacunados en el primer año de vida.
Los estudios realizados en el Reino Unido demostraron que el 75% de la población vacunada dentro del calendario de rutina tenían anticuerpos protectores, que descendía hasta el 36% 18 meses después de la primovacunación. En las cohortes captadas en campañas de rescate se demostró una mejor respuesta en niños vacunados a edad más avanzada (5-17 años comparados con los vacunados entre 1-4 años)50,51. Otros estudios publicados corroboran la pérdida progresiva de anticuerpos especialmente en niños vacunados en el primer o segundo año de vida51,52.
Los estudios de persistencia de anticuerpos53 llevan a recomendar la vacunación de refuerzo en preadolescentes estimando la mejor edad los 12 años, basándose en una mejor respuesta a la vacunación de refuerzo que en niños más pequeños54.
Los estudios realizados en Holanda (desde 2002 con pauta de MenC-TT con una dosis única a los 14 meses de edad y rescate dirigido a la población entre 14 meses y 18 años) demostraron también que la respuesta de anticuerpos y su persistencia en el tiempo tuvieron relación directa con la edad, por lo que recomiendan la aplicación de una dosis de refuerzo en la adolescencia para mantener la inmunidad a largo plazo.
Respecto a la vacunación con dosis única en el primer año, se ha comprobado que la inmunización de lactantes en el primer año de vida con una sola dosis de vacuna y un refuerzo a los 12 meses es inmunógena y protectora55,56. Findlow et al.57 en el Reino Unido demuestran que puede utilizarse con eficacia y seguridad una sola dosis de MenC-TT o MenC-CRM a los 3 meses de edad, con un refuerzo de Hib/MenC-TT en el segundo año de vida.
Las vacunas MenC, por sus características, generan protección indirecta de grupo (demostrada por la disminución de la tasa de ataque en personas no vacunadas) al reducir la tasa de portadores nasofaríngeos de MenC. Esta tasa es hasta 4 veces más alta en adolescentes y adultos jóvenes que en los niños, por lo que el rescate en niños mayores potencia la inmunidad de grupo por descenso del número de portadores nasofaríngeos, principalmente en adolescentes58,59.
El análisis de estos datos ha llevado a que en los últimos años se hayan propuesto nuevas estrategias vacunales en varios países europeos y en EE. UU., coincidiendo todos en la necesidad de vacunar a los adolescentes, por el impacto que esta medida tiene a nivel individual y colectivo, independientemente de cuál haya sido la estrategia de vacunación previa en la infancia.
Así, el Comité Conjunto sobre Vacunación e Inmunización de Reino Unido (JCVI) recomendó en 2012 cambiar a una estrategia 1+1+1, vacunando a los adolescentes entre 13-14 años, en los que se registran altas tasas de colonización nasofaríngea60. En Holanda, la estrategia es 0+1 (una dosis a los 14 meses y rescate en 2002 desde los 14 meses hasta los 18 años con cobertura del 94%) y desde su implantación ha demostrado una gran efectividad. En EE. UU. (octubre de 2012) el ACIP recomendó no vacunar a lactantes sanos, solo a los lactantes con alto riesgo de enfermedad meningocócica, con pauta de 4 dosis de vacuna frente a Hib y frente a los meningococos C e Y conjugados con proteína antitetánica (Hib-MenCY-TT). Esta estrategia se justifica dada la baja carga de enfermedad meningocócica C en este grupo de edad, donde la mayor parte de los casos son producidos por meningococo B, y la protección poco duradera frente a meningitis que induce la vacuna en menores de un año. En el caso de los adolescentes recomiendan vacunar de rutina a los 11-12 años, con refuerzo a los 16 años61,62.
Como ya vaticinó este Comité en las recomendaciones de 2013, el Consejo Interterritorial ha propuesto una pauta 1+1+1 (2 meses + 12 meses + 12 años)4,63, con el objetivo de alargar la protección incluyendo a adolescentes y adultos jóvenes, y así reducir los fallos vacunales y aumentar la protección de grupo. Esta nueva pauta, que debería entrar en vigor en enero de 2014 en todo el país4, suscita algunas incertidumbres. Iniciar esta pauta a los 3 meses de edad en vez de a los 2 ha demostrado ser más inmunógena y por tanto en principio mejor56,67. Además, no todas las CC. AA. han llevado a cabo en los últimos años las mismas estrategias de“catch up”, ni con las mismas coberturas63, por lo que la inmunidad de grupo en la población frente al meningococo C puede ser diferente de unas CC. AA. a otras, lo que unido a la ausencia de estudios de seroprevalencia, sugiere que otras pautas podrían ser más adecuadas.
Las vacunas actualmente utilizadas en calendario son las monovalentes MenC. Pueden coadministrarse con el resto de las vacunas del calendario infantil, al no haberse demostrado interferencias clínicamente significativas en la respuesta inmunitaria frente a los diferentes antígenos vacunales64. No se ha comprobado la intercambiabilidad entre los 3 preparados disponibles, por lo que es recomendable, en primovacunación, utilizar el mismo preparado.
Hoy por hoy no existen datos contundentes para recomendar cuál es la vacuna más adecuada para aplicar con estas nuevas pautas ni cuál es la edad más conveniente para vacunar a los adolescentes. Serán precisos una estrecha vigilancia y seguimiento de la implantación de esta nueva estrategia y de la efectividad de la misma.
Vacunas meningocócicas tetravalentesDesde el año 2010 se dispone en España de una vacuna conjugada tetravalente (Menveo®) frente a los serogrupos de meningococo A, C, W135 e Y conjugada con la proteína CRM197, y en 2012 se autorizó una 2.a vacuna conjugada tetravalente (Nimenrix®) conjugada con toxoide tetánico. Son de uso hospitalario y actualmente están autorizadas a partir de los 2 años de edad, Menveo®, y a partir de los 12 meses de edad, Nimenrix®, en caso de viaje a zonas endémicas de meningitis65. Han demostrado en varios estudios buena inmunogenicidad, buen perfil de seguridad y compatibilidad con todas las vacunas de calendario. Están en marcha estudios de inmunogenicidad en lactantes de 2 meses con Nimenrix®66,67.
La baja carga de enfermedad por serotipos no incluidos en las vacunas MenC actualmente en España (serogrupos A, Y, W135) y la falta de información de la eficacia de las vacunas tetravalentes como refuerzo en los niños previamente vacunados en los primeros años hace que estas vacunas, de momento, se reserven para la vacunación de viajeros a zonas endémicas de estos serogrupos. Es posible que en el futuro sea una buena opción la introducción de las vacunas tetravalentes dentro de la pauta 1+1+1, sobre todo en la dosis de los 12 años, en función de las variaciones epidemiológicas que puedan ocurrir, o como dosis previa a probables viajes, a partir de la adolescencia.
Vacunación frente al neumococoRecomendación CAV-AEP 2014: el CAV-AEP mantiene la recomendación de 2013 de vacunar frente al neumococo de forma sistemática a todos los niños menores de 5 años como la mejor medida para la prevención de la enfermedad neumocócica en la infancia, siendo la vacuna neumocócica conjugada 13-valente (VNC13) la que mejor cobertura proporciona frente a los serotipos neumocócicos circulantes en España. También hace hincapié en la necesidad de vacunar a todos los niños entre 6 y 17 años que padecen inmunodepresión u otras situaciones de riesgo.
Hasta diciembre de 2012, el 44% de los 194 países miembros de la Organización Mundial de la Salud (OMS) ya habían introducido de forma progresiva las vacunas neumocócicas conjugadas (VNC) en los programas de inmunización sistemática infantil68,69, siguiendo la recomendación de la OMS del año 200768.
La evidencia de la efectividad de las VNC para reducir la carga global, tanto de la enfermedad neumocócica invasiva (ENI) como de la no invasiva, continúa acumulándose y añadiéndose a la ya existente2.
Vacuna neumocócica conjugada 13-valenteEn Madrid, se introdujo la VNC13 en el calendario sistemático en junio de 2010 con una pauta 2+1. Un estudio reciente, comparando la incidencia entre los periodos mayo de 2007-abril de 2010 (periodo pre-VNC13) y mayo de 2011-abril de 2012 (periodo-VNC13), ha demostrado la excelente capacidad de esta vacuna para disminuir la carga global de ENI en los menores de 15 años. La tasa de incidencia cayó desde 17/100.000 hasta 7,7/100.000 (reducción del 57%). La disminución de las tasas de incidencia de empiema, neumonía bacteriémica y meningitis neumocócicas ha sido del 46, del 71 y del 55%, respectivamente. La bajada de los serotipos contenidos en la VNC13 (serotipos-VNC13) ha sido del 68%, siendo particularmente marcada en el serotipo 1 (47%) y en el 19A (87%), ambos causantes del 60% de las ENI. Durante el periodo-VNC13 no se ha producido incremento de serotipos no-VNC13. Ningún niño con 3 dosis de VNC13 ha padecido ENI70.
En EE. UU. los datos encontrados son muy similares. En un estudio realizado en 8 hospitales, donde se utiliza un esquema de vacunación 3+1 con VNC13, tras un año de la introducción de la vacuna, la frecuencia global de ENI en todos los niños disminuyó el 42%, y en los niños menores de 24 meses el 53%. Los serotipos-VNC13 disminuyeron un 57%71.
En el Reino Unido, según los datos de la Health Protection Agency, donde la VNC13 se introdujo en el calendario sistemático en abril de 2010, con un esquema 2+1, se ha producido una disminución significativa de la tasa de incidencia acumulada de ENI producida por los serotipos-VNC13 en los niños de todas las edades, lo que de nuevo demuestra la capacidad de la vacuna para inducir inmunidad de grupo72.
Hay también nuevas evidencias sobre la capacidad de la VNC7, ya bien demostrada, para proteger frente a la enfermedad neumocócica no invasiva. Un estudio reciente, llevado a cabo en EE. UU., comparando la tasa anual de hospitalizaciones por neumonía de cualquier causa, entre los periodos 1997-1999 (antes de la introducción de la VNC7) y 2007-2009, ha demostrado una reducción de 551/100.000 en la incidencia anual de hospitalizaciones en niños menores de 2 años, lo que supuso una disminución de 47.000 hospitalizaciones anuales con respecto al periodo prevacunal. Globalmente, para todas las edades, el descenso de la incidencia anual fue 54,8/100.000 personas (168.000 hospitalizaciones menos cada año). La caída en la incidencia en personas de 85 años o más supuso 73.000 hospitalizaciones menos cada año. En los adultos entre 65 y 85 años también hubo reducciones significativas, aunque más modestas73. Este trabajo corrobora otros anteriores sobre la efectividad de la VNC7 para reducir la carga global de neumonía en la comunidad74–76, pero además demuestra que el efecto se ha mantenido una década, pese al incremento de algunos serotipos no-VNC777. La protección de los ancianos frente a la neumonía, por la inmunidad de rebaño generada por las VNC, es primordial desde el punto de vista de la salud pública, ya que la mortalidad cruda en esta edad es superior a la de cualquier otra y alcanza cifras superiores a 20/100.00078. El impacto de las vacunas VNC10 y VNC13 sobre las hospitalizaciones por neumonías podría ser todavía mayor por los serotipos adicionales que contienen, sobre todo el serotipo 1 que causa el 38% de las neumonías bacteriémicas neumocócicas y el 38% de los empiemas pleurales neumocócicos79. En las neumonías no bacteriémicas y sin derrame es más difícil conocer los serotipos causales, pero hay datos indirectos que sugieren que el serotipo 1 produce una proporción sustancial de casos80.
La evidencia de que la VNC13 disminuye alrededor del 40-50% la tasa de colonización nasofaríngea de los serotipos 1, 6A, 7F y 19A en comparación con la VNC7 está totalmente comprobada81–84. Sin embargo, no afecta a la colonización por el serotipo 3, lo que, unido a que la respuesta inmunológica al mismo es menor que la de cualquier otro serotipo de VNC13, plantea incógnitas sobre cómo estos hechos pueden afectar a la efectividad de la vacuna frente a este serotipo. El mayor descenso en las tasas de colonización se produce en el 19A, y es posible que este hecho esté relacionado con la excelente efectividad que la VNC13 ha mostrado frente a este serotipo en Madrid70 y en varios países71,72,85.
La capacidad de la VNC13 para inducir inmunidad de grupo lo demuestra el que la enfermedad invasiva por los serotipos-VNC13 no compartidos con la VNC7 disminuya en los adultos hasta un 45-64% (sobre todo a expensas del descenso de 19A y 7F) cuando se utiliza esta vacuna para la inmunización sistemática de los niños. Otro hecho a destacar es que se consiguen reducciones del 50% en la colonización nasofaríngea por los serotipos-VNC13 con coberturas de solo el 65%84. Esta disminución de la colonización por los serotipos-VNC13 se acompaña del aumento de otros serotipos no vacunales como el 15A, 15B/C y 35B81,82. Sin embargo, este fenómeno no parece acompañarse, hasta el momento actual, de un incremento de ENI por estos serotipos70,71.
Vacuna neumocócica conjugada decavalente (VNC10)En este último año también se han publicado nuevos datos sobre el efecto de la inclusión de la VNC10 en los calendarios de vacunación de algunos países.
En Brasil, esta vacuna redujo el 80% (desde 20,3/100.000 hasta 3,97/100.000) la incidencia de ENI producida por cualquier serotipo neumocócico en niños menores de 2 años de edad86. Para los serotipos-VNC10, la reducción de ENI en la misma edad fue del 97%. La incidencia de ENI por cualquier serotipo en todas las edades tendió a decrecer, pero no fue significativo. En el periodo después de iniciar la vacunación con la VNC10 no se produjo ningún incremento de los serotipos no-VNC10. Es dudoso si esta efectividad podría haber sido la misma en países con alta prevalencia del serotipo 19A, ya que en Brasil fue muy baja en ambos periodos, pre y posvacunal86.
Un estudio llevado a cabo en Finlandia con la vacuna VNC10, en el que se vacunó a niños de diferentes edades con distintas pautas vacunales (menores de 7 meses con pautas 3+1 o 2+1; niños de 7-11 meses con pauta 2+1; y niños de 12-18 meses con pauta de 2 dosis) ha demostrado una efectividad frente a ENI por serotipos-VNC10 del 100% para la pauta 3+1, del 92% para los grupos 2+1 y del 100% para el grupo de rescate. La efectividad global en el conjunto de todos los niños, independientemente del serotipo, fue del 93%87.
En Quebec, Canadá, se sustituyó en 2009 la vacunación universal con VNC7, en vigor desde 2004, por la VNC10, utilizando una pauta 2+1 (2, 4 y 12 meses). La incidencia de ENI en los niños que habían recibido la VNC10 fue 35/100.000 (en un periodo de un año), mientras que en el control histórico de niños vacunados con la VNC7 fue 64/100.000, lo que supone una reducción del 55%. No hubo casos de ENI en niños que habían recibido 2 o más dosis de VNC10 en la serie primaria ni en los que recibieron esta vacuna como refuerzo (aunque la serie primaria se realizase con VNC7). La incidencia de ENI por el serotipo 19A (la más alta de todos los serotipos) en la cohorte de niños vacunados con la VNC10 fue aproximadamente un 50% más baja que en la cohorte de niños vacunados con la VNC7, aunque la diferencia no alcanzó significación estadística. Además, la tendencia ascendente de las ENI por 19A durante los años de vacunación con la VNC7 se revirtió88. Datos recientes obtenidos en Finlandia sugieren que la VNC10 podría tener algún efecto protector frente al serotipo 19A, aunque el número de casos fue demasiado bajo como para obtener conclusiones definitivas89. Se ha postulado que aunque tanto la VNC7 como la VNC10 contienen el serotipo 19F, el diferente método de conjugación da lugar a una configuración química distinta de los epítopos del 19F en ambas vacunas lo que podría dar lugar a un diferente grado de protección frente al 19A.
Por último, la VNC10 ha demostrado protección de grupo al reducir el 50% la incidencia de ENI entre los niños no vacunados de 2 a 5 años de edad90.
Los estudios de colonización nasofaríngea con la VNC10 son escasos. Uno reciente ha demostrado que no hay diferencias en la colonización nasofaríngea por Haemophilus no tipables entre niños vacunados con la VNC10 y la VNC7. Tampoco existieron diferencias en la colonización por neumococo, tanto si se consideró la colonización global por todos los serotipos, como la colonización por los serotipos considerados individualmente, incluido el serotipo 19A91.
Recomendaciones para 2014- 1.
A la luz de la evidencia acumulada, el CAV-AEP se reafirma en las recomendaciones de anteriores calendarios de incluir la vacunación sistemática frente al neumococo para todos los niños españoles menores de 5 años, siendo la VNC13 la que mejor cobertura proporciona actualmente frente a los serotipos circulantes y la que mayor impacto puede tener en el control de la enfermedad neumocócica en España.
- 2.
Mientras no exista vacunación universal frente al neumococo, deberán utilizarse pautas de vacunación 3+1 (3 dosis de primovacunación, más un refuerzo en el segundo año de vida). La carencia de la protección de la inmunidad de grupo, si las coberturas de vacunación no son altas, puede condicionar que algunos niños sean susceptibles a algunos serotipos, como el 6B y 23F, después de 2 dosis de VNC y hasta que se aplique la dosis de refuerzo del segundo año de vida.
- 3.
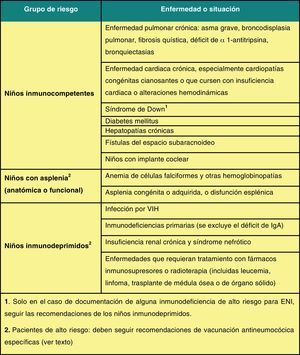
El CAV-AEP hace énfasis en la necesidad de vacunar a los pacientes inmunodeprimidos y con riesgo elevado de padecer infecciones neumocócicas graves (fig. 3), con las pautas recomendadas utilizando esquemas mixtos, que incluyan la VNC13 y la vacuna neumocócica 23-valente de polisacáridos simples (VNP23). Coincidiendo con la ampliación de la edad para el uso de la VNC13 en niños hasta los 17 años, el CAV-AEP propone cambios menores en las nuevas normas de inmunización frente al neumococo en los grupos de riesgo2.
- a.
En los niños inmunodeprimidos y con asplenia orgánica o funcional (anemia de células falciformes u otras hemoglobinopatías) menores de 5 años: 1) utilizar siempre esquemas 3+1 cuando se inicia la vacunación a los 2 meses con las otras vacunas del calendario; 2) es preceptivo que reciban 2 dosis de VNC13 si no han recibido en el primer año de vida, al menos, 2 dosis de esta vacuna; 3) los niños de 2-5 años de edad que no han recibido ninguna dosis de VNC13 deben recibir 2 dosis de esta vacuna separadas por un intervalo mínimo de, al menos, 2 meses; 4) una vez completada la inmunización con VNC13, los mayores de 2 años de edad deben recibir 2 únicas dosis de VNP23, la 2.a a los 5 años de la 1.a.
- b.
En los niños de riesgo (no inmunodeprimidos ni asplénicos, pero con riesgo de padecer infecciones neumocócicas más frecuentes o graves) menores de 5 años (fig. 3) puede optarse por la pauta de los niños inmunodeprimidos o por la del calendario de vacunación sistemático, completándose la inmunización, cuando son mayores de 2 años, con una sola dosis de VNP23 separada por un intervalo mínimo de 2 meses desde la última dosis de VNC132.
- c.
En todos los niños de riesgo (fig. 3) de 6-17 años de edad: 1) administrar una dosis de VNC13; 2) aplicar una dosis de VNP23 separada por un intervalo mínimo de 2 meses de la dosis de VNC13; 3) solo en los inmunodeprimidos y asplénicos se administrará una 2.a dosis y última de VNP23, 5 años después de la 1.a de VNP2392.
- a.
- 4.
los niños prematuros (particularmente los < 32 semanas o < 1700 gramos) tienen más probabilidad de presentar una enfermedad invasora por Streptococcus pneumoniae que los recién nacidos a termino, por lo que se debe recomendar especialmente en estos niños la VNC13.
Recomendación CAV-AEP 2014: el CAV-AEP mantiene la norma general de vacunación que comprende la administración de 2 dosis de la vacuna triple vírica (TV), recomendando la 1.aa los 12 meses y la 2.aa los 2-3 años de edad, preferentemente a los 2 años. En caso necesario, un intervalo mínimo de 4 semanas entre ellas asegura una correcta inmunización. Se reafirma asimismo en la necesidad de alcanzar y mantener altas coberturas vacunales, para conseguir inmunidad de grupo y propiciar la eliminación de las enfermedades que previene.
SarampiónEn los últimos semestres se redujo la presentación de brotes extensos de sarampión autóctono en la Región Europea de la OMS, que abundaron desde 2010 a 201293. Sin embargo, han reaparecido en varios países, como Reino Unido (concretamente en Inglaterra y Gales)94, Rumanía, Italia, Alemania y Holanda95. Cabe destacar el desarrollado en Inglaterra (1.365 casos entre enero y julio de 2013), condicionado básicamente por las bajas coberturas vacunales96, y el iniciado en el «cinturón bíblico» de Holanda, que congrega una comunidad religiosa que rechaza las vacunaciones: desde mayo a agosto de 2013 afectó a más de 1.000 personas, la mayoría en la edad infantil97. Previamente a este brote, entre mayo de 2012 y abril de 2013, se declararon 8.586 casos de la enfermedad en los países de la Unión Europea, correspondiendo a tasas de 14 por millón de habitantes. El 81% de los afectados que disponían de registros de vacunación no estaban vacunados.
En EE. UU. también se han declarado brotes epidémicos98.
En España, durante este periodo de tiempo, se notificaron 255 casos, con unas tasas de 5,5/millón95. Conformaron ocasionalmente pequeños brotes locales debidos a puntuales aumentos de la exposición a virus importados, como el registrado en Barcelona en julio de 2013, relacionado con la asistencia a un macrofestival de música popular al aire libre99; eventos de este tipo favorecen la diseminación de enfermedades transmisibles entre adultos jóvenes de colectivos con bajas coberturas de vacunación100.
Sin embargo, la mayoría de los enfermos notificados en Europa siguen siendo los menores de un año de edad, que no han recibido la 1.a dosis de vacuna TV, seguidos por los de 1 a 4 años. Datos fehacientes muestran que los lactantes menores de 12 meses, y que por tanto no han alcanzado la edad de la primovacunación, constituyen un grupo creciente de riesgo para contraer el sarampión, debido a que los niveles de anticuerpos protectores transferidos por sus madres son cada vez menores en concentración y duración, sobre todo en las que fueron vacunadas y no sufrieron la infección natural. En este escenario, puede afirmarse que la gran mayoría de los niños de 6 a 9 meses de edad de los países occidentales carece actualmente de inmunidad frente al sarampión101,102.
ParotiditisAlgo similar se está reconociendo para la parotiditis, con una corta duración de los anticuerpos maternos, aunque algo mayor en aquellos casos en los que la madre había pasado la enfermedad (3,8 meses versus 2,4 meses; p=0,025)103. Esta situación explica, en gran parte, la persistencia de casos de parotiditis en el área geográfica de Europa, con la reemergencia ocasional de brotes epidémicos en varias de sus regiones. En España se han producido brotes en algunas CC. AA. durante 2012 y el primer semestre de 2013 (Asturias, Madrid)104,105, detectados sobre todo en centros escolares y empresariales. Estos brotes han incidido sobre todo en adolescentes y adultos jóvenes vacunados entre 1993 y 1999, cuando se empleó masivamente una vacuna TV cuyo componente antiparotiditis, la cepa Rubini, resultó escasamente inmunógeno. Ello ha obligado a la implementación de estrategias puntuales de rescate para la corrección de esta deficiencia.
RubeolaLos índices de casos confirmados de rubeola volvieron a descender en la mayoría de los países europeos. Sin embargo, en algunos de ellos persisten situaciones epidémicas (Rumanía, Polonia), con tasas incluso superiores a 220/1.000.000, lo que ha facilitado el resurgimiento de casos de rubeola congénita. En España, su incidencia actual se estima en 0,4 casos/millón de habitantes95.
Vacuna triple vírica: recomendacionesTeniendo en cuenta los cambios epidemiológicos señalados, el CAV-AEP considera que la 1.a dosis de TV debería administrarse a los 12 meses de vida, recomendando el abandono definitivo de la alternativa de los 15 meses. Se reducirá así la ventana de desprotección frente a estas infecciones en lactantes y niños de corta edad. Se abre incluso la posibilidad de adelantarla a los 9-11 meses de modo sistemático en un próximo futuro, como ya se practica en algunos países centroeuropeos106.
La vacuna TV es un preparado muy inmunógeno de virus hiperatenuados frente a sarampión, rubeola y parotiditis. En España se dispone de 2 presentaciones comerciales: Priorix®, de GlaxoSmithKline, autorizada para su administración a partir de los 9 meses de vida, y MMRVaxpro®, de Sanofi Pasteur MSD, a partir del año. Tras la administración de una dosis se alcanzan tasas de seroconversión del 90-95% para el sarampión, del 82-85% para parotiditis y superiores al 95% para la rubeola; después de la administración de la 2.a dosis, se aproximan al 100%. Esta 2.a dosis es imprescindible para lograr una adecuada inmunidad de grupo2,5,107,108 y corregir posibles fallos primarios de la 1.a dosis. Por ello, el CAV-AEP considera que la 2.a dosis de la vacuna TV debería administrarse entre los 2 y los 3 años, preferentemente a los 2 años. Adelantando esta 2.a dosis se disminuyen las posibilidades de enfermar en edades de riesgo, se reduce la circulación de los virus implicados en la comunidad y puede optimizar el cumplimiento de la inmunización, ya que las coberturas decaen a partir de esta edad11.
En España no se dispone de vacunas monocomponentes frente a estas enfermedades, por lo que en todos los casos la inmunización activa deberá realizarse con la vacuna TV. Los niños que hayan recibido preparados monocomponentes en países que dispongan de ellas (inmigrantes, adoptados, etc.) deberán completar y continuar la vacunación con la TV.
El CAV-AEP se reafirma en la necesidad de alcanzar y mantener altas coberturas universales con esta vacuna para conseguir inmunidad de grupo y propiciar la eliminación de las enfermedades que previene. En este sentido, recuerda asimismo la importancia de lograrlas en zonas con bolsas de poblaciones susceptibles a las mismas, frecuente origen y foco de brotes epidémicos.
Actuaciones inmunopreventivas ante una potencial exposición a los virus causales- -
El sarampión es la enfermedad prevenible por la vacuna TV de mayor impacto individual y colectivo. De aquí que, ante el caso de alerta epidemiológica por brote de sarampión o de contactos accidentales con enfermos, se han consensuado actuaciones bien definidas, recogidas en las recomendaciones del calendario de vacunaciones de la AEP 20132. La única modificación posterior realizada en estas estrategias consiste en el cambio de la dosis de inmunoglobulina polivalente que pasa a ser de 0,50ml/kg con un máximo de 15ml, en aquellos casos en las que estaba indicada una dosis de 0,25ml/kg108.
- -
Ante un brote de parotiditis en poblaciones bien vacunadas puede considerarse, de acuerdo con las autoridades locales de salud pública, la administración de una 3.a dosis de TV, estrategia que algunos estudios consideran útil para su declinación109. La vacunación y la inmunoprofilaxis pasiva tras una exposición a la parotiditis −o a la rubeola− probablemente no prevengan la enfermedad, ni modifiquen su curso clínico y por lo general no se recomiendan, pero se podría valorar en brotes epidémicos, ya que en todo caso poner una dosis adicional no constituye ningún riesgo relevante110,111.
- -
Los lactantes de 6 a 11 meses de edad que vayan a emprender un viaje internacional deben recibir una dosis de TV, reiniciando la vacunación a partir de los 12 meses, tras un intervalo mínimo de un mes.
- -
Debe aprovecharse cualquier coyuntura epidemiológica que implique al sarampión, a la rubeola o a la parotiditis para revisar el cumplimiento de la vacunación con TV de los niños mayores de 2-3 años, actualizándola en caso necesario.
Recomendación CAV-AEP 2014: el CAV-AEP mantiene la recomendación de la vacunación sistemática frente al virus del papiloma humano (VPH) de todas las niñas de 11-12 años, como forma de prevención del cáncer cervical y de lesiones precancerosas del tracto genital en la mujer. Es preciso un gran esfuerzo de todos los profesionales sanitarios para incrementar las coberturas vacunales actuales.
Vacunas frente al virus del papiloma humanoExisten 2 vacunas disponibles en España frente al VPH: la vacuna tetravalente (VPH-4) (VPH 6, 11, 16 y 18) Gardasil® (Sanofi Pasteur MSD)112 y la bivalente (VPH-2) (VPH 16 y 18) Cervarix® (GlaxoSmithKline)113.
La vacuna VPH-4, con actualización de su ficha técnica en mayo de 2012, es una vacuna indicada en mujeres, a partir de los 9 años de edad, para la prevención de las lesiones genitales precancerosas (cervicales, vulvares y vaginales) y del cáncer cervical relacionadas causalmente con ciertos tipos oncogénicos del VPH, además de las verrugas genitales relacionadas causalmente con tipos específicos del VPH112. Además, está autorizada para su empleo en varones de 9 a 26 años para la prevención de verrugas genitales externas112. Estas indicaciones están basadas en la demostración, tras la administración de VPH-4, de una adecuada inmunogenicidad en personas de ambos sexos de 9 a 26 años de edad, y de una eficacia adecuada en mujeres de 16 a 45 años de edad y en varones de 16 a 26 años112. La ficha técnica aprobada por la Food and Drug Administration estadounidense contempla la indicación de la VPH-4 para la prevención de cáncer anal causado por VPH 16 y 18 y la prevención de neoplasia anal intraepitelial de cualquier grado causada por VPH 6, 11, 16 y 18 en ambos sexos de 9 a 26 años de edad114, pero la de la Agencia Europea de Medicamentos (EMA) aún no, en espera de más datos112.
La vacuna VPH-2, con última actualización en junio de 2013, está indicada, en mujeres a partir de los 9 años de edad, para la prevención de lesiones genitales premalignas (cervicales, vulvares y vaginales) y del cáncer del cuello uterino relacionadas causalmente con determinados tipos oncogénicos del VPH113. La indicación está basada en la demostración, después de la administración de VPH-2, de una adecuada inmunogenicidad en niñas y mujeres de 9 a 55 años de edad, y de eficacia en mujeres de 15 a 25 años de edad113.
En los ensayos clínicos con un seguimiento de hasta 4 años, se corrobora para ambas vacunas una eficacia superior al 98% para la prevención de las lesiones precancerosas de alto grado (CIN2+ [del inglés cervical intraepitelial neoplasm] y adenocarcinoma in situ) debidas a los VPH oncogénicos 16 y 18, en mujeres en los rangos de edad indicados anteriormente112,113.
Con ambas vacunas se han demostrado diferentes grados de protección cruzada para otros tipos de VPH oncogénicos no incluidos en ambos preparados115,116, lo que permite obtener una eficacia protectora global frente a lesiones preneoplásicas por VPH superior a la esperada. Frente a lesiones preneoplásicas (CIN2+ y adenocarcinoma in situ) por VPH 31, se observa una eficacia del 87% (IC del 95%: 68-96) con la bivalente115 y del 55% (IC del 95%: 26-74) con la vacuna tetravalente116. La vacuna bivalente, además, demuestra una eficacia protectora para CIN2+ del 68% (IC del 95%: 39-84) para VPH 33, y del 82% (IC del 95%: 17-98) para VPH 45 115. Gracias a estos hallazgos, en la ficha técnica de la VPH-2 aparece la indicación frente a los serotipos 31, 33 y 45113.
La posología de las vacunas frente al VPH es de 3 dosis, a los 0, 2 y 6 meses con la VPH-4 112 y a los 0, 1 y 6 meses con la VPH-2 113, para garantizar la máxima eficacia esperable. Recientemente, el fabricante de la VPH-2 ha solicitado a la EMA la aprobación para la administración de 2 dosis (0 y 6 meses) en niñas de 9 a 14 años, en base a los datos obtenidos en el estudio HPV-048, en los que se demuestra la no inferioridad inmunogénica respecto a 3 dosis, tras un seguimiento de 48 meses para los serotipos 16, 18, 31 y 45 117. La vacuna VPH-4 también presenta buenos datos de inmunogenicidad a 36 meses con 2 dosis (0 y 6 meses) en niñas de 9 a 13 años118.
Datos de seguridadTanto los ensayos clínicos realizados119 como el seguimiento poscomercialización120,121, con más de 100 millones de dosis administradas entre ambas vacunas, permiten confirmar la seguridad de estas vacunas y su adecuado balance beneficio/riesgo. En junio de 2009, la OMS reafirmó su adecuado perfil de seguridad, tras revisar todos los datos existentes122, y constató que los efectos adversos más frecuentes son la reactogenicidad local y el dolor muscular generalizado. Se han comunicado algunas reacciones alérgicas en pacientes sensibilizadas a alguno de los componentes y se evidencia un incremento de declaraciones de síncopes tras la administración de vacunas en adolescentes y jóvenes, que se consideran debidos a reacciones vagales que son más frecuentes en este grupo de edad120,122. En un reciente estudio publicado por los Centers for Disease Control and Prevention (CDC), con datos del periodo poscomercialización 2006-2013 en EE. UU., se confirma el buen perfil de seguridad121. En un estudio local en EE. UU., en el que se siguió de forma prospectiva durante 6 meses a más de 189.000 mujeres de entre 9 y 26 años vacunadas con la vacuna VPH-4, no se observó ningún tipo de asociación con la aparición de las 18 principales enfermedades autoinmunitarias, incluyendo las de tipo neurológico y reumatoide123.
Recomendaciones de vacunación frente al virus del papiloma humano en niñas adolescentesEl CAV-AEP recomienda la vacunación sistemática frente al VPH de todas las niñas de 11-12 años, como forma de prevención del cáncer cervical y de lesiones precancerosas del tracto genital en la mujer, y opina que la estrategia de vacunación a los 14 años planteada por el Consejo Interterritorial para 2014 no es la óptima4, por diversas razones que se exponen a continuación:
Actualmente, la cobertura global de vacunación frente al VPH en niñas adolescentes en España no es la deseable, con una media del 70,8% en 201211. De hecho, hay algunas CC. AA. con un índice realmente alarmante (inferior al 50-60%)11. Los programas escolares de vacunación han demostrado obtener coberturas elevadas en las CC. AA. en las que se están llevando a cabo (Cataluña, Extremadura, Navarra, La Rioja, País Vasco). Probablemente, también ayude a obtener mejores índices de cumplimiento vacunar a los 11-12 años que a los 14. Sin duda, el esfuerzo y el convencimiento, a la hora de recomendar la vacunación por parte de los profesionales sanitarios, también es crucial.
Por otro lado, dados los datos españoles del estudio CLEOPATRA, en los que se aprecia un aumento de la prevalencia de infección cervical por VPH en mujeres jóvenes (24% en mujeres de 18 años) y un adelanto progresivo de las relaciones sexuales completas en las adolescentes (21% a los 15 años)124, es más razonable iniciar la vacunación en torno a los 11-12 años que a los 13-14, para conseguir el máximo beneficio de la vacunación en la población diana.
Además, el CAV-AEP recomienda la vacunación de todas las adolescentes que no hubiesen recibido la vacuna por superar la edad fijada por cada comunidad autónoma para la vacunación sistemática. En el documento de consenso sobre la vacunación frente al VPH firmado por 9 sociedades científicas españolas, incluida la AEP, se ofrece información ampliada sobre inmunogenicidad, eficacia, efectividad y seguridad, así como unas recomendaciones finales, empleando el sistema GRADE, que pueden ser consultadas en la web del CAV-AEP125.
Vacunación en varonesLa carga de la enfermedad relacionada con el VPH en varones se va documentando mejor, apareciendo cada vez más datos que confirman el importante papel del hombre, no solo como transmisor a las mujeres, existiendo una prevalencia general del virus en el hombre de entre 18 y 70 años de hasta el 65%126. En España, la incidencia en varones es del 38-43%, no observándose diferencias entre varones menores y mayores de 35 años127.
El VPH es el responsable del 84% del cáncer de ano y sus lesiones precancerosas, y del 47% del cáncer de pene128, siendo los serotipos 6, 11, 16 y 18 los responsables en más del 95% de los casos128. En cuanto al cáncer del área ORL (boca, orofaringe, laringe), parece que el virus podría tener un papel cada vez más prevalente, mayor incluso que el 20-30% que se estimaba hasta hace poco128. En modelos matemáticos, se aprecia que de todos los cánceres relacionados con el VPH en Europa, el 32% corresponderían a varones y el 68% a mujeres129, a expensas fundamentalmente del cáncer de cabeza y cuello, que aportaría un 26% a esa cifra del 32%.
En algunos países se está observando cierta influencia en la carga de la enfermedad por el VPH en el hombre como consecuencia de la vacunación sistemática de las mujeres. Por ejemplo en Australia, con el amplio programa de vacunación en mujeres adolescentes y jóvenes, con una cobertura del 70% con 3 dosis, se ha observado una reducción de las verrugas genitales en varones menores de 21 años, confirmándose el efecto rebaño130.
Con la vacuna VPH-4 se ha confirmado una eficacia del 90% en la prevención de las verrugas genitales en varones131; sin embargo, se dispone de datos limitados acerca de la prevención de lesiones precancerosas y de cáncer de ano y del área oro-faringo-laríngea, aunque parece existir una tendencia hacia la prevención114.
Con la vacuna VPH-2 solo se tienen datos de inmunogenicidad en un estudio con 181 varones, observándose, como era de esperar, una respuesta inmunitaria normal y equiparable a la de las mujeres132.
En Europa, ningún país vacuna a varones, aunque una de las vacunas existentes, la VPH-4, está autorizada para su uso en varones de 9 a 26 años desde 2011, para la prevención de verrugas genitales externas relacionadas con los tipos específicos de VPH112. Solamente algunos países, como EE. UU., Canadá y Australia, han comenzado a vacunar recientemente a varones dentro de su programa sistemático de vacunaciones y los resultados de efectividad comenzarán a documentarse en los próximos años.
En EE. UU., los CDC y la American Academy of Pediatrics la recomiendan para todos los varones de 11 a 21 años, además de una recomendación individualizada de 22 a 26 años5,133,134. En Australia135 y Canadá136 también se comenzó la vacunación sistemática en varones de 12 a 15 años y de 9 a 26 años, respectivamente.
Actualmente existe un debate abierto sobre la estrategia de vacunación en varones, alimentado por todos los datos que se van publicando, que deberán seguir siendo analizados junto a los modelos de eficiencia. Los primeros análisis demuestran que la vacunación en varones podría ser coste-efectiva en situaciones de baja cobertura vacunal en niñas adolescentes, pero parece ser más beneficiosa aún la estrategia basada en incrementar la cobertura de estas137, así como la vacunación selectiva de varones homosexuales138.
En España, a pesar de estar aprobada la administración de la vacuna VPH-4 para varones, no está financiada para estos. Este Comité, con los datos disponibles, y hasta no tener más información de la carga de la enfermedad en varones y de la eficiencia, no se pronuncia al respecto. El consenso español de sociedades científicas de 2011 concluía una valoración individualizada de vacunación con la VPH-4 de varones de 9 a 26 años de edad para la prevención de verrugas genitales125.
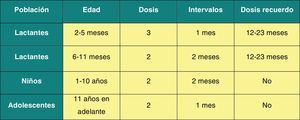
Vacunación frente al rotavirusRecomendación CAV-AEP 2014: el CAV-AEP considera que la vacunación frente al rotavirus, con el preparado pentavalente actualmente disponible en España, es una medida de salud recomendable y segura para todos los lactantes. Se recomienda la administración de 3 dosis. La 1.ase administra entre las 6 y las 12 semanas de edad. El intervalo mínimo entre dosis es de 4 semanas. Las 3 dosis deben ser administradas antes de las 32 semanas de edad. Puede administrarse al mismo tiempo que las otras vacunas del calendario.
En 2006 se aprobaron 2 vacunas vivas atenuadas de administración oral frente a la gastroenteritis aguda por rotavirus (GEA-RV): una monovalente (Rotarix®) y otra pentavalente (RotaTeq®), habiéndose introducido progresivamente en los programas de vacunación nacional de numerosos países, tanto en países en vías de desarrollo como en países industrializados, algunos de ellos de nuestro entorno como Finlandia, Alemania, Austria, Luxemburgo y Bélgica, y desde julio de 2013 en el Reino Unido23. Desde la implantación de la vacunación frente al rotavirus (RV) en muchos de esos países, se han comunicado datos que señalan una disminución significativa en el número de hospitalizaciones debidas a GEA-RV, así como un descenso en la morbimortalidad debida a la infección por RV, y una disminución de las tasas de infección nosocomial por este virus139,140.
Tras la introducción de la vacunación en la población pediátrica en varios países europeos141, EE. UU.142 o Australia143–145, se ha observado una disminución en la prevalencia de la enfermedad, no solo en los niños vacunados, sino en niños no vacunados y en adultos, lo que sugiere una protección de grupo para estas 2 últimas poblaciones, así como una disminución importante y mantenida de la actividad del RV, por debajo del nivel existente en los años previos a la vacunación; datos que han sido corroborados en grupos de niños mayores de 5 años no vacunados y adultos hasta 44 años146.
Se ha especulado que el uso extendido de las vacunas frente al RV podría causar una presión antigénica en los tipos de RV circulantes o llevar a la selección de nuevos RV, disminuyendo la efectividad de estas vacunas. Estos datos justifican realizar una vigilancia de los cambios antigénicos en las proteínas VP4 y VP7 en cepas de RV de tipo salvaje en aquellos países en los que se están administrando estas vacunas147 e implementar en ellos sistemas de vigilancia adecuados y pruebas de detección de RV148, así como poner en marcha estudios epidemiológicos para analizar la efectividad vacunal, como los recientemente propuestos por el Centro Europeo para la Prevención y Control de Enfermedades149,150.
En nuestro país, estas 2 vacunas estuvieron inmovilizadas y se retiraron de los canales de distribución de farmacia durante varios meses en el año 2010, por problemas de calidad en su fabricación, estando en la actualidad solo disponible la vacuna pentavalente (RotaTeq®)151. Un estudio reciente ha evaluado el impacto de aquella interrupción transitoria de la distribución de las vacunas frente al RV, analizándose las hospitalizaciones debidas a GEA-RV, y ha demostrado que aumentaron al tiempo que disminuía la cobertura de la vacuna152. En esta publicación se demuestra por primera vez una evidencia del impacto de la vacuna frente al RV y el aumento en el número de hospitalizaciones tras la retirada transitoria de la vacuna de los canales de comercialización.
En diversos estudios publicados a lo largo de 2013 se valoran tanto la efectividad de la vacuna monovalente y pentavalente frente a la enfermedad grave por RV153 como los costes médicos de las hospitalizaciones por RV y las visitas a urgencias, y se estima el impacto económico que significaría un programa de vacunación frente al RV, apreciándose que, después de la implantación de la vacuna frente al RV, el coste médico total por año disminuyó de forma muy significativa154.
En los estudios de vigilancia poscomercialización de las vacunas frente al RV (entre 2011 y 2013 se han publicado varios estudios) se pone de manifiesto que, en la primera semana tras la vacunación con la 1.a dosis, podría presentarse algún caso más de invaginación intestinal de lo esperado, en función de las tasas basales de incidencia, aunque sin diferencias entre niños vacunados y no vacunados155–157. Sin embargo, los beneficios que se obtienen con la vacunación frente al RV, en descenso tanto de morbilidad como de mortalidad, siguen siendo muy superiores a los hipotéticos riesgos comentados y han sido refrendados por la OMS en sus informes de 2011 y 2013 sobre este tema, manteniendo la recomendación de la vacunación universal frente al RV158,159.
En relación con las recomendaciones 2013 de este Comité sobre la vacunación frente al RV en nuestro país, se han producido muy pocas novedades, continuando categorizada como una vacuna recomendada para todos los lactantes españoles. La vacuna pentavalente, RotaTeq®, sigue siendo la única disponible. Es una vacuna que se aplica en 3 dosis por vía oral. La 1.a dosis se administra entre las 6 y las 12 semanas de edad. El intervalo mínimo entre dosis es de 4 semanas. Las 3 dosis deben ser administradas antes de las 32 semanas de edad. RotaTeq® puede administrarse al mismo tiempo que las otras vacunas del calendario.
Su utilización en niños prematuros es segura, recomendándose la administración en niños pretérminos de más de 25 semanas de gestación, que se encuentren clínicamente estables y no ingresados160.
La vacuna frente al RV, como todas las vacunas, debe ser administrada en centros acreditados para la vacunación y nunca por los padres en su domicilio, para garantizar así su correcta administración, proceder a su registro, mantener una observación posvacunación durante 15-30min, vigilar posibles reacciones adversas inmediatas y desechar el vial utilizado de forma segura, siguiendo los protocolos establecidos161.
Vacunación frente a la varicelaRecomendación CAV-AEP 2014: el CAV-AEP recomienda la administración de la vacuna frente a la varicela a todos los niños con 2 dosis: una 1.adosis a los 12 meses, y una 2.adosis a los 2-3 años, preferentemente a los 2 años.
El Comité mantiene la recomendación de vacunar frente a la varicela a todos los niños con la misma pauta emitida desde el año 2012: una 1.a dosis a los 12 meses (es aceptable entre 12 y 15 meses) y una 2.a dosis a los 2-3 años, a ser posible a los 2 años2. El CAV-AEP sigue estimando que la estrategia de vacunación selectiva a los niños con riesgo de varicela grave y a sus contactos próximos sanos en la primera infancia (CISNS, 2005)162 y la vacunación sistemática a los niños susceptibles a los 12 años de edad propuesta por el CISNS en 2013163 no previenen la mayoría de los casos de varicela ni la mayoría de las complicaciones y hospitalizaciones, que son más frecuentes en números absolutos en la primera infancia.
Efectividad de la vacuna frente a la varicelaLa efectividad de la vacunación se ha ido constatando de forma progresiva en todas aquellas regiones o países en los que se ha introducido.
En EE. UU., donde la vacunación universal comenzó en 1995 (pauta de 2 dosis desde 2006: 1.a a los 12-15 meses y 2.a a los 4-6 años)164, se ha demostrado una disminución sostenida del número de casos de varicela en todos los grupos de edad (82% de 2000 a 2010), así como de las hospitalizaciones debidas a complicaciones de la enfermedad (71% de 2000 a 2006, 95% en menores de 20 años) y los fallecimientos (en 2008-2009 respecto a 1990-1994, 98,5% en menores de 20 años, 96% en adultos menores de 50 años y 49% en mayores de esa edad)165. La reducción de la incidencia de la enfermedad se constató no solo en los vacunados sino también en los no vacunados (95% en 2008 respecto a 1995), como consecuencia de la inmunidad de grupo165. En otros países, como Alemania166, Canadá167 e Italia168, los datos de efectividad son parecidos a los de EE. UU. y se mantienen hasta la actualidad.
Situación en EspañaEn España, 4 comunidades o ciudades autónomas (Madrid, Navarra, Ceuta y Melilla) vacunan universalmente a los niños en el segundo año de vida; además, Ceuta y Melilla incluyen una 2.a dosis a los 2 años y Navarra a los 3 años de edad3.
Todas las CC. AA. hacen vacunación de rescate en adolescentes susceptibles, si bien a edades y con pautas variables (entre los 10 y 14 años, y con una o 2 dosis)3; el CISNS, en marzo de 2013, ha acordado una propuesta de unificación, señalando que la pauta de rescate en adolescentes ha de hacerse a los 12 años de edad y con 2 dosis163, medida que las CC. AA. deberían implementar en sus calendarios de vacunación desde 20144.
Se dispone de escasos datos globales de incidencia de la enfermedad y su evolución en relación con las vacunas disponibles desde 2005. Entre 2001 y 2011 se observan 2 periodos de tiempo distintos; por una parte, de 2001 a 2004, con tasas de incidencia estables (entre 456,4 y 598,1 casos por 100.000 habitantes), y desde 2005 a 2011, en el que se ha constatado una disminución global en España hasta 298,3 casos por 100.000 habitantes (reducción del 40% hasta 2011)169.
Los datos de efectividad más concluyentes son los ofrecidos por las comunidades de Madrid y Navarra, donde está implantada la vacunación universal desde los años 2006 y 2007, respectivamente:
- •
En Madrid (una dosis a los 15 meses de edad), la tasa de incidencia promedio en el periodo 2007-2011 fue un 68,7% inferior que la correspondiente al periodo 2001-2006 (prevacunal); el descenso acumulado en 2011 respecto al periodo prevacunal es del 86,4%169.
Según datos de la Red de Médicos Centinela de esta comunidad autónoma170, desde 2001-2003 a 2011 se ha constado un descenso de la incidencia en todos los grupos de edad, particularmente importante en el grupo de 0 a 4 años (riesgo relativo: 0,04; IC del 95%: 0,02-0,05); en los demás grupos de edad en los que no se ha vacunado, también se ha constatado un descenso sostenido (>14 años: riesgo relativo 0,20; IC del 95%: 0,13-0,30), poniendo de manifiesto los efectos de la inmunidad de grupo. En 2011, la mayor tasa de incidencia se observó en el grupo de 5 a 9 años, lo cual sugiere la necesidad de incorporar una 2.a dosis de la vacuna antes de esta edad.
La tasa de hospitalizaciones por varicela, entre los años 2006 y 2009, se ha reducido en un 50%171.
- •
En Navarra (1.a dosis a los 15 meses y 2.a a los 3 años), entre los años 2006 y 2012 se ha comprobado un descenso global acumulado de la tasa de incidencia del 97,3% (correspondiendo un descenso del 94,8% al periodo 2007-2012, desde una tasa de 416,26 casos/100.000 habitantes en 2007 hasta 21,4 casos/100.000 habitantes en 2012)172. En el mismo periodo de tiempo, 2006-2012, en la población de 0 a 14 años de edad, el descenso acumulado ha sido del 98,1% (desde 5.010 a 100 casos/100.000 habitantes)173.
Asimismo, ha descendido la incidencia de la enfermedad en la población no vacunada: 90,5% en menores de un año de edad; un 89,4% a los 9 años y un 92,4% en mayores de 22 años173.
También se ha observado que la tasa de hospitalización ha descendido un 89% en toda la población (95% en menores de 15 años)173.
Las pautas de vacunación de rescate en adolescentes se llevan a cabo en algunos países de nuestro entorno, con independencia de que se haga o no vacunación sistemática en los primeros años de vida174.
Un estudio reciente desarrollado en el Reino Unido cuestiona que se trate de una intervención con relación coste-beneficio favorable, ya que el 74,1% de los adolescentes vacunados (con antecedentes negativos o inciertos de la enfermedad o de la vacuna) están en realidad inmunizados por una infección natural previa que pasó desapercibida o fue olvidada175.
Pautas de vacunación sistemática con una o 2 dosisEn el momento actual, los datos acumulados refuerzan la necesidad de 2 dosis de vacuna para obtener la máxima eficacia protectora. Con la vacunación sistemática con una sola dosis, incluso con coberturas de vacunación superiores al 90%, se siguen registrando casos y brotes que afectan a no vacunados y también a vacunados. Numerosos datos indican, también, que el riesgo de varicela en vacunados (varicela breakthrough) se incrementa a medida que transcurren los años desde la vacunación, si bien con una influencia variable según distintos estudios.
A este respecto, destacar el trabajo publicado en EE.UU. en el año 2007 en el que se demuestra, durante un periodo de seguimiento de 10 años (1995-2004), que la probabilidad de presentar varicela después de una dosis de vacuna se incrementa significativamente con el paso del tiempo tras la vacunación: desde 1,6 casos por 1.000 personas/año en el primer año a 9 por 1.000 personas/año a los 5 años y a 58,2 por 1.000 personas/año a los 9 años de la vacunación176, observándose, además, que a medida que aumenta el tiempo desde la vacunación no solo crece el número de casos de la enfermedad en niños vacunados, sino que además aumenta la gravedad de los mismos176. Abundando en esta cuestión, destaca un estudio referido a un brote de varicela en Pekín, donde entre 916 escolares que habían recibido una dosis se produjeron 87 casos, sin relación con la edad de vacunación ni con el tiempo transcurrido desde la misma, concluyéndose que la dosis única es efectiva en la prevención de la enfermedad, pero no es suficiente para prevenir brotes177. Recientemente otro estudio, llevado a cabo también en China, ha encontrado que una pauta con una sola dosis está relacionada con un riesgo mayor de varicela breakthrough a partir de 5 años después de la vacunación (odds ratio 4,7; p<0,001)178. Otro estudio examina la efectividad de la vacuna a lo largo de 14 años en EE. UU. y no confirma la hipótesis de la pérdida de efectividad con el tiempo179, si bien esta conclusión ha sido criticada por introducir elementos de confusión180. Un trabajo español reciente ha encontrado que la efectividad tras una dosis fue del 93% en el primer año tras la vacunación y de un 61% después del tercer año181.
Debe señalarse también que la probabilidad de que un niño vacunado con una sola dosis presente la varicela no solo parece debida a la pérdida de la inmunidad inducida por la vacuna con el paso del tiempo, sino sobre todo a fallos primarios de vacunación, posibilidad esta que se recoge con una frecuencia variable que llega hasta al 24% de los casos con una sola dosis182.
La superioridad de la efectividad de las pautas con 2 dosis se pone de manifiesto en trabajos como el de Shapiro et al.183, en el que se encuentra que la efectividad de 2 dosis fue del 98,3%, mientras que la de una fue solo del 86% y que la probabilidad de contraer la enfermedad fue un 95% más baja con 2 dosis que con una. Igualmente, los CDC comunicaron en agosto de 2012 que en EE. UU., entre los años 2006 y 2010, a partir de la recomendación de la pauta de 2 dosis la incidencia de la varicela ha disminuido un 71,6% adicional al descenso que se había producido entre 2000 y 2005 con la dosis única165. Y finalmente, el estudio de Navarra citado antes181 destaca una efectividad de la pauta de 2 dosis de un 97% frente a un 87% de la vacunación con una dosis.
Es importante resaltar la necesidad de obtener una cobertura de vacunación, con las 2 dosis, superior al 90% en los primeros años, pues de lo contrario la circulación del virus se mantendrá, alejando de esta forma el logro del objetivo del control de la enfermedad. Es indudable que, para conseguir coberturas superiores al 90% con las 2 dosis, sería deseable que la vacuna estuviera financiada por la sanidad pública, como lo está en la actualidad en Navarra, Ceuta y Melilla3.
Coste-beneficio de la vacunación frente a la varicelaEn Italia, país de nuestro entorno en el cual la implementación de los programas de vacunación, como en España, se caracteriza por la heterogeneidad entre regiones, han encontrado que la vacunación universal frente a la varicela, además de su impacto sobre la morbilidad de la enfermedad, tiene una relación coste-beneficio favorable teniendo en cuenta todos los costes, directos e indirectos184.
Con relación al coste-efectividad de la estrategia con 2 dosis, los estudios realizados en EE. UU. se muestran favorables185. Sin embargo, dado que este tipo de estudios no es totalmente extrapolable de un país a otro, sería deseable la realización en nuestro medio de estudios con relación a este parámetro para confirmar si los beneficios superan al gasto sanitario necesario.
En una pauta de vacunación con 2 dosis: ¿cuál es el intervalo óptimo entre ambas dosis?Como se ha dicho, una pauta de 2 dosis (con la 1.a dosis en el segundo año de edad, habitualmente entre los 12 y 15 meses de edad) incrementa notablemente la efectividad comparada con una pauta de una dosis; sin embargo, no está bien establecido cuál es el intervalo óptimo entre ambas dosis.
Un estudio reciente examina 19 publicaciones correspondientes a 21 brotes de varicela en población vacunada, con el objeto de determinar las diferencias en cuanto a la capacidad de control de la enfermedad con un intervalo corto (meses) frente a uno largo (años) entre la 1.a y 2.a dosis y, tras constatar la ausencia de patrones estables de presentación de la varicela breakthrough, dice encontrar pruebas de que la mayoría de los casos de varicela en vacunados son debidos a una insuficiente respuesta inmunológica inicial (fallo vacunal primario) y no tanto a una pérdida de la protección con el tiempo (fallo vacunal secundario) −que algunos estudios sitúan ya al cabo de solo un año tras la vacunación−, concluyendo que lo óptimo sería administrar la 2.a dosis tan pronto como sea posible dentro del segundo año de vida y tras un periodo mínimo de 4 semanas entre ambas dosis186.
A tenor de los datos conocidos hasta el momento y lo indicado en las fichas técnicas de las vacunas actualmente disponibles187, el intervalo de tiempo recomendado entre las 2 dosis en niños no vacunados, a partir de los 12 meses de edad y con carácter general, es: en niños de 12 meses a 12 años de edad, intervalo recomendado de 6-12 semanas; y en niños a partir de 13 años el intervalo recomendado es de 4-8 semanas; en todo caso, el intervalo mínimo es de 4 semanas.
En niños con riesgo de varicela grave (inmunodeficiencias, siempre y cuando no esté contraindicada, ciertas enfermedades crónicas, etc.) y en sus contactos próximos sanos, las 2 dosis de vacuna deben administrarse con el intervalo válido más corto posible, con objeto de proporcionarles una protección rápida y corregir, también a corto plazo, un posible fallo primario de la vacunación. En los pacientes con riesgo de varicela grave menores de 13 años la 2.a dosis, si bien puede administrarse al mes de la 1.a, convendría administrarla a los 3 meses de esta y en los mayores de esta edad la 2.a dosis se debería administrar al mes de la 1.a188. En el caso de sus contactos se propone un intervalo de un mes entre ambas dosis a cualquier edad.
Herpes zósterUn aspecto particularmente controvertido es el posible aumento de la incidencia del herpes zóster (HZ) en la población adulta durante un periodo de tiempo de unos 30 años tras la introducción de la vacunación sistemática frente a la varicela. Esta predicción se desarrolló a partir de modelos matemáticos basados en la hipótesis de que el riesgo de reactivación del virus que causa el HZ es mayor cuanto menores son el número y la probabilidad de contactos repetidos con el virus (boosting) a lo largo de los años, que proporcionarían un estímulo inmunológico mantenido que finalmente constituiría el factor determinante en la presencia de la enfermedad en adultos. Numerosos estudios empíricos han avalado la hipótesis de los «refuerzos externos», aunque su impacto real en la reactivación del virus e incidencia del HZ, sin embargo, ha sido relativizado por otros más recientes; también debe destacarse que algunos datos epidemiológicos reunidos hasta ahora en los países donde se lleva a cabo la vacunación sistemática desde hace varios años, aun siendo limitados e insuficientes para dilucidar de forma definitiva la cuestión, muestran una disminución de la carga de la enfermedad tanto por varicela165 como por HZ189 en la población adulta.
Vacunas disponibles en EspañaActualmente, en España, hay disponibles 2 vacunas contra la varicela: Varivax® (Sanofi Pasteur MSD) y Varilrix® (GlaxoSmithKline). Esta última, desde septiembre de 2009, está autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) solo como medicamento de «uso hospitalario» y, por tanto, no está disponible en el canal farmacéutico extrahospitalario, con lo que su administración queda restringida a los servicios de farmacia de los hospitales. Además, la distribución de Varivax® a las oficinas de farmacia está actualmente bloqueada en numerosas regiones españolas sin que la AEMPS haya explicado formalmente las razones y el alcance de dicha medida. Estas circunstancias impiden el uso de estas vacunas fuera de las recomendaciones oficiales de cada CC. AA. que son inexplicablemente variables.
Las pautas de vacunación frente a la rubeola, el sarampión y la parotiditis (TV) por un lado, y la varicela por el otro, se solapan, por lo que el uso de vacunas combinadas (cuádruple vírica: ProQuad® y Priorix-Tetra®), aún no disponibles en España, facilitaría su implementación (la logística y la aceptabilidad) y disminuiría los costes de forma considerable.
Debe recordarse que al ser las vacunas de la varicela y la TV ambas de virus vivos atenuados, pueden administrarse el mismo día en lugares anatómicos diferentes, pero si esto no fuera posible deberá separarse su administración, al menos, un mes.
Vacunación frente a la gripeRecomendación CAV-AEP 2014: el CAV-AEP recomienda la vacunación antigripal en la infancia y la adolescencia en: a) grupos de riesgo, niños a partir de los 6 meses de edad y adolescentes en determinadas situaciones o con enfermedades de base; b) niños sanos a partir de los 6 meses de edad y adolescentes sanos que convivan con pacientes de riesgo, y c) adultos en contacto con niños y adolescentes incluidos en los grupos de riesgo. Es especialmente importante la recomendación de la vacunación antigripal de todos los profesionales sanitarios.
El CAV-AEP considera que la vacunación antigripal es una estrategia especialmente beneficiosa cuando va dirigida a personas, niños y adultos, que se incluyen en los grupos de población considerados de riesgo. Pertenecen a estos grupos de riesgo quienes, debido a la enfermedad de base que padecen o por el tratamiento que reciben, en el caso de contraer la gripe, pueden padecer formas complicadas y más graves de la enfermedad o sufrir una desestabilización de su enfermedad de base, que comportan un mayor riesgo de mortalidad. Sin embargo, muchos niños y adolescentes pertenecientes a estos grupos de riesgo continúan sin recibir, por distintas razones, dicha vacunación anual190. Es necesaria una mayor implicación de los profesionales de la salud, las autoridades sanitarias y todos los agentes sociales para transmitir a la población, y de forma especial a los padres de niños y adolescentes pertenecientes a los grupos de riesgo, las recomendaciones de vacunación frente a la gripe estacional.
Este Comité, al igual que otras sociedades científicas de España, desea hacer un especial énfasis en la vacunación antigripal de todos los profesionales sanitarios en contacto con pacientes3,191.
La información ampliada para esta vacunación puede ser consultada en el documento que este Comité elabora de forma anual, antes del inicio de la temporada epidémica192.
Anualmente, la OMS decide las cepas del virus de la gripe que deben contener las vacunas estacionales. Para esta temporada 2013-2014, la cepa A/H1N1 elegida procede de la cepa H1N1-2009, que fue también empleada en las campañas 2011-2012 y 2012-2013. La cepa A/H3N2 es la misma que en 2012-2013 y, sin embargo, la cepa B es diferente a la empleada en la campaña anterior193.
Recomendaciones del Comité Asesor de Vacunas de la AEPCon relación a la infancia y a la adolescencia, el CAV-AEP recomienda la vacunación antigripal en:
- 1.
Grupos de riesgo. Niños mayores de 6 meses y adolescentes en las siguientes situaciones o enfermedades de base:
- -
Enfermedad respiratoria crónica (p. ej., fibrosis quística, displasia broncopulmonar, bronquiectasias, asma e hiperreactividad bronquial, etc.).
- -
Enfermedad cardiovascular grave (congénita o adquirida).
- -
Enfermedad metabólica crónica (p. ej., diabetes, errores congénitos del metabolismo, etc.).
- -
Enfermedad renal crónica (p. ej., insuficiencia renal, síndrome nefrótico, etc.) o hepática.
- -
Enfermedad inflamatoria intestinal crónica.
- -
Inmunodeficiencia congénita (se excluye el déficit aislado de IgA) o adquirida (se incluye la administración de corticoides sistémicos a dosis altas y mantenidas).
- -
Asplenia funcional o anatómica.
- -
Enfermedad oncológica.
- -
Enfermedad hematológica moderada o grave (p. ej., hemoglobinopatía, leucemia, etc.).
- -
Enfermedad neuromuscular crónica y encefalopatía moderada-grave.
- -
Malnutrición moderada o grave.
- -
Obesidad mórbida (índice de masa corporal mayor o igual a 3 desviaciones estándar por encima de la media).
- -
Síndrome de Down u otros trastornos genéticos con factores de riesgo.
- -
Tratamiento continuado con ácido acetilsalicílico (por riesgo de síndrome de Reye en caso de infección por virus gripal salvaje).
- -
Embarazo en adolescentes.
- -
- 2.
Niños sanos mayores de 6 meses y adolescentes sanos que convivan con pacientes de riesgo.
- 3.
Adultos en contacto con niños y adolescentes pertenecientes a grupos de riesgo.
Debe insistirse en la vacunación frente a la gripe estacional de todos los adultos que sean contactos domiciliarios (convivientes o cuidadores) de niños y adolescentes que pertenezcan a los grupos de riesgo (apartado 1). Se enfatiza la recomendación de la vacunación antigripal en el personal sanitario que trabaja con niños.
Dado que los niños son la fuente principal de propagación del virus de la gripe en la comunidad (familia, escuela, etc.)194, ya que eliminan una mayor carga viral y durante más tiempo que los adultos195, que las mayores tasas de incidencia se registran en la población menor de 15 años196 y que la tasa media de hospitalización en menores de 5 años sanos es de alrededor de 1 por 1.000197, el CAV-AEP considera que los niños mayores de 6 meses sanos y no incluidos en los grupos de riesgo anteriormente mencionados pueden vacunarse frente a la gripe estacional si sus padres lo solicitan o su pediatra lo considera conveniente. Esta actitud preventiva constituye, sin duda, una oferta de salud que proporciona al niño o adolescente vacunado una protección individual directa, además de favorecer una protección familiar y comunitaria indirectas.
La vacunación antigripal universal de todos los niños, en el momento actual en nuestro medio y con las vacunas disponibles, plantea diversas dudas y algunos inconvenientes198: 1) necesidad de añadir anualmente una inyección al calendario de vacunaciones, con los problemas inherentes de implementación y aceptabilidad; 2) la efectividad de las vacunas antigripales trivalentes inactivadas en niños menores de 2 años es baja198–203; 3) el coste sería elevado y en nuestro medio no existen suficientes datos de eficiencia en la edad pediátrica; y 4) ausencia en nuestro medio de vacunas antigripales atenuadas de administración intranasal, así como de vacunas antigripales tetravalentes inactivadas o atenuadas, para su uso en pediatría y que proporcionan una mayor eficacia protectora en comparación con las inactivadas trivalentes disponibles en España.
PosologíaEn los niños menores de 9 años, para la obtención de una protección óptima frente a la gripe, son necesarias 2 dosis de la vacuna, separadas por, al menos, 4 semanas204,205. La 1.a dosis debe administrarse tan pronto como la vacuna esté disponible, para asegurar así que ambas dosis puedan ser recibidas antes del inicio de la actividad gripal, ya que la protección es mayor cuando ambas dosis se administran durante la misma temporada de gripe204. Solo en los siguientes supuestos, en niños menores de 9 años, sería suficiente con una sola dosis204:
- -
Haber recibido 2 o más dosis de vacuna de la gripe estacional desde el 1 de julio de 2010.
- -
Haber recibido 2 o más dosis de vacuna de la gripe estacional antes del 1 de julio de 2010 y, al menos, una dosis de vacuna de la gripe pandémica monovalente 2009 (H1N1).
- -
Haber recibido, al menos, una dosis de vacuna de la gripe estacional antes del 1 de julio de 2010 y, al menos, una dosis de la gripe estacional después del 1 de julio de 2010.
El motivo para esta recomendación está basado en la importancia del antecedente de haber recibido una vacuna antigripal que contuviera la cepa pandémica 2009 (H1N1), ya que es muy probable su circulación predominante durante esta próxima temporada.
En niños de 9 años o más es suficiente con una dosis de vacuna antigripal cada temporada, si existe indicación para ello204.
Vacunas antigripales disponiblesLas únicas vacunas disponibles autorizadas para menores de 18 años en nuestro medio, en el momento actual, son los preparados trivalentes inactivados, procedentes de cultivos en huevos de gallina embrionados, para su administración por vía intramuscular, y las vacunas atenuadas intranasales para la edad entre 2 y 18 años205.
En un futuro relativamente cercano, los nuevos formatos de vacunas antigripales estarán totalmente disponibles en España, como son las vacunas tetravalentes, la vacuna atenuada intranasal y las vacunas basadas en cultivo celular. Con estos nuevos preparados y con datos favorables procedentes de nuevos estudios, tanto de ensayos clínicos como de países con vacunación universal en niños, la posibilidad de una recomendación de vacunación no solo en niños de riesgo sino también en sanos, debería replantearse206,207. Evidentemente, los efectos directos e indirectos, incluyendo estudios de coste-efectividad, deberán ser tenidos muy en cuenta.
Vacunación frente a la hepatitis ARecomendación CAV-AEP 2014: el CAV-AEP recomienda la vacuna frente a la hepatitis A en ciertas situaciones de riesgo con 2 dosis, con un intervalo de, al menos, 6 meses entre ellas. Debe valorarse su administración en niños mayores de 12 meses que acuden a guardería.
Epidemiológicamente, España pertenece a un área de baja prevalencia de infección por el virus de la hepatitis A (VHA) (<50% de población inmune a los 30 años)208, hay escasa circulación del virus y el riesgo de contraer la infección es bajo, a pesar de la elevada proporción de individuos susceptibles. La enfermedad ocurre principalmente en adolescentes y adultos pertenecientes a los grupos con alto riesgo de hepatitis A. El cambio epidemiológico más importante observado es el desplazamiento de la infección por el VHA, en la cual es más frecuente la enfermedad sintomática, con aparición de ictericia hasta en un 70% de los casos. También se producen brotes ocasionales causados por la ingestión de alimentos contaminados, así como brotes en colectividades cerradas a partir de portadores asintomáticos (guarderías).
La vacunación frente a la hepatitis A se justifica por las características de la infección y la enfermedad por el VHA, y por la disponibilidad de una vacuna segura y eficaz. La hepatitis A comporta una importante morbilidad, siendo la enfermedad inmunoprevenible más frecuente en los viajeros. Se considera que su incidencia real es 3-10 veces mayor que la cifra de casos clínicos declarados (infranotificación). Clínicamente da lugar a un alto número de infecciones asintomáticas, subclínicas y formas inespecíficas que cursan sin ictericia y con síntomas compatibles con una gastroenteritis o un proceso viral. Sin embargo, la hepatitis A no siempre es una enfermedad benigna y, aunque raramente y casi siempre en el adulto, pueden presentarse formas fulminantes con fallo hepático grave y hepatitis colestásicas, recurrentes y autoinmunitarias. La letalidad varía entre el 0,1% en los niños menores de 14 años y el 2,1% a partir de los 40 años de edad.
Actualmente, en España, en todas las CC. AA., excepto Cataluña, Ceuta y Melilla, la estrategia de vacunación frente a la hepatitis A se basa en la vacunación selectiva de grupos con riesgo incrementado, siguiendo las recomendaciones expresadas por la circular 15/98 de la Dirección General de Farmacia209, que se puede resumir de la siguiente manera.
La vacunación está indicada en:
- -
Personas que viajan a zonas de alta o media endemicidad de hepatitis A, especialmente si han nacido con posterioridad a 1966 y si se desplazan a zonas rurales o con condiciones higiénico-sanitarias deficientes.
- -
Personas con procesos hepáticos crónicos o en tratamiento mantenido con fármacos hepatotóxicos o con hepatitis B o C que, a pesar de no tener un mayor riesgo de infección, sí lo tienen de sufrir una hepatitis A fulminante.
- -
Pacientes hemofílicos que reciben hemoderivados y los pacientes candidatos a trasplantes de órganos.
- -
Cuidadores o familiares en contacto directo con enfermos de hepatitis A.
- -
Personas con infección por el virus de la inmunodeficiencia humana.
- -
Personas que presentan estilos de vida que suponen un mayor riesgo de infección: p ej., hombres que practican sexo con hombres o usuarios de drogas por vía parenteral.
- -
Personas con un mayor riesgo ocupacional.
- -
Situaciones especiales: manipuladores de alimentos, personal que trabaja en guarderías infantiles y personal sanitario de instituciones asistenciales.
Se incluye la recomendación de vacunar al personal de guarderías infantiles (educadores, personal de limpieza y cocina, etc.), debido a la existencia de casos asintomáticos en los niños que acuden a las mismas y a la facilidad de transmisión y contagio que presentan estos niños que no controlan esfínteres; sin embargo, el uso de la vacuna no debería limitarse solo a estos trabajadores, sino que podría ampliarse a los niños para su propia protección y la de sus familiares y contactos domésticos.
El CAV-AEP recomienda, además, la vacunación frente a la hepatitis A, como profilaxis preexposición, a los niños mayores de 12 meses con elevado riesgo de infección pertenecientes a estos otros grupos:
- -
Niños inmigrantes que visitan sus países de origen que tienen una endemicidad intermedia o alta para la infección por el virus de la hepatitis A.
- -
Residentes en instituciones cerradas y sus cuidadores.
- -
Síndrome de Down y sus cuidadores.
Las indicaciones como profilaxis postexposición, en los 14 días siguientes a la misma, incluyen:
- -
Contacto domiciliario con un caso agudo de infección por virus de la hepatitis A.
- -
De forma preferente, ante la presencia de brotes en guarderías.
En España, el papel de las guarderías en la difusión del virus de la hepatitis A está subestimado. Las guarderías que atienden a niños con pañales tienen más probabilidad de experimentar brotes de esta enfermedad. Por esta razón, los niños mayores de 12 meses que acuden a guardería deberían beneficiarse de la administración de la vacuna contra la hepatitis A210. Idealmente, la vacunación se realizará antes del acceso a las guarderías. Los niños que acuden a edades más tempranas no serán vacunados hasta que tengan 12 meses de edad, edad mínima recomendada para la administración de la vacuna.
La pauta de vacunación en ambos tipos de profilaxis consiste en 2 dosis, a partir de los 12 meses de edad, con un intervalo de, al menos, 6 meses entre ellas211,212. Para los viajeros se recomienda que la 1.a dosis se administre, al menos, un mes antes del viaje a la zona endémica.
Diversos trabajos publicados en el último año han mostrado la persistencia de anticuerpos protectores durante un periodo de 11 a 17 años tras la administración de 2 dosis de vacuna frente a la hepatitis A213–217.
Existen numerosos países (y algunas regiones y ciudades) con programas de vacunación universal en la edad infantil, destacando: EE. UU., Puglia (Italia), Israel, Australia, Minsk (Bielorrusia), Argentina, Grecia, China, Arabia Saudí, Panamá, Uruguay, Paraguay, Bahréin, Catar y Kazajistán218.
Como se ha comentado previamente, en España, Cataluña, Ceuta y Melilla incorporaron hace años la vacunación universal a sus calendarios de vacunación pediátricos. Ceuta y Melilla incluyeron en el año 2000 la vacunación universal frente a la hepatitis A en niños en el segundo año de vida219–222. Cataluña instauró en 1998 la vacunación universal frente a la hepatitis A en los preadolescentes de 12 años, aplicándola en las escuelas en forma de vacuna combinada frente a las hepatitis A y B. Con esta medida, la efectividad frente a la hepatitis A ha sido muy importante, con una reducción del 97% en la incidencia de casos en las cohortes vacunadas y con disminuciones importantes en las no vacunadas, probablemente como consecuencia de la inmunidad de grupo, por lo que han decidido mantener el programa hasta el curso 2013-2014, año en el que las cohortes de niños vacunados frente a la hepatitis B en el primer año de vida llegarán al curso en el que se administra la vacuna combinada frente a ambos virus222–225.
De la misma manera que ocurrió con la estrategia selectiva de la vacunación frente a la hepatitis B, la vacunación frente a la hepatitis A de la población de mayor riesgo tendrá muy poco impacto en la incidencia de la enfermedad, ya que solo se puede prevenir un pequeño porcentaje del total de casos. Únicamente la vacunación universal puede reducir de forma significativa la enfermedad. Además, al no existir un reservorio no humano, ni infecciones crónicas por el virus de la hepatitis A, la vacunación universal tiene el potencial de la eliminación de la enfermedad de una comunidad o país.
En resumen, el CAV-AEP mantiene la recomendación de vacunar frente a la hepatitis A a las personas con un riesgo incrementado de infección, a la vez que considera que, idealmente, la vacunación universal de todos los niños podría ser la estrategia óptima para la eventual eliminación y control de esta enfermedad.
Vacunación frente al meningococo BRecomendación CAV-AEP 2014: este comité recomienda la administración de la vacuna frente al meningococo B para el control de brotes epidémicos e insiste en la necesidad de que sea comercializada libremente en las oficinas de farmacia.
Vacuna frente al meningococo B de 4 componentesEl 15 de noviembre de 2012, el Comité de Medicamentos de Uso Humano de la EMA manifestó una opinión positiva y recomendó la autorización de la vacuna tetravalente frente al meningococo B (4CMenB, Bexsero®, Novartis)226. Fue autorizada por procedimiento centralizado por la EMA el 14 de enero de 2013.
Es una vacuna recombinante obtenida por técnica de vacunología inversa, que contiene 3 antígenos subcapsulares del meningococo B (la adhesina A de Neisseria meningitidis o NadA, la proteína que une el factor H del complemento o GNA2091-fHbp y el antígeno de Neisseria que une la heparina o NHBA-GNA1030) combinados con vesículas de membrana externa (OMV) de la cepa de N. meningitidis NZ 98/254, que expresa el serosubtipo 1.4 de la PorA.
El desarrollo clínico de la vacuna muestra que es segura e inmunógena tanto en niños como en adultos, genera memoria inmunológica y es compatible con las vacunas de uso sistemático, aunque no se dispone de datos de administración simultánea con las vacunas antimeningocócicas conjugadas del serogrupo C, ni con las vacunas antineumocócicas conjugadas actuales. En algunos estudios se han obtenido resultados inferiores en la respuesta inmunológica frente a poliovirus tipo 2 y al serotipo neumocócico 6B, así como al antígeno pertactina de la B. pertussis. Sin embargo, todos estos datos no sugieren consecuencias clínicas significativas227.
Con respecto a la seguridad, en lactantes y niños menores de 2 años, se comprobó que las reacciones adversas locales y sistémicas más comúnmente observadas fueron el dolor y eritema en el lugar de inyección, fiebre e irritabilidad. En los estudios clínicos en lactantes, la fiebre aparecía más frecuentemente cuando 4CMenB se coadministraba con las vacunas sistemáticas que cuando se aplicaba sola. Cuando 4CMenB se administró sola, la frecuencia de aparición de fiebre fue similar a la asociada con las vacunas sistemáticas administradas durante los ensayos clínicos228.
La vacuna está indicada para la inmunización activa de individuos a partir de los 2 meses de edad frente a la enfermedad meningocócica invasiva causada por N. meningitidis serogrupo B. La pauta recomendada está reflejada en la figura 4229.
Esquema de vacunación de la vacuna frente al meningococo B.
Fuente: Novartis. Modificado de la ficha técnica de la EMA229.
Para el cálculo teórico de la cobertura potencial de la vacuna existe un sistema de tipificación del antígeno meningocócico (MATS), desarrollado para relacionar perfiles de antígenos de distintas cepas de meningococos del serogrupo B con la eliminación de las cepas en el ensayo bactericida en suero con complemento humano (hSBA). En un estudio, con aproximadamente 1.000 cepas de meningococos de serogrupo B aisladas durante 2007-2008 en 5 países europeos, se observó que entre el 73 y el 87% de las mismas tenían un perfil de antígeno de MATS adecuado que podía ser cubierto por la vacuna, dependiendo del país de origen. En general, el 78% (IC del 95%: 63-90%) de las cepas estudiadas resultaron potencialmente susceptibles a los anticuerpos inducidos por la vacuna. Los datos de MATS disponibles en España a partir de 300 aislamientos clínicos señalan una cobertura del 69%. Aun así, los expertos consideran que este sistema es muy conservador y que, probablemente, la cobertura real será mayor230.
Tras la aprobación centralizada de la vacuna por parte de la EMA, las agencias reguladoras de cada país han de pronunciarse sobre las condiciones de comercialización de la misma. La AEMPS comunicó, el 5 de abril de 2013, su postura al respecto: «En base a la ausencia de datos de eficacia clínica con esta vacuna, con una incidencia actualmente contenida de enfermedad meningocócica por serogrupo B, y a la espera de obtener datos de efectividad postautorización, y ante la ausencia, en estos momentos, de recomendaciones oficiales de uso por parte de Salud Pública, se recomienda establecer el uso hospitalario de la vacuna Bexsero®, hasta que Salud Pública determine, en el seno del CISNS, el objetivo o la política que se va a seguir con respecto al uso de esta vacuna»231.
A su vez, el 20 de junio de 2013, el Grupo de Trabajo MenB, de la Ponencia de Programas y Registro de Vacunaciones del Ministerio de Sanidad, Servicios Sociales e Igualdad estableció que: «Teniendo en cuenta la información disponible y la situación epidemiológica, en el momento actual no se considera justificada la inclusión de esta vacuna en el calendario sistemático de vacunaciones. Se recomienda proseguir con la evaluación de la vacuna una vez que se disponga de información clave relativa, particularmente, a la protección clínica en regiones geográficas o países de nuestro entorno, así como de un sistema de seguimiento por laboratorio para conocer la efectividad de la vacunación y la evolución de las poblaciones de N. meningitidis. Las autoridades sanitarias valorarán la utilización de la vacuna en situaciones de brotes y casos aislados de enfermedad meningocócica por el serogrupo B»232.
El 24 de julio de 2013, el JCVI del Departamento de Salud del Reino Unido ha tomado la decisión de no recomendar, por el momento, la inclusión de la vacuna 4CMenB en el calendario infantil sistemático de ese país, al considerar que la vacunación sistemática en el lactante no es coste-efectiva, aunque podría serlo en el adolescente. Consideran, sin embargo, que debe valorarse su indicación en ciertos grupos de riesgo, así como su empleo en los contactos de casos de enfermedad invasiva por meningococo B233. El JCVI está a la espera de conocer los resultados de un estudio de coste-efectividad ya iniciado, y cuyos datos preliminares indican que la vacuna puede ser coste-eficaz234.
Recomendaciones de vacunaciónLa reciente aprobación por parte de la EMA de la nueva vacuna frente al meningococo B abre nuevas perspectivas en la prevención de la enfermedad meningocócica producida por este serogrupo. El CAV-AEP considera que esta vacuna debería estar disponible para su uso por los profesionales sanitarios que la consideren indicada. Por otra parte, el CAV-AEP realizará el seguimiento y la evaluación de toda la información futura sobre eficacia, efectividad y compatibilidad con otras vacunas del calendario, para establecer las recomendaciones que sean más beneficiosas para todos los niños. En el momento actual debería ser recomendada para el control de los brotes epidémicos por este germen.
Vacuna frente al meningococo B de 2 componentesEl laboratorio Pfizer está desarrollando otra vacuna frente al meningococo B. Es un preparado bivalente compuesto por 2 variantes (A05 y B01) del grupo de lipoproteínas de membrana externa, designadas como LP2086. Los ensayos clínicos fase 2 realizados en adolescentes muestran que es una vacuna inmunógena y bien tolerada235. Asimismo, los datos de un ensayo fase 1/2 en niños entre 8-14 años muestran que la vacuna es bien tolerada y consigue buena inmunogenicidad tras la administración de 3 dosis236.
Calendarios o pautas de vacunación de rescate para niños y adolescentes con vacunación incompletaEn muchas ocasiones es necesario vacunar a niños que no han recibido vacunas previamente o que no han seguido un calendario de vacunaciones de forma regular, lo han iniciado tardíamente, lo han interrumpido o han sido vacunados en sus países de origen con una pauta diferente a la indicada en España. En todos estos niños se debe realizar una adaptación al calendario de vacunación de nuestro país. Se han elaborado unas tablas para orientar en la realización de pautas de vacunación de rescate en niños y adolescentes con inmunización incompleta (figs. 5–7) que conllevan cambios con respecto a las de 2013 (introducción de cambios en la vacuna frente al meningococo C).
El objetivo de estos calendarios de rescate es que sean un instrumento de ayuda para los pediatras y las enfermeras pediátricas en su práctica diaria. Se basan en recomendaciones de diversas sociedades científicas y de expertos y para interpretarlos deben tenerse en cuenta las siguientes premisas237,238:
- •
Edad del niño y, en función de ella, el número de dosis necesarias para estar correctamente vacunado (fig. 5). Las dosis administradas previamente, si las hubiese, deben considerarse válidas siempre que respeten la edad mínima y el intervalo mínimo entre las dosis. No se reiniciará una pauta de vacunación si el niño ha recibido dosis previas válidas. Para actualizar el calendario se establecerán las dosis necesarias en función de la edad y se restarán las que ya hubiese recibido; el resultado serán las dosis necesarias para poner al día el calendario de vacunas.
- •
Se considerarán válidas las dosis que estén correctamente registradas o identificadas. En los casos en los que no hubiese ninguna prueba documentada de las vacunas administradas y por interrogatorio no se pudiese establecer fehacientemente qué vacunas ha recibido un individuo, podrá optarse por administrar todas las vacunas adecuadas para la edad, como si se tratase de un paciente no vacunado.
- •
Debe respetarse el intervalo mínimo entre dosis para obtener una adecuada respuesta inmunológica y considerar la vacunación como válida. La aplicación de estos intervalos permite completar cuanto antes el calendario de vacunación (pauta de rescate o acelerada) y alcanzar rápidamente un estado de inmunización adecuado. A partir de ese momento será preferible no utilizar los intervalos mínimos para continuar la vacunación, respetando los intervalos habituales recomendados.
- •
Se administrarán de forma simultánea todas las vacunas posibles en lugares anatómicos distintos. Se utilizarán preferentemente vacunas combinadas (para disminuir el número de inyecciones). En caso de que, por distintos motivos, no se pudieran administrar todas las vacunas simultáneamente (deseo del niño, sus padres o tutores, número elevado de dosis pendientes o no disponibilidad de algún preparado comercial) y se considere que el niño volverá a la consulta por tener un domicilio estable, se administrarán primero las vacunas que inmunicen frente a las patologías de mayor riesgo con relación a la edad del niño y a la epidemiología del entorno y las que lo inmunicen frente a enfermedades para las que no hubiese recibido ninguna dosis previa de vacuna.
En las figuras 6 y 7 se muestran los intervalos mínimos y el número de dosis necesarias de las vacunas recomendadas por el CAV-AEP para niños entre 4 meses y 6 años, y para niños y adolescentes entre los 7 y los 18 años de edad, respectivamente. Es necesario, para una correcta comprensión de la figura, leer el pie de la misma, ya que la información allí expresada aclara algunos aspectos que hacen referencia a situaciones específicas.
Conflicto de interesesDMP ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline y como consultor en Advisory Board de Astra-Zeneca, Novartis y Pfizer.
FJAG ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en un Advisory Board de Novartis.
JAF ha colaborado en actividades docentes y como investigador en ensayos clínicos subvencionados por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en un Advisory Board de Novartis.
MJCO ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigadora en ensayos clínicos de Pfizer y como consultora en Advisory Board de GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD.
JMCR ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Sanofi Pasteur MSD y Novartis.
NGS ha asistido a actividades docentes subvencionadas por Pfizer.
AHM ha colaborado como investigador en ensayos clínicos subvencionados por Wyeth y ha recibido ayuda económica para asistir a actividades docentes nacionales.
THSM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigadora en ensayos clínicos subvencionados por GlaxoSmithKline y Pfizer.
MMM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en Advisory Board de Novartis.
LOC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline.
JRC ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
David Moreno-Pérez (DMP), Francisco José Álvarez García (FJAG), Javier Arístegui Fernández (JAF), M.ª José Cilleruelo Ortega (MJCO), José María Corretger Rauet (JMCR), Nuria García Sánchez (NGS), Ángel Hernández Merino (AHM), Teresa Hernández-Sampelayo Matos (THSM), Manuel Merino Moína (MMM), Luis Ortigosa del Castillo (LOC), Jesús Ruiz-Contreras (JRC).