Investigación y control de un brote por virus respiratorio sincitial (VRS) que afectó a la Unidad de Neonatología (UN) de un hospital universitario de octubre a diciembre del 2012.
Pacientes y métodosEstudio de cohortes de los niños ingresados en la UN. Se calculó la tasa de ataque de infección y se realizaron un análisis descriptivo de los casos y un análisis multivariante de aquellas variables que mostraron ser factores de riesgo de infección por VRS.
Las medidas preventivas llevadas a cabo fueron: aislamiento de contacto de casos; formación y observación de higiene de manos; exclusividad del personal sanitario para casos, restricción de visitas; estudio de portadores de VRS y profilaxis con palivizumab.
ResultadosEl brote tuvo 3 ondas epidémicas y un total de 20 casos, de 48 niños ingresados. La tasa de ataque global fue del 42%. De los casos, la mitad fueron niños, con una edad mediana de 36 días (p25=22, p75=58). El peso al nacimiento inferior a 1.000 g (OR=23,5; p=0,002) y tener otra infección nosocomial en la semana previa al diagnóstico de infección por VRS (OR=19,98; p=0,016), fueron factores de riesgo independientes de infección por VRS.
ConclusionesSe trató de un brote epidémico con un elevado número de casos, relacionado con el retraso en la notificación, el tiempo prolongado del estado de portador del VRS y los fallos en el cumplimiento de la higiene de manos, que favoreció la transmisión cruzada de la infección. Las medidas preventivas más eficaces fueron la observación directa de higiene de manos y supervisión de las medidas de aislamiento.
Investigation and control of a respiratory syncytial virus (RSV) outbreak that affected the Neonatal Intensive Care Unit (NICU) of a university hospital from October to December 2012.
Patients and methodsCohort study of children admitted to the NICU. The infection attack rate was calculated. A descriptive analysis of the cases and a multivariate analysis was performed using the variables that were shown to be risk factors for RSV infection.
Preventive measures taken were: contact isolation; hand hygiene training and observation; exclusivity of a health team of nurses and physicians for positive cases, restrictions on visitor numbers; surveillance RSV testing, and palivizumab prophylaxis.
ResultsThe outbreak had three epidemic waves and 20 positive cases out of a total of 48 children admitted. The overall attack rate was 42%. Half of positive cases were children, with a median age of 36 days (p25=22, p75=58). The independent risk factors for RSV infection were birth weight below 1000 grams (OR=23.5; P=.002) and to have another nosocomial infection the week before the diagnosis of RSV infection (OR=19.98; P=.016).
ConclusionsIt was an outbreak with a high number of cases, due to the delay in notification, prolonged RSV carrier status, and low adherence to hand hygiene practice, which favoured the cross-transmission of infection. The most effective preventive measures were direct observation of hand hygiene and supervision of isolation measures.
El VRS es un virus de cadena simple de ácido ribonucleico de la familia Paramyxoviridae. Se divide en los subgrupos A y B, que pueden circular conjuntamente, aunque el subgrupo A suele predominar1.
El VRS es el principal agente causal de infecciones del tracto respiratorio inferior2 y primera causa de bronquiolitis aguda3 en niños. Puede causar catarro de vías altas, infección de vías respiratorias bajas y neumonía4. Produce brotes de carácter estacional, variables según la zona geográfica, siendo máxima la incidencia en nuestro país entre noviembre y febrero5. Es uno de los principales agentes responsables de las infecciones nosocomiales del tracto respiratorio en pacientes pediátricos, produciendo brotes de elevada morbimortalidad, sobre todo en aquellos pacientes que presentan ciertas condiciones subyacentes. La prolongada eliminación viral junto a la potencial susceptibilidad de los pacientes y el personal sanitario, ya que no se crea inmunidad permanente6, dificultan el control de la propagación nosocomial7.
La transmisión es más frecuente por contacto directo, ya que el virus puede permanecer durante horas en la superficie de objetos y en las manos del personal sanitario8.
Analizamos en este artículo un brote por VRS que afectó a 20 niños ingresados en una Unidad de Neonatología (UN) y las medidas llevadas a cabo para controlar la infección.
Pacientes y métodosLa UN forma parte de un hospital universitario de tercer nivel (hospital de referencia)9. El área de Pediatría tiene una población de referencia asignada de 150.619 niños10.
La UN, de referencia dentro de la comunidad autónoma, se divide en: Unidad de Neonatología General (NG): con 28 camas, 5 médicos, y una ratio de una enfermera por 6-7 pacientes; Cuidados Intermedios Neonatales (CI): 16 camas, 6 médicos y una ratio de una enfermera por 3-4 pacientes, y Unidad de Cuidados Intensivos Neonatales (UCI): 12 camas, 6 médicos y una ratio de una enfermera por 2 pacientes.
Definiciones. Se consideró como caso sospechoso de infección por VRS a todo neonato ingresado desde el 2 de octubre hasta el 6 de diciembre en la UN, que presentó clínica compatible con: catarro de vías altas (presencia de tos, rinorrea y/o fiebre); infección respiratoria de vías bajas (hipoxemia, estertores o sibilancias en la auscultación, o uso de la musculatura accesoria para la respiración); neumonía (presencia de síntomas respiratorios y una imagen de consolidación en la radiología de tórax)4 y/o bronquiolitis (rinitis, taquipnea, sibilancias, tos, crepitantes y/o aleteo nasal)3. Caso confirmado: neonato ingresado en la UN entre el 2 de octubre y el 6 de diciembre con detección de antígeno de VRS positivo en muestra de lavado nasofaríngeo y clínica compatible con catarro de vías altas, infección respiratoria de vías bajas, neumonía y/o bronquiolitis. Se definió como portador asintomático a todo neonato ingresado en la UN entre los días 2 de octubre y 6 de diciembre, con detección de antígeno de VRS en muestra de aspirado nasofaríngeo sin clínica aparente de infección respiratoria. El periodo de estancia en la Unidad, se calculó para los casos como los días desde el ingreso hasta la fecha del diagnóstico microbiológico. Para los que no enfermaron, se calculó como los días desde el ingreso hasta la fecha de realización del cribado. Se empleó la clasificación de la Organización Mundial de la Salud (OMS)11 de nacido pretérmino y las subcategorías relativas en función de la edad gestacional (EG), definiéndose como prematuro o nacido pretérmino a aquel recién nacido menor de 37 semanas, prematuro moderado o tardío aquel entre 32 y<37 semanas, muy prematuro entre 28 y<32 semanas, y extremadamente prematuro aquel<28 semanas.
Estudio microbiológico. El diagnóstico del VRS se realizó a partir de muestras obtenidas por lavado nasofaríngeo, determinándose el antígeno del virus mediante técnica de inmunocromatografía (BD Directigen EZ RSV®. New Jersey, EE. UU.). Esta prueba tiene una reproducibilidad del 99,1%, una sensibilidad del 80% y una especificidad del 91%.
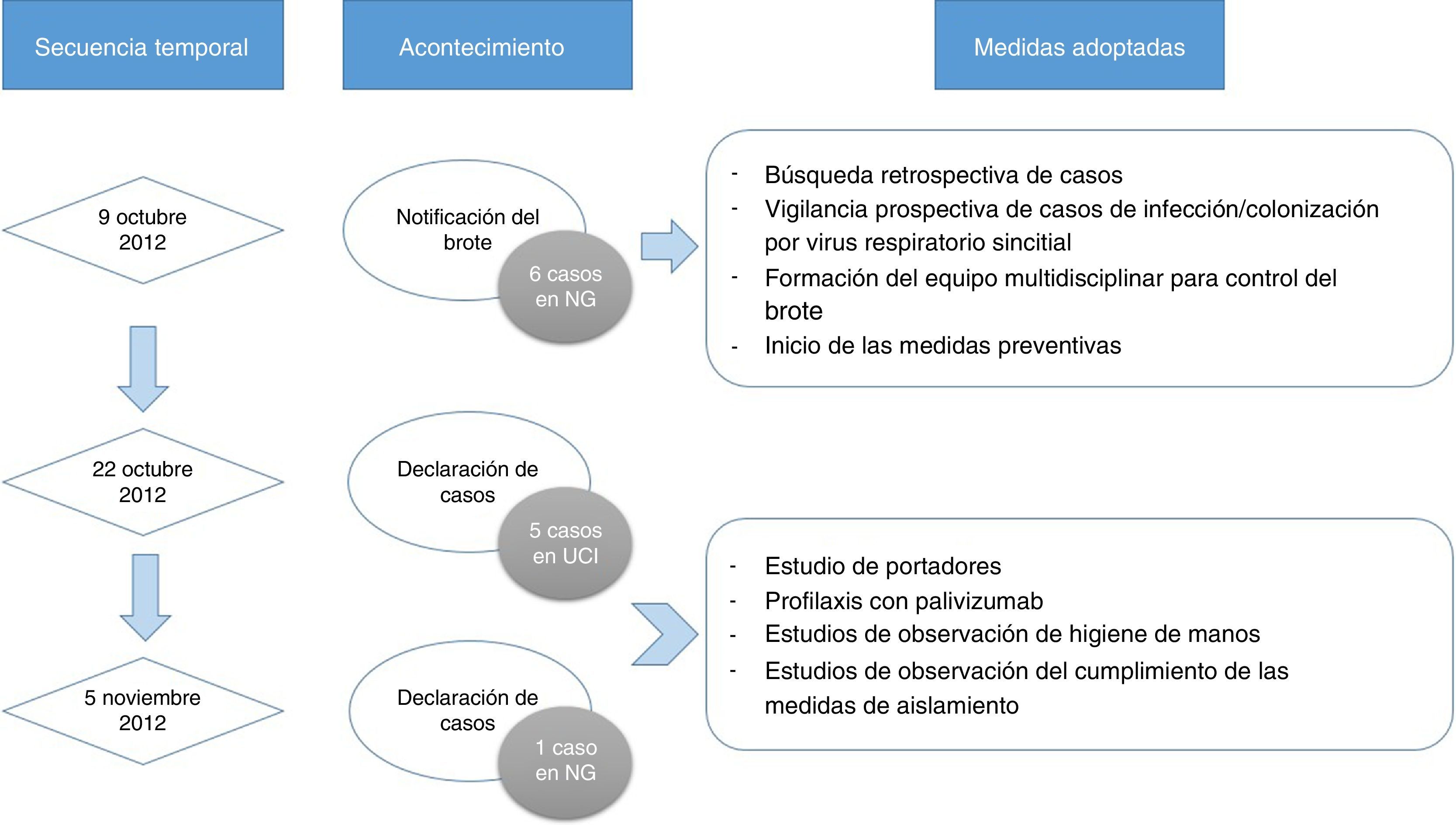
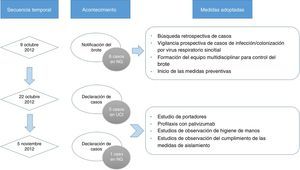
Detección del brote y medidas de intervención. El 9 de octubre del 2012 la jefa de sección de la UN comunica a Medicina Preventiva la existencia de 6 casos de infección por VRS en NG. Tras la notificación, se realizó una búsqueda retrospectiva y vigilancia prospectiva de los casos de infección/colonización por VRS, se formó un equipo multidisciplinar de control del brote y se iniciaron las medidas preventivas, que consistieron en: aislamiento de contacto de los pacientes con sospecha clínica de infección por VRS, especial insistencia en el lavado de manos y cumplimiento estricto de sus indicaciones según las recomendaciones de la OMS12, exclusividad del personal sanitario para el cuidado de los pacientes infectados y limitación de las visitas.
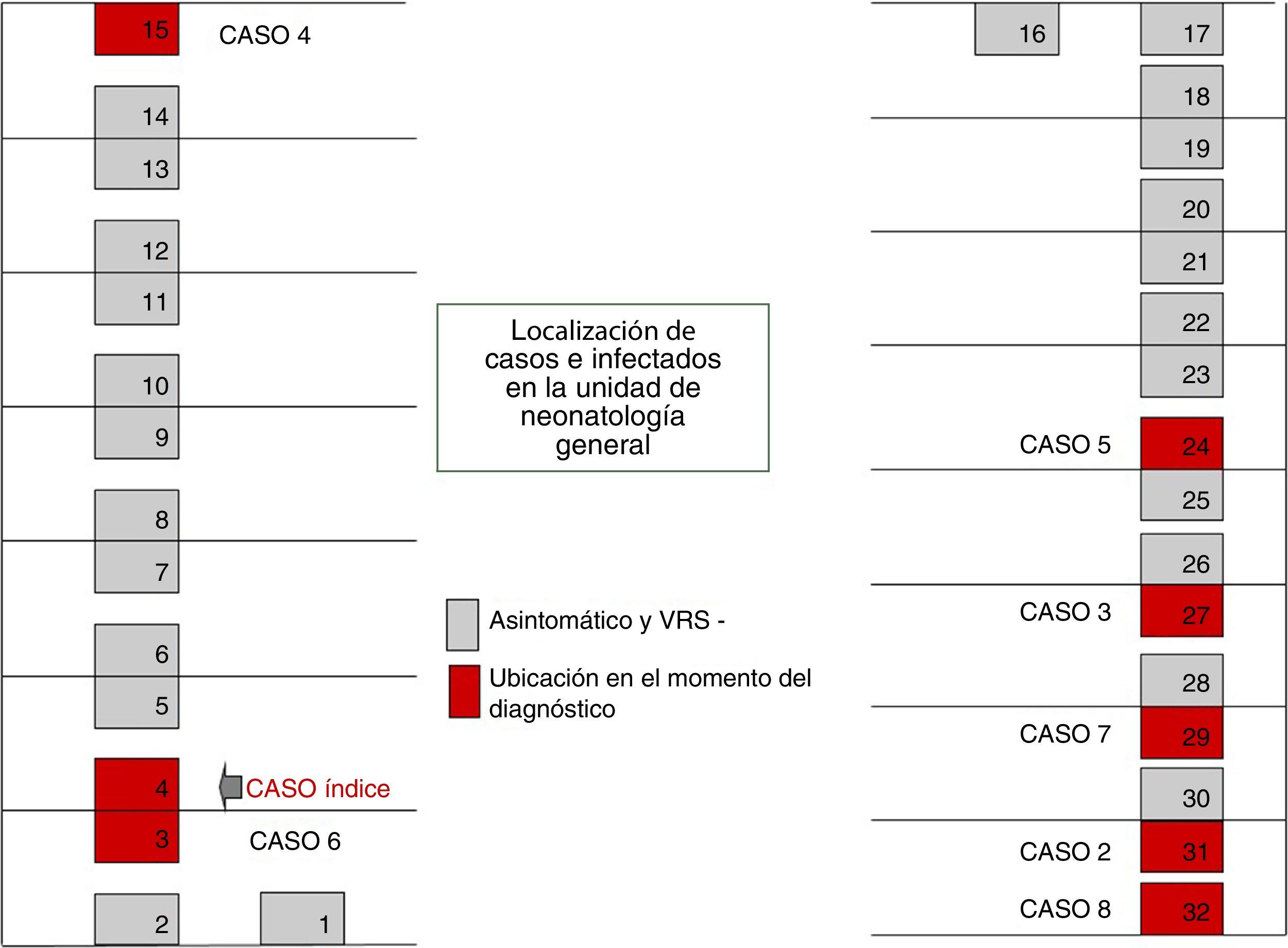
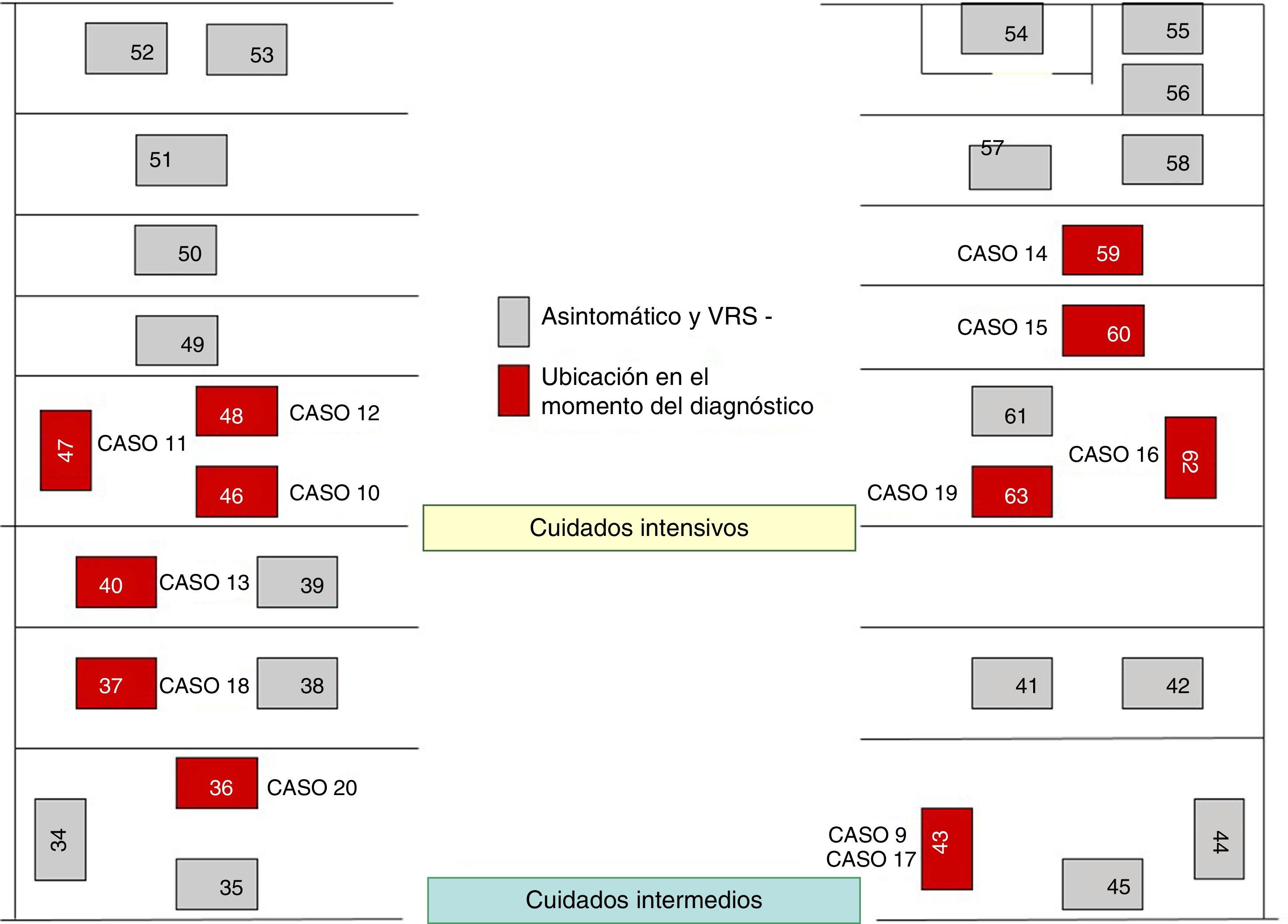
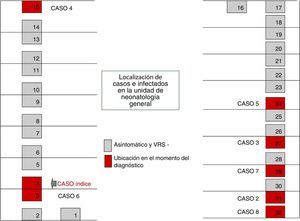
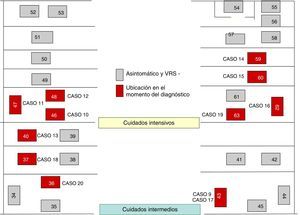
El 22 de octubre y el 5 de noviembre fueron declarados nuevos casos en UCI y NG, respectivamente, añadiéndose nuevas medidas, como: estudio de portadores; profilaxis con palivizumab; estudios de observación de higiene de manos y del cumplimiento de las medidas de aislamiento de las 3 unidades. Las figuras 1 y 2 muestran la ubicación de los casos e infectados en las Unidades afectadas, mientras que la figura 3 resume los acontecimientos.
Diseño del estudio. Estudio de cohortes formadas por todos los niños ingresados en la UN desde que fue diagnosticado el primer caso (2 de octubre del 2012) hasta que se detectaron los 2 últimos (6 de noviembre del 2012).
Recogida de la información. Se empleó la encuesta individual protocolizada elaborada por el Servicio de Medicina Preventiva (véase el anexo 1), donde se recogieron variables de identificación personal, variables asociadas al proceso patológico, variables relacionadas con los antecedentes clínicos y procedimientos realizados.
Análisis estadístico. Se calculó la tasa de ataque de infección por VRS global y para cada unidad, que corresponde a la probabilidad que tienen los pacientes ingresados en alguna de estas Unidades de presentar una infección por VRS. Se consideró como persona en riesgo a todos aquellos niños ingresados en la UN durante el periodo epidémico.
Se realizó un análisis estadístico descriptivo univariante, empleándose la distribución de frecuencias para representar las variables categóricas, y medidas de tendencia central y de dispersión para las variables cuantitativas. El análisis estadístico bivariante estudió la existencia de asociación estadística entre las variables mediante la prueba de la chi al cuadrado o el test exacto de Fisher. Un valor de p < 0,05 fue considerado estadísticamente significativo. La prueba U de Mann-Whitney de muestras independientes se empleó para la comparación de medianas entre dos grupos. Se utilizó la regresión logística como método de análisis multivariante para aquellas variables que mostraron ser factores de riesgo de infección por VRS. Los datos se procesaron mediante el programa estadístico IBM SPSS (Statistical Package of Social Science) versión 20 (Armonk, Nueva York, EE. UU.).
Las variables que se describieron en el análisis univariante/bivariante fueron: edad al diagnóstico de infección por VRS, periodo de estancia en la Unidad hasta diagnóstico de infección por VRS, peso al nacimiento (en gramos), EG (en semanas) y los antecedentes de: enfermedad pulmonar crónica, cardiopatía, ductus arterioso persistente, enfermedad neurológica, malformación congénita, crecimiento uterino retardado (CIR) y desnutrición, cirugía previa al diagnóstico de infección por VRS, ventilación mecánica previa al diagnóstico de infección por VRS, haber tenido otra infección nosocomial en los 7 días previos al diagnóstico de infección por VRS y el grado de prematuridad.
Las variables con un valor de p< 0,05 en el análisis bivariante que se consideraron para el análisis multivariante fueron: la EG, el peso al nacimiento, el periodo de estancia en la Unidad, antecedentes de enfermedad pulmonar crónica, antecedentes de haber tenido otra infección nosocomial y el grado de prematuridad.
ResultadosDescripción del broteLa tasa de ataque global de infección por VRS fue del 42%, siendo del 38, el 42 y el 47% para NG, CI y UCI, respectivamente (tabla 1).
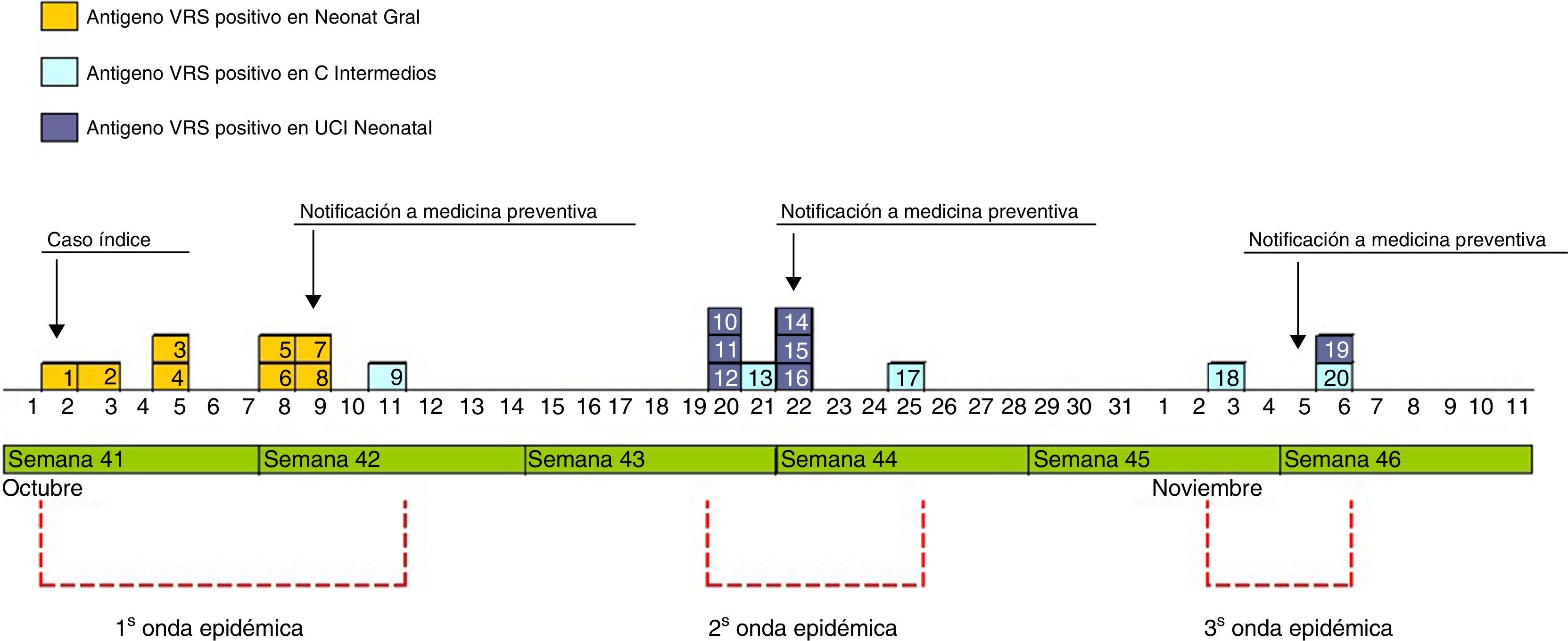
El brote tuvo 3 ondas epidémicas y un total de 20 casos de 48 niños ingresados (fig. 4). La primera onda se inició el 2 de octubre en NG y agrupó 9 casos. El primer caso ingresó en la UCI el 6 de agosto, trasladándose a NG el 28 de septiembre, detectándose el antígeno del VRS en muestra de aspirado nasofaríngeo el 2 de octubre. La segunda onda epidémica afectó a la UCI y CI, abarcó del 20 al 25 de octubre y agrupó 8 casos. La tercera onda, del 3 al 6 de diciembre, agrupó los 3 casos restantes detectados en UCI y CI.
Del total de casos, 12 fueron declarados por NG en el transcurso de las 3 ondas epidémicas y los 8 casos restantes fueron detectados a raíz del estudio de portadores.
De los 20 casos, la mitad fueron niños y el resto niñas, con una edad mediana al diagnóstico de infección por VRS de 36 días (p25=22, p75=58) y con una edad mediana gestacional y peso al nacimiento de 29 semanas (RIC: 25,5-33,8) y 982 gramos (RIC 797-1518), respectivamente. La estancia mediana en la Unidad fue de 30,5 días (p25=17,25, p75=54,25) (tabla 2). Respecto a las manifestaciones clínicas, de los 20 casos 15 presentaron síntomas (75%), aunque leves, y solo un 30% de estos desarrolló un cuadro de bronquiolitis. El patrón radiológico predominante fue la normalidad (60%); el 25% presentó hiperinsuflación o infiltrado perihiliar y el 15% restante presentó condensación o atelectasia.
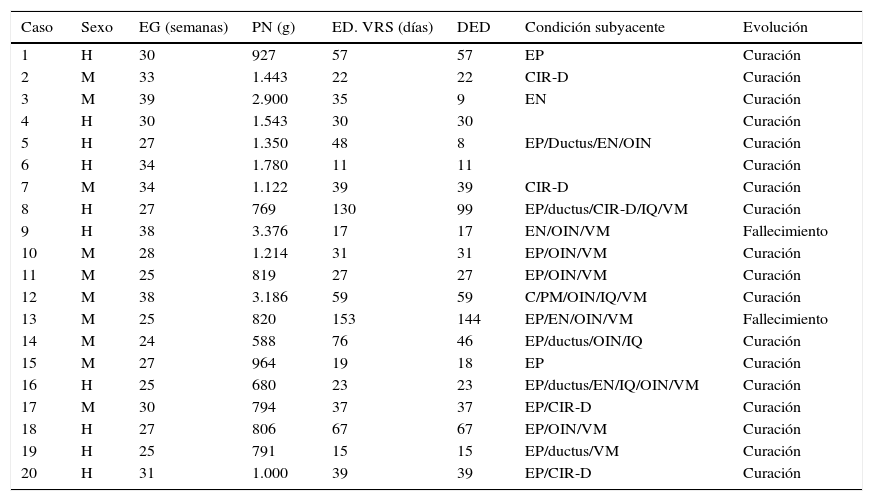
Características de los pacientes con resultado positivo de infección por virus respiratorio sincitial
| Caso | Sexo | EG (semanas) | PN (g) | ED. VRS (días) | DED | Condición subyacente | Evolución |
|---|---|---|---|---|---|---|---|
| 1 | H | 30 | 927 | 57 | 57 | EP | Curación |
| 2 | M | 33 | 1.443 | 22 | 22 | CIR-D | Curación |
| 3 | M | 39 | 2.900 | 35 | 9 | EN | Curación |
| 4 | H | 30 | 1.543 | 30 | 30 | Curación | |
| 5 | H | 27 | 1.350 | 48 | 8 | EP/Ductus/EN/OIN | Curación |
| 6 | H | 34 | 1.780 | 11 | 11 | Curación | |
| 7 | M | 34 | 1.122 | 39 | 39 | CIR-D | Curación |
| 8 | H | 27 | 769 | 130 | 99 | EP/ductus/CIR-D/IQ/VM | Curación |
| 9 | H | 38 | 3.376 | 17 | 17 | EN/OIN/VM | Fallecimiento |
| 10 | M | 28 | 1.214 | 31 | 31 | EP/OIN/VM | Curación |
| 11 | M | 25 | 819 | 27 | 27 | EP/OIN/VM | Curación |
| 12 | M | 38 | 3.186 | 59 | 59 | C/PM/OIN/IQ/VM | Curación |
| 13 | M | 25 | 820 | 153 | 144 | EP/EN/OIN/VM | Fallecimiento |
| 14 | M | 24 | 588 | 76 | 46 | EP/ductus/OIN/IQ | Curación |
| 15 | M | 27 | 964 | 19 | 18 | EP | Curación |
| 16 | H | 25 | 680 | 23 | 23 | EP/ductus/EN/IQ/OIN/VM | Curación |
| 17 | M | 30 | 794 | 37 | 37 | EP/CIR-D | Curación |
| 18 | H | 27 | 806 | 67 | 67 | EP/OIN/VM | Curación |
| 19 | H | 25 | 791 | 15 | 15 | EP/ductus/VM | Curación |
| 20 | H | 31 | 1.000 | 39 | 39 | EP/CIR-D | Curación |
C: cardiopatía; CIR-D: crecimiento intrauterino retardado-desnutrición; DED: días de estancia al diagnóstico de VRS en la Unidad; ED VRS: edad al diagnóstico de VRS; EG: edad gestacional; EN: enfermedad neurológica; EP: enfermedad pulmonar; H: hombre; IQ: intervención quirúrgica previa a la infección por VRS; M: mujer; OIN: otra infección nosocomial; PM: polimalformación; PN: peso al nacimiento; VM: ventilación mecánica invasiva previa a la infección por VRS.
Los niños ingresados sin infección por VRS presentaron una edad mediana de 13,50 días (P25=5,5, P75=24,5), una EG de 36 semanas (p25=32, p75=38), un peso al nacimiento de 2.785 g (p25=1.966, p75=3.565) y un periodo de estancia en la Unidad de 8,5 días (p25=4,25, p75=21). Estas diferencias en peso, EG al nacimiento y estancia en la Unidad entre los casos y los que no enfermaron resultaron estadísticamente significativas en el análisis bivariante para las 3 variables (p<0,001).
El 85% de los casos fueron prematuros frente al 57% de los controles, siendo el 25% de los casos muy prematuros y el 45% extremadamente prematuros, existiendo una asociación estadísticamente significativa entre tener infección por VRS y ser muy prematuro (p=0,029) y extremadamente prematuro (p=0,013). El 65% de los casos tenían antecedentes de enfermedad pulmonar crónica frente al 29% de los controles (p=0,012). El 40% de los casos tuvo otra infección nosocomial en la semana previa al diagnóstico de infección por VRS frente al 3,6% de los controles (p=0,002).
El 50% de los casos recibió profilaxis con anticuerpos monoclonales (palivizumab) frente al 29% del grupo control.
Respecto a la evolución clínica, la mayoría de los pacientes fueron dados de alta por mejoría, 2 casos fallecieron (10%) y uno en el grupo de los no infectados por VRS (3,6%). Los 3 fallecimientos fueron por causas ajenas a la infección por VRS.
No se encontró asociación estadísticamente significativa entre tener infección por VRS y otros antecedentes como cardiopatía, ductus arterioso persistente, enfermedad neurológica, malformación congénita, CIR, cirugía previa al diagnóstico de infección por VRS y ventilación mecánica previa al diagnóstico de infección por VRS.
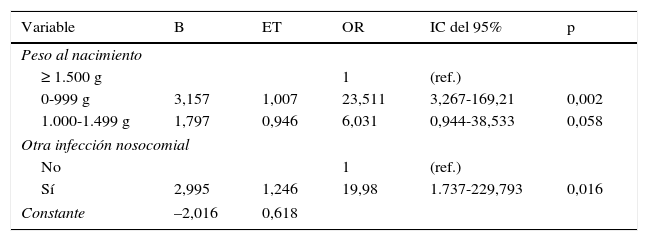
La regresión logística multivariante (tabla 3) identificó como factores de riesgo independientes para tener una infección por VRS el peso al nacimiento inferior a 1.000 g (OR=23,5; IC del 95%, 3,26-169,21; p=0,002) y el haber tenido otra infección nosocomial en la semana previa al diagnóstico de infección por VRS (OR=19,98; IC del 95%, 1,73-229,79; p=0,016). El modelo obtenido clasificó correctamente al 81,3% de los casos analizados, estando comprendida entre un 39,7% (r cuadrado de Cox y Snell) y un 53,5% (r cuadrado de Nagelkerke) la variabilidad de la infección por VRS (variable dependiente) explicada por el mismo.
Regresión logística multivariante. Factores de riesgo independientes de infección por virus respiratorio sincitial
| Variable | B | ET | OR | IC del 95% | p |
|---|---|---|---|---|---|
| Peso al nacimiento | |||||
| ≥ 1.500 g | 1 | (ref.) | |||
| 0-999 g | 3,157 | 1,007 | 23,511 | 3,267-169,21 | 0,002 |
| 1.000-1.499 g | 1,797 | 0,946 | 6,031 | 0,944-38,533 | 0,058 |
| Otra infección nosocomial | |||||
| No | 1 | (ref.) | |||
| Sí | 2,995 | 1,246 | 19,98 | 1.737-229,793 | 0,016 |
| Constante | –2,016 | 0,618 | |||
El VRS es la causa más frecuente de infección del tracto respiratorio bajo en menores de un año13,14, siendo a la vez uno de los principales agentes responsables de brotes de infección nosocomial con elevada morbimortalidad asociadas15,16.
La edad menor de 6 meses, la enfermedad pulmonar crónica, una EG al nacimiento menor a 35 semanas, la enfermedad cardiaca congénita y la inmunodepresión son reconocidos factores de riesgo de infección por VRS17,18. Los recién nacidos prematuros son más susceptibles de ser infectados por el VRS debido a la inmadurez de su sistema inmunológico y los bajos niveles de anticuerpos maternos15,19. En nuestro estudio, los niños infectados por el VRS tuvieron una EG y un peso al nacimiento significativamente más bajos que los no infectados, coincidiendo con otros estudios8,20. También hubo una asociación significativa entre tener infección por VRS y tener antecedentes de enfermedad pulmonar crónica, asociación reflejada en la literatura15,17. La infección por VRS se asoció a un mayor periodo de estancia previa en la Unidad, aunque no se encontró relación con otros factores de riesgo, como la enfermedad cardiaca congénita presente en otros trabajos21. También se encontró una asociación significativa entre tener la infección por VRS y haber tenido otra infección nosocomial en la semana previa al diagnóstico de infección por VRS, que podría explicarse por una disminución de la inmunidad fisiológica de estos niños, con el consiguiente mayor riesgo de infección por otro patógeno, aunque no encontramos datos que apoyen esta hipótesis en la bibliografía. La regresión logística multivariante tan solo identificó como factores de riesgo independientes para tener una infección por VRS el peso al nacimiento inferior a 1.000 g y el haber tenido otra infección nosocomial en la semana previa al diagnóstico de infección por VRS. La variable grado de prematuridad, al estar íntimamente relacionada con el peso al nacimiento, actuó como probable factor de confusión, por lo que se extrajo del modelo de regresión logística.
La mortalidad en pacientes con infección por VRS adquirida en la comunidad es insignificante, a diferencia de la infección nosocomial, que puede ser importante22. El riesgo de mortalidad se incrementa en los niños de menor edad y en aquellos que presentan prematuridad, cardiopatía congénita, displasia broncopulmonar o inmunodeficiencia, dado que son más susceptibles de tener una enfermedad grave6. En nuestro estudio, los 3 fallecimientos que se produjeron en la población estudiada no estuvieron relacionados con la infección por VRS.
La ventilación mecánica invasiva fue precisada por el 30% de los casos, aunque al presentarla todos antes del diagnóstico de infección por VRS no podemos afirmar cuál fue la asociación con el VRS.
La temprana detección de los casos es una medida fundamental para el control de los brotes, con el fin de instaurar las medidas de aislamiento oportunas e impedir la diseminación viral. El VRS se transmite a través del contacto directo, o indirecto a través de fómites, pudiendo sobrevivir en objetos inanimados hasta 12 h, lo que prolonga la posibilidad de contagio en el tiempo8,21. Asimismo, aunque el tiempo de eliminación habitual del virus es de 2 semanas, en niños pretérmino o inmunodeprimidos este periodo puede incrementarse, lo que implica que ante la sospecha de brote de infección por VRS deba investigarse a todos los pacientes, dada la posibilidad de casos asintomáticos de infección. Por todo lo anterior, medidas preventivas como el estudio de portadores del virus no solo son importantes para detectar nuevos casos, sino que pueden orientar sobre el tiempo que se deben mantener las precauciones de contacto8.
Una de las limitaciones del estudio ha sido la no realización de técnicas de reacción en cadena de la polimerasa de las muestras respiratorias de los pacientes, lo que ha podido limitar el diagnóstico de infección por VRS, al tener las técnicas de inmunocromatografía empleadas una sensibilidad menor. Asimismo, la secuenciación de los productos obtenidos en la amplificación posibilitaría la realización de estudios adicionales de genotipificación y epidemiología molecular que no han podido ser llevados a cabo en nuestro estudio. No obstante, disponer de dicha técnica no habría modificado de modo sustancial el tipo de medidas preventivas a llevar a cabo para el control del brote.
En nuestro estudio destacó el elevado número de casos detectados. Entre los factores que pudieron contribuir se encuentran el estudio de portadores (que detectó 8 de los 20 casos diagnosticados), el retraso en la notificación (cuando se notificó había 6 casos infectados por VRS), el levantamiento precoz de los aislamientos (que se hacía sistemáticamente a los 7 días tras su implantación) y fallos en el cumplimiento de la higiene de manos.
A pesar del retraso en la notificación, hecho derivado de fallos en la comunicación interna entre los servicios implicados, la formación del equipo multidisciplinar sirvió de elemento de discusión de dichos aspectos y facilitó la rápida implementación de las medidas preventivas, hecho esencial en el control del brote y su progresión. Dichas medidas, como el aislamiento de los casos, el estudio de portadores, la exclusividad del personal sanitario al cuidado de los pacientes con infección por VRS y la insistencia en el cumplimiento de las medidas de higiene de manos, son las medidas preventivas generalmente recomendadas6,21,23-25. Asimismo, siguiendo las recomendaciones de diferentes estudios26,27 y guías de práctica clínica28,29, se evaluó el cumplimiento de la higiene de manos mediante la observación directa de la práctica de los profesionales durante sus turnos de trabajo y la supervisión de las medidas de aislamiento. En nuestro estudio, el cumplimiento de la higiene de manos por los trabajadores fue del 63%, resultado superior al publicado en una revisión sistemática reciente, que fue del 40%30. No obstante, es necesario tener en cuenta que la monitorización fue hecha durante la investigación del brote, lo que podría aumentar la motivación de los trabajadores en la aplicación estricta de las medidas de higiene de manos. Entre todas las medidas implementadas, las consideradas más eficaces fueron la observación de la higiene de manos y supervisión de las medidas de aislamiento, dado que, a partir de entonces, no se detectaron más casos. El estudio de portadores, por el contrario, aunque permitió identificar nuevos casos, no contribuyó a la finalización del brote.
En conclusión, se trató de un brote epidémico con un elevado número de casos, relacionado con el retraso en la notificación y el tiempo prolongado del estado de portador del VRS, y facilitado por fallos en el cumplimiento en la higiene de manos del personal sanitario y en las medidas de aislamiento de contacto.
La experiencia adquirida en este brote nos permite concluir que la formación de equipos multidisciplinares es esencial en el control de brotes epidémicos, pues aporta uniformidad y rapidez en la implementación de las medidas preventivas. Asimismo, consideramos que su presencia debería ser permanente en Unidades de alto riesgo, pues aporta vías de comunicación efectivas entre las Unidades implicadas en la vigilancia diaria de infecciones asociadas a la asistencia sanitaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa en congresos. Comunicación oral. «Brote nosocomial de infección por virus respiratorio sincitial en una Unidad de Neonatología». Congreso Iberoamericano de Epidemiología y Salud Pública. XXXI Reunión Científica de la Sociedad Española de Epidemiología celebrado en Granada, 4-6 de septiembre del 2013.