El tratamiento con hipotermia ha mejorado el pronóstico de los neonatos con asfixia perinatal. Ampliamente utilizado, este tratamiento ha probado ser seguro sin efectos adversos graves. No descrito en los estudios multicéntricos iniciales, el estridor se ha reportado recientemente como un efecto secundario de este tratamiento. El objetivo de este artículo es revisar la incidencia de estridor respiratorio entre los neonatos con encefalopatía hipóxico-isquémica (EHI) sometidos a tratamiento con hipotermia en nuestra unidad.
MétodosEstudio retrospectivo revisando las historias de todos los pacientes sometidos a hipotermia en nuestra unidad.
ResultadosSiete de 75 (9,3%) pacientes presentaron estridor; 3 recibieron hipotermia corporal total, 3 cerebral selectiva y un caso recibió ambas técnicas. Todos los casos requirieron aumento del soporte respiratorio.
ConclusiónDiferentes mecanismos pueden estar implicados con la aparición de estridor en los pacientes con EHI sometidos a hipotermia, en nuestra serie de casos no encontramos relación ni con el método de hipotermia activa empleado ni con la fase del tratamiento. Para intentar comprender mejor este posible efecto adverso de la hipotermia es necesario desarrollar estudios prospectivos que incluyan laringoscopia.
Hypothermia treatment has improved the prognosis of asphyxiated neonates. Widely used, it has demonstrated to be safe without severe side effects. The aim of this article is to review the incidence of stridor amongst asphyxiated newborns treated with hypothermia in our unit.
MethodsRetrospective chart review of our patients.
ResultsStridor was presented in 7/75 (9.3%) of patients during hypothermia. Three received whole body hypothermia, 3 selective cerebral, and in one case both techniques were used. All cases required increased respiratory support.
ConclusionsDifferent mechanisms may be responsible for the appearance of stridor in patients with hypoxic-ischaemic encephalopathy (HIE). In our series the incidence of stridor was similar for the two hypothermia devices. To better understand these possible side effects of hypothermia, further prospective studies (which should include laryngoscopy) are needed.
La encefalopatía hipóxico-isquémica (EHI) es una causa importante de daño neurológico en el neonato. Su incidencia en países desarrollados es de 1-2 por cada 1.000 recién nacidos vivos1.
Las consecuencias de la enfermedad hipóxico-isquémica son importantes tanto en términos de mortalidad como de morbilidad a largo plazo pues el 25% de los afectados van a presentar secuelas a largo plazo en el neurodesarrollo2. La EHI es responsable aproximadamente del 20% de casos de parálisis cerebral en la niñez3.
En la última década, la reducción de la temperatura corporal entre 3-4°C iniciada precozmente, antes de las 6 h de vida, mantenida durante 72 h aplicada de manera corporal total o cerebral selectiva ha demostrado mejorar el pronóstico de estos pacientes, disminuyendo significativamente la mortalidad y la afectación moderada o grave del neurodesarrollo a los 18, 22 y 24 meses con un NNT 6-72,4,5. Esta mejoría se ha mantenido en los estudios de seguimiento a largo plazo6,7.
Los metaanálisis realizados analizando los efectos secundarios del tratamiento con hipotermia en el ambiente controlado de una unidad de cuidados intensivos bajo la atención de un equipo entrenado y experto en el manejo de estos pacientes solo han objetivado un aumento significativo de la incidencia de bradicardia sinusal y de trombocitopenia, sin consecuencias clínicas importantes1,2,4,8.
En un estudio de seguridad con escaso número de pacientes9 se menciona que el estridor es más frecuente en los pacientes sometidos a hipotermia activa corporal total frente a pacientes con EHI sin tratamiento con hipotermia (p = 0,01) con una incidencia del 29%.
Un estudio más reciente10 comunica 5 casos de estridor en pacientes sometidos a hipotermia corporal total, lo que supone una incidencia del 9,6%.
En este trabajo revisamos los casos de estridor en nuestros pacientes con EHI tratados en hipotermia corporal total o cerebral selectiva.
Material y métodosDiseño de un estudio descriptivo retrospectivo analizando las historias clínicas de todos los pacientes ≥ 36 semanas de edad gestacional diagnosticados de encefalopatía hipóxico-isquémica sometidos a tratamiento con hipotermia activa siguiendo las recomendaciones de la Sociedad Española de Neonatología11 en nuestro centro. Nuestro principal criterio para la entrada en hipotermia activa fue el grado de encefalopatía clínica valorado por el nivel de alerta del recién nacido con antecedentes perinatales de riesgo y signos clínicos de afectación neonatal.
Se incluyó a todos los pacientes desde enero del 2010 hasta diciembre del 2014, lo que supone 71 pacientes. Los criterios de exclusión fueron malformaciones de la vía aérea o enfermedad neuromuscular primaria.
Se obtuvo la autorización del comité ético y de investigación clínica previa a la realización del estudio.
ResultadosEn nuestro centro, desde enero del 2010 hasta diciembre del 2014 recibieron tratamiento con hipotermia activa por EHI un total de 71 pacientes con edad gestacional ≥ 36 semanas; de ellos, 43 lo hicieron mediante hipotermia cerebral selectiva y 28 mediante hipotermia corporal total.
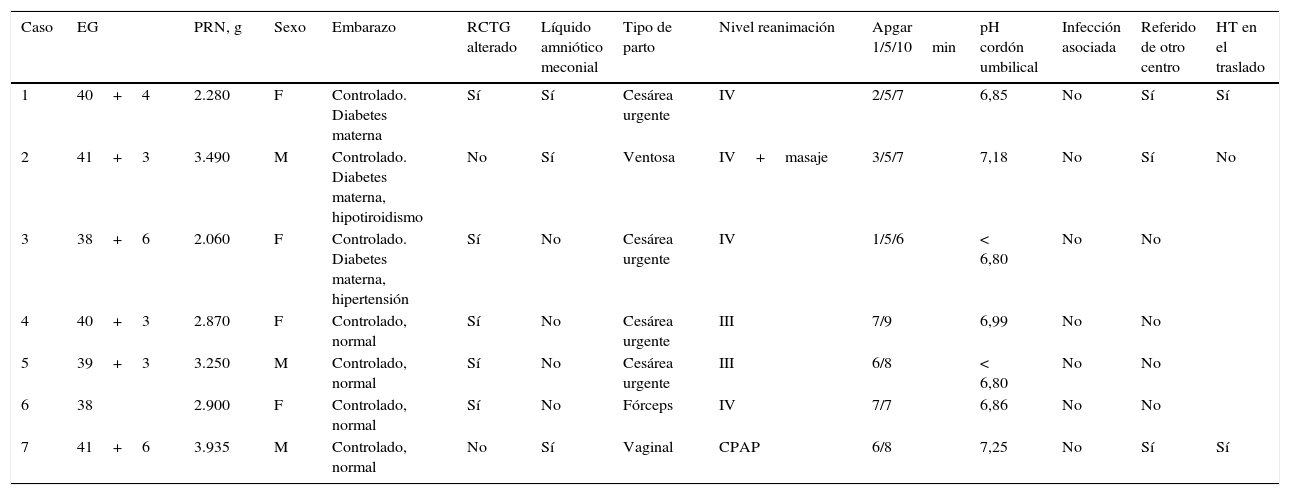
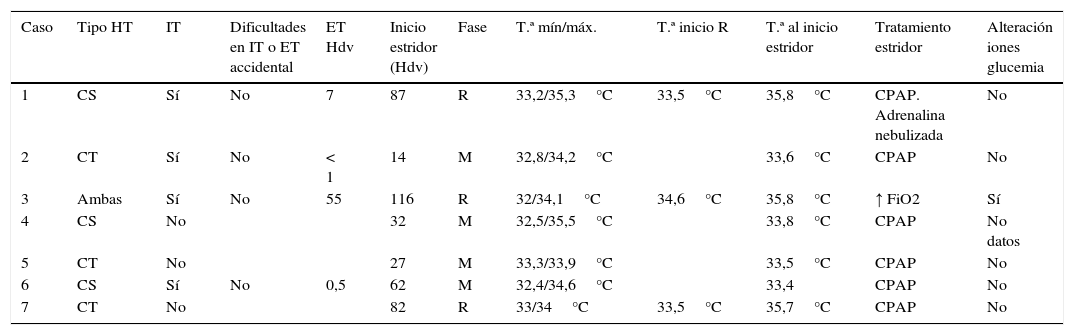
Siete recién nacidos presentaron estridor durante su ingreso, lo que supone una incidencia del 9,8%. Las características generales de los pacientes y el tratamiento con hipotermia se reflejan en las tablas 1 y 2.
Características embarazo y parto
| Caso | EG | PRN, g | Sexo | Embarazo | RCTG alterado | Líquido amniótico meconial | Tipo de parto | Nivel reanimación | Apgar 1/5/10min | pH cordón umbilical | Infección asociada | Referido de otro centro | HT en el traslado |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 40+4 | 2.280 | F | Controlado. Diabetes materna | Sí | Sí | Cesárea urgente | IV | 2/5/7 | 6,85 | No | Sí | Sí |
| 2 | 41+3 | 3.490 | M | Controlado. Diabetes materna, hipotiroidismo | No | Sí | Ventosa | IV+masaje | 3/5/7 | 7,18 | No | Sí | No |
| 3 | 38+6 | 2.060 | F | Controlado. Diabetes materna, hipertensión | Sí | No | Cesárea urgente | IV | 1/5/6 | < 6,80 | No | No | |
| 4 | 40+3 | 2.870 | F | Controlado, normal | Sí | No | Cesárea urgente | III | 7/9 | 6,99 | No | No | |
| 5 | 39+3 | 3.250 | M | Controlado, normal | Sí | No | Cesárea urgente | III | 6/8 | < 6,80 | No | No | |
| 6 | 38 | 2.900 | F | Controlado, normal | Sí | No | Fórceps | IV | 7/7 | 6,86 | No | No | |
| 7 | 41+6 | 3.935 | M | Controlado, normal | No | Sí | Vaginal | CPAP | 6/8 | 7,25 | No | Sí | Sí |
CPAP: presión positiva continua en la vía aérea; EG: edad gestacional; F: femenino; HT: hipotermia; M: masculino; PRN: peso de recién nacido en gramos; RCTG: registro cardiotocográfico.
Características estridor
| Caso | Tipo HT | IT | Dificultades en IT o ET accidental | ET Hdv | Inicio estridor (Hdv) | Fase | T.ª mín/máx. | T.ª inicio R | T.ª al inicio estridor | Tratamiento estridor | Alteración iones glucemia |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | CS | Sí | No | 7 | 87 | R | 33,2/35,3°C | 33,5°C | 35,8°C | CPAP. Adrenalina nebulizada | No |
| 2 | CT | Sí | No | < 1 | 14 | M | 32,8/34,2°C | 33,6°C | CPAP | No | |
| 3 | Ambas | Sí | No | 55 | 116 | R | 32/34,1°C | 34,6°C | 35,8°C | ↑ FiO2 | Sí |
| 4 | CS | No | 32 | M | 32,5/35,5°C | 33,8°C | CPAP | No datos | |||
| 5 | CT | No | 27 | M | 33,3/33,9°C | 33,5°C | CPAP | No | |||
| 6 | CS | Sí | No | 0,5 | 62 | M | 32,4/34,6°C | 33,4 | CPAP | No | |
| 7 | CT | No | 82 | R | 33/34°C | 33,5°C | 35,7°C | CPAP | No |
CPAP: presión positiva continua en la vía aérea; CS: cerebral selectiva; CT: corporal total; ET: extubación; FiO2: fracción de oxígeno inspirada; Hdv: horas de vida; IT: intubación; M: mantenimiento; R: recalentamiento; T.ª: temperatura.
Todos los pacientes presentaron encefalopatía moderada, excepto el caso 3, que fue grave, y el 7, con EHI leve-moderada (este caso se incluyó por afectación fundamental del nivel de alerta).
Los pacientes 4, 5 y 6, a pesar de tener puntuaciones de Apgar relativamente altas, presentaron marcadores claros de estado fetal no tranquilizador (registro cardiotocográfico alterado, pH cuero cabelludo<7) y de afectación neonatal (todos presentaron EHI clínica con alteración del nivel de alerta y pH cordón<7 o monitorización de función cerebral patológica).
El paciente 7 fue referido de otro centro por clínica de EHI moderada con antecedentes de líquido meconial y una circular de cordón aparentemente sin otros indicadores de afectación fetal o neonatal, pero importante afectación del estado de alerta que se mantuvo a la llegada a nuestro centro, por lo que se continuó la hipotermia pasiva iniciada en el hospital de referencia con hipotermia activa.
Respecto al método de hipotermia empleado en los pacientes descritos con estridor, no hubo contraindicación ni preferencia para ninguno de los 2 métodos de hipotermia (afectación sistémica importante vs. hemorragia o fractura craneal significativa), salvo la disponibilidad del equipo y la preferencia del neonatólogo de guardia.
Durante el tratamiento con hipotermia todos los pacientes recibieron cloruro mórfico como analgesia. Las características de los pacientes se recogen en las tablas 1 y 2.
Caso 1: llega a nuestro centro a las 7 h de vida con una temperatura (T.ª) rectal de 30,6°C, se realiza extubación programada a CPAP nasal bien tolerada, pudiendo retirarse a las 2 h con una fracción de oxígeno inspirada (FiO2) máxima del 21%, sin clínica de estridor. Inicia tratamiento con hipotermia cerebral selectiva a las 9 h de vida. Cumplidas las 72 h de tratamiento se inicia recalentamiento y es en esta fase cuando desarrolla estridor inspiratorio con tiraje subcostal y acidosis respiratoria que precisa inicio de soporte con CPAP nasal con FiO2 máxima de 39% y la administración de adrenalina nebulizada. Mejoría en pocas horas de la clínica de dificultad respiratoria, permitiendo disminuir FiO2 al 21% a las 9 h del inicio del cuadro y retirada de CPAP a las 31 h.
Caso 2: se traslada a nuestro centro ante la aparición de crisis convulsivas. A su llegada, a las 7 h de vida con T.ª 38° C, se objetiva EHI moderada con convulsiones, por lo que se inicia hipotermia activa corporal total. A las 6 h de inicio del tratamiento, con 14 h de vida, inicia estridor inspiratorio y dificultad respiratoria que precisa soporte con CPAP nasal FiO2 máxima de 21% durante 48 h, con desaparición posterior de la clínica respiratoria. Las crisis se trataron con levetiracetam y fenobarbital.
Caso 3: por clínica de encefalopatía severa sin afectación de tronco, inicia hipotermia activa corporal total a las 4h y 45 min de vida. Recibe tratamiento con fenobarbital y levetiracetam por crisis convulsivas. Asistencia respiratoria máxima en ventilación mecánica convencional con FiO2 21%. Se realiza extubación programada a las 55 h de vida a CPAP nasal, bien tolerada; 60 h tras la extubación (116 h de vida), y coincidiendo con la fase de recalentamiento, inicia estridor inspiratorio que precisa aumento de la oxigenoterapia en CPAP nasal máxima de 30%. La temperatura previa al inicio del estridor fue de 34,6° C y de 35,8° C en su origen, en dicho momento presentaba hipopotasemia 2,6mmol/l e hipernatremia 147mmol/l. La clínica de estridor desaparece a las 48 h. En total, y debido a las convulsiones, el paciente permaneció en hipotermia 4 días, las últimas 24 h con hipotermia cerebral selectiva por problemas técnicos con el equipo de hipotermia corporal total.
Caso 4: al ingreso, precisa ventilación no invasiva con CPAP nasal FiO2 máxima de 40% por dificultad respiratoria sin estridor que se retira a las 6 h de vida. Se mantiene en hipotermia pasiva hasta las 10 h de vida, en que se inicia hipotermia activa cerebral selectiva por crisis eléctricas que se trataron con levetiracetam. A las 32 h de vida inicia estridor inspiratorio y aumento del trabajo respiratorio que precisa reinicio de ventilación con CPAP nasal FiO2 máxima de 25%. La temperatura previa al estridor era de 33,2° C y en el momento de su inicio de 33,8° C. Desaparición del estridor en 24 h, permitiendo retirada de soporte respiratorio.
Caso 5: se traslada a la unidad desde paritorio con soporte con CPAP nasal FiO2 máxima de 30% y en hipotermia pasiva. A las 3 h y 50 min de vida, se inicia hipotermia activa. Se sustituye CPAP a las 17 h de vida por gafas nasales con FiO2 máxima de 21% bien tolerado. Recibe tratamiento desde las 12 h de vida con levetiracetam por crisis eléctricas sin correlato clínico. A las 27 h de vida, inicia clínica de estridor y dificultad respiratoria con acidosis respiratoria (pH 7,21, PCO2 67mmHg, HCO3 26,8mmol/l) que precisa reintroducir soporte con CPAP nasal FiO2 máxima de 21%, con mejoría y desaparición de la clínica en 12 h. La temperatura la hora previa al inicio del estridor fue de 33,4° C y en el momento del mismo de 33,5° C. Se realiza recalentamiento a las 72 h sin incidencias.
Caso 6: se mantiene en hipotermia pasiva desde el nacimiento, iniciando hipotermia activa a las 12 h de vida. A las 62 h de vida inicia estridor inspiratorio con trabajo respiratorio que precisa soporte con CPAP nasal FiO2 máxima de 21%. La temperatura en la hora previa al inicio del estridor fue de 33,2° C y en el momento de la clínica de 33,4° C. Presenta evolución favorable, permitiendo retirar CPAP a las 26 h de su inicio.
Caso 7: a su llegada, presenta T.ª 34,3° C, no precisa soporte respiratorio, inicia hipotermia activa a las 5h y 45 min de vida, sin complicaciones. Recalentamiento a las 72 h desde una temperatura de 33,5° C y a las 6 h con una temperatura de 35,7° C inicia estridor inspiratorio y dificultad respiratoria, por lo que precisa soporte con CPAP nasal con FiO2 21%. Evolución favorable, permitiendo retirada de soporte a las 9 h de su inicio.
DiscusiónPresentamos 7 casos de estridor en pacientes con EHI tratados con hipotermia, en esta serie de casos no hemos encontrado relación con el método de hipotermia, ya sea cerebral selectivo o corporal total, pues hemos observado 3 casos con hipotermia corporal total, 3 con cerebral selectiva y un paciente que recibió tratamiento con ambos métodos; tampoco hemos encontrado relación con el momento del tratamiento pues 3 pacientes (42,8%) presentaron estridor durante el recalentamiento y 4 (57,2%) durante el periodo de mantenimiento. Todos los casos salvo uno requirieron inicio de soporte respiratorio con ventilación no invasiva y en todos los casos la clínica se resolvió en menos de 72 h.
Aunque ninguno de nuestros pacientes precisó reintubación y ventilación mecánica, en la serie de Orme et al.10 uno de los 5 pacientes sí lo hizo.
En nuestra serie, solo 4 de los 7 pacientes (57,2%) requirieron intubación en paritorio. Todos se extubaron sin incidencias y la clínica de estridor se inició pasadas más de 13 h desde la extubación, por lo que además de la intubación previa puede haber otros mecanismos implicados en el inicio del estridor.
Los mecanismos implicados podrían ser varios. En la mucosa laríngea existen diferentes tipos de receptores (quimiorreceptores, mecanorreceptores) y es conocido que estimulan la rama interna del nervio laríngeo superior (ruta aferente), llevando la información al sistema nervioso central a través del tracto solitario y de ahí al núcleo ambiguo ipsolateral localizado en el tronco del encéfalo. Las neuronas motoras aquí localizadas, a través del nervio recurrente (ruta eferente) dan lugar a una contracción bilateral de los músculos tiroaritenoideos, que tensan el ligamento vocal dando lugar al cierre glótico. Los estímulos que pueden activar este reflejo pueden ser mecánicos, químicos12 o térmicos.
Publicaciones anteriores han relacionado, entre otros factores, la temperatura como uno de los elementos implicados en la alteración en este reflejo13,14. Incrementos de la temperatura corporal pueden ocasionar una hipersensibilidad del reflejo de cierre glótico, lo que se ha puesto en relación por varios autores como una de las posibles causas de apnea y síndrome de muerte súbita en lactantes febriles15,16.
Esto viene a confirmar hallazgos previos de receptores sensibles al frío en mucosa nasal/etmoidal, ya que este tipo de receptores han sido descritos en mucosa etmoidal de gatos17,18 y perros19.
Este mecanismo de abducción/aducción glótica es complejo y depende en gran parte del equilibrio entre la musculatura abductora (músculo cricoaritenoideo posterior) y aductora (resto de la musculatura intrínseca de la laringe). A su vez, esta musculatura depende de la inervación de la rama externa del nervio laríngeo superior y del nervio recurrente, si bien los patrones clásicos de inervación están cada vez más en entredicho y actualmente se confirma la importante variabilidad (interpersonal e incluso con diferencias entre un lado y otro de la laringe de un mismo individuo) en los aportes motores de uno y otro nervio a los distintos músculos.
La sensibilidad de la supraglotis es responsabilidad de la rama interna del nervio laríngeo superior, que penetra en la laringe a través de la membrana tirohioidea, mientras que los planos glótico y subglótico dependen del nervio recurrente.
Ensayos realizados en perros han puesto de manifiesto el efecto depresor del frío, que puede disminuir hasta en un 66% la actividad del músculo cricoaritenoideo posterior el único músculo intrínseco de la laringe abductor de las cuerdas vocales, por tanto, conlleva una disminución del espacio glótico con el consiguiente aumento de la resistencia al paso aéreo. Este músculo está inervado (principalmente) por el nervio recurrente (si bien, como ya se ha expuesto, puede recibir también inervación del laríngeo superior). Este efecto inhibidor del frío sobre el cricoartienoideo posterior desaparece tras la anestesia tópica de la mucosa supraglótica o sección del nervio laríngeo superior20, lo que lleva a pensar en la presencia de termorreceptores en la supraglotis.
Wadie et al.21, en un estudio experimental en cerdos adultos, analizan la intensidad del reflejo subglótico en distintos escenarios en función de la temperatura corporal. Su análisis concluye que la hipertermia aumenta dicho reflejo mientras que la hipotermia lo disminuye.
La temperatura, por tanto, puede ser un mecanismo fundamental implicado en el desarrollo de estridor en estos pacientes; en este sentido, es importante destacar que en el estudio realizado por Eicher et al.9, en el que la incidencia de estridor es del 29% y la ventilación de los pacientes se realiza con aire humidificado a 34° C, mientras que en nuestra serie y en la de Orme et al.10 la ventilación se realiza con aire humidificado entre 36 y 37° C, observando una incidencia de estridor menor y prácticamente idéntica del 9,8 y el 9,6%, respectivamente. Sería interesante conocer el manejo respiratorio y la incidencia de estridor en otras unidades que realizan hipotermia para evaluar la importancia real de estas diferencias.
El otro mecanismo implicado podría ser el edema de la vía área superior; algunas publicaciones sugieren que el edema extracelular que se produce durante la hipotermia podría generar una disminución del calibre de la vía aérea superior, incrementando de este modo la resistencia al flujo de aire y dando lugar a la aparición de estridor. Este efecto sería muy relevante en neonatos dado el pequeño calibre de su vía aérea, especialmente en la subglotis donde alcanza su diámetro más pequeño.
Nuestro estudio tiene en su naturaleza retrospectiva una de sus principales limitaciones; la revisión de historias puede hacer que algún caso de estridor no haya sido detectado. Otra limitación importante es la no realización de una exploración laríngea en el momento de inicio del estridor.
ConclusionesDiferentes mecanismos pueden estar implicados en la aparición de estridor en los pacientes con EHI sometidos a hipotermia; en nuestra serie de casos no encontramos relación ni con el método de hipotermia activa empleado ni con la fase del tratamiento.
Futuros estudios prospectivos con laringoscopia podrían ayudarnos a entender mejor la fisiopatología del estridor en los niños con hipotermia y permitirnos anticipar medidas de prevención y la elección del tratamiento más eficaz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.