La supervivencia de pacientes con linfoma de Hodgkin (LH) se ha incrementado en las últimas décadas. Sin embargo, el tratamiento con radioterapia (RT) y alquilantes aumenta el riesgo de desarrollo de enfermedad tiroidea a largo plazo.
MétodosSe realizó un estudio observacional y retrospectivo en un hospital de referencia para oncología pediátrica, sobre pacientes diagnosticados de LH desde 2007-2022 mediante revisión de historias clínicas del sistema «historia clínica electrónica» (HCIS). Se recogieron en Microsoft Excel® datos demográficos (edad, sexo), clínicos, radiológicos y anatomopatológicos, así como dosis de RT y alquilantes recibidas, y alteraciones tiroideas encontradas. Estos datos fueron analizados mediante el sistema estadístico SPSS® v.17, utilizando el test de Fisher para el análisis cualitativo y pruebas no paramétricas para las variables cuantitativas, así como las curvas de Kaplan-Meier.
ResultadosSe diagnosticaron 60 pacientes con LH, con una mediana de seguimiento de 78,5 meses. Se detectaron 4 casos de hipotiroidismo, 5 nódulos y un caso de hipertiroidismo subclínico. El tratamiento con RT resultó estadísticamente significativo para el desarrollo de hipotiroidismo (p=0,026), nódulos tiroideos (p=0,01) y enfermedad tiroidea total (p=0,003). Este riesgo aumenta a razón de un 8% por cada grey administrado (p=0,017; HR=1,081; IC 95%=1,014-1,152).
ConclusionesLos pacientes con LH tratados con RT presentan un mayor riesgo de desarrollo de enfermedad tiroidea a largo plazo, principalmente hipotiroidismo y neoplasias. Este riesgo aumenta cuanto mayor es la dosis recibida y mayor el tiempo de seguimiento. No se ha podido demostrar que los agentes alquilantes aumenten el riesgo de desarrollo de enfermedad tiroidea.
Survival in paediatric patients with Hodgkin lymphoma (HL) has increased over the last decades. However, these patients are at increased risk of developing late thyroid sequelae due to the treatment with irradiation and alkylating agents.
MethodsWe conducted an observational and retrospective study in patients with a diagnosis of HL between 2007 and 2022, in a hospital that is a paediatric oncology reference centre, through the review of electronic health records. We collected data on demographic (age, sex), clinical, radiological and histopathological variables, the dosage of alkylating agents and radiotherapy (RT) and on thyroid disorders using Microsoft Excel®. The data analysis was conducted with SPSS version 17, using the Fisher exact test for qualitative data, a nonparametric test for quantitative data and Kaplan-Meier curves.
ResultsSixty patients received a diagnosis of HL from 2007 to 2022. The median duration of followup was 78.5 months. There were 4 detected cases of hypothyroidism, 5 of thyroid nodules and 1 of subclinical hyperthyroidism. Treatment with RT was significantly associated with the development of hypothyroidism (P=.026), thyroid nodules (P=.01) and thyroid disease overall (P=.003). We estimated that the risk of thyroid disease increased 8-fold with each additional Grey received (hazard ratio, 1.081; 95% CI, 1.014-1.152; P=.017).
ConclusionHodgkin lymphoma patients treated with RT are at increased risk of late thyroid disorders, mainly hypothyroidism and malignancy. This risk is greater the higher the RT dosage and the longer the followup. We did not find evidence of an association between the use of alkylating agents and an increase in the risk of thyroid disease.
El linfoma de Hodgkin (LH) es la neoplasia más frecuente en adolescentes, y supone menos del 5% de los nuevos diagnósticos de cáncer en menores de 15 años1. El tratamiento se basa en el empleo de regímenes de poliquimioterapia, restringiéndose la radioterapia (RT) para aquellos pacientes de alto riesgo con escasa quimiosensibilidad. En la última década se están incorporando, además, nuevos fármacos como anticuerpos monoclonales e inhibidores checkpoint, generalmente empleados como segunda línea de tratamiento en población pediátrica. Actualmente las tasas de curación superan el 90% en pacientes con estadios localizados sin factores de riesgo y alcanzan el 60-80% en casos de enfermedad avanzada1.
Este significativo aumento de la supervivencia hace necesario el desarrollo de programas de seguimiento a largo plazo, como el que existe en el nuestro centro, referente para oncología pediátrica, con el objetivo de monitorizar posibles efectos secundarios tardíos del tratamiento, como enfermedad cardiovascular, pulmonar y músculo-esquelética, infertilidad y otros trastornos endocrinológicos o segundas neoplasias2,3.
La incidencia de alteraciones de la función tiroidea y carcinoma de tiroides es superior en supervivientes de un LH frente a la población general, pero resulta complejo cuantificar objetivamente el riesgo por la heterogeneidad e interferencia de los distintos tratamientos, así como por el pequeño tamaño muestral y corto seguimiento de los estudios previamente publicados3.
Este estudio tiene el objetivo de describir la incidencia de neoplasias y alteraciones de la función tiroidea en una cohorte retrospectiva de niños y adolescentes diagnosticados de LH clásico y tratados en un servicio de onco-hematología pediátrica de referencia nacional e internacional.
Material y métodosSe realizó un estudio observacional y retrospectivo, incluyendo los pacientes de 0-18 años diagnosticados de LH en nuestro centro (referente para oncología pediátrica), desde 2007-2022, mediante revisión de historias clínicas del sistema «historia clínica electrónica» (HCIS). Se recogieron en Microsoft Excel® datos demográficos (edad, sexo), clínicos, radiológicos y anatomopatológicos, así como dosis de RT (expresada en unidades Grey) y alquilantes recibidas (dosis equivalente de ciclofosfamida (DEC) (calculada según la fórmula publicada por Green et al.)4 y las alteraciones tiroideas encontradas. Estos datos fueron analizados mediante el sistema estadístico SPSS® v.17, utilizando el test de Fisher y la prueba de Chi-cuadrado de tendencia lineal para el análisis cualitativo y las pruebas no paramétricas para las variables cuantitativas, así como las curvas de Kaplan-Meier.
Alteraciones tiroideasDefinimos como alteraciones tiroideas las 5 siguientes: a) hipotiroidismo: analítica alterada (TSH>5,5μUI/ml, T4<0,63) y clínica; b) hipertiroidismo: analítica alterada (TSH<0,36μUI/ml, T4L>1,4ng/dl) y clínica; c) hipotiroidismo subclínico: analítica alterada (TSH>5,5μUI/ml, T4L y T3L en rango normal) y ausencia de síntomas compatibles; d) hipertiroidismo subclínico (TSH<0,36μUI/ml o indetectable y T4L y T3L en rango normal) y ausencia de síntomas; y e) nódulos tiroideos: detectados mediante ecografía.
Se elaboraron tablas de contingencia, agrupando las 5 alteraciones en 3 grupos: hipotiroidismo total (hipotiroidismo clínico + hipotiroidismo subclínico), hipertiroidismo total (hipertiroidismo clínico + hipertiroidismo subclínico) y nódulo. Se asociaron estas variables con las variables RT, agentes alquilantes y la suma de ambos tratamientos.
Consideraciones éticasEste proyecto se diseñó y realizó de acuerdo con las recomendaciones establecidas por el Código Internacional de Ética Médica y la Declaración de Helsinki. Todos los datos de carácter personal de los sujetos participantes se trataron de manera estrictamente confidencial, de acuerdo con la normativa de protección de datos vigente, Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y Garantía de los Derechos Digitales y el Reglamento (UE) 2016/679 del Parlamento Europeo. Los datos recogidos en el estudio pertenecían a la historia clínica del paciente y fueron identificados mediante un código numérico y recogidos en un fichero de investigación del centro. Para la realización del trabajo, no se precisó contacto directo con los pacientes y todos los datos se recogieron de forma retrospectiva con un periodo de estudio de 15 años, por lo que se solicitó la exención al consentimiento tal como recoge la legislación vigente. Este proyecto fue aprobado por el Comité de Ética de la Investigación con Medicamentos de nuestro centro (código R-0089/22, 31 de enero de 2023).
ResultadosSe diagnosticaron 62 casos de LH en nuestro centro en el período de estudio. De estos, 2 se excluyeron por no disponer de datos en relación con el esquema terapéutico administrado. De los 60 casos incluidos en el análisis, 31 eran varones y 29 mujeres, con una mediana de edad al diagnóstico de 13,6 años (P25 11.5-P75 15.6). Los estadios y variantes de LH de los pacientes al diagnóstico, así como los tratamientos recibidos y alteraciones endocrinas detectadas se reflejan en la tabla 1.
Resumen de la analítica descriptiva
| Variables | Frecuencia: N (%) |
|---|---|
| Número de pacientes | 60 (100) |
| Sexo | |
| Varón | 31 (51,7) |
| Variante LH | |
| NOS | 7 (11,7) |
| Esclerosis nodular | 45 (75) |
| Celularidad mixta | 6 (10) |
| Rico en linfocitos | 1 (1,7) |
| Predominio linfocitario | 1 (1,7) |
| Estadio | |
| I | 1 (1,7) |
| II | 31 (51,7) |
| III | 12 (20) |
| IV | 16 (26,7) |
| Línea de tratamiento | |
| 1.ª línea | 54 (90) |
| 2.ª línea | 3 (5) |
| Desconocida | 3 (5) |
| Protocolo | |
| SEOP-EH-01 | 1 (1,7) |
| SEOP-EH-03 | 3 (5) |
| EuroNet-PHL-C1 | 15 (25) |
| EuroNet-PHL-C1 interim | 15 (25) |
| EuroNet-PHL-C2 | 17 (28,3) |
| EuroNet-PHL-C2 interim | 5 (8,3) |
| Otros | 4 (6,7) |
| QT con alquilante | 50 (83,3) |
| RT | 25 (41,7) |
| Bocio | 1 (1,7) |
| Alteración analítica y/o ecográfica | 9 (15) |
| Alteración genética/AF | 2 (3,3) |
AF: antecedentes familiares de enfermedad tiroidea; EuroNet PHL-C1: primer estudio internacional intergrupo para el linfoma de Hodgkin clásico en niños y adolescentes; EuroNet-PHL-C2: segundo estudio internacional intergrupo para el linfoma de Hodgkin clásico en niños y adolescentes; LH: linfoma de Hodgkin; NOS: variante no especificada; QT: quimioterapia; RT: radioterapia; SEOP-EH: protocolo para el tratamiento de la enfermedad de Hodgkin de la Sociedad Española de Oncología Pediátrica.
De los 60 pacientes incluidos en el estudio, 54 recibieron tratamiento de primera línea basado en el protocolo vigente en cada período (SEOP-EH-01, SEOP-EH-03, Euronet-PHL-C1, Euronet-PHL-C1 interim, Euronet-PHL-C2, Euronet-PHL-C2 interim) (tabla 2), mientras que 3 pacientes recibieron esquemas de quimioterapia y/o RT fuera de protocolo. Tres casos fueron remitidos a nuestro centro para recibir una segunda línea de tratamiento. Un 16,6% (10/60) de pacientes recayeron durante su seguimiento en nuestro centro y requirieron un tratamiento de 2.a línea. De estos, un 70% (7/10) se sometieron a un trasplante autólogo de sangre periférica (TASPE). En total 3/60 pacientes (5%) han fallecido durante su seguimiento: uno por complicaciones infecciosas durante el tratamiento de primera línea, otro por complicaciones infecciosas durante el acondicionamiento pretrasplante, y finalmente otro tras el TASPE.
Tratamientos quimioterápicos
| Protocolo | Grupo de tratamiento | Quimioterapia | Tipos de agentes alquilantes |
|---|---|---|---|
| SEOP-EH-01 | OPPA+COPP | Ciclofosfamida, procarbazina | |
| SEOP-EH-03 | OPPA/OEPA+COPP | Ciclofosfamida, procarbazina | |
| EuroNet PHL-C1 | TG-1 | OEPA | 0 |
| EuroNet PHL-C1 | TG-2 | OEPA+COPP/COPDAC | Ciclofosfamida, dacarbazina |
| EuroNet PHL-C1 | TG-3 | OEPA+COPDAC±ABVD | Ciclofosfamida, dacarbazina |
| EuroNet PHL-C1 Interim | TG-1 | OEPA | 0 |
| EuroNet PHL-C1 Interim | TG-2, TG-3 | COPDAC±OEPA | Ciclofosfamida, dacarbazina |
| EuroNet PHL-C2 | TL-1 | COPDAC+OEPA | Ciclofosfamida, dacarbazina |
| EuroNet PHL-C2 | TL-2 | DECOPDAC+OEPA | Ciclofosfamida, dacarbazina |
| EuroNet PHL-C2 | TL-3 | COPDAC+OEPA | Ciclofosfamida, dacarbazina |
| EuroNet PHL-C2 Interim | TL-1, TL-2 | COPDAC/DECOPDAC+OEPA±GEV±bendamustina | Ciclofosfamida, dacarbazina |
| Otros | ABVD/DHAP/BEACOPP/IGEV | Ciclofosfamida (BEACOPP) | |
| BEAM | Melfalán |
ABVD: adriamicina, bleomicina, vinblastina, etopósido, prednisona, ciclofosfamoda; BEACOPP: bleomicina, etopósido, adriamicina, ciclofosfamida, vincristina, procarbazina, prednisona; BEAM: carmustina, citarabina, melfalán, etopósido; COPDAC: ciclofosfamida, vincristina, prednisona, dacarbazina; COPP: ciclofosfamida, vincristina, procarbacina, prednisona; DECOPDAC: adriamicina (doxorrubicina), etopósido, ciclofosfamida, vincristina, prednisona, dacarbacina; DHAP: dexametasona, cisplatino, citarabina; EuroNet PHL-C1: primer estudio internacional intergrupo para el linfoma de Hodgkin clásico en niños y adolescentes; EuroNet PHL-C2: segundo estudio internacional intergrupo para el linfoma de Hodgkin clásico en niños y adolescentes; IGEV: ifosfamida, gemcitabina, vinorelbina; OEPA: vincristina, prednisona, etopósido, adriamicina; OPPA: vincristina, prednisona, procarbacina, adriamicina; SEOP-EH: protocolo para el tratamiento de la enfermedad de Hodgkin de la Sociedad Española de Oncología Pediátrica.
El 83% (50/60) de los pacientes recibió tratamiento con alquilantes, siendo la mediana de DEC de 4.971mg/m2 (P25 3.685,5-P75 7.452,94mg/m2). En total, el 41,6% (25/60) de los pacientes recibieron RT de cabeza y cuello, con una mediana de dosis de 25Gy (P25 19,8-P75 29,8Gy), y un 35% (21/60) recibieron tratamiento alquilante y RT (tablas 1 y 3).
Tras una mediana de 78,5 meses de seguimiento (P25 42,5-P75 113,75), se diagnosticaron alteraciones tiroideas en el 16,7% de los pacientes: 3,3% desarrolló hipotiroidismo, 3,3% hipotiroidismo subclínico, 1,7% hipertiroidismo subclínico y 8,3% nódulos tiroideos, de los cuales 4/5 fueron de etiología maligna (carcinoma papilar de tiroides). Solo uno de los pacientes con nódulos tiroideo presentaba además hipotiroidismo subclínico.
De los 50 pacientes que recibieron alquilantes, el 12% (6/50) desarrolló alteraciones tiroideas, con una mediana de 5.771mg/m2 (P25 3.299,81-P75 15.824,72mg/m2). Los pacientes sin enfermedad tiroidea recibieron una mediana de 4.378,25mg/m2 (P25 3.685,5-P75 7.616,81mg/m2), sin diferencias estadísticamente significativas entre ambos grupos (p=0,763) (tabla 3).
Medianas de dosis de tratamiento recibidas
| Tratamiento | Total | Con alteración tiroidea | Sin alteración tiroidea | Valor de p |
|---|---|---|---|---|
| Radioterapia (Gy) | 25,0 (19,8-29,8) | 29,8 (19,8-29,8) | 20,0 (19,8-29,8) | 0,577 |
| Dosis: mediana (RIQ) | ||||
| Agente alquilante (mg/m2) | 4.971 (3.685,5-7452,94) | 5.771 (3.299,81-15.824,72) | 4.378,25 (3.685,5-7.616,81) | 0,763 |
| Dosis: mediana (RIQ) |
RIQ: rango intercuartílico.
De los 25 pacientes que recibieron RT, un 32% (8/25) desarrolló alteraciones tiroideas, habiendo recibido una mediana de 29,8Gy (P25 19,8-P75 29,8Gy). Entre los pacientes sin enfermedad tiroidea, la mediana de dosis de RT fue de 20Gy (P25 19,8-P75 29,8Gy) (tabla 3). No se observaron diferencias estadísticamente significativas con respecto al desarrollo de enfermedad tiroidea en función de la dosis de RT recibida (p=0,577).
Se realizó un análisis exploratorio de la frecuencia observada de complicaciones tiroideas en función del tratamiento recibido: alquilantes, RT y aquilantes más RT, sin que se observasen diferencias significativas entre dichas frecuencias. A continuación, se clasificaron los tratamientos recibidos en 4 grupos ordenados por su frecuencia de eventos tiroideos, obtenidos del análisis anterior. Estos grupos se ordenaron de menor a mayor frecuencia: otros tratamientos (sin RT ni alquilantes), solo alquilantes, alquilantes más RT y solo RT. En la tabla 4 se muestran los resultados obtenidos. Con el fin de disponer de resultados más homogéneos en este análisis, no se contabilizó el único caso con hipertiroidismo.
Tendencia en la frecuencia de enfermedad tiroidea en función del tratamiento recibido. No se incluye el caso con hipertiroidismo
| QT sin agentes alquilantes (n=6) | Solo agentes alquilantes (n=28) | Agentes alquilantes + RT (n=21) | Solo RT (n=4) | Chi-cuadrado | ||
|---|---|---|---|---|---|---|
| Valor de p | Tendencia (valor de p) | |||||
| Nódulos (n=5) | 0 (0%) | 0 (0%) | 2 (9,5%) | 3 (75%) | <0,001 | <0,001 |
| Hipotiroidismo (n=4) | 0 (0%) | 0 (0%) | 3 (14,3%) | 1 (25,0%) | 0,092 | 0,020 |
| Alt. tiroidea total (n=8) | 0 (0%) | 0 (0%) | 5 (23,8%) | 3 (75%) | <0,001 | <0,001 |
Total de pacientes incluidos: 59.
QT: quimioterapia; RT: radioterapia.
Se observa en esta tabla que, tanto en la enfermedad de nódulos tiroideos como en la alteración tiroidea total, se obtuvo una p de tendencia significativa (p<0,001), mientras que en el hipotiroidismo no alcanzó la significación estadística. Estos datos muestran así que el uso de la RT aumenta la probabilidad de la presentación de estas complicaciones en mayor medida que los agentes alquilantes solos o incluso acompañados de RT.
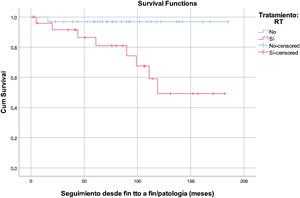
En el análisis multivariante, la RT supone un factor de riesgo para el desarrollo de alteraciones tiroideas, incrementándose dicho riesgo al aumentar el tiempo de seguimiento (p=0,028, un HR=10,246 y un IC 95%=1,279-82,056). Se estimó que cada Grey administrado supone un 8% de incremento del riesgo (p=0,017, HR=1,081, IC 95%=1,014-1,152) (fig. 1).
Finalmente, no se encontraron diferencias estadísticamente significativas en el desarrollo de neoplasias tiroidea en función del sexo y la edad al inicio del tratamiento (p=0,792 y p=0,191, respectivamente).
DiscusiónEn las últimas décadas, los avances tanto diagnósticos como terapéuticos de los pacientes con LH han favorecido el aumento de las tasas de supervivencia. Junto con este aumento de la supervivencia, se ha observado un número considerable de secuelas a largo plazo que ha propiciado un interés, cada vez mayor, en el desarrollo de estrategias de seguimiento óptimo5,6. Hay que tener en cuenta que las secuelas tiroideas, tanto de disfunción como neoplasias, pueden incluso manifestarse décadas después, y suelen ir acompañadas de una clínica indolente e inespecífica7,8.
HipotiroidismoEn nuestro estudio se detectaron un 16,7% de alteraciones tiroideas totales, tanto ecográficas como analíticas. De estas alteraciones, un 6,7% fueron casos de hipotiroidismo (clínico y subclínico). El hipotiroidismo es la secuela tiroidea descrita con más frecuencia en pacientes supervivientes de LH infantil9. En algunos estudios se describen cifras de hasta el 60%, dependiendo de la población estudiada y los criterios empleados para definirlo5. Nuestro porcentaje de casos, considerablemente menor, se debe probablemente al reducido número de pacientes en comparación con la mayoría de los estudios y al menor tiempo de seguimiento.
Se ha encontrado una asociación estadísticamente significativa entre el uso de RT y la aparición de hipotiroidismo. La RT en el cuello es el principal factor de riesgo para el desarrollo de hipotiroidismo en pacientes oncológicos, y este suele aparecer con una prevalencia de en torno al 30% en la mayoría de los estudios, en los 10 años siguientes al fin de la RT5. Sin embargo, el riesgo de hipotiroidismo radioinducido permanece elevado incluso pasados 25 años tras la exposición a la RT10. Además, se ha observado que el desarrollo de hipotiroidismo guarda una relación dosis/respuesta con la RT recibida9. Aunque en este estudio no se han hallado diferencias estadísticamente significativas entre las dosis de RT del grupo que no desarrolló alteración tiroidea frente a los que sí la desarrollaron, el impacto del uso de RT en el desarrollo de secuelas tiroideas es fuerte, y considerable en el desarrollo de hipotiroidismo. Teniendo en cuenta las limitaciones que supone el reducido tamaño muestral del que se dispone, que estas asociaciones resulten estadísticamente significativas refuerza el papel de la RT como agente causal de daño tiroideo. La mediana de dosis de RT recibida en los pacientes con alteraciones tiroideas fue de 29,8Gy. En el estudio de Sklar et al., se identificó una prevalencia del 30% de hipotiroidismo asociado a dosis de 30-45Gy, y hasta un 50% si la dosis superaba los 45Gy. Además, en estos últimos, el riesgo de desarrollo hipotiroidismo a los 20 años del diagnóstico fue del 50%4. Duarte et al. identificaron que una dosis de RT que superase los 35Gy tenía un impacto marcado (p<0,01) en el desarrollo de hipotiroidismo. En este mismo estudio, se postula que el riesgo es mayor en pacientes que reciben RT craneoespinal y cervical frente a aquellos que reciben RT total body11, en contraposición a Madanat et al. que afirman que no existen diferencias entre los distintos campos de irradiación12. También se conoce el papel beneficioso de la RT hiperfraccionada frente a la RT convencional, así como el uso de protones en lugar de fotones para minimizar la dosis de escape que puede causar daños a otros niveles8. Otros factores de riesgo que influyen en el desarrollo de hipotiroidismo secundario a RT son la edad a la exposición, dosis de RT, tiempo de exposición y tiempo transcurrido desde el final del tratamiento8,10.
La correlación entre el uso de alquilantes y la aparición de hipotiroidismo no resultó estadísticamente significativa en nuestro estudio (p=0,528). Existen escasos trabajos que apoyan esta hipótesis. Uno de ellos, un proyecto del Childhood Cancer Survivor Study, atribuyó un 9,4% de casos de hipotiroidismo total al uso de bleomicina y alquilantes (ciclofosfamida y CCNU)10. Sin embargo, el papel de la QT como agente causal es bastante controvertido y, por el momento, se disponen de pocos datos que lo avalen5,13.
Nódulos tiroideosDe los cinco nódulos encontrados en nuestra serie, 4 fueron diagnosticados como carcinoma papilar de tiroides tras realizar PAAF. Al igual que en el hipotiroidismo, la RT también supone un factor de riesgo para el desarrollo de neoplasias tiroideas, tanto benignas como malignas. En pacientes pediátricos resulta aún más lesiva, pues los niños menores de 5-10 años son más sensibles a los efectos nocivos de la radiación14-16. El cáncer de tiroides, especialmente su variante papilar, es una de las neoplasias malignas secundarias más frecuentemente diagnosticadas en supervivientes de cáncer infantil17. En general, el periodo de latencia desde el diagnóstico del cáncer primario hasta la aparición de estas segundas neoplasias varía ampliamente en la literatura18, pudiendo darse en los 4 años siguientes al final de tratamiento6 o incluso 20 años después17. Y, aunque el incremento de riesgo disminuye gradualmente conforme pasa el tiempo, nunca llega a igualarse al de la población general19.
En nuestra serie, encontramos una relación estadísticamente significativa entre el uso de RT y la aparición de nódulos tiroideos (p=0,01). Está descrito que cualquier dosis de radiación supone un incremento de riesgo de desarrollo de neoplasia8, sin embargo, parece que al llegar a los 20Gy aproximadamente, se da un efecto downturn. Esta hipótesis sugiere que cuanto mayor es la dosis de RT a la que se expone el parénquima glandular tiroideo, mayor es el efecto citolítico directo y, por tanto, menor el número de células viables remanentes que en el futuro puedan sufrir transformación maligna8,20,21. Sin embargo en nuestra serie, todos los pacientes que desarrollaron cáncer de tiroides recibieron una mediana de dosis de RT de 29,8Gy.
Respecto a la edad y al sexo, y su relación con la aparición de neoplasias tiroideas, no se encontraron diferencias estadísticamente significativas. Sin embargo, en un estudio realizado con pacientes supervivientes de LH con neoplasia secundaria de tiroides, se detectó que aquellos pacientes irradiados a una menor edad y las pacientes de sexo femenino tenían un mayor riesgo22. En otro estudio más reciente, el análisis multivariante reflejó el impacto de la edad menor de 20 años (p=0,032) y el sexo femenino (p=0,016) en el desarrollo de cáncer secundario11. La discordancia de nuestros resultados con la línea general que se observa en la literatura se debe muy probablemente a la limitación que supone nuestro reducido tamaño muestral y poco tiempo de seguimiento.
El papel de los alquilantes en el desarrollo de neoplasias, al igual que sucede con el hipotiroidismo, no es del todo conocido. En un estudio del Childhood Cancer Survivor Study, se detectaron 119 casos de cáncer de tiroides en una cohorte de 12.547 pacientes, con una media de seguimiento de 5 años. Se halló relación estadísticamente significativa entre los pacientes con cáncer de tiroides y el tratamiento concomitante de RT (a dosis <20Gy) y alquilantes (RR=4,7; IC 95%=1,5-15; p=0,04)23. De los 5 casos de nódulos tiroideos de nuestra serie, todos recibieron RT y 3 de ellos no recibieron quimioterapia con alquilantes. Dado el escaso tamaño muestral de nuestra serie (5 pacientes con nódulos y 8 con alteraciones tiroideas totales), no podemos establecer una relación causa efecto entre el desarrollo de esta enfermedad y el uso de agentes alquilantes.
Debido al escaso número de pacientes con cáncer papilar de tiroides encontrados en nuestra serie, no se ha podido estudiar su correlación con alteraciones analíticas.
HipertiroidismoÚnicamente se detectó un caso de hipertiroidismo (subclínico), con una frecuencia del 1,7% (hipertiroidismo clínico + hipertiroidismo subclínico) en nuestros pacientes. De todas las alteraciones tiroideas, el hipertiroidismo es la más infrecuente5 y, generalmente, este suele cursar de modo subclínico. Además, puede tratarse de una secuela transitoria debida a cierto nivel de tirotoxicosis por el daño directo de la RT, que luego se normaliza8. Por este motivo se recomienda evaluar la función tiroidea dejando un margen de meses tras la finalizar el tratamiento para evitar sesgos por la tiroiditis inmediata que se produce11.
Enfermedad tiroidea totalRespecto al desarrollo general de alteraciones tiroideas, se ha podido observar que existe una asociación robusta entre el uso de RT y la aparición de las mismas (p=0,003). El análisis multivariante también mostró significación estadística (p=0,028) y, a pesar de que el IC 95% (1,279-82,056) es amplio por la dispersión de los pocos datos de los que disponemos, esta asociación sugiere consistencia. Además de existir esta asociación por la presencia o ausencia de RT, hemos estimado que, por cada unidad Gy, el riesgo de desarrollar enfermedad tiroidea aumenta un 8% (p=0,017; HR=1,081; IC 95%=1,014-1,152). Estos datos concuerdan con lo descrito por otros autores como Steven et al., que definen un aumento del riesgo relativo de desarrollo de hipotiroidismo en un 1,06 por cada grey administrado (p=0,000001).
Seguimiento y screening a largo plazoTeniendo en cuenta todo lo expuesto, es preciso mencionar la importancia de la vigilancia estrecha y el seguimiento en estos pacientes. El número de supervivientes de LH cada vez es mayor, y la variedad de secuelas y su afectación a múltiples niveles requieren estrategias cuyo abordaje sea multidisciplinar24. Los hallazgos observados en este estudio y la literatura que lo acompaña sugieren que el riesgo de alteraciones tiroideas en supervivientes de LH pediátrico aumenta de forma consistente en el tiempo. La incidencia acumulada del cáncer de tiroides continúa creciendo incluso 30 años después del diagnóstico del cáncer primario25 y, a pesar de que estas segundas neoplasias radioinducidas no son aparentemente más agresivas que las esporádicas, conviene llevar a cabo un cribado y seguimiento adecuados26. Las sociedades endocrinológicas son partidarias de realizar una ecografía de rutina en pacientes con antecedente de tratamiento con RT5, mientras que otros sostienen que la palpación y el examen físico son suficientes, y reducen los costes derivados y el posible malestar psicológico asociado a una prueba diagnóstica8. Un seguimiento estrecho a largo plazo de los pacientes supervivientes de LH es necesario para detectar a tiempo alteraciones tiroideas que puedan comprometer su vida.
Las principales limitaciones que presenta este estudio son el reducido tamaño muestral y su carácter retrospectivo. El tiempo de seguimiento, escaso en comparación con otros estudios, también supone un impedimento.
ConclusionesLos pacientes supervivientes de LH presentan un porcentaje no desdeñable de enfermedad tiroidea. Las secuelas tiroideas más frecuentes son el hipotiroidismo y la enfermedad neoplásica.
El tratamiento con RT ha demostrado ser un factor causal de enfermedad tiroidea, aumentando el riesgo de su desarrollo con el paso del tiempo y la dosis recibida.
No se ha podido demostrar que el uso de alquilantes, asociado o no a RT, aumente el riesgo de desarrollo de enfermedad tiroidea. Serían necesarios estudios con un mayor número de pacientes para demostrar si existe o no asociación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Me gustaría agradecer el interés, atención y dedicación de todos los autores que han participado en la elaboración de este artículo, destacando el trabajo de la Dra. Paloma Conejero González, la implicación docente de la Dra. Maitane Andión y el estudio estadístico de D. Alberto Martín Vega.