Determinar las alteraciones de la función pulmonar en niños tras un trasplante de progenitores hematopoyéticos. Comparar dichas alteraciones tras realizar un trasplante autólogo y un trasplante alogénico.
Pacientes y métodosEstudio observacional, prospectivo, desde 1996 hasta 2005. Se realizó un test de función pulmonar a 93 niños sometidos a trasplante, 47 con trasplante autólogo y 46 con trasplante alogénico, antes del trasplante y a los 2, 6, 12 y 24 meses posteriores a éste. Se determinaron las alteraciones en el volumen espiratorio forzado en un segundo (FEV1), FEV1/capacidad vital forzada (FCV), capacidad pulmonar total (TLC) y capacidad de difusión (DLCO). Se realizó un análisis estadístico de los datos mediante comparación de medias de datos relacionados.
ResultadosAntes de la realización del trasplante, el 6,8 % de los pacientes presentó FEV1 inferior al 80 %, el 1% presentó FEV1/FVC inferior al 80 %, el 7,8 % tuvo TLC inferior al 80% y el 13,5% presentó una alteración aislada de la DLCO. Todos los parámetros empeoraron tras el trasplante, y dicho empeoramiento fue máximo a los 2 y a los 6 meses posteriores al trasplante. A los 6 meses, el 8% de los niños presentó FEV1/FVC inferior al 80 %, un 25% presentó TLC inferior al 80 % y otro 13 % DLCO inferior al 70 % con el resto de los parámetros normales. A partir de los 6 meses la función pulmonar mejoró, pero a los 2 años no había llegado al punto inicial. Fueron estadísticamente significativos el descenso de FEV1/FVC a los 2 meses (p _ 0,05), de TLC a los 2 meses (p _ 0,011) y DLCO a los 2meses (p < 0,001). No se encontraron diferencias significativas entre trasplantes autólogos y alogénicos salvo por FEV1/FVC, más alterado en el grupo de pacientes sometidos a trasplantes alogénicos a los 6 meses (p _ 0,02).
ConclusionesTras el trasplante de progenitores se producen importantes alteraciones de la función pulmonar, sobre todo en los primeros 2 meses posteriores al trasplante, con una mejoría posterior a partir de los 6 meses, que no alcanza los valores previos.
To evaluate lung function abnormalities in children who underwent haematopoietic stem cell transplantation (HSCT) and to compare these abnormalities between autologous and allogenic transplantation.
Patients and methodsProspective observational study from 1996 to 2005. Ninety-three children receiving HSCT, 47 autologous and 46 allogenic, were included. Lung function tests were performed before transplantation and at 2, 6, 12 and 24 months afterwards. The following indices were determined: forced expiratory volume in 1 s (FEV1), FEV1/ forced vital capacity (FVC), total lung capacity (TLC), and carbon monoxide diffusing capacity (DLCO). Paired Student's t-test was used for statistical analysis of data.
ResultsBefore HSCT, 6,8% of the children had FEV1 < 80 %, 1% FEV1/FVC < 80 %, 7,8% TLC < 80 % and 13.5% DLCO < 70%. At 2 months, FEV1/FVC, TLC and DLCO were significantly reduced, when compared to pre-transplantation values (p _ 0.05, 0.011 and p < 0.001, respectively). Lung function gradually improved from 6 months post-transplantation, but did not reach pre-transplantation values at 24 months. No significant differences were found when comparing allogenic and autologous transplantation, apart from a lower FEV1/ FVC value at 6 months (p _ 0.02) in the first group.
ConclusionsAn important proportion of children who undergo HSCT have early pulmonary abnormalities (at 2 and 6 months after transplantation) with partial recovery at 24 months.
El trasplante de progenitores hematopoyéticos es un procedimiento terapéutico indicado en un número cada vez mayor de enfermedades, tanto neoplásicas como no neoplásicas1. Cada vez es mayor el número de niños que tras un trasplante, bien autólogo o bien alogénico, sobreviven muchos años, y en los que cobran gran importancia las posibles secuelas de aquél. El pulmón es el órgano diana de una gran morbimortalidad relacionada con este procedimiento2–5. Entre las secuelas que pueden afectarle destacan las alteraciones de la función pulmonar5,6, que pueden condicionar la vida de los supervivientes al trasplante. La bibliografía sobre el tema describe alteraciones tanto restrictivas como obstructivas6–8; sin embargo, las publicaciones son escasas y sobre un número pequeño de pacientes pediátricos.
El objetivo de este trabajo ha sido estudiar la evolución de la función pulmonar en un grupo amplio de niños sometidos a trasplantes, determinando las alteraciones que se produjeron, y comparando las diferencias entre el trasplante autólogo y el trasplante alogénico.
PACIENTES Y MÉTODOSPacientesSe incluyeron los niños capaces de colaborar en los estudios de función pulmonar, que habían sido sometidos a un trasplante de progenitores hematopoyéticos en el Hospital Universitario Niño Jesús, desde enero de 1996 hasta diciembre de 2005. Fueron incluidos 93 pacientes mayores de 5 años con una situación clínica estable que permitió la realización de las pruebas.
Los datos se recogieron de forma prospectiva desde el año 1996 hasta el año 2005, y se había incorporado al protocolo de trasplante la realización de pruebas de función pulmonar antes del trasplante y de forma seriada en la evolución posterior a éste.
La muestra presentaba una distribución por sexos similar: el 49 % niños y el 51 % niñas, y una edad media de 9 años (rango, 5–17).
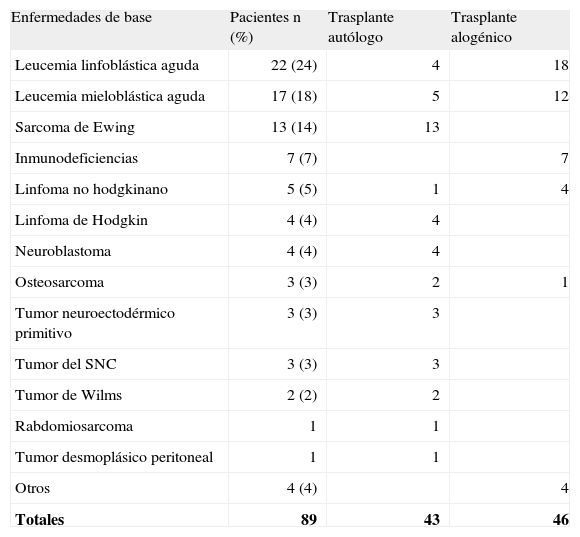
En la tabla 1 se recogen las enfermedades de base de los pacientes. La mayoría presentaba un cuadro tumoral linfoide, en segundo lugar mieloide y, en tercer lugar, tumores sólidos. El número de trasplantes autólogos y alogénicos fue similar (47 y 46, respectivamente).
Enfermedades de base de los pacientes y tipo de trasplante
| Enfermedades de base | Pacientes n (%) | Trasplante autólogo | Trasplante alogénico |
| Leucemia linfoblástica aguda | 22 (24) | 4 | 18 |
| Leucemia mieloblástica aguda | 17 (18) | 5 | 12 |
| Sarcoma de Ewing | 13 (14) | 13 | |
| Inmunodeficiencias | 7 (7) | 7 | |
| Linfoma no hodgkinano | 5 (5) | 1 | 4 |
| Linfoma de Hodgkin | 4 (4) | 4 | |
| Neuroblastoma | 4 (4) | 4 | |
| Osteosarcoma | 3 (3) | 2 | 1 |
| Tumor neuroectodérmico primitivo | 3 (3) | 3 | |
| Tumor del SNC | 3 (3) | 3 | |
| Tumor de Wilms | 2 (2) | 2 | |
| Rabdomiosarcoma | 1 | 1 | |
| Tumor desmoplásico peritoneal | 1 | 1 | |
| Otros | 4 (4) | 4 | |
| Totales | 89 | 43 | 46 |
SNC: sistema nervioso central.
Los pacientes recibieron acondicionamiento previo al trasplante mediante quimioterápicos. Ninguno recibió irradiación corporal total. Como fármacos principales se administraron busulfan y ciclofosfamida, en el caso de los trasplantes alogénicos, y busulfán y melfalán para el trasplante autólogo.
Estudio de función pulmonarSe realizaron espirometría, pletismografía y test de difusión mediante el método de respiración única con un Master Screen Jaeger®, E. Jaeger GMBH Würzburg, Alemania, siguiendo recomendaciones ERS/ATS9–11. Las mediciones se realizaron antes del trasplante y a los 2, 6, 12 y 24 meses tras el procedimiento.
Los valores se expresaron como porcentaje sobre el valor esperable para la edad, peso y talla, publicado por Zapletal12.
Las alteraciones de la función pulmonar se agruparon en tres patrones según la normativa del American College of Chest Physicians y la SEPAR13: a) patrón restrictivo, disminución de la TLC por debajo del 80 %; b) patrón obstructivo, disminución del índice de FEV1/FVC por debajo del 80 %, y c) alteración aislada de la capacidad de difusión del CO, disminución del DLCO por debajo del 70% sin ninguna otra alteración añadida.
Análisis estadísticoSe utilizó para el análisis estadístico el programa SPSS versión 11.0.3.
Se estudiaron la función pulmonar previa al trasplante y la existencia de alteraciones posteriores tanto para la muestra total de pacientes como por separado para trasplantes alogénicos y autólogos. Mediante comparación de medias para muestras relacionadas, con el test de la t de Student se comprobó si en el conjunto de los niños se produjeron cambios respecto a la situación basal en la función pulmonar a los 2, 6, 12 y 24 meses posteriores al trasplante. Se consideró significativa la diferencia para p < 0,05. Seguidamente se repitió el procedimiento para el grupo sometido a trasplante alogénico y para el sometido a trasplante autólogo por separado; al disminuir el tamaño de la muestra se comprobó la normalidad de la serie mediante el test de Kolmogorov-Smirnov y, en caso de no poder asegurarse la distribución normal, se utilizó el test de Wilcoxon, considerándose significativa la diferencia para z < 0,05.
Por último, se compararon las diferencias en FEV1/FVC, TLC y DLCO a lo largo del tiempo entre el grupo de alogénicos y de autólogos, mediante la comparación de medias para datos independientes (t de Student o U de Mann–Whitney según se comprobara la normalidad o no mediante el test de Kolmogorov-Smirnov).
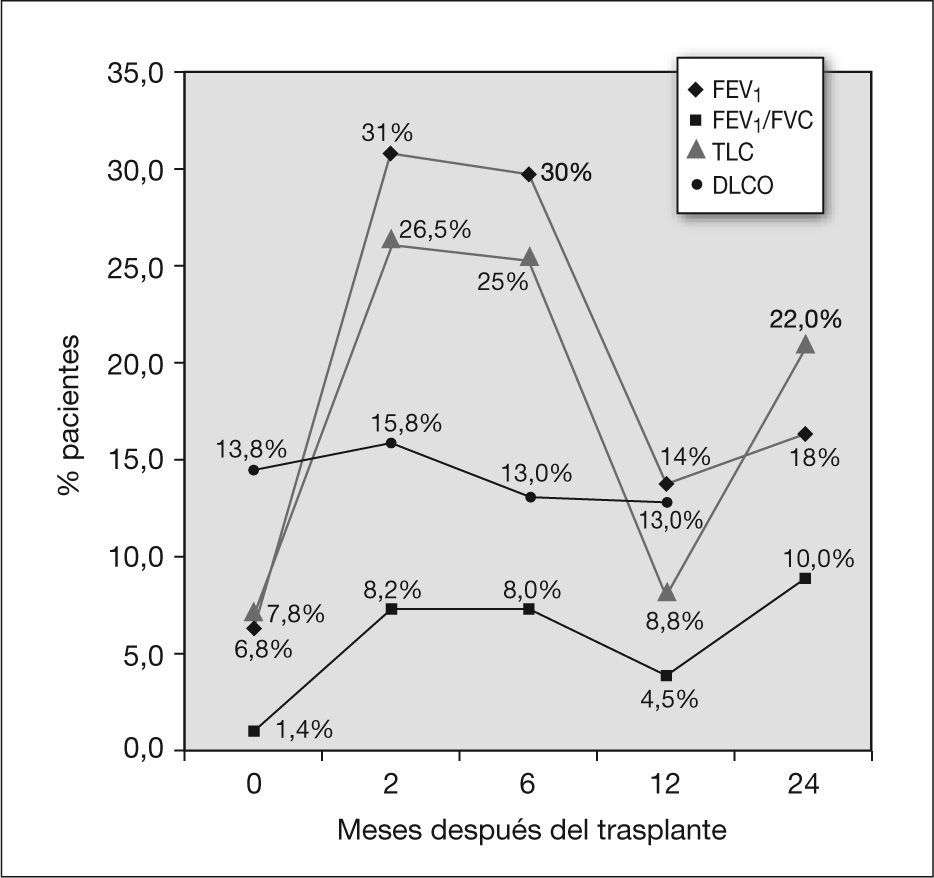
RESULTADOSEvolución de la función pulmonar en el total de los pacientesSe dispone de datos previos al trasplante de 74 pacientes: en 5 de ellos los valores de TLC fueron inferiores al 80%, en uno, el FEV1/FVC fue patológico y siete de los niños obtuvieron valores de DLCO inferiores al 70 % sin otra alteración.
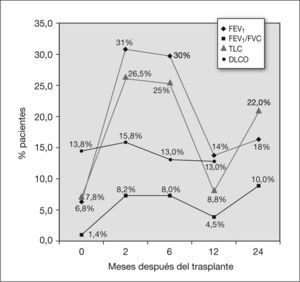
Al obtener el FEV1/FVC, como se observa en la figura 1, a los 2 y 6 meses posteriores al trasplante el porcentaje de pacientes que presentaba FEV1/FVC menor del 80 % aumentó al 8 % (5 niños). A los 2 años del trasplante, en el 10 % de los pacientes continuaba existiendo un patrón obstructivo (3 de 29 casos).
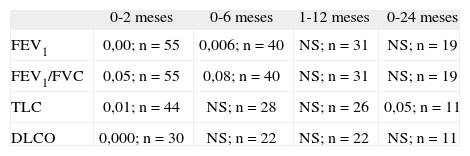
Al aplicar el análisis estadístico al descenso de este parámetro (tabla 2), se objetiva el descenso, sobre todo en los primeros 6 meses posteriores al trasplante, pero sin alcanzar significación estadística (p = 0,05 a los 2 meses y 0,08 a los 6 meses).
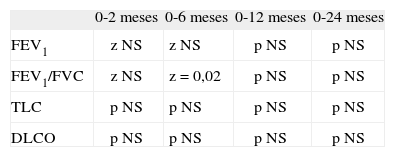
Significación estadística de las alteraciones de parámetros de función pulmonar con el tiempo (test de la t de Student)
| 0-2 meses | 0-6 meses | 1-12 meses | 0-24 meses | |
| FEV1 | 0,00; n = 55 | 0,006; n = 40 | NS; n = 31 | NS; n = 19 |
| FEV1/FVC | 0,05; n = 55 | 0,08; n = 40 | NS; n = 31 | NS; n = 19 |
| TLC | 0,01; n = 44 | NS; n = 28 | NS; n = 26 | 0,05; n = 11 |
| DLCO | 0,000; n = 30 | NS; n = 22 | NS; n = 22 | NS; n = 11 |
DLCO: capacidad de difusión; FCV: capacidad vital forzada; FEV1: volumen espiratorio forzado en un segundo; n: número de pacientes incluidos en la comparación; NS: no significativo; TLC: capacidad pulmonar total.
Se produjo un descenso de la TLC a partir del momento del trasplante en un porcentaje relevante de pacientes (fig. 1): a los 2 meses, el 26 % de los pacientes (13 niños) presentaron TLC inferior al 80 %, a los 6 meses el 25 % y a los 24 meses, el 22 %. Se constató también la tendencia a la normalización de los valores tras los primeros 6 meses del trasplante, pero no totalmente. El descenso de la TLC fue estadísticamente significativo en los primeros 2 meses posteriores al trasplante (p = 0,011 a los 0–2 meses) con tendencia en el resto de los períodos, sobre todo a los 24 meses, con p = 0,05 (tabla 2).
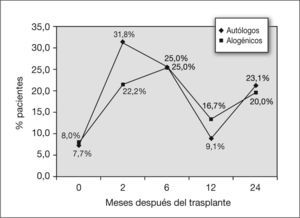
Los porcentajes de pacientes con alteración aislada de DLCO (fig. 1) se mantuvieron estables a lo largo del tiempo, con valores del 15,8 % a los 2 meses (sobre 39 pacientes), del 13 % a los 6 y 12 meses (sobre 30 pacientes) y a los 24 meses (sobre 15 pacientes). La disminución de la capacidad de difusión fue significativa a los 2 meses posteriores al trasplante (tabla 2).
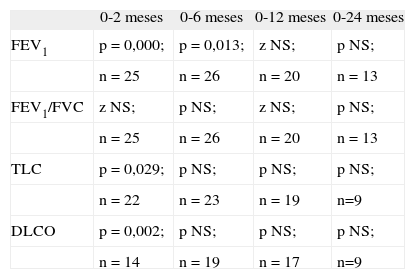
Evolución de la función pulmonar en los pacientes tras la realización del trasplante autólogoComo se observa en la figura 2, los porcentajes de pacientes sometidos a trasplante autólogo con FEV1/FVC menor del 80 % no presentaron una variación muy notable a lo largo del tiempo posterior al trasplante. El análisis resultó no significativo (tabla 3).
Significación estadística de las alteraciones de parámetros de función pulmonar con el tiempo posterior al trasplante autólogo
| 0-2 meses | 0-6 meses | 0-12 meses | 0-24 meses | |
| FEV1 | p = 0,000; | p = 0,013; | z NS; | p NS; |
| n = 25 | n = 26 | n = 20 | n = 13 | |
| FEV1/FVC | z NS; | p NS; | z NS; | p NS; |
| n = 25 | n = 26 | n = 20 | n = 13 | |
| TLC | p = 0,029; | p NS; | p NS; | p NS; |
| n = 22 | n = 23 | n = 19 | n=9 | |
| DLCO | p = 0,002; | p NS; | p NS; | p NS; |
| n = 14 | n = 19 | n = 17 | n=9 |
DLCO: capacidad de difusión; FCV: capacidad vital forzada; FEV1: volumen espiratorio forzado en un segundo; n: número de pacientes incluidos en la comparación; NS: no significativo; p: prueba de la t para datos apareados; TLC: capacidad pulmonar total; z: prueba de los rangos con signo de Wilcoxon.
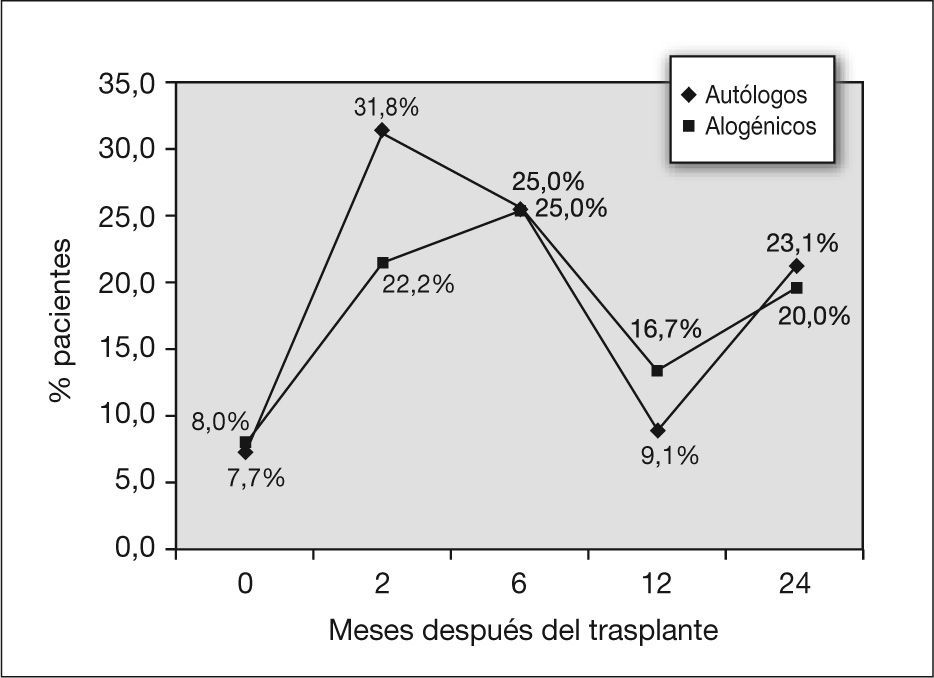
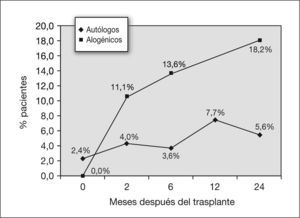
En cuanto al TLC, 2 meses después del trasplante autólogo, el 31,8 % de los pacientes presentaba una TLC inferior al 80 % en la pletismografía. A los 6 meses este porcentaje disminuyó al 25 % y a los 12 meses, al 9 % (fig. 3). Se halló significación estadística en el descenso de la TLC en los primeros 2 meses después del trasplante, con una p de 0,029 (tabla 3).
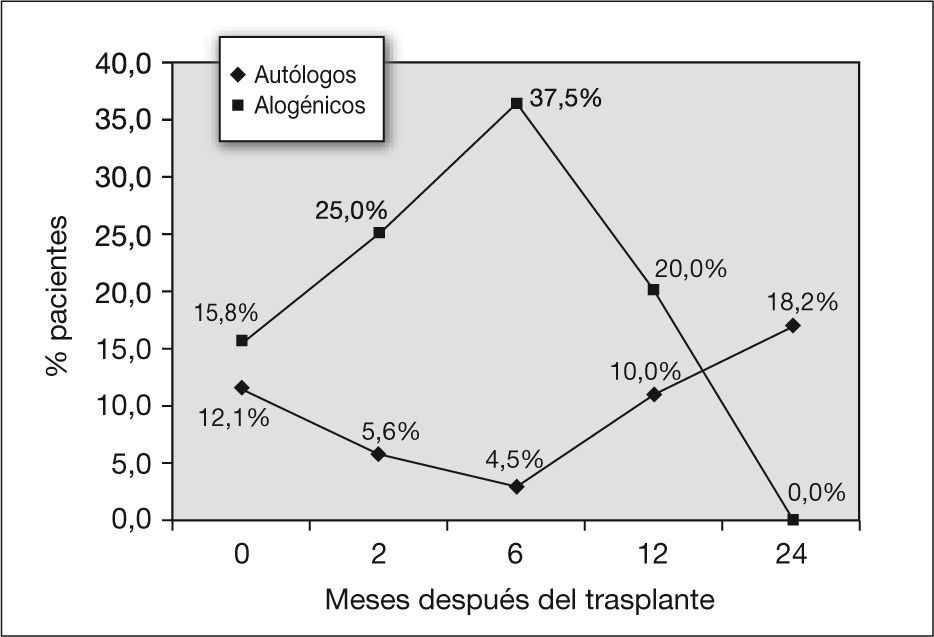
También se encuentra alteración de la difusión. A los 2 y 6 meses después del trasplante, el 5,6 y el 4,5 % de los pacientes presentaron alteración aislada de la capacidad de difusión. A partir de ese momento el porcentaje aumentó al 10 % a los 12 meses y al 18 % a los 24 meses (fig. 4). Fue significativo el descenso de la DLCO en los primeros 2 meses, con una p = 0,002 (tabla 3).
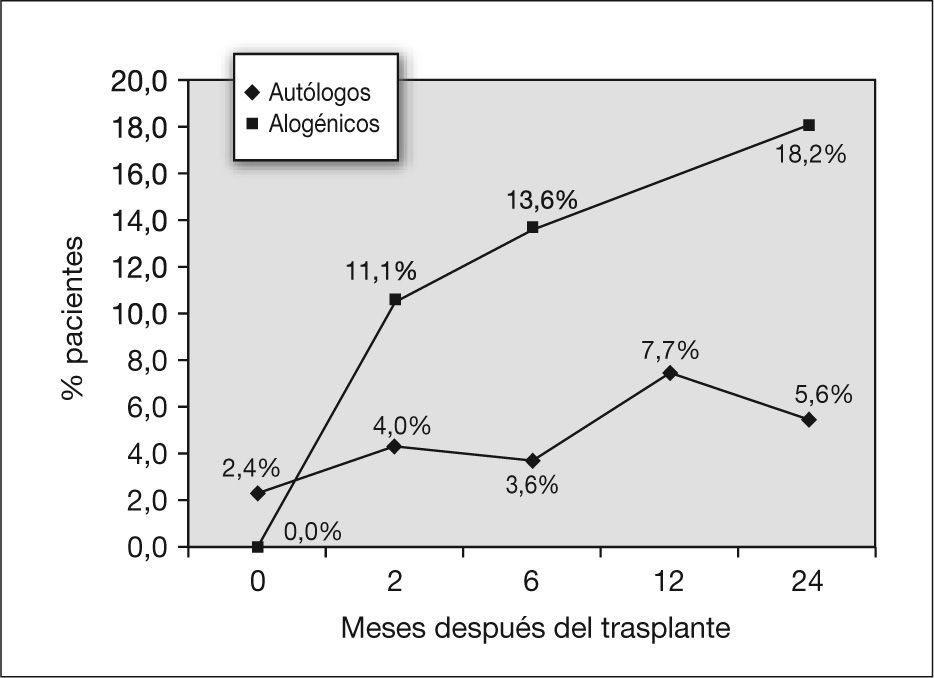
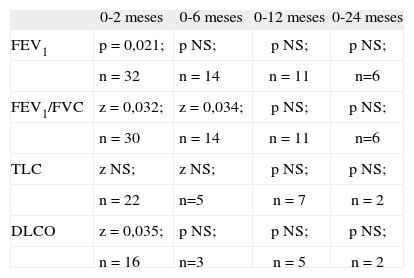
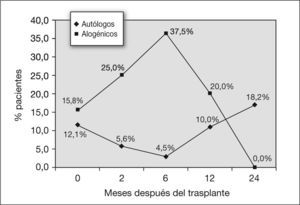
Evolución de la función pulmonar en los pacientes tras la realización del trasplante alogénicoAntes de la realización del trasplante, ningún paciente presentó FEV1/FVC inferior al 80 %, mientras que a los 2 meses presentaron este valor el 11,1 % de los pacientes, y a los 6 meses, el 13,6 % (fig. 2). A los 24 meses, el 18,2 % de los pacientes para los que se dispone de datos presentaban esta alteración. La disminución del FEV1/FVC fue estadísticamente significativa para los 2 y los 6 meses posteriores al trasplante (z = 0,032 y 0,034) (tabla 4).
Significación estadística de las alteraciones de parámetros de función pulmonar con el tiempo posterior al trasplante alogénico
| 0-2 meses | 0-6 meses | 0-12 meses | 0-24 meses | |
| FEV1 | p = 0,021; | p NS; | p NS; | p NS; |
| n = 32 | n = 14 | n = 11 | n=6 | |
| FEV1/FVC | z = 0,032; | z = 0,034; | p NS; | p NS; |
| n = 30 | n = 14 | n = 11 | n=6 | |
| TLC | z NS; | z NS; | p NS; | p NS; |
| n = 22 | n=5 | n = 7 | n = 2 | |
| DLCO | z = 0,035; | p NS; | p NS; | p NS; |
| n = 16 | n=3 | n = 5 | n = 2 |
DLCO: capacidad de difusión; FCV: capacidad vital forzada; FEV1: volumen espiratorio forzado en un segundo; n: número de pacientes incluidos en la comparación; NS: no significativo; p: prueba de la t para datos apareados; TLC: capacidad pulmonar total; z: prueba de los rangos con signo de Wilcoxon.
En este grupo, a los 2 y 6 meses después del trasplante, el 25,9 y el 25 %, respectivamente, de los pacientes presentaron una TLC menor del 80 %. Este porcentaje disminuyó a partir de este momento, y fue del 16,7 % a los 12 meses y del 20 % a los 24 meses (fig. 3). La disminución del TLC no resultó significativa en el análisis estadístico (tabla 4).
En cuanto a la DLCO, a los 2 meses el 25 % de los niños sometidos a trasplante alogénico presentaron una alteración aislada de la capacidad de difusión, y a los 6 meses, el 37 %. A partir de ese momento se produce una disminución del porcentaje de niños afectados, que pasa a ser del 20 % a los 12 meses y de ninguno (de 4 pacientes para quienes se dispone del dato) a los 2 años (fig. 4). La disminución de la capacidad de difusión del CO con el tiempo tras el trasplante alogénico fue significativa, con una z = 0,035 a los 2 meses después del trasplante (tabla 4).
Comparación de las alteraciones de la función pulmonar tras trasplante autólogo y alogénicoEn la figura 2 se exponen los porcentajes de pacientes que presentaron alteraciones de la función pulmonar de tipo obstructivo tras el trasplante, que se refleja en la disminución del FEV1/FVC de menos del 80 %. En todo momento fue mayor el número de afectados entre los niños que habían sido sometidos a un trasplante alogénico, aunque ambas curvas siguen una distribución similar; la morbilidad es máxima hasta los 6 meses y se recupera a partir de ese momento, si bien a los 2 años no se ha llegado aún a la situación basal. Al comparar estadísticamente los dos grupos, autólogo y alogénico (tabla 5), se encontró una diferencia estadísticamente significativa en las disminuciones del FEV1/FVC con el tiempo a los 2 meses.
Significación estadística de las diferencias de las alteraciones de parámetros de función pulmonar con el tiempo posterior al trasplante autólogo y al trasplante alogénico
| 0-2 meses | 0-6 meses | 0-12 meses | 0-24 meses | |
| FEV1 | z NS | z NS | p NS | p NS |
| FEV1/FVC | z NS | z = 0,02 | p NS | p NS |
| TLC | p NS | p NS | p NS | p NS |
| DLCO | p NS | p NS | p NS | p NS |
DLCO: capacidad de difusión; FCV: capacidad vital forzada; FEV1: volumen espiratorio forzado en un segundo; NS: no significativo; p: prueba de la t para datos apareados; TLC: capacidad pulmonar total; z: test de Mann–Whitney.
En cuanto a las alteraciones restrictivas, en la figura 3 se exponen los porcentajes de pacientes con TLC inferior al 80 %. Se vieron afectados más pacientes sometidos a trasplante autólogo. La diferencia de los descensos de la TLC entre los dos grupos no resultó significativa (tabla 5).
Por último, sobre los pacientes que presentan una alteración aislada de la difusión, en la figura 4 se observa cómo los porcentajes de pacientes afectados son mayores durante el primer año posterior al trasplante en el grupo de los sometidos a trasplantes alogénicos. Al aplicar tests estadísticos sobre la diferencia del descenso de la DLCO entre los dos tipos de trasplante, no se encuentra significación estadística (tabla 5).
DISCUSIÓNEl trasplante de progenitores hematopoyéticos en niños es una herramienta terapéutica para un número cada vez mayor de enfermedades, neoplásicas y no neoplásicas1; sus protocolos se perfeccionan cada vez más, y se consiguen mayores porcentajes de curación. Esto implica un número cada vez mayor de individuos supervivientes de enfermedades que en el pasado eran incurables, con una carga de morbilidad secundaria a los tratamientos recibidos, entre ellos el trasplante de progenitores. Es preciso establecer las implicaciones de dicha morbilidad a largo plazo para estos niños que se curan de su enfermedad y que tienen una larga esperanza de vida.
Uno de los órganos diana más castigados por los tratamientos oncológicos y por el trasplante de progenitores es el pulmón4–6 y una vez superadas las complicaciones inmediatamente posteriores a la realización del trasplante, las alteraciones de la función pulmonar cobran gran importancia sobre la calidad de vida futura del individuo7, y los cuidados y tratamientos que éste debe seguir. Por ello es importante determinar cuáles son esas alteraciones, cuáles son sus factores de riesgo y cuál es su probable evolución con el tiempo.
Este estudio es importante dado el elevado número de la muestra, 93 pacientes, y por el hecho de que todos sean niños y sometidos a trasplantes en el mismo centro asistencial. Es una limitación el hecho de que realizar los tests de función pulmonar precisa que los niños sean mayores de 5 años, colaboradores y con situación clínica estable. El problema de este estudio son los numerosos datos perdidos, porque en ese momento el paciente no estuviera en condiciones de realizar la prueba o porque hubiera fallecido. Puede que la escasez de datos sea la causa de la falta de significación en algunas comparaciones. A pesar de ello, se considera que la muestra es lo suficientemente numerosa como para poder observar tendencias.
A diferencia de otros trabajos publicados, que no incluyen el estado de la función pulmonar anterior al trasplante, este estudio dedica su primer apartado a este punto. Un número considerable de niños presentaba alteraciones anteriores al trasplante, lo que se relaciona o con su enfermedad de base o con los tratamientos empleados hasta ese momento14,15. Es importante tener en cuenta en qué estado llegan los pacientes al trasplante, al haber sido sometidos a tratamientos tan agresivos la mayoría de ellos. Efectivamente, antes del procedimiento, un 6,8% de los individuos presentaba una alteración del FEV1, un 7,8 % tenía una alteración de la TLC, y hasta un 13,5% presentaba una alteración aislada de la difusión de CO. Estos datos apoyan la idea, ya expuesta en la bibliografía médica, de que la DLCO es uno de los parámetros más sensibles de lesión pulmonar7,8,16,17 y, por tanto, el que más frecuentemente se encuentra alterado ya antes del trasplante.
A partir del trasplante, las alteraciones de la función pulmonar, tanto obstructivas como restrictivas, se producen en un porcentaje considerable de pacientes. Al estudiar a 93 niños, el tamaño de la muestra es lo suficientemente amplio como para que las observaciones sean relevantes. Las alteraciones encontradas son máximas en los primeros 6 meses posteriores al trasplante, y disminuye el FEV1 por debajo del 80 % en un 30 % de los niños. Se produce un patrón restrictivo mayoritario, con caída de la TLC, en la cuarta parte de los niños trasplantados (un 26,5 % a los 2 meses y un 25 % a los 6 meses). Esta observación ya se había reflejado anteriormente en estudios realizados con muestras más pequeñas16,17. En un 8 % de los niños durante los primeros 6 meses se produce una alteración de tipo obstructivo, con FEV1/FCV menor del 80 %, que se mantiene durante todo el estudio (un 10 % a los 2 años).
A partir de los 6 meses posteriores al trasplante la tendencia es a la recuperación, aunque parcialmente; a los 2 años no se ha llegado a la situación basal. Todos estos resultados coinciden con los de otros trabajos ya publicados7,8,16,17.
El hecho de que las alteraciones más importantes se produzcan en los primeros 6 meses se ve reforzado por la significación estadística que alcanza en ese período la disminución de FEV1, FEV1/FVC y TLC. Hay que destacar que las pérdidas de datos son mayores según avanza el estudio, por lo que el análisis estadístico pierde potencia para las comparaciones a uno y 2 años posteriores al trasplante.
En cuanto a la alteración aislada de la capacidad de difusión, la disminución de la DLCO a los 2 meses del trasplante resulta estadísticamente significativa. Sin embargo, no se observan cambios de prevalencia con el tiempo, quizá porque a la vez que se altera la DLCO lo hacen también los demás parámetros.
Al estudiar por separado los trasplantes alogénicos y autólogos, el tamaño de la muestra se reduce considerablemente, y algunas de las comparaciones estadísticas se realizan sobre un número de datos muy reducido. Es preciso aplicar tests estadísticos no paramétricos, con menor potencia.
Los pacientes sometidos a trasplante autólogo se caracterizan por precisar menos inmunosupresión y por la ausencia de complicaciones, como la enfermedad del injerto contra el huésped, pero, por otro lado, son sometidos a trasplante como tratamiento de tumores agresivos que precisan dosis altas de quimioterapia y/o radioterapia, con las consecuencias que ello acarrea para el pulmón18,19. Se objetiva en estos pacientes una alteración predominantemente restrictiva, en un 31,8 % de los pacientes a los 2 meses del trasplante, que mejora con el tiempo, pero aún se encuentra presente en el 23 % a los 2 años del trasplante. Las alteraciones aisladas de la capacidad de difusión también se encuentran presentes, sobre todo a los 12 y a los 24 meses posteriores al trasplante, cuando mejoran los demás parámetros. Estos resultados coinciden con otros ya publicados20,21.
El grupo de niños sometidos a trasplante alogénico incluye neoplasias, pero también defectos de hematopoyesis. Están sometidos a mayor inmunosupresión, por lo que el riesgo de infecciones es superior, además de su susceptibilidad a presentar una enfermedad del injerto contra el huésped. El número de datos perdidos en este grupo es elevado, debido a su gran morbimortalidad. Por esta razón, no fue posible realizar el análisis a los 12 meses posteriores al trasplante, al ser insuficientes los datos de los que se disponía.
Las alteraciones de los parámetros estudiados dentro de este grupo presentaron una evolución con el tiempo similar a la de la muestra total y al grupo de pacientes sometidos a trasplantes autólogos, con las mayores alteraciones en los primeros 6 meses y mejoría posterior. A los 6 meses, un 25 % de los pacientes presentó un patrón restrictivo, un 13 % obstructivo, y un 37 % tuvo una afectación aislada de la DLCO. Las mayores alteraciones fueron de tipo restrictivo, aunque menores que en el grupo sometido a trasplante autólogo; de hecho, la disminución de TLC con el tiempo en este grupo no alcanzó significación estadística en ningún momento. Se produjeron importantes alteraciones de tipo obstructivo, con FEV1/FVC menor del 80 %, que aún se objetivaron en el 18 % de los pacientes a los 2 años. La disminución de este índice fue significativa para los 2 y los 6 meses en este grupo (tabla 4). La mayor afectación obstructiva en el grupo de pacientes sometidos a trasplantes alogénicos se explica por la mayor incidencia de enfermedad del injerto contra el huésped y de bronquiolitis obliterante (10 casos de bronquiolitis obliterante en el grupo de trasplantes alogénicos y un caso en el grupo de trasplantes autólogos), que persisten en el tiempo. La alteración aislada de la capacidad de difusión en los primeros meses fue mucho más pronunciada que en el grupo de pacientes sometidos a trasplantes autólogos y la caída del DLCO a los 2 meses del trasplante fue significativa. Se confirma la alteración aislada de la capacidad de difusión como un parámetro extremadamente sensible de lesión pulmonar a largo plazo, más acusado en el grupo de trasplantes alogénicos, pero sin diferencia estadísticamente significativa, con igual patrón de empeoramiento en los primeros 6 meses después del trasplante y mejoría posterior. Todos estos resultados coinciden con otros publicados anteriormente22–24.
En su último apartado, el estudio compara las alteraciones de los parámetros de función pulmonar en los dos grupos. La caída de FEV1, FEV1/FVC y DLCO es superior en el grupo de trasplantes alogénicos y la disminución de TLC es mayor para los sometidos a trasplantes autólogos, pero el análisis estadístico no reveló diferencias significativas, quizá por el reducido tamaño de la muestra, salvo para el FEV1/FVC a los 6 meses del trasplante.
Los resultados obtenidos confirman la importancia de las alteraciones de la función pulmonar a largo plazo tras el trasplante de progenitores y justifican la realización de estudios de función pulmonar de forma seriada a todos los pacientes sometidos a este procedimiento y la importancia de poder estudiar factores de riesgo y cómo minimizar las alteraciones, si ello es posible.