El objetivo de este estudio ha sido determinar si la forma de presentación inicial de la pubertad precoz central (PPC) varía en relación con la etiología y permite el diagnóstico diferencial entre formas idiopáticas y orgánicas (neurogénicas), lo que haría innecesarias las pruebas de imagen del sistema nervioso central (SNC) en determinados pacientes.
Pacientes y métodosLos niños con PPC evaluados fueron incluidos de forma consecutiva en un estudio prospectivo observacional. Se recogieron los hallazgos clínicos, de laboratorio y ecográficos. Se compararon los hallazgos de PPC idiopática (3 niños y 49 niñas) y orgánica (2 niños y 8 niñas).
ResultadosNo hubo diferencias en cuanto al estadio puberal, edad de inicio puberal (7,0 [5,8-7,5] frente a 7,3 [5,1-8,3] años), cociente edad ósea/edad cronológica (1,26 [1,2-1,3] frente a 1,23 [1,1-1,3]) y menarquia materna (11,7 (± 0,2 frente a 11,7 ± 0,6 años) entre PPC idiopática y orgánica, respectivamente. Los pacientes con PPC orgánica presentaron una menor desviación estándar (DE) de la talla (0,35 ± 0,4 frente a 1,6 ± 0,1; p < 0,01), predicción de talla adulta y DE de la velocidad de crecimiento (0,8 ± 0,9 frente a 3,7 ± 0,7). Las niñas con PPC orgánica presentaban de forma significativa unas mayores concentraciones plasmáticas de estradiol (47,5 [25-68] frente a 27 [14-43] pg/ml) que las niñas con PPC idiopática. La ecografía pélvica realizada en el momento del diagnóstico reveló la presencia de cambios puberales en genitales internos en el 43,9 % de las niñas (el 37,2 % en la subpoblación con PPC idiopática frente al 62,5 % en el grupo de PPC orgánica; p ± 0,18).
ConclusionesExiste un solapamiento clínico-ecográfico entre PPC idiopática y orgánica. Las pruebas de imagen del SNC siguen siendo necesarias en todos los casos de PPC y los estudios ecográficos no pueden sustituir a otras investigaciones diagnósticas.
To determine whether initial presentation varies according to aetiology, whether such differences allow differential diagnosis between idiopathic and organic forms, and whether CNS imaging can be avoided in some patients with central precocious puberty (CPP).
Patients and methodsChildren referred for evaluation of precocious puberty were evaluated, and the subpopulation of children with CPP was enrolled in this prospective observational study. Clinical, laboratory and ultrasound features of 62 consecutive patients with CPP (5 boys and 57 girls) were recorded. We compared the characteristics of idiopathic (3 boys, 49 girls) and organic (2 boys, 8 girls) CPP.
ResultsThere were no differences in pubertal staging, age at puberty onset (7.0 [5.8-7.5] vs. 7.3 [5.1-8.3] years), bone age/chronological age ratio (1.26 [1.2-1.3] vs. 1.23 [1.1-1.3]), maternal menarche (11.7 ± 0.2 vs. 11.7 ± 0.6 years) between idiopathic and organic CPP, respectively. Organic CPP patients had a poorer height SD (0.35 ± 0.4 vs. 1.6 ± 0.1; p < 0.01), predicted adult height, growth rate and growth rate SD (0.8 ± 0.9 vs. 3.7 ± 0.7). Girls with organic CPP had significantly higher oestradiol levels (47.5 [25-68] vs. 27 [14-43] pg/ml) than girls with idiopathic CPP. Pelvic ultrasound at the time of diagnosis revealed the presence of pubertal changes in internal genitalia in 43.9 % of girls (37.2 % idiopathic versus 62.5% organic CPP subpopulation; p ± 0.18).
ConclusionsThere is a clinical-ultrasound overlap between idiopathic and organic CPP. Imaging remains necessary in all cases of central precocious puberty, and ultrasound data should not be replaced by other diagnostic investigations.
La pubertad precoz engloba un conjunto de entidades que oscilan entre la precocidad incompleta (adrenarquia prematura) hasta las alteraciones en las que el diagnóstico y el tratamiento precoces podrían salvar la vida del paciente (tumor maligno de células germinales). Pese a que los límites de edad para su diagnóstico han sido ampliamente discutidos1,2, en la actualidad no existen evidencias de que haya una reducción reciente en la edad de inicio del desarrollo puberal en mujeres en países distintos a Estados Unidos, y el límite clásico de edad para el inicio del desarrollo puberal antes de los 8 años en niñas y 9 años en niños requiere la evaluación por parte de un endocrinólogo pediátrico3,4.
En la pubertad precoz central (PPC) existe una activación prematura en cascada del sistema hipotalámico-hipofisario-gonadal, que conlleva una virilización en niños y una feminización en niñas, con aceleración del crecimiento lineal y maduración ósea en ambos sexos. La PPC se considera de causa orgánica o neurogénica cuando se asocia con la presencia de una lesión del sistema nervioso central (SNC), y se define como idiopática cuando en la resonancia magnética (RM) se observa la ausencia de lesiones en el SNC. La incidencia de las formas idiopáticas y el patrón de desarrollo de la PPC varían en función del sexo y de la etiología.
La integración de los hallazgos clínicos con la edad ósea, ecografía pélvica y datos hormonales, así como la monitorización de la progresión del desarrollo son fundamentales para definir qué pacientes son subsidiarios de recibir tratamiento.
El objetivo del presente estudio fue revisar los hallazgos clínicos y ecográficos de los pacientes remitidos debido a la presencia de PPC, determinando si la forma de presentación variaba en función de la etiología, si estas diferencias permitían el diagnóstico diferencial entre formas idiopáticas y orgánicas, y si las pruebas de imagen del SNC podrían evitarse en determinados pacientes con PPC.
PACIENTES Y MÉTODOSPacientesSe evaluaron los niños remitidos por sospecha de pubertad precoz, en el departamento de endocrinología pediátrica de un hospital de tercer nivel; la subpoblación de niños con PPC se incluyó en este estudio observacional longitudinal prospectivo. Se estudiaron un total de 62 pacientes consecutivos con PPC (5 niños y 57 niñas). El diagnóstico de PPC se basó en la aparición temprana de caracteres sexuales secundarios, edad ósea avanzada, velocidad de crecimiento acelerada, respuesta puberal de la hormona luteinizante (LH) y la hormona foliculoestimulante (FSH) a la prueba de estímulo con GnRH y concentraciones puberales de esteroides sexuales de forma basal. Se consideró como una respuesta puberal a la prueba de estímulo la presencia de un pico de LH superior a 6 U/l en niños y niñas, y un cociente pico de LH/FSH superior a 1. La existencia de concentraciones detectables de testosterona (> 0,2ng/ml) en varones o de estradiol plasmático superior a 15pg/ml en mujeres también sugerían una PPC5,6.
Se documentó la edad de aparición de los signos de presentación, edad de la menarquia materna, peso y talla corporal, exploración física con estadificación puberal, edad ósea, ecografía pélvica en niñas, RM cerebral y evaluación hormonal. El seguimiento clínico se mantuvo hasta la obtención de la talla final adulta.
MétodosLa talla fue medida mediante un estadímetro en el centro de estudio por parte de dos investigadores principales. La desviación estándar (DE) de la talla fue calculada de acuerdo con el método de Tanner-Whitehouse7. La predicción de la talla adulta (PTA) se determinó mediante el método de Bayley-Pinneau8. La talla diana (TD) fue calculada como la media de la talla de los padres menos 6,5cm para las niñas y como la media de la talla de los padres más 6,5cm para los niños. La velocidad de crecimiento expresada como cm/año y en DE para su edad cronológica se midió durante el primer año de seguimiento. Un endocrinólogo pediátrico experimentado estimó la edad ósea usando el método de Greulich y Pyle9. El estadio puberal fue evaluado mediante la escala de Tanner10. La evaluación hormonal incluyó las concentraciones basales de estradiol con una sensibilidad analítica igual o inferior a 10pg/ml, coeficiente de variación (CV) del 4,6 % intraanálisis y del 4,6 % interanálisis, y testosterona con una sensibilidad analítica de 0,08ng/ml, un CV del 4 % intraanálsis para valores de 0,8ng/ml y del 2,1% para valores de 5ng/ml (Chemiluminescent Enzyme Immunoassay [ICMA], ARCHITEC, Abbott laboratories, Abbott Park, IL 60064, EE.UU.); DHEA-S con un CV del 9,5 % intraanálisis y del 13 % interanálisis (ICMA, IMMULITE 2000 DHEA-SO4, DPC, Diagnostics Products Corporation, 5700 West 96th, Los Ángeles, CA 90045–5597, EE.UU.) y androstendiona con un CV del 7,1 % intraanálisis y del 7,3 % interanálisis (radioimmunoassay [RIA], COAT-A-COUNT, DPC, Diagnostics Products Corporation, 5700 West 96th, Los Ángeles, CA 90045–5597, EE.UU.). El eje hipotalámico-hipofisario-gonadal fue investigado mediante la medición basal y tras estímulo (GnRH 100mg/m2 i.v.) de las concentraciones plasmáticas de LH y FSH, así como el cociente de las concentraciones máximas de LH y FSH tras estímulo (LH/FSH pico) (ICMA; ARCHITEC, Abbott Laboratories, Abbott Park, IL 60064, EE.UU.). Los exámenes ecográficos en niñas fueron realizados con la técnica convencional de vejiga repleta; los estudios transabdominales fueron obtenidos por un único observador empleando una aparato de diagnóstico Toshiba PowerVision 6000 (Toshiba America Medical Systems, Tustin, CA, EE.UU.) con un transductor de 3,75MHz. El volumen ovárico fue determinado usando la fórmula de la elipse alargada, donde el volumen (cm3) = diámetro longitudinal × anteroposterior × transversal × 0,523. La morfología uterina fue evaluada mediante la medición de la longitud del útero. La interpretación de los hallazgos ecográficos en niñas con precocidad sexual se realizó comparando con datos de población estándar11; los cambios puberales ecográficos se definieron como un volumen ovárico o un volumen/longitud uterina superior al percentil 97 para su edad.
Todos los datos registrados fueron analizados usando el paquete estadístico SPSS, empleando estadísticos descriptivos y pruebas paramétricas. Salvo especificación, los datos se expresan como media ± DE o mediana (P25-P75). Con la excepción de los parámetros edad de inicio puberal, LH basal, estradiol, LH pico, FSH pico y cociente EO/EC (z de Kolmogorov-Smirnov), el resto de las variables tienen una distribución normal. La comparación entre los grupos de variables cuantitativas fue realizada mediante la prueba de la t de Student para datos independientes. Para el análisis de las variables categóricas, se empleó la prueba de chi al cuadrado. La asociación lineal entre variables fue establecida mediante el coeficiente de correlación de Pearson. Para las variables no paramétricas se aplicaron la correlación de Spearman y la prueba de la U de Mann–Whitney. Un valor de p < 0,05 se consideró estadísticamente significativo.
RESULTADOSSe incluyeron en el estudio 5 niños (tres con PPC idiopática y dos con PPC orgánica) y 57 niñas (49 con PPC idiopática y ocho con PPC orgánica que revelaba la presencia de una lesión en el SNC o una lesión del SNC tratada) (tabla 1). El desarrollo mamario fue el dato clínico más destacable de la niñas con PPC (73,2 %; intervalo de confianza [IC], 60,4-83); el 21,4 % (IC, 12,7-33,8) presentaba pubarquia y el 5,1 % (IC, 1,8-14,6), menarquia. En 2 de las 8 niñas con PPC orgánica (25 %; IC, 7,1-59), la menarquia fue el signo de consulta de pubertad precoz (p < 0,01). Aunque 4 de los 5 niños presentaban un volumen testicular superior a 4ml en la exploración física, sólo un paciente se consultó por este motivo; la pubarquia era el signo clínico de presentación más prominente en los niños (80 %; IC, 37,5-96,3). El 52 % de los pacientes tenían dos o más signos de pubertad precoz en la exploración física inicial.
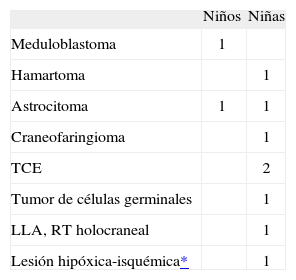
Distribución de las etiologías de la pubertad precoz central orgánica
| Niños | Niñas | |
| Meduloblastoma | 1 | |
| Hamartoma | 1 | |
| Astrocitoma | 1 | 1 |
| Craneofaringioma | 1 | |
| TCE | 2 | |
| Tumor de células germinales | 1 | |
| LLA, RT holocraneal | 1 | |
| Lesión hipóxica-isquémica* | 1 |
LLA: leucemia linfoblástica aguda; RT: radioterapia; TCE: traumatismo craneoencefálico.
En la estadificación puberal se observó la ausencia de vello axilar en el 78,6 % de los pacientes (IC, 66,1-87,2), de vello púbico en estadio 2 en el 44,3 % (IC, 32,5-56,7) y en estadio 3 en el 21,3 % (IC, 12,9-33,1), mientras que el 27,9 % (IC, 18,1-40,1) de los niños presentaban un estadio prepuberal. El desarrollo mamario en estadio 2 fue documentado en el 57,1 % (IC, 44,1-69,2), el estadio 3 en el 26,8 % (IC, 14,1-35,7) y el estadio 4–5 en el 10,7 % (IC, 2,8-16,9). No se detectaron diferencias entre los grupos.
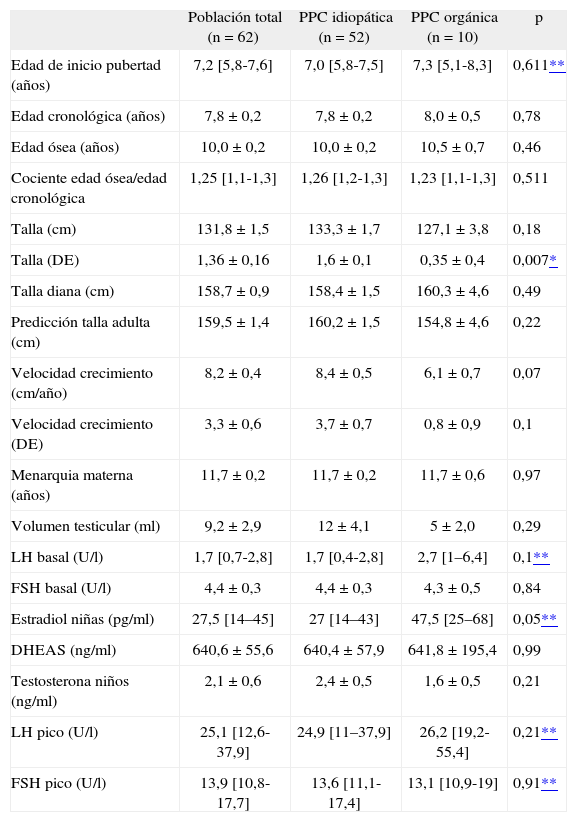
Los hallazgos relevantes sobre los parámetros auxológicos y de laboratorio, en población total y en las subpoblaciones de PPC idiopática y neurogénica, se exponen en la tabla 2. Dos pacientes en el último grupo (un niño con un astrocitoma y una niña con un craneofaringioma) presentaban déficit de GH y fueron excluidos del análisis auxológico. Los pacientes con PPC orgánica presentaron una peor talla basal, DE de la talla (p < 0,01), PTA, velocidad de crecimiento y DE de la velocidad de crecimiento. Las niñas con PPC orgánica tenían una mayor concentración de estradiol que las niñas con PPC idiopática (p = 0,05), mientras que no existieron diferencias en el resto de parámetros hormonales. La concentración de LH elevada de forma basal se correlacionó de forma muy importante (0,71, rho de Spearman, p < 0,01) con una LH elevada tras el estímulo con GnRH.
Hallazgos clínicos y de laboratorio en pacientes con pubertad precoz central
| Población total (n = 62) | PPC idiopática (n = 52) | PPC orgánica (n = 10) | p | |
| Edad de inicio pubertad (años) | 7,2 [5,8-7,6] | 7,0 [5,8-7,5] | 7,3 [5,1-8,3] | 0,611** |
| Edad cronológica (años) | 7,8 ± 0,2 | 7,8 ± 0,2 | 8,0 ± 0,5 | 0,78 |
| Edad ósea (años) | 10,0 ± 0,2 | 10,0 ± 0,2 | 10,5 ± 0,7 | 0,46 |
| Cociente edad ósea/edad cronológica | 1,25 [1,1-1,3] | 1,26 [1,2-1,3] | 1,23 [1,1-1,3] | 0,511 |
| Talla (cm) | 131,8 ± 1,5 | 133,3 ± 1,7 | 127,1 ± 3,8 | 0,18 |
| Talla (DE) | 1,36 ± 0,16 | 1,6 ± 0,1 | 0,35 ± 0,4 | 0,007* |
| Talla diana (cm) | 158,7 ± 0,9 | 158,4 ± 1,5 | 160,3 ± 4,6 | 0,49 |
| Predicción talla adulta (cm) | 159,5 ± 1,4 | 160,2 ± 1,5 | 154,8 ± 4,6 | 0,22 |
| Velocidad crecimiento (cm/año) | 8,2 ± 0,4 | 8,4 ± 0,5 | 6,1 ± 0,7 | 0,07 |
| Velocidad crecimiento (DE) | 3,3 ± 0,6 | 3,7 ± 0,7 | 0,8 ± 0,9 | 0,1 |
| Menarquia materna (años) | 11,7 ± 0,2 | 11,7 ± 0,2 | 11,7 ± 0,6 | 0,97 |
| Volumen testicular (ml) | 9,2 ± 2,9 | 12 ± 4,1 | 5 ± 2,0 | 0,29 |
| LH basal (U/l) | 1,7 [0,7-2,8] | 1,7 [0,4-2,8] | 2,7 [1–6,4] | 0,1** |
| FSH basal (U/l) | 4,4 ± 0,3 | 4,4 ± 0,3 | 4,3 ± 0,5 | 0,84 |
| Estradiol niñas (pg/ml) | 27,5 [14–45] | 27 [14–43] | 47,5 [25–68] | 0,05** |
| DHEAS (ng/ml) | 640,6 ± 55,6 | 640,4 ± 57,9 | 641,8 ± 195,4 | 0,99 |
| Testosterona niños (ng/ml) | 2,1 ± 0,6 | 2,4 ± 0,5 | 1,6 ± 0,5 | 0,21 |
| LH pico (U/l) | 25,1 [12,6-37,9] | 24,9 [11–37,9] | 26,2 [19,2-55,4] | 0,21** |
| FSH pico (U/l) | 13,9 [10,8-17,7] | 13,6 [11,1-17,4] | 13,1 [10,9-19] | 0,91** |
Media ± DE; Mediana [P25-P75].
DE: desviación estándar; FSH: hormona foliculoestimulante; LH: hormona luteinizante; PPC: pubertad precoz central.
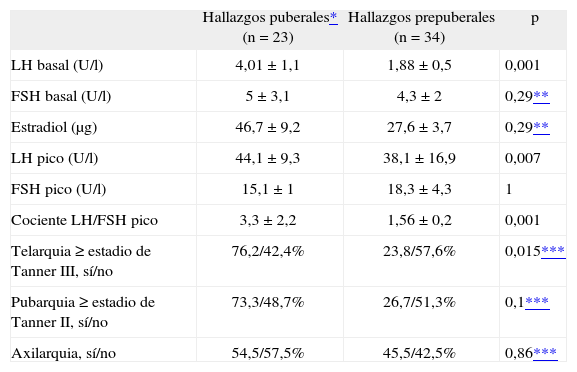
La ecografía pélvica en el momento del diagnóstico reveló la presencia de cambios puberales en los genitales internos en el 40,4 % de las niñas (IC, 28–53; un 37,2% en subpoblación con PPC idiopática frente a un 62,5% con PPC orgánica; p = 0,18). Todas la niñas (cinco) con datos ecográficos de pubertad precoz en la subpoblación con PPC orgánica presentaban un aumento de tamaño ovárico y uterino, mientras que las niñas con PPC idiopática presentaban ambos signos en el 43,8 % (IC, 23,1-66,8), cambios ováricos en el 6,3 % (IC, 1,1-28,3) y aumento de tamaño del útero como único dato en el 50% de los casos (IC, 28–72; p = 0,08). La presencia de cambios ecográficos puberales se correlacionó con la LH basal, LH tras estímulo, cociente LH/FSH pico, estradiol y grado de telarquia (p < 0,04) (tabla 3).
Datos hormonales y estadio puberal de las niñas con cambios puberales y sin ellos en la ecografía pélvica
| Hallazgos puberales* (n = 23) | Hallazgos prepuberales (n = 34) | p | |
| LH basal (U/l) | 4,01 ± 1,1 | 1,88 ± 0,5 | 0,001 |
| FSH basal (U/l) | 5 ± 3,1 | 4,3 ± 2 | 0,29** |
| Estradiol (μg) | 46,7 ± 9,2 | 27,6 ± 3,7 | 0,29** |
| LH pico (U/l) | 44,1 ± 9,3 | 38,1 ± 16,9 | 0,007 |
| FSH pico (U/l) | 15,1 ± 1 | 18,3 ± 4,3 | 1 |
| Cociente LH/FSH pico | 3,3 ± 2,2 | 1,56 ± 0,2 | 0,001 |
| Telarquia ≥ estadio de Tanner III, sí/no | 76,2/42,4% | 23,8/57,6% | 0,015*** |
| Pubarquia ≥ estadio de Tanner II, sí/no | 73,3/48,7% | 26,7/51,3% | 0,1*** |
| Axilarquia, sí/no | 54,5/57,5% | 45,5/42,5% | 0,86*** |
FSH: hormona foliculoestimulante; LH: hormona luteinizante.
Los volúmenes ováricos derecho (2,8 ± 1,7) e izquierdo (2,81 ± 1,9ml) estaban correlacionados (Pearson, r = 0,6; p < 0,01), mientras que el tamaño del útero (4,33 ± 1,6cm) presentó una buena correlación con las concentraciones basales de LH y estradiol (0,49 y 0,62, rho de Spearman, respectivamente; p < 0,05). Las niñas con PPC orgánica tenían de forma significativa un mayor volumen ovárico derecho (5,57 ± 2,3 frente a 2,27 ± 1,1ml en la PPC idiopática) e izquierdo (6,25 ± 0,6 frente a 2,5 ± 1,7ml en la PPC idiomática; p < 0,007), mientras que el diámetro uterino no fue significativamente diferente entre los diferentes grupos de PPC (5,26 ± 1,7 frente a 4,15 ± 1,5cm).
DISCUSIÓNLa PPC es un motivo de preocupación para los médicos, dado que puede ocultar la existencia de una lesión subyacente en el SNC. En las niñas, la PPC es casi siempre de origen idiopático, pero también deben tenerse en cuenta un amplio espectro de causas orgánicas. Los niños también presentan PPC idiopática, pero tienen un mayor riesgo de que se trate de una enfermedad subyacente. Las estimaciones son variables; aproximadamente en el 85% de los casos de PPC en niñas el origen es idiopático, mientras que en el 60 % de los niños tiene una causa patológica12–14. Las diferencias en la prevalencia de PPC entre ambos sexos podrían explicarse por la tendencia social de los padres a preocuparse ante la aparición de síntomas y signos de pubertad precoz en las niñas, pero no tanto en los niños.
En nuestra serie, que engloba a 62 pacientes con PPC completa, las niñas presentaban esta entidad con una frecuencia 10 veces superior a la de los niños, y la forma idiopática ha sido cuatro veces más frecuente en niñas que en niños. En estos últimos, las alteraciones neurológicas fueron casi tan frecuentes como la pubertad precoz verdadera de origen idiopático, mientras en las niñas la frecuencia de lesiones orgánicas representaba la sexta parte de las alteraciones idiopáticas. Estos hallazgos concuerdan con los referidos en publicaciones recientes15–18.
No hubo diferencias en la edad de desarrollo puberal entre PPC orgánica e idiopática, y la PPC conllevó el diagnóstico de la presencia de una lesión del SNC hasta la edad de 9 años en los niños y 8 años en las niñas. Por tanto, en pacientes con PPC no existe una edad concreta a partir de la cual pueda descartarse la existencia de una lesión del SNC, como se ha sugerido en un estudio observacional previo19. Pese a que la mayoría de los pacientes con PPC pertenecen a la categoría idiopática, la posible asociación con lesiones del SNC obliga a la realización de una RM, incluso sin sintomatología neurológica12,13,19. Esto es aún más importante en niños, porque en algunos casos la precocidad sexual puede ser la única manifestación de un tumor del SNC.
Algunos estudios refieren una clara tendencia al comienzo de la PPC neurogénica a una edad más temprana que en formas idiopáticas19. Sin embargo, esta tendencia se altamente influida por la presencia de pacientes con hamartomas. Dada la naturaleza de los hamartomas hipotalámicos como malformaciones congénitas, éstos causan la pubertad precoz a una edad relativamente temprana, usualmente en menores de 4 años20–22. En nuestro estudio, la presencia de sólo una niña con hamartoma en la subpoblación con PPC orgánica, con una edad de 2,5 años al inicio de los cambios puberales, podría explicar la similitud en la edad media puberal de las dos subpoblaciones.
En la actualidad, la PPC idiopática es una entidad de origen desconocido que parece estar relacionada con una maduración precoz hipotálamo-hipofisaria. Pueden existir antecedentes de maduración temprana en la familia, aunque la mayoría de los niños desarrollan PPC idiopática sin una tendencia familiar hacia la maduración precoz. En nuestra serie, la edad media de la menarquia materna en las subpoblaciones de PPC orgánica e idiopática fue idéntica, y comparable a la de la población estándar23; esto descarta cualquier contribución importante de factores genéticos a la PPC idiopática. La bibliografía médica reciente aboga por un nuevo factor que podría contribuir a la aparición de PPC, la leptina (hormona producida en el tejido adiposo o adipocitocina, que es capaz de estimular la secreción pulsátil de GnRH24), aunque el papel de este mensajero en la patogenia de la PPC no ha sido aclarado25–27. Otro factor presumiblemente infraestimado a tener en cuenta sería el papel de los condicionantes medioambientales en la patogenia de la PPC, incluyendo compuestos dietéticos con sustancias con una composición molecular semejante a la de los estrógenos.
La PPC se caracteriza por una respuesta puberal de LH tras estímulo con GnRH o con un agonista de GnRH (el punto de corte de concentración de LH puberal dependerá del análisis de LH), con una respuesta predominante de LH frente a la elevación de FSH28–30. Asimismo, existe la posibilidad de utilizar un test diagnóstico administrando un agonista de GnRH. Con la introducción de los análisis ICMA de tercera generación ultrasensibles, ha sido posible la detección de concentraciones elevadas de LH de forma basal31,32. Como hemos expuesto en nuestra serie, las concentraciones séricas de LH basal se correlacionan de forma muy importante con el pico de LH tras estímulo con GnRH, de modo que las concentraciones de LH basal podrían ser útiles como prueba de cribado para la identificación de pacientes con PPC32. Sin embargo, pese a que el 68,3 % de nuestros pacientes presentaron concentraciones puberales de LH, sólo el 13,3% se acompañó de un cociente LH/FSH basal superior a 1 (que sugeriría deasrrollo puberal), por lo que se necesita la presencia de estos dos hallazgos para el diagnóstico de PPC en ausencia de prueba de estímulo con GnRH33. Por tanto, la prueba de estímulo con GnRH, con una sensibilidad del 92 % en el diagnóstico de PPC, sigue siendo la prueba de forma aislada más importante en el abordaje diagnóstico de niños con sospecha de PPC28,29.
Las concentraciones basales de testosterona están elevadas en todos los niños con PPC, pero el valor diagnóstico del estradiol en niñas es limitado dada su secreción episódica. Los valores prepuberales de estradiol, presentes en el 27,7 % de nuestras niñas (IC, 0,17-0,4), no descarta la presencia de PPC; aproximadamente la mitad de las niñas con PPC pueden presentar concentraciones bajas-prepuberales de estradiol de forma aislada34. Otros estudios de laboratorio, como la determinación de pruebas de función tiroidea, 17-hidroxiprogesterona y hCG, podrían ser necesarios para la exclusión de otras causas de pubertad precoz.
La ecografía pélvica permite una evaluación no invasiva del tamaño y apariencia del útero y los ovarios. Aunque algunos autores encuentran que el volumen uterino ofrece una sensibilidad y una especificidad del 100 % en el diagnóstico diferencial de pubertad precoz verdadera e incompleta35, en nuestras niñas con PPC el 61,5 % tenían un longitud de útero normal, un 75 % un volumen ovárico normal, y el 59,6 % un volumen ovárico y longitud de útero normal. Nuestros resultados, con una sensibilidad de la ecografía pélvica del 43,9 % para detectar la presencia de cambios puberales en genitales internos en niñas con PPC, sugieren que existe un solapamiento considerable entre los sujetos normales y los sujetos con pubertad precoz incompleta o verdadera, en concordancia con las observaciones de la mayoría de autores36–38. La correlación entre los hallazgos hormonales y la presencia de cambios puberales ecográficos viene explicada por el hecho de que la secreción pulsátil de gonadotropinas causa un aumento de tamaño ovárico, mientras que el estradiol sérico produce el incremento en el tamaño del útero. Las diferencias en la prevalencia de cambios puberales ecográficos entre formas idiopáticas y neurogénicas de PPC podrían reflejar una mayor activación/maduración del sistema hipotalámico-hipofisario gonadal en niñas con PPC orgánica, como reflejan sus datos hormonales basales.
Se puede llegar a la conclusión de que pese a que los hallazgos en la presentación de la PPC pueden variar de acuerdo con la etiología implicada, nuestra serie presenta un solapamiento clínico-ecográfico entre la PPC idiopática y orgánica. El estudio por imagen del SNC continúa siendo necesario en todos los casos de PPC. Los hallazgos ecográficos deberían ser interpretados con precaución y no pueden sustituir a la realización de otras investigaciones diagnósticas.