La alergia a las proteínas de leche de vaca no mediada por IgE es una patología frecuente, en cuyo manejo están implicados profesionales de diferentes áreas existiendo a día de hoy una gran variabilidad en la forma de abordar su diagnóstico, tratamiento, seguimiento y prevención. Con el objetivo de unificar pautas de actuación se ha elaborado un documento de consenso entre cuatro de las sociedades científicas implicadas en el abordaje de niños con dicha patología.
Non-IgE-mediated cow's milk allergy is a frequent disorder in paediatrics. As patients might be seen by professionals from different specialties and levels of expertise, a great variability in diagnostic procedures and disease monitoring is commonly observed. Therefore, four scientific societies involved in its management have developed a consensus document providing specific recommendations related to its prevention, diagnosis, treatment and follow up.
La alergia a proteínas de leche de vaca (APLV) constituye la alergia alimentaria más frecuente en menores de un año. Es el resultado de una respuesta inapropiada del sistema inmune (mediada por IgE, no mediada por IgE o de naturaleza mixta) frente a las proteínas de leche de vaca (PLV)1,2. A pesar de la existencia de diferentes guías y recomendaciones sobre el manejo de niños con APLV2–11, en nuestro medio sigue observándose una gran variabilidad en su diagnóstico y tratamiento, especialmente en los casos no mediados por IgE12. El presente documento ofrece recomendaciones de un grupo multidisciplinar de expertos pediátricos en base a la bibliografía existente, con el fin de unificar pautas de diagnóstico, tratamiento, control y prevención de la APLV no mediada por IgE (APLV-no IgE) en niños menores de 2 años en España, tanto en Atención Primaria como en Atención Especializada. No se aborda el manejo de la APLV mediada por IgE, la dermatitis atópica, las esofagitis, gastritis y gastroenteritis eosinofílicas ni aquellas reacciones adversas no mediadas por mecanismos inmunológicos.
Método de elaboración del documento- •
Grupo de trabajo. Lo constituyeron 11 expertos, representantes de cuatro Sociedades Pediátricas: Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), Asociación Española de Pediatría de Atención Primaria (AEPAP), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP). Una vez consensuados los aspectos a considerar en los apartados de clínica, diagnóstico, tratamiento, seguimiento y prevención de la APLV-no IgE, estos se distribuyeron para su revisión en función de la experiencia personal.
- •
Búsqueda bibliográfica. Se realizaron dos búsquedas en Pubmed/Medline (anexo, material adicional en Internet, figura S1), remitiéndose el listado de artículos a todos los coautores y seleccionando cada uno de ellos los artículos adecuados para responder a preguntas específicas.
- •
Redacción del documento. Tras la revisión de los artículos seleccionados los resultados se expresaron como declaraciones, fundamentos y recomendaciones que posteriormente fueron sometidas a votación por todos los miembros del grupo. El documento completo puede consultarse en las páginas web de cada una de las Sociedades que han participado en su elaboración.
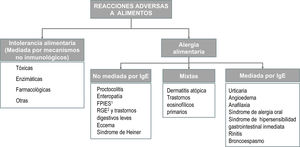
El término alergia abarca solo aquellas reacciones adversas en las que se comprueba o se tiene una alta sospecha de la implicación de uno o varios mecanismos inmunológicos y deben diferenciarse de aquellas debidas a mecanismos enzimáticos, tóxicos o farmacológicos3,13 (material adicional en Internet, figura S2). Las reacciones mediadas por IgE se caracterizan, desde el punto de vista clínico, por la aparición de forma inmediata de una sintomatología predominantemente cutánea o respiratoria asociada a la presencia de anticuerpos IgE específicos. Las formas no mediadas por IgE, son generalmente debidas a reacciones de inmunidad celular aunque, en la mayoría de los casos no pueda demostrarse la implicación de un mecanismo inmunológico.
Una historia clínica detallada y la prueba de exclusión-provocación son las únicas herramientas disponibles para diagnosticar la APLV-no IgE14–16. La primera sirve de base para sospechar su existencia mientras que la segunda es obligatoria para establecer un diagnóstico de certeza.
La sintomatología, de aparición tardía es predominantemente digestiva, incluyendo tres síndromes: la proctocolitis, la enteropatía y la enterocolitis inducida por PLV (FPIES)17(material adicional en Internet, tabla S1). Recientemente se han publicado criterios diagnósticos internacionales para esta última9 (tabla 1). No existen criterios diagnósticos específicos para las otras dos, debiendo realizarse la orientación diagnóstica en base a sus características clínicas (tabla 2). Además, la APLV-no IgE puede simular trastornos gastrointestinales frecuentes como el reflujo gastroesofágico (RGE), el cólico del lactante y el estreñimiento17–21. La existencia de antecedentes familiares de atopia, la afectación de varios aparatos (digestivo, cutáneo, respiratorio) y la ausencia de mejoría ante las medidas terapéuticas habituales permitirían sospechar una APLV-no IgE en dichos casos15,16,20,21.
Recomendación 1. Una historia clínica detallada –incluyendo exploración física, valoración nutricional e historia dietética– es el elemento clave para establecer la sospecha diagnóstica.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 2. Debe considerarse el diagnóstico de una APLV-no IgE en:
2a: lactantes que presenten uno o varios de los siguientes síntomas: diarrea prolongada, afectación nutricional, vómitos repetidos, distensión abdominal, presencia de sangre en las heces, anemia ferropénica u otros síntomas digestivos persistentes de carácter leve que no responden a las medidas terapéuticas habituales. La existencia concomitante de manifestaciones cutáneas o respiratorias sugestivas de atopia aumentará la sospecha clínica.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
2b: pacientes que presenten las características correspondientes a una de las tres entidades digestivas definidas: proctocolitis alérgica, enteropatía y FPIES.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 3. En niños con RGE, estreñimiento o cólico persistentes que no responden a las medidas terapéuticas habituales la mejoría clínica o la resolución de la sintomatología tras la exclusión de las PLV apoya la sospecha diagnóstica de APLV-no IgE, siendo siempre obligatoria la realización de una prueba de provocación posterior para su confirmación.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Criterios diagnósticos de FPIES a PLV
| FPIES agudo a PLV: |
| Se requiere la presencia del criterio mayor y al menos 3 criterios menores relacionados con la ingesta de PLV |
| Criterio mayor: |
| Vómitos en el período de 1 a 4 h después de la ingestión de PLV y ausencia de síntomas clásicos cutáneos o respiratorios mediados por IgE |
| Criterios menores: |
| 1. Un segundo (o más) episodio de vómitos después de ingerir PLV |
| 2. Vómitos repetidos 1-4 h después de la ingesta de otro alimento |
| 3. Letargia |
| 4. Palidez marcada |
| 5. Necesidad de acudir al servicio de urgencias para controlar la reacción adversa |
| 6. Necesidad de soporte de líquidos intravenoso para controlar la reacción adversa |
| 7. Diarrea en las 24 h (normalmente 5-10 h) siguientes a la ingesta de PLV |
| 8. Hipotensión |
| 9. Hipotermia (temperatura<35°) |
| FPIES crónico a PLV: |
| Se requiere una prueba de provocación en la que se cumplan los criterios diagnósticos de la forma aguda |
| • Presentación grave (cuando las PLV se ingieren de forma regular): vómitos intermitentes pero progresivos y diarrea (ocasionalmente con sangre), a veces con deshidratación y acidosis metabólica |
| • Presentación moderada (cuando las PLV se ingieren en menores cantidades): vómitos intermitentes y/o diarrea generalmente con escasa ganancia ponderal /fallo de medro pero sin deshidratación ni acidosis metabólica |
Modificado de Nowak-Wegrzyn et al. 9.
Características clínicas de la enteropatía y la proctocolitis
| Proctocolitis inducida por PLV: |
| Para el diagnóstico es imprescindible hacer prueba de provocación a las 2-4 semanas de la retirada de las PLV, siempre que hayan desaparecido los síntomas |
| • Presencia de sangre roja fresca en las heces de un lactante por lo demás sano alimentado con LM (madre con dieta que incluye lácteos) o fórmula con PLV |
| • Ausencia de fallo de medro |
| • Ausencia de afectación del estado general |
| • Coprocultivos negativos |
| • Desaparición del sangrado en las siguientes 4 semanas a la retirada de las PLV de la dieta (en la madre en casos de LM) |
| • Reaparición de los síntomas tras la prueba de provocación |
| Enteropatía inducida por PLV: |
| Para el diagnóstico es imprescindible hacer prueba de provocación a las 4-6 semanas de la retirada de las PLV, una vez que hayan desaparecido los síntomas |
| • Anorexia y rechazo de las tomas |
| • Inicialmente la afectación puede expresarse con vómitos intermitentes y estreñimiento |
| • Diarrea de más de 15 días de duración con o sin fallo de medro asociado que desaparece en las siguientes 4 semanas tras la retirada de las PLV de la dieta del lactante |
| • El cuadro diarreico reaparece de forma insidiosa y progresiva tras la reintroducción de las proteínas de leche de vaca en la dieta |
En un lactante con sospecha de APLV en base a su historia clínica, se procederá a retirar las PLV de su dieta. Esto producirá la mejoría y resolución de la sintomatología en un periodo variable, desde 1-5 días en las formas agudas (FPIES agudo, vómitos), 1-2 semanas en casos de eccema o sangrado digestivo, y hasta 2-4 semanas en pacientes con estreñimiento, diarrea y/o afectación del estado nutricional22. La dieta exenta de PLV se mantendrá hasta la total normalización clínica, no debiendo prolongarla más de 6 semanas sin efectuar una confirmación diagnóstica mediante prueba de provocación. Solo se contempla eludir la misma en aquellos pacientes en los que por la gravedad de la reacción inicial el riesgo de reproducirla sería elevado.
Recomendación 4. Para la confirmación diagnóstica el grupo de expertos no recomienda:
4.a: la realización de prick test y/o la determinación de IgE específica frente a PLV salvo cuando existan dudas sobre la implicación de un mecanismo IgE.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
4.b: la realización sistemática de ninguna prueba complementaria de laboratorio.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
4.c: el uso de las pruebas del parche o epicutáneas (patch test).
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
4.d: la realización sistemática de una endoscopia excepto cuando se plantean dudas en el diagnóstico o no hay respuesta a la dieta de exclusión, quedando la indicación a criterio del gastroenterólogo.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 5: para efectuar el diagnóstico de una APLV-no IgE es obligatorio excluir las PLV de la dieta durante un periodo no superior a 6 semanas (prueba de exclusión), comprobar la resolución de los síntomas y posteriormente volver a introducirlas de forma controlada (prueba de provocación), salvo en los casos de FPIES graves.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
En proctocolitis, trastornos tipo RGE, estreñimiento o cólico, la sintomatología secundaria a la reintroducción de las PLV suele ser leve y de fácil manejo ambulatorio, por lo que la prueba podría realizarse en domicilio bajo supervisión de su pediatra (tabla 3). Ante la sospecha de la implicación de un mecanismo IgE (síntomas menos de 2 h tras la ingesta y/o manifestaciones cutáneas y respiratorias ligadas a mecanismos IgE), dermatitis atópica grave, FPIES y en las enteropatías moderadas/graves, la reintroducción de las PLV puede suponer un riesgo importante, por lo que debe efectuarse en el medio hospitalario (tabla 4 y material adicional en Internet, tabla S2) (fig. 1).
Prueba de provocación en domicilio
| Requisitos |
| - Resolución completa de las manifestaciones clínicas tras la dieta de exclusión de PLV |
| - En caso de presentar un proceso intercurrente, especialmente respiratorio o infeccioso, deberá posponerse hasta la resolución de los síntomas y hasta una semana después de la finalización del tratamiento indicado para controlar el mismo |
| No debe realizarse prueba de provocación en domicilio en: formas clínicas graves, FPIES, sospecha clínica de un mecanismo mediado por IgE, pruebas IgE específica/prick test positivas a las PLV |
| Metodología |
| • En niños alimentados con lactancia artificial: sustituir cada día una medida de fórmula especial por una de fórmula de lactantes* en al menos dos de las tomas. Si no hay síntomas, una vez completado el cambio en esas dos tomas, se podrá sustituir cada día un biberón de fórmula especial por uno de fórmula de lactantes* hasta completar totalmente la reintroducción |
| • En niños alimentados con LM: reintroducir leche de vaca y derivados en la dieta materna (comenzar con 1 toma de leche o derivado lácteo al día la primera semana y, en caso de no presentar síntomas, aumentar progresivamente la cantidad de lácteos en la dieta) |
| Observar la posible aparición de síntomas hasta 4 semanas tras la reintroducción |
| En caso de reaparecer la sintomatología sospechosa de APLV durante la prueba, se deberá suspender la administración de PLV |
| No debe introducirse otro alimento nuevo en la dieta mientras se está efectuando la prueba de provocación |
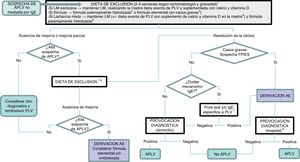
Algoritmo diagnóstico.
AE: Atención Especializada; APLV: alergia a proteínas de leche de vaca; FPIES: síndrome de enterocolitis por proteínas de la dieta; LM: lactancia materna; PLV: proteínas de leche de vaca.
1 La mejoría a la dieta de exclusión debe esperarse en un tiempo variable según la entidad clínica: entre 1-5 días en las formas agudas (FPIES agudo, vómitos); 1-2 semanas en eccema y sangrado digestivo; 2-4 semanas en estreñimiento, diarrea y afectación nutricional.
2 Excluir también la lactosa en casos de sospecha de intolerancia a la lactosa asociada, enteropatía y/o afectación nutricional.
3 Casos con afectación nutricional importante (desnutrición, hipoalbuminemia), sangrado rectal que condicione inestabilidad hemodinámica o FPIES grave.
4 Cuando los síntomas aparecen en las primeras tomas de fórmula, en niños hasta entonces alimentados al pecho y previamente asintomáticos, se debe recomendar LM sin ser necesaria la exclusión de PLV en la madre.
5 Cambio a otra fórmula extensamente hidrolizada con diferentes características o a una fórmula de arroz hidrolizada. Exclusión de soja y huevo (en el lactante y/o en la madre) en caso de sospecha de alergia concomitante.
6Sospechar un mecanismo IgE mediado cuando existan síntomas inmediatos (menos de 2 h tras la ingesta) y/o manifestaciones cutáneas y respiratorias ligadas a mecanismos IgE (urticaria, eritema, edema, broncoespasmo).
7En caso de no tener disponibilidad en Atención Primaria, deberá derivarse a Atención Especializada.
8 Puede evitarse la prueba de provocación en casos graves y en casos de FPIES que cumplan criterios diagnósticos.
En dermatitis atópica grave y/o FPIES es recomendable prick test/IgE específica antes de la provocación diagnóstica. En casos de IgE específica/prick test positivo se realizará la prueba de provocación según pauta IgE.
La interpretación de la prueba de provocación se basa en datos clínicos, i.e. reaparición de los síntomas aunque estos pueden demorarse 1-2 semanas (o 2-4 semanas en los casos de alteraciones en el hábito intestinal o eccemas) y no ser lo suficientemente llamativos en los primeros días en los que la ingesta de PLV es menor. Por ello, la observación en casos dudosos debe mantenerse al menos 4 semanas tras la reintroducción de las PLV en la dieta. En las formas leves y con síntomas similares a trastornos funcionales el sistema de puntuación Cow's Milk-related Symptom Score puede ser de utilidad20,21.
Recomendación 6. En casos de proctocolitis, RGE, cólico, estreñimiento y otros trastornos digestivos leves la prueba de provocación puede efectuarse en domicilio bajo supervisión del pediatra.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 7. En casos con sintomatología inmediata, dermatitis atópica grave, FPIES, enteropatías moderadas/graves o cuando se sospeche un mecanismo mediado por IgE, la prueba de provocación se realizará siempre en un centro hospitalario.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 8. Durante la prueba de provocación, el periodo de observación tras la reintroducción de las PLV en la dieta, en caso de que no aparezcan síntomas, debe durar al menos 2 semanas y prolongarse hasta 4 semanas, especialmente en casos de estreñimiento y enteropatía.
Votación: acuerdo 10, abstención 1, desacuerdo 0. Consenso 91%.
El tratamiento de la APLV-no IgE se basa en la exclusión de las PLV de la dieta. En los lactantes con LM exclusiva siempre debe priorizarse su mantenimiento, debiendo hacer la madre una dieta exenta de PLV. La persistencia de los síntomas a pesar de la dieta materna puede deberse a la sensibilización a otros alimentos (fundamentalmente soja y huevo), debiendo considerarse también la exclusión de los mismos. Cuando la clínica se desarrolle ligada al inicio de la suplementación con fórmula o lácteos, no se considera necesario inicialmente una dieta de exclusión en la madre23,24.
Recomendación 9. En niños con LM exclusiva, esta debe mantenerse siempre indicando la retirada de las PLV de la dieta materna. En casos de persistencia de la sintomatología a pesar del correcto cumplimiento de la dieta, se recomienda mantener la LM igualmente y valorar la exclusión de otros alimentos que pueden estar implicados (especialmente soja y/o huevo).
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 10. En niños con lactancia mixta, cuando la sintomatología coincida con la introducción de tomas de fórmula, debe mantenerse la LM y la mayoría de las veces no es necesario indicar una dieta de exclusión en la madre.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Existen diferentes fórmulas válidas para el tratamiento de lactantes con APLV. Entre estas, las fórmulas extensamente hidrolizadas (FEH) de caseína y/o seroproteínas se consideran la primera opción2–11,25,26. En lactantes con afectación del estado nutricional se valorará utilizar FEH enriquecidas en triglicéridos de cadena media y cuando no se sospeche afectación de la actividad lactásica intestinal podrá emplearse una fórmula que contenga lactosa. Aunque en los últimos años varios trabajos muestran un impacto positivo de las fórmulas suplementadas con probióticos en la adquisición de tolerancia27–29, es necesario un mayor nivel de evidencia.
En niños que rechacen las FEH, no las toleren o en familias vegetarianas, las fórmulas a base de arroz hidrolizado han demostrado ser eficaces y seguras2–11,30. Las fórmulas de soja no se recomiendan en lactantes menores de 6 meses2. En los casos graves, con afectación nutricional importante o con sangrado rectal que condicione inestabilidad hemodinámica, las fórmulas elementales basadas en aminoácidos libres son la primera opción terapéutica31.
Recomendación 11. En niños alimentados con fórmula para lactantes que desarrollan APLV-no IgE:
11.a: el tratamiento de elección de las formas leves o moderadas son las FEH de caseína y/o seroproteínas.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
11.b: las fórmulas de arroz hidrolizado pueden ser recomendadas a cualquier edad y pueden ser una alternativa en algunos casos que rechacen o no respondan al tratamiento con FEH de caseína y/o seroproteínas. No se recomienda el uso de fórmulas a base de soja en lactantes menores de 6 meses.
Votación: acuerdo 10, abstención 1, desacuerdo 0. Consenso 91%.
11.c: una fórmula a base de aminoácidos (elemental) es el tratamiento de elección en casos graves de enteropatía o FPIES. Asimismo pueden emplearse como alternativa en casos que no responden al tratamiento con FEH de caseína y/o seroproteínas.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 12. No hay evidencias suficientes para recomendar el empleo de forma sistemática de fórmulas suplementadas con prebióticos y/o probióticos en el tratamiento de niños con APLV.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Las fórmulas parcialmente hidrolizadas y las leches o fórmulas procedentes de otros mamíferos (oveja, cabra, búfala) tienen un alto potencial de no ser toleradas por niños con APLV2–11. Las bebidas de origen vegetal a partir de soja, arroz, avena, quinoa, chufa o almendra, tienen un escaso valor nutricional y un contenido proteico y energético bajos, a diferencia de las fórmulas vegetales diseñadas específicamente para lactantes. Nunca deben ser tomadas como un sustituto de la leche de vaca aunque pueden ser consumidas, dentro de una alimentación variada, por niños mayores de dos años2,6,31.
Recomendación 13. Las fórmulas parcialmente hidrolizadas, las leches o fórmulas procedentes de otros mamíferos (cabra, oveja, búfala, yegua, camella, burra) y las bebidas vegetales (soja, arroz, avena, almendra, chufa, etc.) no deben utilizarse en el tratamiento de lactantes con APLV.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
No hay que olvidar que las madres y lactantes con dieta exenta de PLV constituyen un grupo de riesgo de ingesta deficitaria de vitamina D y calcio. Es recomendable que las madres reciban suplementos de ambos. En lactantes se administrará vitamina D y se deberá valorar la suplementación con calcio en casos de ingesta insuficiente15,32,33.
Recomendación 14. Tras el diagnóstico, se debe indicar una dieta exenta en PLV. No es necesaria la evitación de los productos etiquetados como «pueden contener trazas» si el niño los tolera.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 15. Se recomienda siempre supervisión médica de las dietas restrictivas, preferentemente con el apoyo de un nutricionista/dietista.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 16. Las madres que precisen excluir la PLV de su alimentación para el manejo de la APLV de sus hijos deben recibir suplementación con calcio (1g/día) y vitamina D (600 UI/día).
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 17. En los lactantes y niños que no tomen LM se recomienda la ingesta de una cantidad apropiada de una fórmula sustitutiva que garantice, entre otros, el aporte adecuado de calcio. En aquellos casos en los que se compruebe que no ingieren las cantidades adecuadas se recomienda la suplementación con calcio. Respecto a la vitamina D, se debe mantener su suplementación (400 UI/día) mientras se efectúe la dieta de exclusión.
Votación: acuerdo 10, abstención 1, desacuerdo 0. Consenso 91%.
La mayor parte de los niños con APLV toleran el consumo de ternera y otros bóvidos (buey, toro…) bien cocinados por lo que, a menos que se demuestren manifestaciones clínicas ligadas a su consumo, no es necesario evitarlos10.
Recomendación 18. La alimentación complementaria del lactante con APLV debe seguir las mismas pautas que se aplican a cualquier lactante sano en sus mismas circunstancias, salvo en lo referente a evitar las PLV en la dieta.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 19. La ternera y otras carnes relacionadas, siempre bien cocinadas, pueden ser incluidas a priori en la alimentación de los niños con APLV.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
La valoración de la persistencia o resolución de la APLV solo puede establecerse mediante la prueba de adquisición de tolerancia, la cual implica la reintroducción controlada bajo supervisión médica de la PLV. Debe realizarse de forma periódica, en función de las características de cada caso y la gravedad de la respuesta en una prueba previa. Las formas leves de RGE, cólico, estreñimiento y proctocolitis pueden desarrollar tolerancia precozmente, en torno a 3-6 meses, mientras que en FPIES se desarrolla más tarde, debiendo demorar su realización hasta los 12, 18 o incluso 24 meses en los casos más graves9,17.
Recomendación 20. En relación al seguimiento, el grupo de expertos no recomienda:
20.a: la prescripción de autoinyectores de adrenalina en niños con FPIES excepto en aquellos casos en los que exista una alergia concomitante mediada por IgE.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
20.b: la realización de forma sistemática de pruebas complementarias.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
20.c: la modificación del calendario vacunal.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 21. El tratamiento con dieta exenta de PLV debe mantenerse durante un período de tiempo variable: de 3 a 6 meses en las formas leves o hasta los 12 meses en las formas más graves. En casos de respuesta desfavorable a la reintroducción de las PLV, la adquisición de tolerancia debe reevaluarse periódicamente cada 6-12 meses bajo supervisión médica.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Antes de efectuar la reintroducción de las PLV deberá considerarse la necesidad de realizar una IgE específica y/o prick test. En el denominado FPIES atípico dichas pruebas son positivas al diagnóstico o posteriormente y el desarrollo de tolerancia tiende a ser más tardío9,34,35. Aunque la mayoría mantiene un perfil clínico típico de alergia no IgE, aproximadamente un 35% de los casos asocian manifestaciones típicas mediadas por IgE34. Asimismo, los casos graves, aquellos con manifestaciones clínicas inmediatas (aparición en las 2 primeras h tras la ingesta) o con antecedentes personales de atopia (dermatitis atópica, broncoespasmo de repetición, rinitis alérgica y/o sensibilización IgE mediada a otros alimentos) deben considerarse de riesgo para el desarrollo de reacciones mediadas por IgE tras un periodo de exclusión prolongado6 (fig. 2).
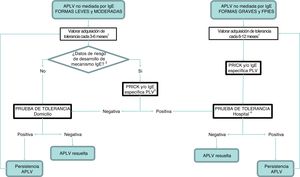
Algoritmo de seguimiento.
APLV: alergia a proteínas de leche de vaca; FPIES: síndrome de enterocolitis inducida por proteínas alimentarias; PLV: proteínas de la leche de vaca.
1 La periodicidad de la prueba queda a criterio del clínico, siendo recomendable una frecuencia mayor cuanto más leve sea el cuadro. En caso de transgresiones acompañadas de síntomas, posponer.
2 Se consideran pacientes de riesgo de desarrollo de un mecanismo IgE mediado los que presentan antecedentes personales de atopia y aquellos que manifestaron síntomas inmediatos tras la ingesta de PLV.
3 En caso de no disponibilidad en Atención Primaria, debe realizarse derivación a Atención Especializada.
4 Realización según protocolo IgE en caso de prick/IgE positiva.
La prueba de adquisición de tolerancia puede realizarse en domicilio mediante la reintroducción gradual y controlada de las PLV en aquellos casos de APLV-no IgE con sintomatología leve o moderada6,7,15 (fig. 3), y debe realizarse en medio hospitalario siempre que exista riesgo de reacción sistémica (FPIES y casos graves de enteropatía) o de reacción mediada por IgE (niños en los que en la evolución hayan positivizado IgE específica y/o prick test)9 (tabla 4).
Recomendación 22. En casos de antecedentes personales de atopia, síntomas inmediatos (aparición en las 2 primeras h tras la ingesta), FPIES y en todas las formas graves, previamente a la prueba de adquisición de tolerancia se realizará la determinación de IgE específica a PLV y/o prick test.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Recomendación 23. En los casos graves, FPIES y en aquellos en los que se constate sensibilización mediante IgE específica/prick test frente a PLV, siempre debe hacerse la prueba de adquisición de tolerancia en medio hospitalario. En los casos leves podrá realizarse en domicilio bajo control facultativo.
Votación: acuerdo 11, abstención 0, desacuerdo 0. Consenso 100%.
Prueba de tolerancia oral escalonada en domicilio. Adecuar el tipo de productos a la edad del paciente.
LM: lactancia materna; LV: leche de vaca.
1 Galletas simples, tipo María (sin chocolate, cremas, etc…). En lactantes se pueden administrar trituradas en la papilla de frutas.
2 Se puede añadir fruta natural o endulzar ligeramente con un poco de miel o azúcar.
3 En niños que continúen con LM se demorará la introducción de la leche de vaca hasta que se suspenda la LM o sea necesaria su suplementación.
4 Fórmula extensamente hidrolizada, fórmula de arroz hidrolizada o fórmula de soja.
5 Eventualmente introducir inicialmente una fórmula sin lactosa, pasando posteriormente a una fórmula adaptada.
6 En niños que no tomen fórmulas especiales (por ejemplo, alimentados con bebidas vegetales) se puede iniciar la introducción con leche semidesnatada (para facilitar aceptación) pasando a las 2 semanas a leche entera.
Prueba de provocación en medio hospitalario
| Metodología |
| 1. Obtener el peso actual del paciente |
| 2. Asegurarse de que hay una determinación reciente de IgE específica y/o prick test a PLV negativa* |
| 3. Asegurar acceso venoso** |
| 4. Calcular la cantidad de fórmula en g de proteína y administrarla vía oral, repartida en 3 dosis separadas por intervalos de 30-45 min*** |
| La dosis total será entre 0,06-0,6 g por kg de peso corporal (generalmente 0,15-0,3 g por kg de peso corporal), hasta un máximo de 10 g |
| 5. Observar al paciente durante 4 h después de la última dosis |
| 6. En caso de tolerancia, continuar en domicilio con una toma al día de 150-200 ml de fórmula o leche de vaca durante 2 semanas. Posteriormente, si no aparece sintomatología adversa relacionada, liberar progresivamente la dieta |
Modificado de Nowak-Wegrzyn et al. 9.
Los datos referentes a los posibles factores de riesgo en APLV-no IgE son escasos, ya que la mayoría de los estudios hacen referencia a poblaciones con alergias IgE36–38. Ninguna medida ha demostrado con suficiente evidencia que pueda prevenir el desarrollo de APLV-no IgE39–43. La LM exclusiva durante los primeros 6 meses de vida es el mejor alimento posible para el lactante y aunque no hay evidencia consistente de su efecto preventivo sobre el desarrollo de enfermedad alérgica, siempre debe recomendarse por la gran cantidad de beneficios que aporta43.
Conflicto de interesesBeatriz Espín Jaime ha participado en actividades docentes y simposios financiados por diferentes laboratorios dedicados a la alimentación infantil: Mead Johnson, Hero, Nestlé, Nutricia, Ordesa, Nutribén, Lactalis. Ha participado en advisory boards de laboratorios: Nutricia.
Juan J. Díaz Martín ha recibido honorarios por participar en charlas y simposios organizados por diferentes laboratorios dedicados a la alimentación infantil: Mead Johnson, Hero, Nestlé, Nutricia, Ordesa, Nutribén. Ha recibido becas para asistencia a congresos científicos por parte de diferentes laboratorios: Mead Johnson, Nestlé, Ordesa, Nutricia. Ha participado en advisory boards de laboratorios: Nutricia, Abbvie.
Luis Carlos Blesa Baviera ha recibido de la mayoría de las empresas relacionadas con la alimentación infantil pagos o apoyos de diversa índole (alojamiento, inscripción, desplazamiento) por la realización de ponencias o participación y/o asistencia a diferentes cursos-congresos-jornadas-reuniones relacionadas con la pediatría.
Anselmo Hernández Hernández ha participado en mesas redondas, ponencias y asistencia a cursos y congresos para los que ha recibido ayudas para: inscripción, viaje y alojamiento por industrias relacionadas con la alimentación infantil y otras.
Cristóbal Coronel Rodríguez ha participado como moderador y ponente en mesas, cursos y simposios patrocinados por laboratorios dedicados a la alimentación infantil.
Enriqueta Román Riechmann ha participado en actividades docentes financiadas por Alter, Casen Fleet, Ferrer Internacional, Ferring, Hero, Mead Johnson y Nestlé.
Carmen Ribes Koninckx ha recibido honorarios por participar en charlas y simposios organizados por diferentes laboratorios dedicados a la alimentación infantil: Mead Johnson, Nestlé, Nutricia. Ha participado en advisory boards de laboratorios: Nutricia, Nestlé y Mead Johnson.
Ángela Claver Monzón, José Ignacio García Burriel, María José García Mérida y Celia Pinto Fernández no tienen ningún conflicto de intereses.
Este documento se presentó como Mesa Redonda en el 66 Congreso de la AEP. Zaragoza, 7-9 de junio, 2018.