La reducción de la movilidad y el empleo de los glucocorticoides como terapia coadyuvante son causa de osteoporosis en la distrofia muscular de Duchenne. El alendronato ha sido utilizado en la osteoporosis infantil de otras etiologías con buenos resultados y sin efectos adversos.
PacientesTres pacientes con distrofia de Duchenne, síntomas de afectación ósea (historia previa de fracturas y dolor óseo generalizado) y densidad mineral ósea (DMO) por densitometría radiológica de doble energía con Z-score ≤-2 desviaciones estándar. Se inicia tratamiento con alendronato oral (10mg/día). Resultados: se produce en todos los casos un incremento de la DMO lumbar (L2-L4) con mejoría del dolor óseo. No fracturas ni efectos adversos durante el seguimiento.
ConclusionesEl alendronato oral produce en estos pacientes un incremento de la DMO con buena tolerancia y sin necesidad de ingreso hospitalario, por lo que mejora la calidad de vida y reduce el gasto sanitario.
Reduced mobility and glucocorticoids as adjunctive therapy causes osteoporosis in Duchenne muscular dystrophy. Alendronate has been used in childhood osteoporosis of other aetiologies with good results and no adverse effects.
Patients and methodsThree patients with Duchenne dystrophy, symptoms of bone involvement (prior history of generalized bone pain and fractures) and bone mineral density (BMD) by dual-energy X-ray absorptiometry with Z-score ≤-2 SD. Treatment with oral alendronate was initiated (10mg/day).
ResultsThere was an increase in lumbar (L2-L4) BMD in all cases, with improvement of bone pain. No fractures and adverse effects were observed during follow up.
ConclusionOral alendronate produces an increase in BMD in these patients, with good tolerance and no need for hospitalization, and so improves quality of life and reduces health care costs.
La distrofia de Duchenne es la enfermedad neuromuscular hereditaria más frecuente de la infancia con una incidencia de 1 por cada 3.600 recién nacidos varones vivos. Al tener una herencia recesiva ligada al cromosoma X se presenta fundamentalmente en varones (aunque se han recogido casos en niñas con síndrome de Turner)1. Está producida por alteraciones del gen que codifica la distrofina, cuya deficiencia da lugar a debilidad muscular progresiva, de modo que en la mayoría de los pacientes se produce la pérdida de la capacidad de deambulación a partir de la segunda década de la vida.
La pérdida de movilidad de estos pacientes unido a la administración de corticoides sistémicos como terapia coadyuvante favorecen la disminución de la densidad mineral ósea, produciendo en ocasiones osteopenia y osteoporosis. Los bifosfonatos se utilizan en la edad pediátrica para el tratamiento de la osteoporosis con buena respuesta, principalmente el pamidronato intravenoso, si bien en los últimos años ha comenzado a emplearse el alendronato oral con resultados similares y sin necesidad de hospitalización2.
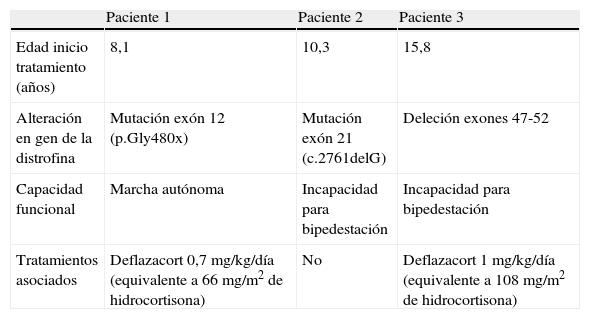
Pacientes y métodosSe estudian 3 pacientes diagnosticados de distrofia muscular de Duchenne que son remitidos por sospecha de osteoporosis (tabla 1). Se realiza inicialmente anamnesis, exploración física con especial atención a la exploración neurológica y a la presencia de deformidades óseas. Se recoge estudio analítico con determinaciones del metabolismo fosfocálcico: calcio y fósforo totales, fosfatasa alcalina total paratohormona, 1,25 di-hidroxi-vitamina D3, osteocalcina y calciuria. Se solicita densitometría radiológica de doble energía (DEXA) según el modelo Hologic®, obteniéndose la densidad mineral ósea (DMO) en g/cm2 para columna lumbar (L2-L4). Se calcula el Z-score para edad y sexo según valores de referencia de Yeste et al3 (obtenidos mediante el modelo Lunar®, por lo que se aplica el factor de corrección correspondiente).
Características de los pacientes
| Paciente 1 | Paciente 2 | Paciente 3 | |
| Edad inicio tratamiento (años) | 8,1 | 10,3 | 15,8 |
| Alteración en gen de la distrofina | Mutación exón 12 (p.Gly480x) | Mutación exón 21 (c.2761delG) | Deleción exones 47-52 |
| Capacidad funcional | Marcha autónoma | Incapacidad para bipedestación | Incapacidad para bipedestación |
| Tratamientos asociados | Deflazacort 0,7mg/kg/día (equivalente a 66 mg/m2 de hidrocortisona) | No | Deflazacort 1 mg/kg/día (equivalente a 108mg/m2 de hidrocortisona) |
Todos los pacientes tienen antecedentes de fracturas óseas sin traumatismo previo (2 de ellos presentaron dos fracturas en miembros inferiores y el restante una en miembro inferior y otra en el superior). Además, durante la anamnesis refieren dolor persistente de presentación diaria en región lumbosacra y miembros inferiores que dificulta aún más los movimientos y no cede con el reposo.
Una vez objetivada una DMO con Z-score inferior a -2,0 desviaciones estándar (DE) en los 3 pacientes junto a los síntomas antes referidos, se inicia tratamiento con alendronato oral (10mg/día en dosis única) previa solicitud como medicamento de uso compasivo. Se realizan controles clínicos y analíticos cada 4-6 meses y de densitometría ósea (DEXA-Hologic®) cada 6-12 meses.
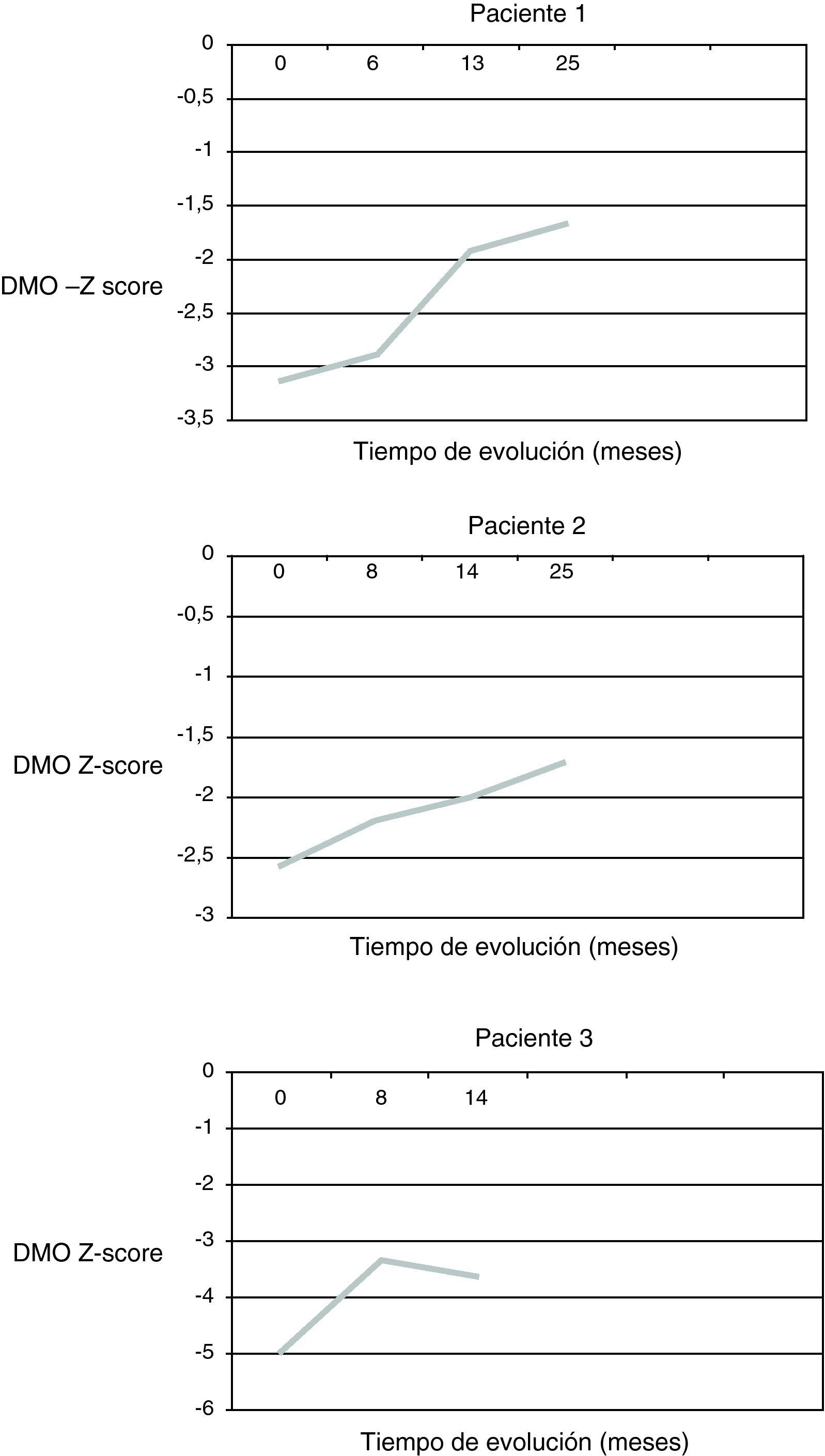
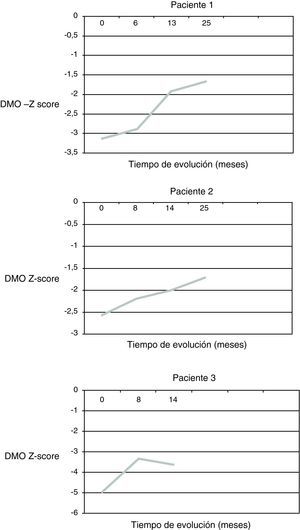
ResultadosDespués de 25 meses de tratamiento en 2 pacientes y de 14 meses en el tercero se observa una mejoría de la DMO en todos los casos (fig. 1). En el momento actual, los pacientes 1 y 2 (aquellos con una mayor duración del tratamiento) presentan una DMO en rango de osteopenia (Z-score -1,6 y -1,7 DE respectivamente).
Durante el seguimiento ninguno de los pacientes presenta fracturas óseas, mejorando significativamente el dolor en la región lumbosacra y en los miembros inferiores, que pasa de ser diario y continuo a lo largo del día a ser esporádico (1-2 días por semana) y puntual (al final del día), de forma que cede con el reposo y permite el descanso nocturno. Tampoco se evidencian durante el seguimiento cambios en la capacidad funcional de los pacientes.
En los controles analíticos del metabolismo fosfocálcico no se observan diferencias significativas en los valores séricos de calcio, fósforo fosfatasa alcalina, paratohormona, 1,25 di-hidroxi-vitamina D3 osteocalcina y calciuria; permaneciendo dichos parámetros en todo momento dentro de la normalidad.
Durante los controles clínicos los pacientes muestran una buena tolerancia del tratamiento, sin referir en ningún caso la aparición de dolor abdominal o síntomas dispépticos, que son los efectos adversos que con mayor frecuencia se describen en el tratamiento con alendronato oral.
DiscusiónLa distrofia muscular de Duchenne es una de las causas de osteoporosis secundarias en la infancia junto a otras enfermedades neuromusculares4 (tabla 2). Es bien conocido que las fuerzas mecánicas aplicadas al hueso resultan esenciales para el desarrollo del mismo, de modo que las alteraciones musculares y la disminución secundaria de la movilidad que esta enfermedad produce van a tener una influencia negativa en la masa y en la microarquitectura óseas5. Esta carga mecánica determina en gran medida el crecimiento transversal del hueso a expensas de una expansión perióstica, por lo que es característico que en aquellos pacientes con enfermedades neuromusculares los huesos presenten un menor grosor, y por tanto sean más propensos a las fracturas, sobre todo en el caso de los huesos largos. Así, por tomografía computarizada cuantitativa (QTC) se ha objetivado una disminución de la circunferencia perióstica en los huesos largos de niños con parálisis cerebral6. Del mismo modo, en pacientes con enfermedad de Duchenne se ha observado un aumento del riesgo de fracturas en miembros inferiores, especialmente en fémur distal, presentando una incidencia del 44%7. Por ello, la natación, la hidroterapia y los ejercicios con pesas han demostrado incrementar la DMO del cuello femoral en niños con parálisis cerebral severa e inmovilización secundaria5. Por su parte, la aplicación de corrientes de alta frecuencia por medio de plataformas vibratorias en niños sin capacidad de deambulación, ha producido un aumento en la DMO cuantificada a nivel de tibia proximal8.
Clasificación de la osteoporosis en la edad pediátrica
| Osteoporosis primaria |
| • Osteogénesis imperfecta |
| • Osteoporosis idiopática juvenil |
| • Síndrome osteoporosis-pseudoglioma |
| Osteoporosis secundaria |
| • Asociadas a disminución de la movilidad |
| ∘ Parálisis cerebral |
| ∘ Lesiones medulares y espina bífida |
| ∘ Distrofia muscular de Duchenne |
| ∘ Atrofia muscular espinal |
| ∘ Lesiones cerebrales adquiridas |
| ∘ Otras alteraciones del neurodesarrollo de etiología desconocida |
| • Asociadas a procesos inflamatorios mediados por citoquinas |
| ∘ Artritis idiopática juvenil |
| ∘ Lupus eritematoso sistémico |
| ∘ Dermatomiositis |
| ∘ Enfermedad inflamatoria intestinal |
| • Asociada a tratamiento sistémico con glucocorticoides |
| • Asociadas a situaciones de desnutrición |
| • Otras enfermedades asociadas |
| ∘ Hipogonadismo |
| ∘ Galactosemia |
| ∘ Talasemia mayor |
Los glucocorticoides se emplean a menudo en el tratamiento coadyuvante de la enfermedad de Duchenne, mejorando la fuerza muscular a corto plazo9. Sin embargo, es conocida la influencia de estos fármacos sobre el metabolismo óseo: inhiben la osteoblastogénesis y la producción de componentes de la matriz ósea por los osteoblastos, inhiben la producción del insulin-like growth factor I (IGF-I), que es un factor anabólico del hueso, estimulan la osteoclastogénesis y, por último, producen un balance negativo de calcio en el organismo10. Dichos efectos son mayores a nivel del hueso trabecular; por lo que van a afectarse fundamentalmente las vértebras11. Aun así, se ha observado que el deflazacort (como en los casos presentados) produce una pérdida menor de masa ósea que la prednisona o la metil-prednisolona, por lo que es el glucocorticoide más utilizado en estos pacientes12.
El alendronato es un análogo sintético del pirofosfato inorgánico, cuyo mecanismo de acción principal consiste en inhibir la reabsorción ósea adhiriéndose a los cristales de hidroxiapatita de fosfato cálcico de la matriz ósea, haciéndola así más resistente a la acción de los osteoclastos13. Aunque en la edad pediátrica el bifosfonato más utilizado es el pamidronato intravenoso, sobre todo en la osteogénesis imperfecta, existen diversos estudios sobre el empleo del alendronato en la osteoporosis de diversas etiologías2,13–19. En todos ellos se recoge un incremento en la DMO con disminución del número de fracturas y mejoría significativa del dolor óseo. Cuando se compara el alendronato con el pamidronato en pacientes diagnosticados de osteogénesis imperfecta se observa una eficacia equivalente entre ambos2. Asimismo, en uno de los estudios se encuentra una mejoría en distintos indicadores de calidad de vida: dolor, uso de analgesia, sensación de bienestar y capacidad de autocuidado17. En cuanto a la dosis, ésta oscila en los distintos estudios entre 0,3 y 1mg/kg/día, si bien parece que dosis menores tienen la misma eficacia2,13,18; en nuestros pacientes la dosis oscila entre 0,2 y 0,3mg/kg/día.
No se describen en los mismos trabajos efectos adversos reseñables. En los casos del presente estudio tampoco se han objetivado, mostrando una tolerancia adecuada al tratamiento. Conviene reseñar, no obstante, la importancia de explicar bien a los pacientes y a sus familias cómo tomar el tratamiento; de modo que el alendronato debe administrarse en ayunas y no tumbarse una vez ingerido el comprimido para evitar las molestias gastrointestinales, especialmente los síntomas dispépticos.
Otro aspecto que debe tenerse en cuenta es la facilidad de su administración, de forma que no precisa ingresos hospitalarios periódicos como en el caso del pamidronato intravenoso. Este hecho produce en los pacientes una mejoría en la calidad de vida así como una reducción del gasto sanitario2,13,16. Se ha estimado que 1 mes de tratamiento con pamidronato intravenoso es 10 veces más caro que 1 mes con alendronato oral13. Estas ventajas son especialmente apreciables en el caso de nuestros pacientes, ya que su enfermedad subyacente ocasiona múltiples visitas médicas e ingresos hospitalarios, y además proceden de poblaciones muy alejadas de nuestro hospital con la dificultad que conllevan sus desplazamientos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.