La agammaglobulinemia ligada al cromosoma X (ALX) se caracteriza por la detención de la diferenciación celular de los linfocitos B, que da lugar a infecciones bacterianas recurrentes. La terapia de por vida de reemplazo de inmunoglobulina (TRI) está indicada para prevenir infecciones y sus complicaciones.
Material y métodosSe hizo un estudio retrospectivo de pacientes con ALX en un hospital terciario. Los datos se revisaron retrospectivamente revisando historias clínicas.
ResultadosSe diagnosticó ALX en 9 niños. Uno de ellos (11%) tenía antecedentes familiares y había sido diagnosticado prenatalmente. El resto presentó signos de infección (89%) a una edad media de 13 meses, siendo su edad media al diagnóstico de 3,4 años de edad. Las infecciones más frecuentes fueron otitis media aguda (7/9) y neumonía (5/9). Siete niños (78%) presentaron niveles séricos de inmunoglobulina G (IgG) inferiores a 200mg/dL y todos tenían niveles de células B CD19+ B por debajo del 2%. Tres pacientes tuvieron neutropenia al diagnóstico (33%). En todos los casos se detectaron mutaciones en la tirosincinasa de Bruton (BTK). También en todos se inició la TRI por la vía intravenosa, que luego continuó por la vía subcutánea. La duración media del seguimiento fue de 10,7 años, con un número total acumulado de 97 años. Ocho niños (89%) alcanzaron niveles séricos de IgG superiores a los 800mg/dL. En un caso se observaron niveles más bajos por pérdida renal. No hubo ninguna defunción. El tipo de infección más frecuente tras el diagnóstico fue la otitis media aguda (6/9). A pesar de haberse conseguido niveles estables adecuados de IgG mediante la TRI, 2 pacientes desarrollaron bronquiectasias.
ConclusionesEn general, el pronóstico de la ALX es bueno siempre y cuando los pacientes reciban el tratamiento adecuado de manera precoz. Aun así, es posible que a pesar de ser tratados correctamente con TRI desarrollen bronquiectasias.
X-Linked agammaglobulinemia (XLA) is characterized by an arrest of B cell differentiation, leading to recurrent bacterial infections. Lifelong immunoglobulin replacement therapy (IRT) is indicated to prevent infections and their complications.
Material and methodsA retrospective study of patients with XLA followed in a level three hospital was performed; data was collected retrospectively by review of clinical files.
ResultsXLA was diagnosed in 9 children. One (11%) had a positive family history with a prenatal diagnosis. Infection was the clinical presentation in all the others (89%), at an average age of 13 months; diagnosis was established at a mean age of 3.4 years. Acute otitis media (7/9) and pneumonia (5/9) were the most frequently observed. Seven (78%) presented serum immunoglobulin G (IgG) levels below 200mg/dL and all of them had CD19+ B cells below 2%. Neutropenia was present at diagnosis in three patients (33%). Bruton tyrosine kinase (BTK) mutations were identified in all cases. Intravenous IRT was initiated, switched later to subcutaneous administration, in all. The mean time of follow-up was 10.7 years with cumulative time of 97 years. Eight children (89%) achieved IgG serum levels above 800mg/dL. One presented lower values due to renal loss. No deaths occurred. After diagnosis the most frequent infections were acute otitis media (6/9). In spite of stable adequate IgG levels on IRT, two patients developed bronchiectasis.
ConclusionsXLA overall prognosis is good, as long as patients have an early and adequate treatment. However, bronchiectasis can occur even on adequate immunoglobulin replacement therapy.
La agammaglobulinemia ligada al cromosoma X (ALX [MIM 300755]) es una inmunodeficiencia primaria caracterizada por la detención del desarrollo de las células B1, con una reducción notable en el número de linfocitos B y niveles séricos de inmunoglobulinas (Ig) que comporta una mayor susceptibilidad a las infecciones recurrentes y graves2. Las infecciones suelen comenzar a aparecer entre los 3 y los 6 meses de edad, al disminuir los niveles de IgG materna. Si hay antecedentes de la enfermedad en la familia, se puede sospechar la ALX y realizar un diagnóstico prenatal3. Las infecciones de las vías respiratorias por bacterias encapsuladas son el sello distintivo de la ALX, especialmente la otitis, la sinusitis, y la neumonía2,4,5. La mayoría de estas infecciones se deben a bacterias encapsuladas piogénicas (Streptococcus pneumoniae, Haemophilus influenzae y Staphylococcus aureus)2. La literatura existente indica que los patógenos aislados con más frecuencia en pacientes con sepsis corresponden a distintas especies de Pseudomonas2,6. También son frecuentes las infecciones del tracto digestivo por Giardia lamblia2. Los pacientes con ALX son particularmente susceptibles a los enterovirus y en particular al poliovirus, echovirus, y virus Coxsackie. Se han descrito casos de poliomielitis causada por la administración de la vacuna viva atenuada, con tasas altas de mortalidad2.
La incidencia estimada varía de 1:100.000 a 1:200.000 casos por nacidos vivos2. La ALX se debe a mutaciones en el gen BTK que codifica la tirosincinasa de Bruton, localizado en el cromosoma X (Xq21.3- Xq22)7. La proteína BTK está involucrada en todas las etapas del desarrollo del linaje B y en los precursores mieloides y eritroides, no afectando a los linfocitos T ni a las células NK. Sus mutaciones causan fallos en las etapas tempranas del desarrollo de las células B, resultando en una reducción considerable en el nivel de las células B en sangre2. Hasta la fecha, se han descrito más de 800 mutaciones distintas8. La detección de mutaciones en el BTK es un criterio necesario para el diagnóstico definitivo y el asesoramiento genético9.
La terapia de reemplazo de Ig (TRI) está indicada de por vida en estos pacientes. Si la enfermedad se detecta precozmente, los pacientes pueden llegar a tener una buena calidad de vida. El tratamiento precoz con TRI es esencial para reducir la recurrencia y la gravedad de las infecciones, el número de ingresos hospitalarios y la morbilidad debida a complicaciones crónicas de la enfermedad2,10.
El objetivo de este estudio era conocer las características de los pacientes con ALX con seguimiento en la Unidad de Enfermedades Infecciosas e Inmunodeficiencias pediátricas del Departamento de Pediatría de un hospital terciario del norte de Portugal, evaluando su presentación clínica y su evolución.
Material y métodosDiseño y protocolo del estudio: entre enero de 1991 y diciembre del 2013 se llevó a cabo un estudio descriptivo retrospectivo de los pacientes diagnosticados con ALX con seguimiento en la Unidad de Enfermedades Infecciosas e Inmunodeficiencias pediátricas del Departamento de Pediatría de un hospital terciario del norte de Portugal. Los datos se recogieron mediante la revisión de historias clínicas.
Datos: los datos recogidos incluyeron el factor que motivó el diagnóstico (presencia de antecedentes familiares o de infecciones), la edad al inicio de las manifestaciones clínicas (basada en la fecha de la primera infección), edad al diagnóstico, el tipo de infecciones previas al diagnóstico y a los ingresos hospitalarios, los niveles de IgG, valores de células B CD19+ B al diagnóstico, la mutación identificada en el BTK, la duración de administración de TRI, y las infecciones y complicaciones no infecciosas durante el seguimiento.
Definiciones empleadas por los autores: el diagnóstico de ALX se basó en criterios establecidos: paciente varón con menos del 2% de células B CD19+ y mutación en el gen BTK, conforme a la definición de la European Society for Immunodeficiencies11.
Se consideraba que había presencia de antecedentes familiares cuando algún miembro de la familia había sido diagnosticado de ALX.
El retraso del diagnóstico se definió como el tiempo transcurrido desde la edad al inicio de los síntomas (primera infección) y la edad al diagnóstico.
La otitis media recurrente se definió como la ocurrencia de 3 o más episodios de otitis media aguda y la neumonía recurrente, como la ocurrencia de más de un episodio de neumonía.
La TRI consistió en la administración por vía intravenosa de IgG cada 3 o 4 semanas en las dosis necesarias para mantener una concentración mínima de IgG en suero superior a los 800mg/dL, o la administración subcutánea de IgG 1 o 2 veces por semana. El preparado para la administración subcutánea está disponible en Portugal desde 2007.
Análisis descriptivos: los resultados de las variables cuantitativas se expresan como media, mediana y rango, y los de las variables categóricas, como porcentajes.
ResultadosDe los 247 pacientes con deficiencias de anticuerpos con seguimiento en nuestra Unidad de Enfermedades Infecciosas e Inmunodeficiencias pediátricas, 9 (3,6%) recibieron un diagnóstico de ALX (la tabla 1 presenta sus datos clínicos y de laboratorio).
Perfil clínico y datos de laboratorio
| Paciente | Edad al comienzo de los síntomas (meses) | Edad al diagnóstico(meses) | Infecciones previas al diagnóstico | Neutropenia al diagnóstico | IgG en suero(mg/dL) | CD19+(% de linfocitos totales) | Mutación BTK | Complicaciones durante el seguimiento | Duración de la TRI (años) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Infecciosas | No infecciosas | |||||||||
| 1 | 2 | 36 | OM recurrente; otitis con mastoiditis; neumonía con derrame pleural | No | 53 | 0,1 | p.Arg641His | OM aguda; conjuntivitis | 5 | |
| 2 | 2 | 16 | OM recurrente; ectima gangrenoso | Sí | 43 | 0,1 | p.Tyr361X | OM aguda; conjuntivitis | 6 | |
| 3 | 24 | 48 | OM recurrente; artritis séptica | No | 214 | 0,2 | c.1178-1G>A (intrón 13) | OM aguda; giardiasis | 10 | |
| 4 | 9 | 72 | Neumonía recurrente; OM recurrente; gastroenteritis aguda | No | 720 | 0,6 | c.1178-1G>A (intrón 13) | OM aguda; giardiasis | Bronquiectasia | 13 |
| 5 | – | Período neonatala | – | No | 0 | 1,4 | p.Arg288Gln | Neumonía | Glomerulonefritis membranoproliferativa | 12 |
| 6 | 35 | 42 | OM recurrente; neumonía | Sí | 0 | 0 | p.Glu7X | OM aguda; conjuntivitis; giardiasis | 5 | |
| 7 | 6 | 72 | Neumonía recurrente; artritis séptica | No | 0 | 0 | Deleción del exón 6 | Conjuntivitis; sinusitis | 22 | |
| 8 | 24 | 36 | OM recurrente; neumonía | Sí | 0 | 0,1 | Deleción del exón 16 | OM aguda; conjuntivitis | Bronquiectasia | 13 |
| 9 | 2 | 12 | OM recurrente | No | 0 | 0 | p.Arg255X | 11 | ||
OM: otitis media.
En la mayoría de los casos, el diagnóstico se hizo a raíz de infecciones graves o recurrentes (8-89%), con una edad media al diagnóstico de 3,4 años (rango: 1 a 6 años) y de 13 meses al inicio del cuadro clínico (mediana: 7,5 meses; rango: 2 a 35 meses). La mayoría de los pacientes (63%) presentaron manifestaciones clínicas en el primer año de vida. Cinco casos (63%) se diagnosticaron antes de los 3 años de edad. La media de tiempo transcurrido entre la aparición de los síntomas y el diagnóstico fue de 2,5 años. Todos los niños habían sido hospitalizados por infección.
Las infecciones más comunes antes del diagnóstico fueron de las vías respiratorias y entre ellas la más frecuente fue la otitis media (88%), en uno de los casos complicada con mastoiditis. También fueron comunes las neumonías (56%), recurrentes en 4 de los pacientes. Dos pacientes tuvieron artritis séptica y uno ingresó en el hospital con ectima gangrenoso asociado a infección por Pseudomonas. Los tipos de infección presentes antes del diagnóstico se muestran en la tabla 1.
Un paciente con antecedentes familiares de ALX se diagnosticó antes del nacimiento y fue tratado en el período neonatal antes de contraer infecciones.
La mayoría de los pacientes tenían niveles muy bajos de IgG en suero al diagnóstico, con una media de 114mg/dL y 7 pacientes (78%) con niveles inferiores a 200mg/dL. Los recuentos de células B tenían valores del 0 al 1,4%.
Un tercio de los niños presentaron neutropenia asociada a infecciones. Las concentraciones mínimas fueron de entre 0 y 510/mm3 y 2 niños tuvieron concentraciones de neutrófilos inferiores a los 500/mm3. En los 3 niños, los valores se normalizaron en la primera semana de tratamiento con antibióticos y TRI. La neutropenia no recurrió en ninguno de ellos.
En cada caso se identificó una mutación distinta del gen BTK, salvo en los pacientes 3 y 4, que eran hermanos (tabla 1).
Todos los pacientes iniciaron la TRI con IgG por vía intravenosa (IVIG) para alcanzar niveles adecuados de IgG rápidamente. Una vez alcanzados, todos los pacientes optaron por cambiar a la IgG subcutánea (SCIG) para la autoadministración en el domicilio.
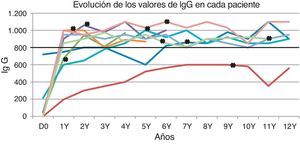
La duración media de la TRI fue de 10,7 años, sumando un total de 97 años. Ocho pacientes alcanzaron niveles mínimos adecuados de IgG; solo en un caso no se pudieron obtener concentraciones mínimas superiores a los 800mg/dL pese a la administración de dosis altas de reemplazo de IgG (fig. 1). Este último paciente desarrolló un síndrome nefrótico a los 10 años de edad, con pérdidas masivas de proteína en la orina.
Se observaron complicaciones infecciosas leves —otitis media aguda y conjuntivitis— en la mayoría de los pacientes tras el inicio de la TRI. Ninguna requirió ingreso hospitalario. Dos pacientes desarrollaron bronquiectasia (pacientes 4 y 8).
No hubo ningún fallecimiento. Todos los pacientes han tenido un crecimiento normal y hasta hoy ninguno ha desarrollado enfermedades autoinmunes o cancerosas.
DiscusiónLa literatura existente concluye que alrededor del 50% de los pacientes con ALX tienen manifestaciones clínicas antes de cumplir un año y, aproximadamente, el 50% de los casos se diagnostican antes de los 2 años de edad3. Nuestro estudio obtuvo resultados similares en ambos aspectos. Tal y como se observa en estudios anteriores3, la presentación clínica más común es la infección (89%). Las infecciones bacterianas recurrentes y la falta de respuesta a los antibióticos por vía oral fueron las claves principales para el diagnóstico de inmunodeficiencia. La otitis media recurrente fue la infección más común en nuestros pacientes antes del diagnóstico, seguida de la neumonía, tal y como refiere la literatura12-14.
La presentación clásica de ALX se observó en el paciente 1 (tabla 1), que tuvo episodios recurrentes de otitis media aguda desde los 2 meses de edad, 3 episodios de mastoiditis y una neumonía bacteriana con derrame pleural a los 3 años de edad, que es cuando se diagnosticó la ALX. El paciente 2 tuvo una presentación atípica de ALX (tabla 1): ingresó en el hospital con sepsis por Pseudomonas y ectima gangrenoso a los 16 meses de edad. Esta presentación se ha descrito previamente en la literatura y puede ocurrir en un 10% de los casos2.
En nuestro estudio, la edad media al diagnóstico fue de 3,4 años, con un retraso del diagnóstico de 2,5 años. Como un mayor índice de sospecha puede acortar el retraso del diagnóstico, hay que aumentar la sensibilización de los pediatras sobre esta enfermedad rara. Analizar los niveles de Ig en suero resulta sencillo y barato. Si el diagnóstico se hace antes, se puede comenzar antes el tratamiento y mejorar los resultados.
Uno de los niños se benefició de un diagnóstico prenatal que posibilitó la iniciación de la TRI antes de contraer infecciones, ilustrando la importancia de las pruebas genéticas para detectar mutaciones en el gen BTK, tanto para confirmar el diagnóstico como para detectar portadores y ofrecer asesoramiento prenatal a las familias.
Los datos publicados muestran porcentajes variables de neutropenia en pacientes con ALX de entre el 10 y el 25%15,16. La neutropenia fue parte de la presentación clínica del 11% de los casos en un registro estadounidense antes de iniciar la TRI3 y se describió en el 18% de los casos en un estudio japonés de alcance nacional17. Aunque aún no se ha determinado el papel del gen BTK en el desarrollo de los neutrófilos, el gen está asociado a una alta carga bacteriana, característica de una infección activa, que suele responder al tratamiento con antimicrobianos e Ig16. Nuestros datos mostraron neutropenia en un tercio de los casos (pacientes 2, 10 y 12), siendo grave en 2. Los niveles de neutrófilos se normalizaron al resolverse la infección y mediante la TRI, y no se documentaron recurrencias.
El sello distintivo de los pacientes con ALX es una reducción considerable en todas las clases de Ig y células B. En nuestro estudio, todos los pacientes tenían las células B por debajo del 2% y la mayoría mostraba niveles extremadamente bajos (< 1%). También se observaron niveles bajos en todas las clases de Ig; al diagnóstico, el 78% presentó niveles de IgG inferiores a 200mg/dL. Los autores desean destacar la dificultad del diagnóstico del paciente 4, debida a una presentación atípica de ALX, con otitis media y neumonía recurrentes, pero con niveles séricos de IgG de alrededor de 720mg/dL. La investigación posterior reveló la ausencia de isohemoaglutininas, una respuesta pobre a las vacunas, y niveles muy bajos de células B (0,6%), lo que llevó al diagnóstico de ALX, que luego se confirmó con la identificación de una mutación en el BTK.
Nuestros datos mostraron una mutación en el BTK en todos los pacientes. Según varias publicaciones, solo hay antecedentes familiares en el 30-50% de los pacientes de ALX1. En nuestra serie, 2 pacientes tenían antecedentes familiares, pero todas las madres eran portadoras. Se encontró la misma mutación en 2 casos, los pacientes 3 y 4, que eran hermanos.
La TRI es la clave del tratamiento de la ALX. Existen 2 preparaciones de TRI, la IVIG y la SCIG, ambas disponibles en Portugal. Datos provenientes de estudios observacionales muestran que la TRI reduce las tasas de infección y de hospitalización en pacientes con ALX1,18. En nuestro estudio, todos los pacientes evolucionaron favorablemente con la TRI: un número pequeño de infecciones y ninguna infección grave. Todos los pacientes se pasaron a la SCIG para la autoadministración en domicilio y reducir las visitas al hospital. El tratamiento intensivo con antibióticos de cualquier infección sospechada o probada es otro elemento a destacar en el seguimiento de estos pacientes2. También es conveniente ofrecer asesoramiento para prevenir la exposición a patógenos.
Se ha observado que las infecciones del tracto respiratorio son un problema clínico de envergadura a pesar de la TRI1,4. Así, algunos estudios han demostrado que la neumonía y la sinusitis crónica o aguda son las infecciones del tracto respiratorio más comunes tras la IRT2,3, infecciones que también encontramos en nuestros pacientes: la mayoría presentaron complicaciones infecciosas menores, en su mayoría otitis medias (67%). Nuestros datos no mostraron ninguna infección grave durante la TRI.
Se sabe que la TRI tiene limitaciones. No se puede esperar que el tratamiento con altas dosis de TRI contribuya de manera significativa a prevenir las sinusitis infecciosas, no solo por la escasa presencia de IgG en las mucosas, sino también porque en estas superficies la protección la brindan sobre todo los anticuerpos IgA e IgM secretores, de los que también se carece en la ALX13. El hallazgo de una incidencia significativamente menor de infecciones bacterianas graves con concentraciones residuales de IgG en suero superiores a los 800mg/dL en lugar de a los 500mg/dL sugiere que el umbral de 500mg/dL es demasiado bajo10. Nuestros pacientes recibieron dosis de reemplazo para alcanzar un umbral de 800mg/dL, y todos menos uno consiguieron alcanzar concentraciones altas estables (fig. 1); un niño que tenía proteinuria masiva (paciente 5) no fue capaz de mantener niveles altos a pesar de recibir TRI a dosis altas.
Algunos estudios demuestran que aunque los pacientes con ALX sean correctamente tratados, podrían acabar desarrollando una enfermedad respiratoria crónica4, lo que resalta la importancia de hacer un seguimiento a los pacientes para detectar daño pulmonar subclínico pero progresivo3,4. Este seguimiento se lleva a cabo mediante pruebas de función pulmonar y de radiología4. Un estudio italiano de 73 pacientes no encontró vínculo alguno entre el desarrollo de daño pulmonar crónico y la edad al diagnóstico o los niveles séricos de Ig13. Dos pacientes (22%) desarrollaron bronquiectasias durante el seguimiento, 3 y 11 años después del inicio de la TRI. Habían presentado neumonía al diagnóstico, tras lo cual tuvieron tomografía computarizadas pulmonares normales y recibieron el tratamiento adecuado para el reemplazo de IgG. Esto presenta el problema de que unos niveles adecuados de IgG en suero no bastaron para prevenir esta complicación y de que debe de haber otros factores involucrados en el desarrollo de bronquiectasias, como niveles bajos de IgA e IgG en mucosa.
La conjuntivitis recurrente fue un problema de importancia en nuestros pacientes (44%) y de difícil manejo. Algunos expertos recomiendan la aplicación tópica de IgG, pero su uso no está basado en la evidencia y no existen preparados oculares.
Existen datos contradictorios en cuanto al riesgo de cáncer en pacientes con ALX, sobre todo en lo que respecta a las neoplasias linfoides19. Todavía no se ha esclarecido la relación entre la ALX y el cáncer19. Los datos de nuestro estudio no revelaron ningún caso de cáncer.
El pronóstico de la ALX ha mejorado considerablemente en los últimos 25 años gracias a diagnósticos más tempranos, al uso de la TRI con objeto elevar los umbrales, y al tratamiento temprano de las infecciones. Se pueden obtener buenos resultados con un diagnóstico precoz y un tratamiento inmediato con TRI, tal y como observamos en nuestra serie. El número de pacientes incluido en el estudio fue pequeño, por lo que no permite sacar más conclusiones. Convendría comprender mejor la fisiopatología del daño en las mucosas (ocular, respiratoria y gastrointestinal) para desarrollar estrategias terapéuticas mejores y prevenir complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa: comunicación oral en el «XXXVIII Reunião Anual da Sociedade Portuguesa de Imunologia-Dos distúrbios imunológicos às imunoterapias»; Oporto, Portugal, 25 a 27 de noviembre del 2012.