La asfixia perinatal es un acontecimiento con efectos de gran alcance, pudiendo conducir no solo al desarrollo de encefalopatía neonatal, sino también a un fallo multiorgánico (FMO). Esta afectación posiblemente se deba a la redistribución del flujo sanguíneo, mediante el cual se conserva la irrigación de órganos vitales como el corazón, el cerebro y las glándulas suprarrenales, a expensas de su disminución en otros órganos.
El objetivo del presente trabajo fue conocer la incidencia y la etiopatogenia de los órganos más frecuentemente afectados en el FMO neonatal tras la asfixia perinatal.
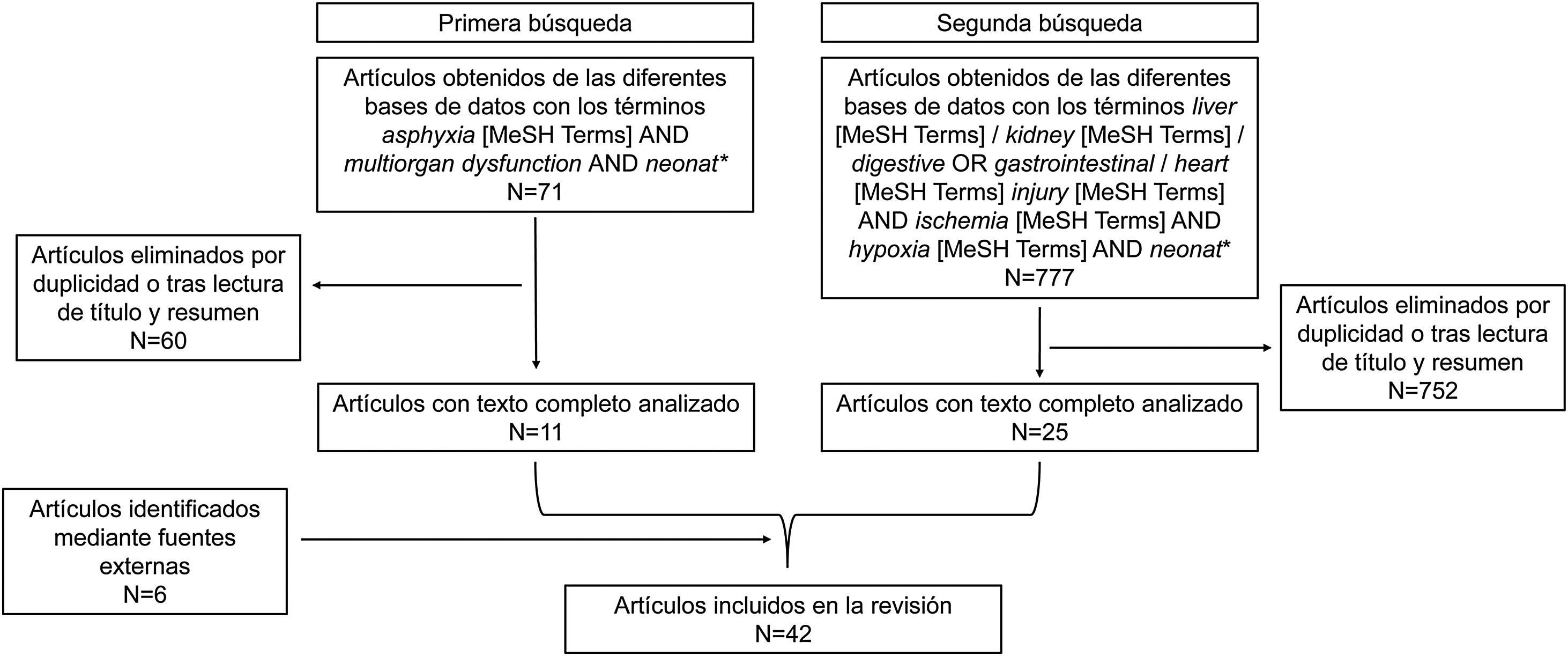
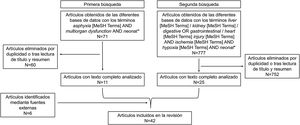
Se realizó una búsqueda bibliográfica sistemática en las bases de datos Pubmed, Scopus y The Cochrane Library empleando los términos MeSH (ischemia AND hypoxia AND multiorgan dysfunction AND neonat*), (asphyxia AND multiorgan dysfunction AND neonat*) y (liver / kidney / digestive OR gastrointestinal / heart injury AND ischemia AND hypoxia AND neonat*). Se incluyeron trabajos clínicos y preclínicos posteriores al año 2000 y se excluyeron series de casos, cartas al director, cohortes sin grupo comparador y abstracts.
En el presente trabajo describimos que el fallo multiorgánico asociado a la asfixia perinatal es un fenómeno frecuente y relevante en la morbimortalidad del neonato, pudiendo llegar a producir no solo alteraciones en riñón, hígado y tracto gastrointestinal, sino también miocardiopatía si el fenómeno se prolonga o es de elevada gravedad.
Perinatal asphyxia is an event with far-reaching consequences that can lead not only to the development of neonatal encephalopathy, but also to multiple organ failure (MOF). This ailment may result from the redistribution of blood flow, which would preserve the perfusion of vital organs such as the heart, brain and adrenal glands at the expense of other organs.
The objective of the study was to determine the incidence and aetiopathogenesis of failure in the organs most frequently involved in neonatal MOF following perinatal asphyxia.
We conducted a systematic literature search in the PubMed, Scopus and Cochrane Library databases using the MeSH terms (ischemia AND hypoxia AND multiorgan dysfunction AND neonat*), (asphyxia AND multiorgan dysfunction AND neonat*) and (liver/kidney/digestive OR gastrointestinal/heart injury AND ischemia AND hypoxia AND neonat*). We selected clinical and preclinical studies published after 2000 and excluded case series, letters to the editor, cohort studies without comparison groups and abstracts.
In this study, we found that MOF associated with perinatal asphyxia is a frequent phenomenon with a relevant impact on neonatal morbidity and mortality, as it can cause changes not only in the kidney, liver and gastrointestinal tract, but also cardiomyopathy if the ailment is protracted or severe.
La asfixia perinatal sigue teniendo una incidencia relativamente elevada (1-6‰) en los recién nacidos (RN) vivos1. Se entiende por tal el proceso en el que se produce hipoxia progresiva, hipercapnia y acidosis2, tratándose de una privación de oxígeno transitoria pero potencialmente lesiva. La consecuencia principal y de mayor severidad es el desarrollo de encefalopatía hipóxica-isquémica (EHI), que con una incidencia de 2,5 por cada 1000 nacidos vivos3, se trata de una condición patológica grave con elevada morbimortalidad4.
Durante la asfixia, para poder preservar la perfusión sanguínea y la correcta oxigenación del cerebro, corazón y suprarrenales, la redistribución del gasto cardíaco a expensas de disminuir la irrigación de otros órganos puede producir la consiguiente lesión secundaria de estos últimos2,5,6. Es una de las causas principales que se contemplan en el fallo multiorgánico (FMO) derivado de la interrupción del flujo placentario2,5. Si la reducción del flujo sanguíneo se prolonga en el tiempo, la vasoconstricción local puede causar daño celular y una función tisular insuficiente, derivando en disfunción posnatal5,6. Shah et al.6 mostraron que todos los lactantes que presentaban EHI secundaria a asfixia grave manifestaron evidencias de disfunción de al menos un órgano o sistema, además del sistema nervioso central. Así, la asfixia perinatal y el FMO posterior podrían implicar un elevado riesgo de desarrollar morbilidades graves de por vida que deben ser consideradas7.
Material y métodosSe realizó una revisión sistemática de artículos con la ayuda del motor de búsqueda PubMed, que permite el acceso a diferentes bases de datos bibliográficas recopiladas por la National Center for Biotechnology Information en la National Library of Medicine, así como en Scopus y The Cochrane Library. Se incluyeron trabajos clínicos y preclínicos posteriores al año 2000 y se excluyeron series de casos, cartas al director, cohortes sin grupo comparador y resúmenes/abstracts.
En una primera búsqueda se incluyeron los términos asphyxia [MeSH Terms] AND multiorgan dysfunction AND neonat*. A continuación, se leyeron los resúmenes para comprobar si trataban específicamente del fallo multiorgánico tras asfixia perinatal, si podían incluir datos relevantes o si, por el contrario, no procedía incluirlos en el trabajo. Se seleccionaron 11 trabajos.
Pese a que los artículos escogidos aportaron una visión general para comenzar a desarrollar el trabajo, no proporcionaban suficientes datos de cada órgano en particular, por lo que se decidió realizar nuevas búsquedas para cada órgano de interés. Así, los órganos escogidos fueron: hígado, riñón, tracto gastrointestinal y corazón. Esta selección se realizó teniendo en cuenta la frecuencia con que se afectaban cada uno de ellos tras la asfixia perinatal y su posible trascendencia en la morbimortalidad neonatal. No se incluyeron datos sobre alteraciones del sistema nervioso central, ya que la lesión cerebral, aunque de suma importancia, es bien conocida y la finalidad de este trabajo fue mostrar la afectación de otros órganos distintos al cerebro tras la asfixia.
Los términos incluidos en la segunda búsqueda de información sobre los diferentes órganos fueron liver [MeSH Terms] / kidney [MeSH Terms] / digestive OR gastrointestinal / heart [MeSH Terms] injury [MeSH Terms] AND ischemia [MeSH Terms] AND hypoxia [MeSH Terms] AND neonat*, acotando nuevamente los años de publicación de los artículos entre 2000 y 2021. El proceso de selección de las publicaciones obtenidas fue similar al explicado anteriormente, procediendo a la lectura de los resúmenes y, en el caso de tratar concretamente sobre fallo multiorgánico tras asfixia perinatal y/o presentar datos relevantes para la revisión (incidencia, etiología, correlaciones y/o biomarcadores), se evaluaron los artículos completos. Tras la exclusión de los trabajos repetidos ya incluidos procedentes de la primera búsqueda y de los que no guardaban relación con el tema a desarrollar, junto con la incorporación de trabajos mediante fuentes externas, se obtuvieron finalmente un total de 42 publicaciones para su inclusión en la revisión (fig. 1). Todo el proceso de búsqueda y revisión fue realizado por duplicado. Las discordancias de criterio entre los autores se resolvieron por consenso.
Fallo multiorgánico tras asfixia perinatalA continuación, se describen los datos encontrados sobre los órganos más frecuentemente afectados tras la asfixia perinatal.
RiñónIncidenciaLa incidencia de lesión renal entre los RN a término asfixiados es significativa (50-72%), habiéndose asociado a un mayor riesgo de mortalidad. Es importante considerar que no existen unos criterios concretos que determinen su presencia. Para ello se suele tener en cuenta la elevación de urea y creatinina acompañada de una reducción de la diuresis8; aunque debemos recordar que la creatinina no suele elevarse hasta que no se ha perdido un 25-50% de la función renal y que el fracaso renal no siempre va acompañado de oliguria5,8.
Lesión renal y su etiologíaA pesar de la significativa incidencia de lesión renal, pocos estudios han estimado los cambios que sufre el riñón. La elevada resistencia vascular renal intraútero, la alta actividad de la renina plasmática y la baja tasa de filtrado glomerular, entre otros factores, hacen a este órgano especialmente sensible a la hipoperfusión. La principal lesión renal es la necrosis tubular aguda y, en casos más extremos, la necrosis cortical renal difusa8. La hipoperfusión mantenida no solo disminuirá el filtrado glomerular, sino que puede lesionar aquellas células con mayor consumo energético (las células tubulares) originando necrosis del túbulo proximal y de la porción ascendente del asa de Henle. Además, la infiltración de neutrófilos circulantes en el tejido renal isquémico y la liberación de productos citotóxicos pueden favorecer la lesión, no solo de las células endoteliales, sino de todo el tejido renal9.
Du et al.10, en un estudio in vitro con células del túbulo renal proximal de humanos sometidas a hipoxia seguida de reoxigenación, describieron un menor número de células viables y mayor actividad de lactato deshidrogenasa. Pudieron concluir que la integridad de la membrana se ve lesionada por episodios hipóxicos y que las células tubulares pueden dañarse de forma irreversible. En un modelo experimental de cerdo neonatal, Satas et al.11 observaron la presencia de infarto renal secundario a hipoxia-isquemia.
Basados en la guía KDIGO12, el estudio AWAKEN definió la lesión renal aguda en neonatos como el aumento de la creatinina sérica de ≥0,3mg/dl (26,5μmol/l) o ≥50% del valor más bajo anterior, y/o si la diuresis fue <1ml/kg/h en los días posnatales 2 a 713. En este estudio, el límite de creatinina sérica para el estado 3 se estableció en 2,5mg/dl (221μmol/l), en lugar de los 4,0mg/dl (353,6μmol/l) que se usan en adultos12,13. Así mismo, se han desarrollado herramientas predictivas como la «renal angina index», que trata de identificar a los niños en riesgo de lesión renal aguda que perdure 72h, más allá de la lesión funcional. Los signos clínicos de lesión se basan en cambios en el aclaramiento de creatinina estimado o el porcentaje de sobrecarga de líquidos14. Más recientemente, el puntaje neonatal STARZ sirve para determinar de forma rápida y cuantitativa el riesgo de lesión renal aguda en los RN ingresados en la UCIN, incluyendo variables como la edad de ingreso, edad gestacional, sepsis, enfermedad cardíaca importante, diuresis, creatinina sérica y uso de fármacos nefrotóxicos, de furosemida o de inotropos15.
En RN con encefalopatía neonatal tratados con hipotermia terapéutica, se describe una gran variabilidad en la función renal y la lesión. Algunos autores señalan que el estudio de los valores de creatinina sérica sobre la edad posnatal puede proporcionar información relevante para el tratamiento de estos neonatos16. Otros trabajos han tratado de evaluar el rendimiento predictivo de diversos biomarcadores de orina para la lesión renal aguda: pese a que la lipocalina asociada a gelatinasa de neutrófilos, la molécula de daño renal-1 y la interleucina-18 mostraron niveles elevados en RN con encefalopatía hipóxico-isquémica que recibieron hipotermia terapéutica y desarrollaron lesión renal aguda, su amplia variabilidad y unos niveles de corte poco definidos hacen que su utilidad clínica no esté clara17.
Alteración electrolíticaSecundariamente a la lesión renal aguda oligúrica, el neonato asfíctico corre riesgo de presentar hiponatremia debido a la retención de agua y disminución de reabsorción de sodio a nivel tubular8. Además, puede aparecer un síndrome de secreción inadecuada de hormona antidiurética, contribuyendo a desarrollar hiponatremia, aumento de peso considerable, disminución de la osmolaridad sérica, oliguria y/o aumento de la osmolaridad úrica2,8.
En estos RN en los que existe un riesgo aumentado de presentar hiperpotasemia por el fallo renal, es importante tener en cuenta el aumento de excitabilidad al nivel del miocardio8. Esta alteración cardíaca puede verse agravada por la hipocalcemia2. La concentración de magnesio también puede verse alterada bien al alza o bien a la baja8, habiéndose determinado niveles bajos en la fase poliúrica de la necrosis tubular2.
HígadoLa lesión hepática parece estar más relacionada con la hipoperfusión secundaria a la redistribución cardiovascular que a la propia hipoxia5, puesto que la disminución del flujo sanguíneo al parénquima hepático, en especial al lóbulo derecho18, puede producir hepatitis hipóxica19.
IncidenciaSe ha relacionado la asfixia perinatal y la lesión hepática, aunque con una incidencia muy variable (22-80%) (tabla 1). Hankins et al.20 refieren la incidencia más elevada (80%), aunque este valor pudiera estar relacionado con la gravedad de los pacientes incluidos en el estudio, ya que era necesario que presentaran una EHI tras el episodio asfíctico. En un trabajo posterior21, cerca del 50% de los RN no presentaban EHI. Bien es cierto que en ambos trabajos los criterios de daño hepático parecen ser menos estrictos que los de otros estudios como el de Tarcan et al.22, en los que la alanina aminotransferasa debe tener valores superiores a 100U/L, o el de Barnett et al.23, en el que esta proteína o la aspartato aminotransferasa deben tener un valor máximo de 200U/L a las 48h. Quizás por ello, estos trabajos presenten una incidencia del 39% y del 22%, respectivamente. Además, este último trabajo incluía a neonatos que habían fallecido por asfixia perinatal, lo que nos orienta sobre la intensidad del evento de asfixia de los RN de su muestra.
Variabilidad de la incidencia de la lesión hepática en función del estudio realizado. Se presenta la referencia de cada artículo, el tipo de estudio, la incidencia, los principales criterios de inclusión de la muestra, así como los biomarcadores y criterios de daño hepático empleados por cada estudio. ALT: alanina aminotransferasa, AST: aspartato aminotransferasa, FA: fosfatasa alcalina, LDH: lactato deshidrogenasa, PT: tiempo de protrombina, INR: índice internacional normalizado, GGT: gamma-glutamil transferasa
| ReferenciaTipo estudio | Incidencia | Muestra | Biomarcadores | Criterios de daño hepático |
|---|---|---|---|---|
| Choudhary et al., 2015Estudio de casos (n=70) y controles (n=30) prospectivo en RN | 42,85% | 14,28% HIE etapa I,25,73% HIE etapa II,11,42% HIE etapa III,48,57% normales | ALT, AST, FA, LDH, proteínas totales, albúmina sérica, TP, INR | ALP50U/L,AST>140U/L,FA>420U/L,LDH>580U/L,proteínas totales <4,5g/dl,albúmina sérica <2,5g/dl,TP>20segundosy/o INR>1,2 |
| Karlsson et al., 2009Modelo preclínico en cerdos (n=19) | 63,16% | Episodio de isquemia-hipoxia global de 45min seguido de 72h de supervivencia | 4 secciones histológicas de áreas hepáticas estandarizadas | Daño objetivado en el corte histológico |
| Tarcan et al., 2007Estudio de cohortes retrospectivo en RN (n=56) | 39% | Neonatos ingresados en la Unidad de Cuidados Intensivos con diagnóstico de asfixia perinatal | ALT | ALT elevada el doble del valor normal (>100U/L aprox.) |
| Karlsson et al., 2006Estudio de casos (n=26) y controles (n=56) en RN | 46% | Neonatos a término asfixiados con Apgar menor de 7 a los 5min | AST, ALT, LDH, GGT, albúmina, bilirrubina total y conjugada, actividad de la colinesterasa, INR, recuento de células sanguíneas | Elevación de AST o ALT superior al valor medio del grupo control más 2 desviaciones estándar, con el valor máximo observado más tarde de las 24h después del nacimiento, y un posterior descenso a valores casi normales a los 10 días |
| Barnett et al., 1997Estudio de cohortes retrospectivo en RN (n=58) | 22% | Fallecidos tras asfixia perinatal | ALT, AST | ALT o AST con valor máximo a las 48h de 200U/L |
| Hankins et al., 2002Estudio de cohortes prospectivo (n=46) | 80% | Imprescindible que el RN presentara encefalopatía tras asfixia | AST, ALT, LDH | AST o ALT o LDH con valor 1,5 veces superior al grupo control |
Esta variabilidad en la incidencia podría explicarse no solo por las diferencias en la definición de la disfunción hepática, sino por los criterios de selección de la muestra de cada estudio. Cabe destacar que también puede existir un infradiagnóstico de lesión hepática al usar biomarcadores hepáticos para su determinación, ya que, aunque existe una correlación entre los niveles de transaminasas hepáticas y el daño hepático21, unos niveles normales de estas o de lactato deshidrogenasa no lo descartan.
Correlación histológica de la lesión hepáticaEn un estudio en 19 lechones, los hallazgos observados por Karlsson et al.24 incluyeron focos de necrosis en 5 animales, infarto en 6, infiltrado neutrofílico en 6, trombos en las venas portales intrahepáticas en 3 y hematoma subcapsular en uno. Ikeda et al.18 han referido la presencia de eosinofilia citoplasmática y colestasis canalicular en una de las muestras de corderos asfixiados y presencia de cambios grasos en muestras de tejido que había sufrido asfixia leve. Dos corderos fetales con daño cerebral grave mostraron cambios grasos y congestión, así como presencia de un infiltrado de células inflamatorias y necrosis centrolobulillar.
Barnett et al.23 en autopsias de niños que habían fallecido por EHI postasfíctica, encontraron congestión en 22, cambios grasos en 13, hemorragia en 4, necrosis centrolobulillar en 7 y otras lesiones necrótico-isquémicas en 2.
Aunque se refiere una rara evolución hacia una insuficiencia hepática completa21, también se describe que la afectación hepática se asocia a una elevada mortalidad22.
Alteraciones en la coagulaciónEn lactantes que han sufrido asfixia perinatal el tiempo de protrombina e índice internacional normalizado se encuentran significativamente elevados19,21, pudiendo existir riesgo de hemorragia si otros parámetros se encuentran también alterados, como el recuento bajo de plaquetas o la disminución de fibrinógeno5.
En el hígado se sintetizan gran parte de las proteínas involucradas en la coagulación sanguínea, pero el proceso por el que la hipoxia provoca hemorragia no está bien definido. Es por ello que, al existir un deterioro de la capacidad de este órgano, se esperaría encontrar coagulopatías11. No obstante, Chadd et al.25 realizaron un estudio de casos y controles con 47 RN a término, mediante el cual establecieron que los neonatos que habían sufrido hipoxia presentaban un estado de coagulación alterado en comparación con el grupo control, y que el origen de este parece ser una coagulopatía por consumo: esto es, una coagulación intravascular diseminada. Similares resultados fueron descritos por Chessells y Wigglesworth26 en 9 lactantes que sufrieron hipoxia grave, por lo que el daño hepático directo tomaría un papel secundario.
Tracto grastointestinalIncidenciaLa asfixia perinatal puede originar una disminución en la perfusión del tracto gastrointestinal, con presencia de vómitos, diarrea, hemorragia gastrointestinal e incluso enterocolitis necrotizante (ECN)4. Su incidencia se sitúa en el 29%27.
El intestino es uno de los órganos más sensibles a la isquemia27, al presentar territorios situados entre dos arterias principales (arterias mesentéricas), lugares propensos a sufrir lesiones secundarias a asfixia perinatal5. Además, el daño tisular no solo viene dado por la isquemia, sino también por la reperfusión27.
Junto con un sistema de regulación de la resistencia vascular poco desarrollado, el intestino inmaduro presenta gran demanda metabólica. El problema surge en los episodios de estrés cardiovascular, donde los bebés no son capaces de aumentar el flujo sanguíneo intestinal, anulándose así la capacidad del neonato para aumentar el consumo de oxígeno. Se produce entonces una autorregulación defectuosa de la presión de flujo en respuesta a la hipotensión, desembocando en hipoxia tisular28. Así, entre las morbilidades presentes en asfixia perinatal destacan las complicaciones gastrointestinales, siendo estas lesiones intestinales similares a la ECN29.
Enterocolitis necrotizanteLa ECN es una afectación intestinal adquirida potencialmente devastadora en los lactantes prematuros. Su incidencia en RN con muy bajo peso al nacer es del 7%, asociándose a una mortalidad (15-30%) y morbilidad significativas29–32. Esta patología se caracteriza por presentar inflamación e isquemia intestinal con alteraciones en la microcirculación intestinal33,34.
EtiopatogeniaLa etiología de la ECN no está claramente definida, aunque parece que los principales factores de riesgo son la alimentación, la colonización por patógenos y la hipoxia sistémica, entre otros, produciéndose una intensa respuesta inflamatoria que afecta al epitelio inmaduro del neonato28,35. La alimentación puede aumentar la demanda de oxígeno más allá de su suministro en el intestino neonatal, lo que conduce a una hipoxia relativa. Se han detectado casos de ECN asociados a eventos isquémicos, hecho que, junto con una mayor frecuencia de esta patología en zonas intestinales más sensibles a la isquemia por encontrarse entre las arterias mesentéricas inferior y superior (tales como el íleon distal y el colon proximal), induce a pensar que se trata de un trastorno en el sistema circulatorio28,35.
Mediante el empleo de modelos en ratas, Balyemez et al.30 concluyeron que las lesiones microscópicas observadas eran prácticamente las mismas que las descritas en la ECN neonatal: destrucción severa de las vellosidades y criptas de la mucosa intestinal.
CorazónCuando la interrupción del flujo sanguíneo placentario es severa o prolongada, y los mecanismos compensatorios terminan fallando, la disminución del gasto cardíaco y la caída de la presión arterial media desembocan en una reducción de la irrigación cerebral y de los órganos sistémicos, elevando así la probabilidad de lesión isquémica2,33,36.
Aslam y Molloy34 incluyeron al corazón entre los órganos más frecuentemente afectados por la asfixia perinatal, quizás debido a la inmadurez del tejido muscular del neonato, que llevaría a una respuesta inadecuada ante el periodo asfíctico. Además, la disfunción cardíaca complica aún más el estado circulatorio33.
IncidenciaLa disfunción cardiovascular en neonatos se tiene en consideración cada vez más como resultado del daño hipóxico-isquémico del miocardio, ocurriendo hasta en un tercio de estos lactantes y pudiendo contribuir a aumentar la mortalidad y morbilidad del RN7,37. Hankins et al.20 llevaron a cabo un estudio de cohortes de asfixia aguda perinatal y posterior encefalopatía en el que el 78% de los casos presentaron lesión cardíaca, entendiendo esta como la necesidad de fármacos tras las 2 primeras horas de vida y/o la elevación de la creatinina quinasa-MB. Por su parte, Shah et al.6 objetivaron una incidencia del 62%, frente al 29% que fue la establecida por Martín-Ancel et al.27
Marcadores de daño cardíacoCuando el corazón se ve afectado por el evento asfíctico puede sufrir una isquemia miocárdica transitoria, denominada miocardiopatía hipóxica. Con el objetivo de detectar con qué frecuencia se presenta esta afección en neonatos cardiovascularmente sintomáticos, se realizó un estudio de cohortes, determinándose la incidencia en el 70% de los RN que sufrieron asfixia perinatal38.
Uno de los marcadores utilizados para la determinación de lesión cardíaca es la creatina quinasa-MB14,37,39. Sin embargo, otros autores consideran esta proteína como un biomarcador con poca especificidad cardíaca en neonatos, debido a que las enzimas disminuyen de forma considerable tras 24h del evento de asfixia38. Es por esto que valores normales de este isoenzima no excluyen de forma fiable el daño miocárdico27. Otros marcadores que han mostrado sensibilidad son la troponina-T, la troponina-I y el péptido natriurético39,40.
Junto a los marcadores mencionados y a otras pruebas diagnósticas como el electrocardiograma y la radiografía de tórax, es posible realizar una detección temprana del daño miocárdico. Esto es de suma importancia, ya que se ha demostrado que la isquemia miocárdica transitoria secundaria a asfixia perinatal parece ser más frecuente de lo esperado38. Un diagnóstico precoz de lesión miocárdica nos ayudará por tanto a plantear un tratamiento dirigido, mejorando así el pronóstico del neonato38,40.
Función cardíacaBarberi et al.37 demostraron a través de un estudio observacional en RN con asfixia grave que, además de un incremento de las enzimas cardíacas y cambios electrocardiográficos isquémicos relevantes, los pacientes también presentaron función ventricular deprimida.
Hochwald et al.41 compararon el gasto cardíaco del ventrículo izquierdo de RN con EHI con RN sanos observando una disminución del 42,34% en el primer grupo. Gurgul et al.36 comprobaron en ratas neonatales que la fuerza contráctil se veía afectada únicamente en las cavidades ventriculares.
Alteraciones mitocondrialesLa incidencia del daño miocárdico determinado histológicamente tras la asfixia perinatal parece ser mayor que la esperada en términos clínicos. Gurgul et al.36 estudiaron las células cardíacas mediante microscopia electrónica, observando alteraciones degenerativas en algunas células miocárdicas que presentaban adelgazamiento y rotura de algunas miofibrillas, así como cambios mitocondriales degenerativos. Yang et al.42 comprobaron que estas alteraciones mitocondriales se veían reflejadas en su función, concluyendo que se producía una afectación de la cadena respiratoria mitocondrial en la célula miocárdica, probablemente causada por una sobrecarga intracelular de calcio.
ConclusionesLa asfixia es un fenómeno con una prevalencia trascendente. Una de las afectaciones secundarias más frecuentes a este evento es el FMO, siendo el fenómeno de redistribución cardiovascular su principal causa. Periodos de asfixia perinatal prolongados y/o graves pueden llegar a producir miocardiopatía.
Existen dificultades para determinar un rango de incidencia estrecho de la afectación de cada órgano en el contexto de FMO en asfixia perinatal. Es por ello que se considera necesario el establecimiento de criterios comunes que permitan unificar los resultados de los diferentes estudios.
Perspectivas futurasParece recomendable establecer la definición de disfunción de cada órgano y los criterios para establecer el FMO, ya que existe una relevante oscilación de su incidencia en los diferentes estudios que abordan este tema. Además, sería necesario disponer de más estudios en los que se determinara la incidencia de afectación hallada del tracto gastrointestinal.
Una vez puesto de manifiesto la evidente relación entre la asfixia perinatal y el FMO, puede ser interesante profundizar en el tratamiento específico de cada órgano afectado en el neonato asfixiado y la rentabilidad de este.
Resultaría atractivo poder investigar cómo afecta la hipotermia terapéutica a los diferentes órganos puesto que, en la actualidad, es el único tratamiento autorizado eficaz para reducir las secuelas de la EHI tras asfixia perinatal.
Pese a que anatómica y fisiológicamente hombres y mujeres difieren de manera significativa, y otras patologías ya han descrito divergencias en su gravedad y respuesta al tratamiento en función del sexo, no se dispone de información suficiente acerca de la influencia del sexo en el FMO.
FinanciaciónAyuda otorgada por EITB Maratoia-BIOEF, España (BIO18/IC/003) y el Ministerio de Ciencia e Innovación, España (MINECOR20/P66/AEI/10.13039/501100011033).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.