El rotavirus (RV) es la causa principal de diarrea infantil grave en todo el mundo e infecta prácticamente a todos los niños en los primeros 5años de vida, sobre todo en los primeros 2años. Existen dos vacunas atenuadas de administración oral frente al RV disponibles en nuestro medio que han demostrado ser seguras y eficaces frente a la enfermedad.
El objetivo principal de estas vacunas ha sido reproducir la historia natural de la infección y proteger frente a la enfermedad grave en los primeros meses de vida. Los recién nacidos prematuros son especialmente vulnerables a la enfermedad por RV, no solo por tener más riesgo de adquirir la infección, sino también por sus complicaciones.
La vacunación frente al RV en niños prematuros ha mostrado resultados de eficacia y seguridad similares a los comunicados en niños a término, y los datos existentes sugieren un riesgo bajo de diseminación e infección nosocomial cuando la vacunación se realiza durante la hospitalización.
Dado que un porcentaje estimable de recién nacidos prematuros permanecen ingresados en las unidades neonatales más allá de las 12semanas de vida, se considera que estos, siempre que su condición clínica lo permita, deben recibir la vacunación frente al RV sin retrasos, incluso durante la hospitalización si así fuese necesario.
Rotavirus (RV) is the leading cause of severe acute gastroenteritis in infants worldwide. Most children are infected by RV by the age of 5years, and especially in the first 2years. Two oral attenuated vaccines against RV are licensed in industrialised countries, which have proven to be safe and effective against the disease.
The main objective of these vaccines has been to reproduce the natural history of infection and protect against severe disease in the first months of life. Preterm infants are at higher risk of severe RV infection compared to full-term infants and infants with normal birth weight.
Data collected on RV vaccination in preterm infants demonstrated that RV vaccines are effective and safe, compared with full-term infants, with a marginal risk of horizontal viral transmission and dissemination when vaccination is performed during hospitalisation.
Preterm infants frequently require admission to hospital after the beginning of the 12th week of life, which suggests that they should receive RV vaccines during admission according to the official immunisation schedule.
La infección por rotavirus (RV) es la causa principal de diarrea infantil grave en todo el mundo y un problema relevante de salud pública en los países desarrollados. Los niños prematuros constituyen una población muy vulnerable tanto en términos de riesgo de infección como respecto a la gravedad de esta. En la actualidad existen en Europa dos vacunas disponibles: la vacuna pentavalente bovina-humana reordenada (RotaTeq, MSD) y la monovalente humana atenuada (Rotarix, GlaxoSmithKline Biologicals). La evidencia disponible indica que la vacunación frente al RV en niños prematuros es bien tolerada y segura, con una eficacia similar a la de los niños a término. La transmisión horizontal del virus vacunal, aun siendo posible, no ha sido documentada en estudios clínicos, y los existentes hasta ahora, aunque con sus limitaciones, sugieren un riesgo bajo al respecto. Como quiera que los niños prematuros, especialmente los de menos de 1.500g, con frecuencia están todavía hospitalizados cuando corresponde la administración de la primera dosis, es deseable, siempre que su condición clínica lo permita, que la vacunación tenga lugar sin retrasos, incluso mientras estén hospitalizados.
Impacto de la infección por rotavirusEl RV es un agente universal que prácticamente infecta a todos los niños antes de cumplir los 5años y es globalmente la primera causa de diarrea con deshidratación en menores de 5años1. En España, la infección por RV causa el 14-30% de todos los casos de gastroenteritis aguda (GEA), y una cuarta parte de ellos requieren hospitalización2.
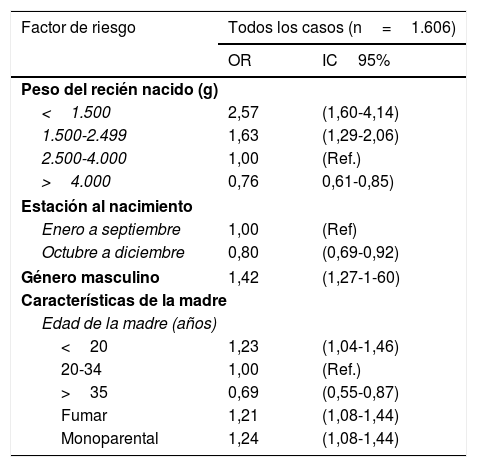
Los recién nacidos (RN) prematuros son más vulnerables frente a los RV que los nacidos a término debido, entre otros factores, a que han tenido una menor transferencia materna de anticuerpos y porque habitualmente la tasa de lactancia materna en ellos es menor que en los recién nacidos a término3. A su vez, tienen un mayor riesgo de enfermedad grave por RV, incluso varios meses después del nacimiento, en comparación con los RN a término y los RN con peso normal al nacer. La deshidratación grave, las deposiciones con sangre y la enterocolitis necrosante son más comunes en los prematuros que en los niños a término. El mayor riesgo de enfermedad grave por RV en los RN prematuros se demostró en un estudio en el que las tasas de hospitalización por diarrea por RV en los primeros meses de vida estaban estrechamente relacionadas con el peso al nacer y tendían a aumentar cuanto menos peso tuvieran los RN4 (tabla 1). Dennehy et al.5 posteriormente publicaron el efecto a largo plazo de la prematuridad en la diarrea por RV, y el peso al nacer <2.500g se asoció con un riesgo aproximadamente tres veces mayor de requerir hospitalización en las GEA por RV, incluso más allá de los primeros meses de vida, comparado con los RN con peso al nacer >2.500g (OR: 2,8; IC95%: 1,6-5,0). Por otra parte, se han descrito brotes epidémicos de GEA por infección natural por RV en las unidades de neonatología6. Se estima que casi una cuarta parte de los brotes epidémicos de infecciones víricas en estas unidades son debidos a RV7, y entre los factores de riesgo implicados se encuentra la prematuridad6.
Análisis multivariante de factores de riesgo para la hospitalización por gastroenteritis aguda por rotavirus
| Factor de riesgo | Todos los casos (n=1.606) | |
|---|---|---|
| OR | IC95% | |
| Peso del recién nacido (g) | ||
| <1.500 | 2,57 | (1,60-4,14) |
| 1.500-2.499 | 1,63 | (1,29-2,06) |
| 2.500-4.000 | 1,00 | (Ref.) |
| >4.000 | 0,76 | 0,61-0,85) |
| Estación al nacimiento | ||
| Enero a septiembre | 1,00 | (Ref) |
| Octubre a diciembre | 0,80 | (0,69-0,92) |
| Género masculino | 1,42 | (1,27-1-60) |
| Características de la madre | ||
| Edad de la madre (años) | ||
| <20 | 1,23 | (1,04-1,46) |
| 20-34 | 1,00 | (Ref.) |
| >35 | 0,69 | (0,55-0,87) |
| Fumar | 1,21 | (1,08-1,44) |
| Monoparental | 1,24 | (1,08-1,44) |
Adaptado de Newman et al.4.
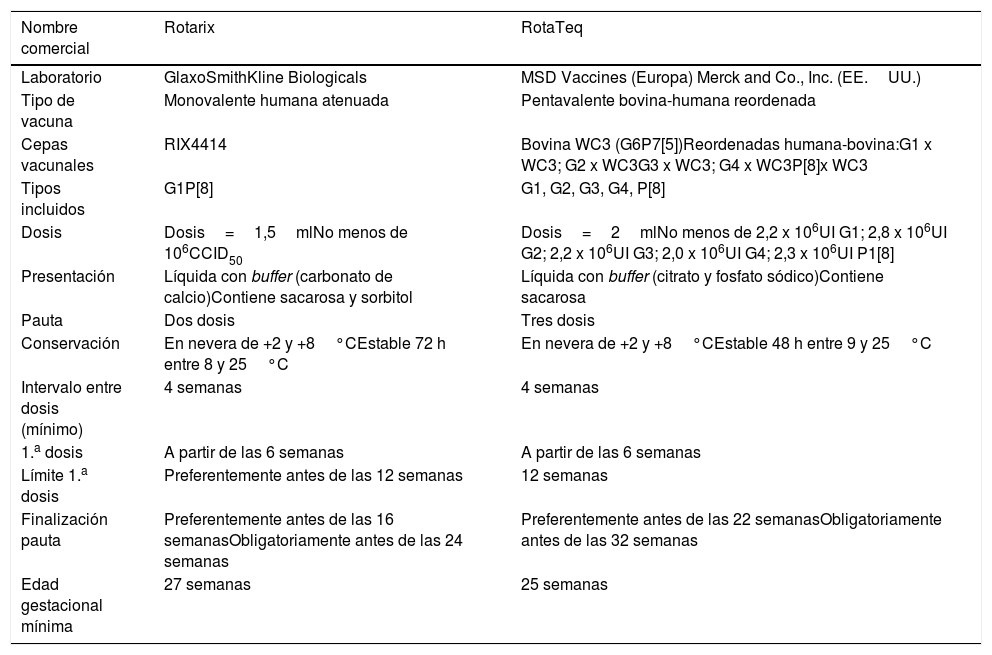
Existen dos vacunas frente al RV disponibles en Europa: la vacuna pentavalente bovina-humana reordenada (RotaTeq, MSD) y la monovalente humana atenuada (Rotarix, GlaxoSmithKline Biologicals) (tabla 2). Un metaanálisis de ensayos clínicos aleatorizados señala que ambas vacunas muestran una eficacia similar en términos de prevención de diarreas graves8.
Vacunas frente al rotavirus disponibles y pautas de administración
| Nombre comercial | Rotarix | RotaTeq |
|---|---|---|
| Laboratorio | GlaxoSmithKline Biologicals | MSD Vaccines (Europa) Merck and Co., Inc. (EE.UU.) |
| Tipo de vacuna | Monovalente humana atenuada | Pentavalente bovina-humana reordenada |
| Cepas vacunales | RIX4414 | Bovina WC3 (G6P7[5])Reordenadas humana-bovina:G1 x WC3; G2 x WC3G3 x WC3; G4 x WC3P[8]x WC3 |
| Tipos incluidos | G1P[8] | G1, G2, G3, G4, P[8] |
| Dosis | Dosis=1,5mlNo menos de 106CCID50 | Dosis=2mlNo menos de 2,2 x 106UI G1; 2,8 x 106UI G2; 2,2 x 106UI G3; 2,0 x 106UI G4; 2,3 x 106UI P1[8] |
| Presentación | Líquida con buffer (carbonato de calcio)Contiene sacarosa y sorbitol | Líquida con buffer (citrato y fosfato sódico)Contiene sacarosa |
| Pauta | Dos dosis | Tres dosis |
| Conservación | En nevera de +2 y +8°CEstable 72 h entre 8 y 25°C | En nevera de +2 y +8°CEstable 48 h entre 9 y 25°C |
| Intervalo entre dosis (mínimo) | 4 semanas | 4 semanas |
| 1.a dosis | A partir de las 6 semanas | A partir de las 6 semanas |
| Límite 1.a dosis | Preferentemente antes de las 12 semanas | 12 semanas |
| Finalización pauta | Preferentemente antes de las 16 semanasObligatoriamente antes de las 24 semanas | Preferentemente antes de las 22 semanasObligatoriamente antes de las 32 semanas |
| Edad gestacional mínima | 27 semanas | 25 semanas |
Específicamente en niños prematuros, disponemos de datos de dos ensayos clínicos. Uno de ellos evaluó la inmunogenicidad con 1.009 niños prematuros que recibieron la vacuna monovalente frente al RV o placebo, con dos dosis, siguiendo las mismas recomendaciones que para los niños a término9. Las tasas de seroconversión de anticuerpos IgA anti-RV tras la segunda dosis fueron del 86% globalmente en el grupo vacunado (76% en aquellos con edad gestacional de 27-30semanas y 88% en los neonatos de 31 a 36semanas de gestación) frente al 16% en el grupo que recibió placebo. La tolerabilidad de esta vacuna fue buena, presentando acontecimientos adversos de forma similar en el grupo vacunado y en los que recibieron placebo (5% vs. 7%, respectivamente).
En otro estudio post hoc de un ensayo clínico aleatorizado de eficacia se comparó la vacuna pentavalente frente al RV y placebo, administrándose tres dosis a un total de 2.070 niños prematuros10. La eficacia en cuanto a la reducción del número de hospitalizaciones frente a placebo fue del 100% (IC95%: 59-100), y del 92% (IC95%: 57-100) respecto a la reducción de las visitas a urgencias. En un subgrupo de 308 prematuros en los que se estudió de forma detallada la seguridad, la frecuencia de eventos adversos fue similar entre los niños vacunados y los que recibieron placebo.
En ninguno de los dos ensayos clínicos en RN prematuros o de los estudios observacionales realizados con ambas vacunas se comunicaron casos de invaginación intestinal.
Estudios observacionales en niños prematurosUn estudio prospectivo realizado en Estados Unidos con la vacuna monovalente en 15niños prematuros con fallo intestinal mostró buenos datos de inmunogenicidad, con desarrollo de seroconversión de anticuerpos IgA frente a RV en 12 de los 14 pacientes evaluables (86%)11. Un estudio poblacional prospectivo realizado en Francia (estudio IVANHOE), que inició un programa de vacunación frente a RV en 2007, utilizando datos de 217 niños prematuros de la cohorte vacunada con la vacuna pentavalente, comunicó que el número de hospitalizaciones se redujo por un factor de 2,6 en las dos primeras temporadas epidémicas tras la vacunación y por un factor de 11 en la tercera temporada12,13. En conjunto, los estudios observacionales publicados hasta la fecha muestran que la vacunación frente a RV en niños prematuros presenta un buen perfil de tolerabilidad y seguridad, y estos buenos resultados también se han observado en las series publicadas en niños prematuros con patología gastrointestinal relevante14,15, como la enterocolitis necrosante.
En otro análisis retrospectivo de los datos de más de 1,6 millones de vacunaciones realizadas entre 2001 y 2015 en Michigan (EE.UU.), para niños con peso normal, bajo y muy bajo, la reducción de las tasas de hospitalización por infección por RV fueron del 91, del 98 y del 93%, respectivamente, y la reducción en las tasas de hospitalización por GEA en comparación con niños no vacunados fue del 62, del 72 y del 71%, respectivamente16.
Diseminación y transmisión del virus vacunal en niños prematuros hospitalizadosUna de las razones por las que la vacuna se utiliza menos en prematuros hospitalizados es el riesgo potencial de transmisión horizontal como consecuencia de la eliminación en heces del virus vacunal y la posible diseminación a otros niños ingresados en las unidades neonatales.
Existen varios estudios que han evaluado el riesgo de transmisión del RV de prematuros vacunados a otros niños hospitalizados. En un estudio realizado en dos unidades de cuidados intensivos neonatales de Canadá en 102 niños vacunados con la vacuna pentavalente, los autores analizaron las infecciones nosocomiales por RV en un periodo de más de 2años previos al inicio de las vacunaciones y 20meses posteriores a dicho inicio17. En uno de los hospitales no hubo infecciones nosocomiales por RV en los periodos pre y posvacunación. En el otro hospital las tasas de infección nosocomial por RV fue de 4,9 (IC95%: 2,0-10,1) casos por 10.000 pacientes-días en el periodo prevacunal, y de 0,0 (IC95%: 0,0-2,6) en el periodo posvacunal. Monk et al.18, en el estudio de mayor tamaño muestral comunicado hasta la fecha, analizaron retrospectivamente los datos de 96 niños prematuros vacunados con vacuna pentavalente en una unidad de cuidados intensivos neonatales de Estados Unidos y de 801 niños no vacunados vecinos de la unidad. En el periodo de realización del estudio no se detectó ningún caso confirmado de GEA nosocomial por RV en la unidad.
En un estudio realizado específicamente en una unidad neonatal se analizaron los resultados de la vacunación con vacuna pentavalente o monovalente a un total de 19 neonatos vacunados y 49 neonatos ingresados cuyas camas estaban próximas a las de los vacunados. Los resultados de la PCR a tiempo real no mostraron genoma vírico en ninguna de las muestras de heces de los 49 neonatos no vacunados19. En otro estudio se analizó la transmisión nosocomial de RV en las unidades pediátricas, neonatales y de otras especialidades de un hospital donde se administraba la vacunación de RV con vacuna pentavalente. De las casi 1.200 muestras de heces recogidas durante el estudio, solamente 13 (1,1%) fueron positivas para RV mediante PCR a tiempo real: una en un niño no vacunado que mostró una cepa natural y 12 en niños vacunados; no hubo casos producidos por cepas del virus vacunal entre los niños no vacunados20.
Por tanto, la transmisión horizontal del virus vacunal, aun siendo posible, no ha sido documentada en estudios clínicos, y los limitados estudios existentes hasta ahora sugieren un riesgo muy bajo al respecto. Es más, se ha señalado que la diseminación del virus es más probable que resulte en una inmunidad colectiva inducida que en una enfermedad sintomática21.
Beneficios frente a riesgos de la vacunación en la unidad neonatalSe considera que, con los datos existentes, la vacunación frente al RV presenta una relación beneficio-riesgo adecuada para su utilización en unidades neonatales, y por ello debería revisarse la recomendación que existe en determinados países de no vacunar antes del alta a los niños ingresados en una unidad neonatal21-24. Esperar hasta después del alta puede suponer la superación de la edad para recibir esta vacuna y, en definitiva, que se reduzca la cobertura de vacunación en esta población. Así, en un estudio en una unidad de neonatos en Estados Unidos se encontró que el 63% de los niños con bajo peso no habían recibido vacuna frente al RV en el momento del alta, principalmente porque eran demasiado mayores14. Este no es el único motivo de la infrautilización de la vacuna frente al RV; así, en el Reino Unido, donde la vacunación frente al RV está recomendada y, a diferencia de Estados Unidos, la recomendación incluye los niños hospitalizados, una proporción importante de unidades neonatales no administra la vacuna25.
Recomendaciones respecto a la vacunación frente al rotavirus en niños prematurosEn las recomendaciones respecto a la vacuna frente al RV en el Reino Unido se remarca el beneficio de la vacunación en niños prematuros y muy prematuros señalando que el riesgo de transmisión es bajo si se mantienen las medidas habituales de control de infecciones y que, además, el virus vacunal está muy atenuado como para producir una infección muy virulenta. Por tanto, establecen que, si el niño hospitalizado está clínicamente estable, no se debe retrasar la vacunación26.
La European Society for Paediatric Infectious Diseases (ESPID) recomienda la vacunación en prematuros de acuerdo con su edad cronológica, incluyendo los prematuros <32semanas de gestación y los hospitalizados, siempre que se tomen las precauciones necesarias para evitar la transmisión a contactos de riesgo alto27.
El Advisory Committee on Immunization Practices (ACIP) estadounidense recomienda la vacunación frente al RV a niños prematuros siempre que cumplan los requisitos en edad cronológica, se encuentren clínicamente estables y, contrariamente a lo comentado para el Reino Unido, que la vacunación se realice al alta o con posterioridad28.
El National Advisory Committee on Immunization (NACI) de Canadá señala que pueden recibir la vacunación frente al RV los niños prematuros que tengan una edad cronológica entre 6semanas y 8meses, estén sanos y no estén hospitalizados29. No obstante, la última Guía Canadiense de Inmunización señala que se está valorando la posibilidad de vacunar al niño mientras esté hospitalizado, tras una discusión entre el neonatólogo y el servicio de medicina preventiva30.
Las autoridades australianas señalan respecto a la vacunación en niños hospitalizados, incluyendo los prematuros, que el riesgo de transmisión del virus es bajo y que, por tanto, siempre que el RN esté médicamente estable no se debería retrasar la vacunación, especialmente si existe riesgo de superar la edad límite para ella. Añaden, además, que si un niño vacunado requiere hospitalización no se deben tomar más precauciones que las habituales para evitar la trasmisión del virus31.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) ha realizado una serie de recomendaciones generales sobre la vacunación de prematuros32. Así, el prematuro debe ser vacunado de acuerdo a su edad cronológica, independientemente de su edad gestacional y de su peso al nacimiento. Es importante iniciar la vacunación a partir de las 6semanas de vida y, salvo en situaciones excepcionales, no se debe retrasar la edad de la vacunación, administrando todas las vacunaciones en el hospital, incluida la del RV, si así fuera necesario. Los lactantes prematuros menores de 28semanas y <1.500g tienen mayor riesgo de apnea y bradicardia en las 48-72h después de la vacunación, pero estos fenómenos son transitorios. La seguridad de las vacunas en los niños prematuros es alta y la reactogenicidad es similar a la de los niños a término. Los niños prematuros que permanecen ingresados deben estar clínicamente estables y sin presentar acontecimientos cardiorrespiratorios en el momento de la vacunación. La administración de la vacunación frente al RV en prematuros hospitalizados se ha constatado que es segura bajo unas adecuadas condiciones higiénicas, por lo que debería ser una práctica habitual en las unidades de neonatología cuando alcanzan la edad de 6-8semanas de edad cronológica si están clínicamente estables2. Como precaución, cuando se administre la vacunación a niños prematuros ≤28semanas de gestación, y especialmente en aquellos con historial de inmadurez respiratoria, se debe considerar la necesidad de monitorización durante 48-72h.
Administración simultáneaLas vacunas frente al RV pueden administrarse simultáneamente con las vacunas inactivadas de la serie de primovacunación del calendario. Asimismo, se pueden administrar coincidiendo con alimentación materna, de banco o sucedáneo de leche materna (fraccionada o a débito continuo). Las precauciones y contraindicaciones se muestran en las tablas 3 y 4, respectivamente.
Precauciones de la vacunación frente al rotavirus
| • Los virus de la vacuna se excretan por heces durante la primera semana tras la vacunación. Se recomienda a los padres el lavado de manos tras cada cambio de pañal |
| • Los lactantes que viven en hogares con personas inmunocomprometidas o mujeres embarazadas pueden ser inmunizados |
| • La vacuna contra el rotavirus no debe administrarse a niños con gastroenteritis aguda, de moderada a grave hasta que la condición mejore. Los lactantes con gastroenteritis aguda leve pueden ser inmunizados, especialmente si el hecho de retrasar la dosis pudiera implicar rebasar la edad máxima recomendada para su administración, según la ficha técnica |
| • La vacunación tampoco debe retrasarse debido a una enfermedad leve de las vías respiratorias, con o sin fiebre. Al igual que con todas las vacunas, la presencia de una enfermedad aguda de moderada a grave es una precaución para la administración de la vacuna contra el rotavirus |
| • La vacuna no se debe volver a administrar a los bebés que regurgitan o vomitan durante o después de la administración de la vacuna. Los bebés deben recibir las dosis restantes de la vacuna de acuerdo con el calendario establecido |
| • Los lactantes con afecciones del tracto gastrointestinal preexistentes (por ejemplo, síndromes de malabsorción congénita, enfermedad de Hirschsprung) que no reciben tratamiento inmunosupresor deben beneficiarse de la vacunación contra el rotavirus |
Contraindicaciones de la vacunación frente al rotavirus
| • La vacuna contra el rotavirus no debe administrarse a lactantes con antecedentes de reacción alérgica grave (anafilaxia) después de una dosis previa de la vacuna contra el rotavirus o a un componente de la vacuna |
| • Antecedentes de alergia al látex. Debido a que el aplicador para Rotarix contiene látex, los bebés con alergia grave al látex deben recibir RotaTeq en su lugar |
| • No se debe administrar en lactantes con inmunodeficiencia combinada grave, trasplante de médula, inmunodeficiencias humorales graves en tratamiento con inmunoglobulinas, lactantes que precisen quimioterapia |
| • Los médicos deben sopesar los riesgos y beneficios potenciales de administrar la vacuna contra el rotavirus a los niños inmunocomprometidos |
| • Lactante con antecedente de invaginación intestinal o enfermedad/malformación congénita no corregida que la predisponga |
Los lactantes prematuros deben inmunizarse en el mismo programa y con las mismas precauciones que los niños a término si están clínicamente estables y cumplen con los requisitos de edad para la vacunación frente al RV.
Si llegasen al límite de edad para la administración de la primera dosis (según el preparado) y estuviesen ingresados todavía, se pueden vacunar en la unidad con las siguientes precauciones para evitar transmisión horizontal en las 2semanas tras la administración de cualquier dosis:
- ∘
Aislamiento de contacto (bata y guantes).
- ∘
Lavado de manos previo y posterior a la manipulación del paciente.
- ∘
Estrictas medidas higiénicas en el cambio de pañales.
- ∘
Estas medidas incluyen a pacientes que, habiendo sido dados de alta, reingresasen en la unidad por cualquier otro motivo.
Si el niño prematuro es alimentado por sonda nasogástrica, la vacuna se puede administrar por la sonda y administrar un poco de suero fisiológico o leche tras ella.
Si un lactante inmunizado es readmitido en la unidad dentro de las 2semanas posteriores a la administración de la vacuna, las precauciones de contacto deben establecerse y mantenerse durante 2semanas después de la administración.
La vacunación contra el RV se puede administrar en cualquier momento antes, junto con o después de la administración de cualquier producto sanguíneo, incluidos los productos que contienen anticuerpos.
Cuando los RN sean vacunados (en la unidad o en la consulta) se procederá al registro de la vacunación (según el caso en el documento existente, cartilla vacunal o registro informático).
En el caso de pacientes fuera de protocolo (>32semanas de gestación) cuyos padres aporten la vacuna comprada por sus medios, se facilitará su administración y el correspondiente registro.
Para los RN que hubieran tenido GEA por RV antes de iniciar o completar la serie de vacunación, es recomendable que inicien o completen la vacunación, según sea el caso, ya que la infección inicial por el RV podría brindar solo una protección parcial frente al genotipo causante y no frente a otros genotipos de RV para los que las vacunas confieren protección.
Lactantes prematuros nacidos antes de las recomendaciones por edad gestacional: las fichas técnicas de estas vacunas no incluyen a los RN nacidos antes de las 25semanas de edad gestacional (RotaTeq)33 y de las 27semanas de edad gestacional (Rotarix)34. Esta población no se incluyó en los estudios científicos para obtener la licencia de cada una de las vacunas. No hay datos de que dichas vacunas sean menos seguras en estos niños. Dado que los RN muy prematuros tienen mayor riesgo de GEA graves por RV, se recomienda su vacunación tras consensuarlo con los padres.
Recomendación final de la Sociedad Española de Neonatología y del Comité Asesor de Vacunas de la Asociación Española de PediatríaLa infección por RV continúa siendo un problema relevante de salud pública en los países desarrollados y los niños prematuros constituyen una población más vulnerable tanto en términos de riesgo de infección como respecto a sufrir complicaciones derivadas de ella.
La vacunación frente al RV en niños prematuros ha mostrado resultados de eficacia y seguridad similares a los comunicados en niños a término, y los datos existentes sugieren un riesgo muy bajo de diseminación e infección nosocomial cuando la vacunación se realiza durante el ingreso.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría recomienda que la vacunación frente al RV sea incluida en el calendario sistemático de todos los lactantes35.
Mientras tanto, y entendiendo el mayor riesgo de enfermedad grave de los prematuros, se recomienda que todos los RN menores de 32semanas de edad gestacional al nacer, siempre que su condición clínica lo permita y no exista contraindicación, reciban la vacunación frente al RV sin retrasos, incluyendo su administración mientras estén hospitalizados, si así fuese necesario.
Esta es una recomendación de vacunación financiada como grupo de riesgo, y no excluye la posibilidad de ampliarla a otros prematuros >32semanas si así se considerase.
Conflicto de interesesJAA ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y MSD, como consultor en Advisory Board de GlaxoSmithKline y MSD, y como investigador en ensayos clínicos de GlaxoSmithKline.
SAS declara no tener ningún conflicto de interés.
CDG declara no tener ningún conflicto de interés.
AMM declara no tener ningún conflicto de interés.
RGS declara no tener ningún conflicto de interés.
HBA ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y como consultor en Advisory Board de GlaxoSmithKline.
DMP ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y MSD, y como consultor en Advisory Board de GlaxoSmithKline.