Se analizan prácticas de reanimación neonatal en salas de partos (SP) de centros hospitalarios españoles.
MétodosSe envió un cuestionario por centro a neonatólogos responsables de la atención del RN en SP de hospitales españoles.
ResultadosDe 180 cuestionarios enviados, se cumplimentaron 155 (86%); 71 centros fueron de nivel i-ii (46%) y 84 de nivel iii (54%). La familia y el equipo médico participaron en decisiones de no reanimar o interrumpir la reanimación en el 74,2% de los centros. La disponibilidad de 2 o más reanimadores fue del 80% (94,0% en nivel ii i y 63,9% en nivel i-ii, p < 0,001). En un 90,3% de centros se realizan cursos de Reanimación. En centros de nivel iii fueron más frecuentes los mezcladores de gases, pulsioxímetros, ventiladores manuales y envoltorios de plástico. El uso de envoltorios de polietileno fue del 63,9%. En RN a término se inició la reanimación con aire en el 89,7% de los centros. El dispositivo más usado para aplicar VPP fue el «ventilador manual» (78,6% en nivel iii y 42,3% en nivel i-ii, p<0,001). En el 91,7% de los centros de nivel iii se utilizó CPAP precoz en prematuros. En los últimos 5 años han mejorado prácticas como son la formación de profesionales, el uso de pulsioxímetros y de CPAP precoz.
ConclusionesExiste una mejora progresiva en algunas prácticas de reanimación neonatal. Se encuentran diferencias en aspectos generales, equipamientos y protocolos de actuación durante la reanimación y transporte entre unidades de diferentes niveles.
An analysis is presented of delivery room (DR) neonatal resuscitation practices in Spanish hospitals.
MethodsA questionnaire was sent by e-mail to all hospitals attending deliveries in Spain.
ResultsA total of 180 questionnaires were sent, of which 155 were fully completed (86%). Less than half (71, 46%) were level i or ii hospitals, while 84 were level iii hospital (54%). In almost three-quarters (74.2%) of the centres, parents and medical staff were involved in the decision on whether to start resuscitation or withdraw it. A qualified resuscitation team (at least two members) was available in 80% of the participant centres (63.9% level i-ii, and 94.0% level iii, P<.001). Neonatal resuscitation courses were held in 90.3% of the centres. The availability of gas blenders, pulse oximeters, manual ventilators, and plastic wraps was higher in level iii hospitals. Plastic wraps for pre-term hypothermia prevention were used in 63.9% of the centres (40.8% level i-iiand 83.3% level iii, P<.001). Term newborn resuscitation was started on room air in 89.7% of the centres. A manual ventilator (T-piece) was the device used in most cases when ventilation was required (42.3% level i-iiand 78.6% level iii, P<.001). Early CPAP in preterm infants was applied in 91.7% of the tertiary hospitals. In last 5 years some practices have improved, such neonatal resuscitation training, pulse oximeter use, or early CPAP support.
ConclusionsThere is an improvement in some practices of neonatal resuscitation. Significant differences have been found as regards the equipment or practices in the DR, when comparing hospitals of different levels of care.
La estabilización y la reanimación en el nacimiento siguen siendo prácticas médicas de uso universal y se estima que una cuarta parte de las muertes neonatales son causadas por asfixia al nacer1.
Diferentes organizaciones, como son International Liason Committee on Resuscitation (ILCOR)2, European Resuscitation Council3, American Heart Association4 y Australian and New Zeeland Resuscitation Council5, han publicado periódicamente recomendaciones en reanimación neonatal. El Grupo de Reanimación Neonatal de la SENeo (GRN-SENeo) ha difundido desde su origen estas recomendaciones mediante un manual que ya lleva 3 ediciones6 y artículos de divulgación7.
A pesar de existir consenso institucional, las prácticas en reanimación neonatal varían entre diferentes estados y en el seno de los hospitales de un propio país8-13.
El GRN-SENeo en el año 2009 publicó una encuesta de reanimación neonatal en el paritorio que resumía las prácticas de los principales hospitales durante el año 2007 en España14. Posteriormente a la publicación de las recomendaciones del 20102-4 y de la tercera edición del Manual de reanimación neonatal español7, el GRN-SENeo elaboró una nueva encuesta con el objetivo de evaluar los cambios de las prácticas de reanimación neonatal dentro de nuestro país. En este artículo se exponen y discuten los principales resultados obtenidos al respecto, comparándolos con prácticas de otros países.
Material y métodosEn el último trimestre del año 2012, se envió un cuestionario por correo electrónico a los principales hospitales que atienden partos en nuestro país. El cuestionario utilizado es un documento de 48 preguntas que explora áreas relacionadas con la reanimación en el paritorio: demografía de los centros, ética, equipo y material, disponibilidad y capacitación del personal, prácticas clínicas durante la reanimación y gestión posterior a la reanimación (véase el anexo 2).
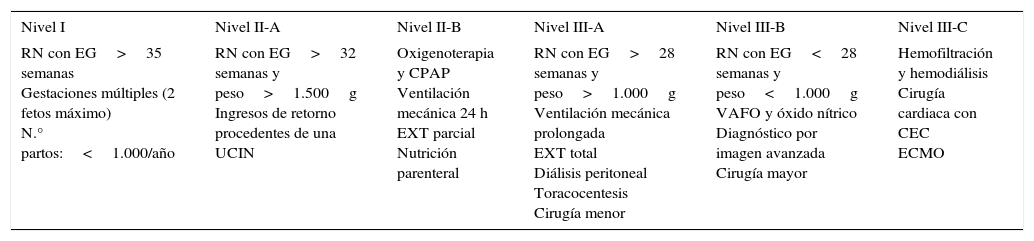
Se ha utilizado estadística descriptiva para analizar los resultados mediante la expresión de variables cualitativas en valores absolutos y proporcionales. Comparación de variables cualitativas mediante prueba de la χ2. Valores de p ≤ 0,05 se consideraron significativos. Se muestran resultados globales por diferentes áreas y se han comparado los centros asistenciales por niveles de complejidad (tabla 1).
Niveles de la Unidades Neonatales
| Nivel I | Nivel II-A | Nivel II-B | Nivel III-A | Nivel III-B | Nivel III-C |
|---|---|---|---|---|---|
| RN con EG>35 semanas Gestaciones múltiples (2 fetos máximo) N.° partos:<1.000/año | RN con EG>32 semanas y peso>1.500g Ingresos de retorno procedentes de una UCIN | Oxigenoterapia y CPAP Ventilación mecánica 24 h EXT parcial Nutrición parenteral | RN con EG>28 semanas y peso>1.000g Ventilación mecánica prolongada EXT total Diálisis peritoneal Toracocentesis Cirugía menor | RN con EG<28 semanas y peso<1.000g VAFO y óxido nítrico Diagnóstico por imagen avanzada Cirugía mayor | Hemofiltración y hemodiálisis Cirugía cardiaca con CEC ECMO |
CEC: circulación extracorpórea; CPAP: presión de la vía aérea continua y positiva; EG: edad gestacional; ECMO: oxigenación por membrana extracorpórea; EXT: exanguinotransfusión; RN: recién nacido; UCIN: Unidad de Cuidados Intensivos Neonatales; VAFO: ventilación de alta frecuencia.
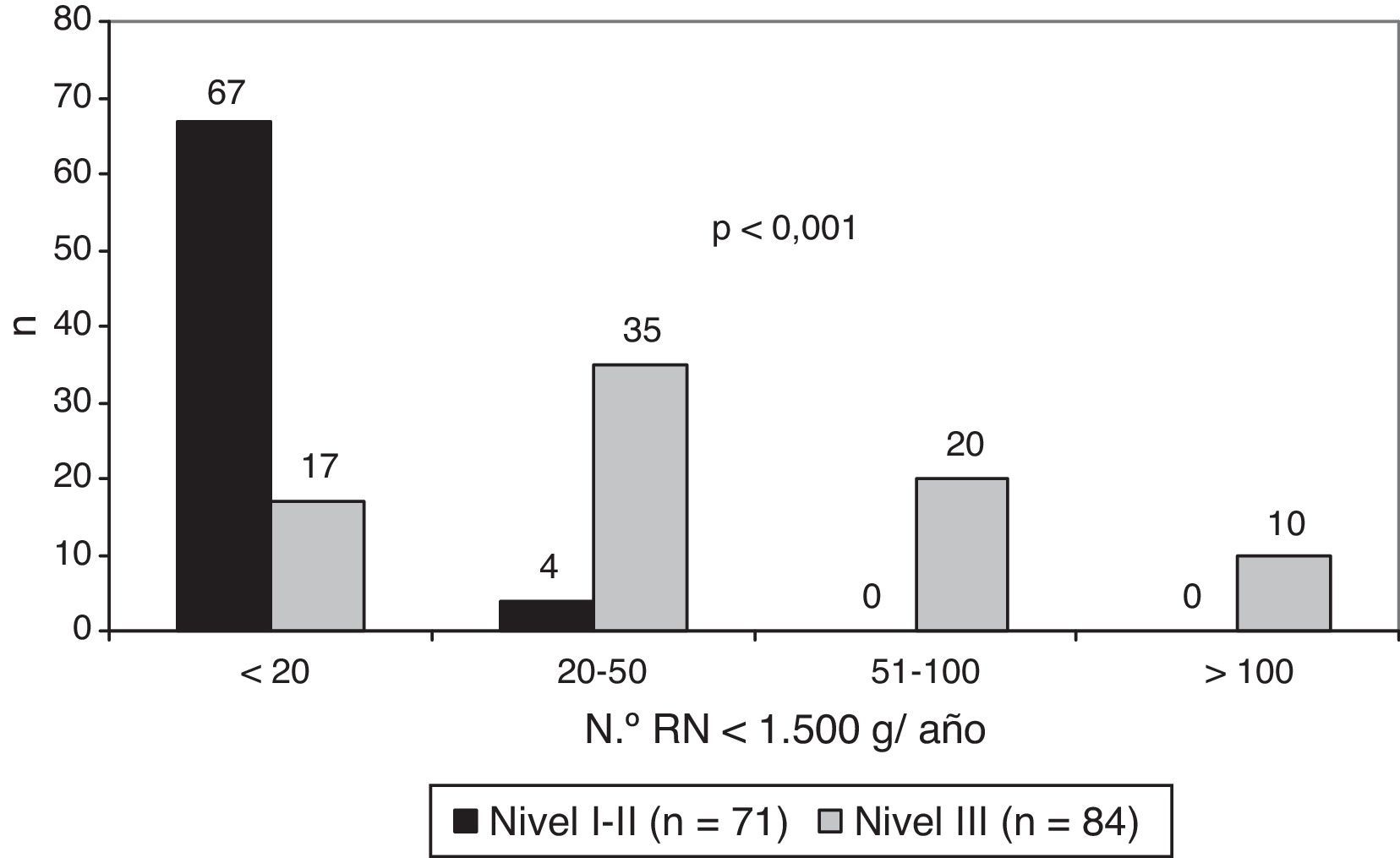
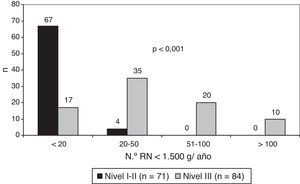
De un total de 180 cuestionarios enviados, se respondieron 155 (86%). De los 155 centros participantes, 35 eran nivel i (23%), 36 nivel ii (23%) y 84 nivel iii (54%): 36 IIIA (23%), 38 IIIB (24,5%) y 10 IIIC (6,5%). La figura 1 muestra el número de recién nacidos (RN) con peso al nacimiento<1.500g/año (RNMBP) de acuerdo con el nivel asistencial de los centros.
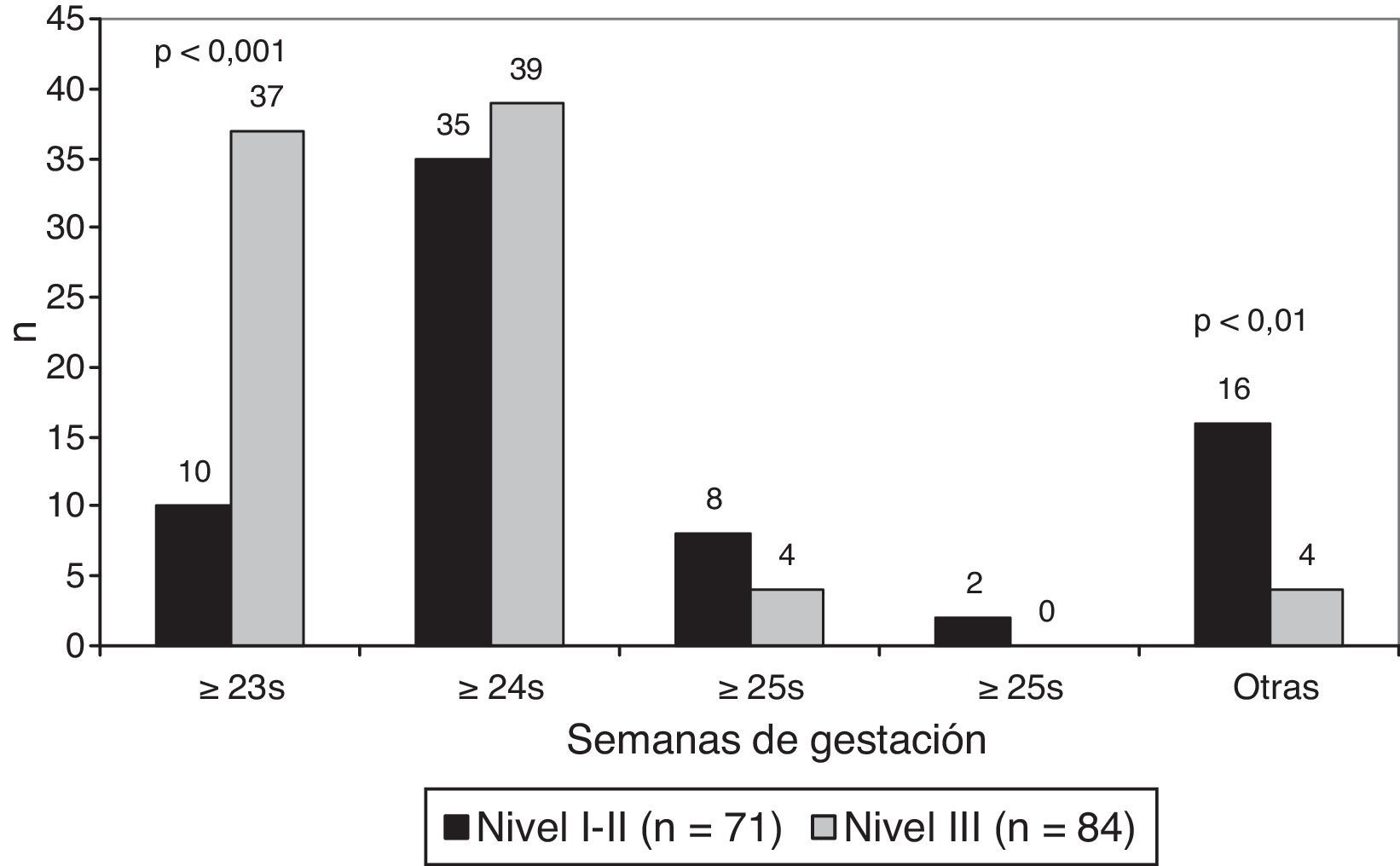
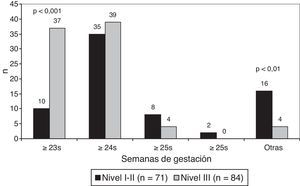
La edad gestacional límite en el que se inició la reanimación fue ≥ 23 semanas en 47 centros (30,3%), ≥ 24 semanas en 74 centros (47,7%) y ≥ 25 semanas en 12 centros (7,7%). En centros de nivel iii es más frecuente el límite de viabilidad de ≥ 23 semanas (p<0,001) (fig. 2).
En el 72,3 y el 62,6% de los casos, el centro tiene un lugar habilitado en el paritorio para asistir al RN junto a la madre o en sala adyacente, respectivamente.
En relación con la presencia del padre o pareja en el paritorio, en el 97,5% de casos tienen posibilidad de estar junto a la madre, aunque solo en el 26,5% pueden acompañarla en todos los partos, incluyendo cesáreas. El plan de parto aportado por los padres es atendido y aceptado en el 75,5% de los centros sin diferencias entre niveles.
La familia participa con el equipo médico en decisiones de no reanimar o interrumpir la reanimación en el 62,0% de los centros de nivel i-iiiy el 84,5% de los de nivel iii (p<0,01). La interrupción de la reanimación, en caso de ausencia de respuesta (Apgar 0 mantenido), se indica a los 10, 15 y 20 min en el 51,6, el 28,8 y el 18,3% de los centros, respectivamente. En centros de nivel iii, respecto del nivel i-ii, el cese de la reanimación es más frecuente a los 10 min (61,9% vs. 38,0%, p<0,01).
Composición y aspectos docentes del equipo de reanimaciónEn centros de nivel iii, el equipo de reanimación (ER) está compuesto principalmente por neonatólogos y residentes de pediatría (94,0% y 78,6%, respectivamente), mientras que en nivel i-ii, pediatras generales (93,0%), matronas (76,1%) y anestesiólogos (64,8%) son los principales profesionales encargados (p<0,001). La disponibilidad de 2 o más miembros del ER cualificados las 24 h del día es del 80%, siendo mayor en los de nivel iii (94,0% vs. 63,9%, p < 0,001).
En un 90,3% de los centros se realizan cursos de reanimación neonatal (CRN), con una periodicidad anual mayoritaria (40%). La presencia de instructores acreditados por el GRN-SENeo es más frecuente en centros de nivel iii(94,0% vs. 71,8%, p < 0,001), así como la realización de CRN certificados (97,6% vs. 81,7%, p < 0,01). La filmación en el paritorio se realiza en 5 hospitales (todos de nivel iii) y los cursos de simulación en el 20,6% de los centros.
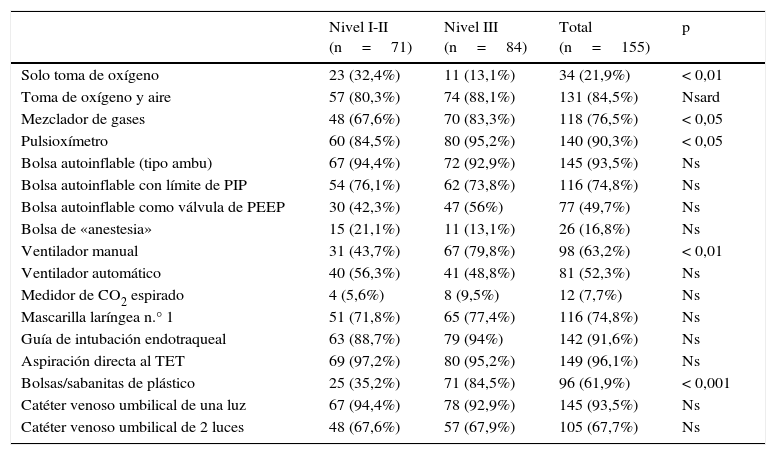
Material en el área de reanimaciónEl material de reanimación se muestra en la tabla 2. En centros de nivel i-ii son más frecuentes las tomas únicas de oxígeno (O2); en cambio, la disponibilidad de mezcladores de gas, pulsioxímetros, ventiladores manuales y envoltorios de plástico predominan en los de nivel iii.
Material en el puesto de reanimación
| Nivel I-II (n=71) | Nivel III (n=84) | Total (n=155) | p | |
|---|---|---|---|---|
| Solo toma de oxígeno | 23 (32,4%) | 11 (13,1%) | 34 (21,9%) | < 0,01 |
| Toma de oxígeno y aire | 57 (80,3%) | 74 (88,1%) | 131 (84,5%) | Nsard |
| Mezclador de gases | 48 (67,6%) | 70 (83,3%) | 118 (76,5%) | < 0,05 |
| Pulsioxímetro | 60 (84,5%) | 80 (95,2%) | 140 (90,3%) | < 0,05 |
| Bolsa autoinflable (tipo ambu) | 67 (94,4%) | 72 (92,9%) | 145 (93,5%) | Ns |
| Bolsa autoinflable con límite de PIP | 54 (76,1%) | 62 (73,8%) | 116 (74,8%) | Ns |
| Bolsa autoinflable como válvula de PEEP | 30 (42,3%) | 47 (56%) | 77 (49,7%) | Ns |
| Bolsa de «anestesia» | 15 (21,1%) | 11 (13,1%) | 26 (16,8%) | Ns |
| Ventilador manual | 31 (43,7%) | 67 (79,8%) | 98 (63,2%) | < 0,01 |
| Ventilador automático | 40 (56,3%) | 41 (48,8%) | 81 (52,3%) | Ns |
| Medidor de CO2 espirado | 4 (5,6%) | 8 (9,5%) | 12 (7,7%) | Ns |
| Mascarilla laríngea n.° 1 | 51 (71,8%) | 65 (77,4%) | 116 (74,8%) | Ns |
| Guía de intubación endotraqueal | 63 (88,7%) | 79 (94%) | 142 (91,6%) | Ns |
| Aspiración directa al TET | 69 (97,2%) | 80 (95,2%) | 149 (96,1%) | Ns |
| Bolsas/sabanitas de plástico | 25 (35,2%) | 71 (84,5%) | 96 (61,9%) | < 0,001 |
| Catéter venoso umbilical de una luz | 67 (94,4%) | 78 (92,9%) | 145 (93,5%) | Ns |
| Catéter venoso umbilical de 2 luces | 48 (67,6%) | 57 (67,9%) | 105 (67,7%) | Ns |
Ns: no significativo; PEEP: presión espiratoria final positiva; PIP: presión positiva inspiratoria; TET: tubo endotraqueal.
El 17,4% de centros dispone de bañera de agua, siendo más frecuentes (p<0,05) en centros de nivel i-ii (25,4% vs. 10,7%).
Aspectos clínicos del proceso de reanimaciónLa temperatura del RN en el paritorio se registra «nunca o de vez en cuando» en el 72,3% de centros; en cambio, se monitoriza «siempre» en el 14,2%, predominantemente en los de nivel i-ii (21,1% vs. 8,3%, p<0,05). El riesgo de encefalopatía hipóxico-isquémica (EHI) es la situación clínica que con mayor frecuencia se registra la temperatura del RN en el paritorio, seguido de la prematuridad. Como medida de prevención de la pérdida de calor del RN prematuro, el 100% de los centros utilizan cunas térmicas, el 98% gorrito y el 71,6% tallas precalentadas. El uso de bolsas de polietileno es del 63,9%, predominando en centros de nivel iii (83,3% vs. 40,8%, p<0,001). Solo el 30,3% de los centros tienen temperatura ambiental adecuada (≥ 26°C) y el uso de cunas térmicas y gorritos en la cabeza es del 100 y el 98,1% respectivamente. La hipotermia terapéutica como tratamiento de la EHI se inicia en el paritorio en el 79% de centros (el 66% nivel i-ii y el 90% nivel iii, p<0,001), siendo la «desconexión de la fuente de calor tras estabilizar al paciente», el método más utilizado (80,6%). En el 94% de centros, se toma «siempre o a menudo» la temperatura del RN durante la primera hora de ingreso en la Unidad de Cuidados Intensivos Neonatales (UCIN).
En relación con el uso de O2 en el paritorio, un 36% de los centros lo administran a «flujo libre» (el 56,3% nivel i-ii y el 19% nivel ii, p<0,001). La pulsioximetría se utiliza en el 90,3% de centros («siempre o a menudo» en el 78,0%). El motivo más frecuentemente para «utilizar poco o nunca el pulsioxímetro» es la lectura tardía. En RN a término se inicia la reanimación con aire ambiental en el 89,7% de los hospitales. En RN prematuros se utiliza una fracción inspiratoria de O2 (FIO2) inicial de 0,3-0,5 en el 73,2% de centros de nivel i-ii y en el 88,1% de nivel iii (p<0,05). Para cambiar la FIO2 durante la reanimación, el valor de Sp02 se ha utilizado en el 94,0% de los hospitales de nivel iii y en el 77,5% de nivel i-ii (p < 0,01), mientras que el color se utiliza para este propósito en el 59,2% de los de nivel i-ii y en el 31,0% de nivel iii (p < 0,001). El 5,2% de los centros tiene un detector de anhídrido carbónico (CO2) disponible en el área de reanimación y solo un 2,6% lo usa para confirmar la intubación del RN.
Para administrar presión positiva con mascarilla facial el dispositivo más utilizado es el «ventilador manual» (el 61,9% de los centros, con predominio en nivel iii: 78,6% vs. 42,3%, p<0,001).
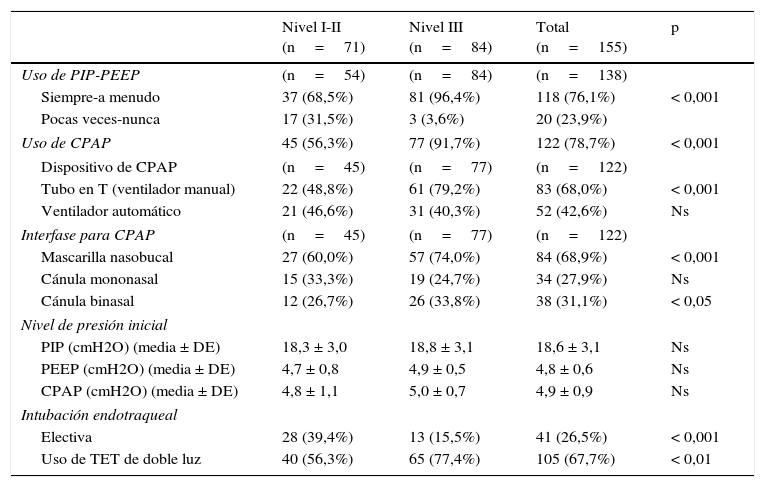
La tabla 3 resume prácticas de asistencia ventilatoria en RN prematuros. El uso controlado de presión positiva inspiratoria (PIP), presión espiratoria final positiva (PEEP) y de presión positiva continua de la vía aérea (CPAP) es más frecuente en los centros de nivel iii. El «dispositivo de CPAP» más utilizado es la «pieza en T» de un ventilador manual (68%) y la «interfase de CPAP» más común es la «mascarilla nasobucal» (68,9%), usada más frecuentemente en centros de nivel iii (p<0,001). La «insuflación sostenida» se usa en el 11% de los centros, sin unanimidad en la PIP utilizada o la duración de las insuflaciones. La intubación endotraqueal «electiva» en prematuros es más frecuente en centros de nivel i-ii (p<0,001), en cambio, el uso de tubos endotraqueales de «doble luz» predomina en los terciarios (p<0,01). El 47% de los hospitales usan surfactante en el paritorio.
Asistencia respiratoria de prematuros en sala de partos
| Nivel I-II (n=71) | Nivel III (n=84) | Total (n=155) | p | |
|---|---|---|---|---|
| Uso de PIP-PEEP | (n=54) | (n=84) | (n=138) | |
| Siempre-a menudo | 37 (68,5%) | 81 (96,4%) | 118 (76,1%) | < 0,001 |
| Pocas veces-nunca | 17 (31,5%) | 3 (3,6%) | 20 (23,9%) | |
| Uso de CPAP | 45 (56,3%) | 77 (91,7%) | 122 (78,7%) | < 0,001 |
| Dispositivo de CPAP | (n=45) | (n=77) | (n=122) | |
| Tubo en T (ventilador manual) | 22 (48,8%) | 61 (79,2%) | 83 (68,0%) | < 0,001 |
| Ventilador automático | 21 (46,6%) | 31 (40,3%) | 52 (42,6%) | Ns |
| Interfase para CPAP | (n=45) | (n=77) | (n=122) | |
| Mascarilla nasobucal | 27 (60,0%) | 57 (74,0%) | 84 (68,9%) | < 0,001 |
| Cánula mononasal | 15 (33,3%) | 19 (24,7%) | 34 (27,9%) | Ns |
| Cánula binasal | 12 (26,7%) | 26 (33,8%) | 38 (31,1%) | < 0,05 |
| Nivel de presión inicial | ||||
| PIP (cmH2O) (media ± DE) | 18,3 ± 3,0 | 18,8 ± 3,1 | 18,6 ± 3,1 | Ns |
| PEEP (cmH2O) (media ± DE) | 4,7 ± 0,8 | 4,9 ± 0,5 | 4,8 ± 0,6 | Ns |
| CPAP (cmH2O) (media ± DE) | 4,8 ± 1,1 | 5,0 ± 0,7 | 4,9 ± 0,9 | Ns |
| Intubación endotraqueal | ||||
| Electiva | 28 (39,4%) | 13 (15,5%) | 41 (26,5%) | < 0,001 |
| Uso de TET de doble luz | 40 (56,3%) | 65 (77,4%) | 105 (67,7%) | < 0,01 |
CPAP: presión positiva continua de la vía aérea; Ns: no significativo; PEEP: presión espiratoria final positiva; PIP: presión positiva inspiratoria; TET: tubo endotraqueal.
La adrenalina intratraqueal (IT) es la medicación más empleada en el paritorio (96,8%), seguida del surfactante (47,1%). La dosis más utilizada de adrenalina IT es 0,05-0,1mg/kg (65%). El bicarbonato sódico en una reanimación prolongada se utiliza de forma «ocasional» en el 86,4% de centros. La naloxona en el paritorio sigue utilizándose en un 33,5%. No existen diferencias significativas en el uso de medicamentos entre centros de diferentes niveles.
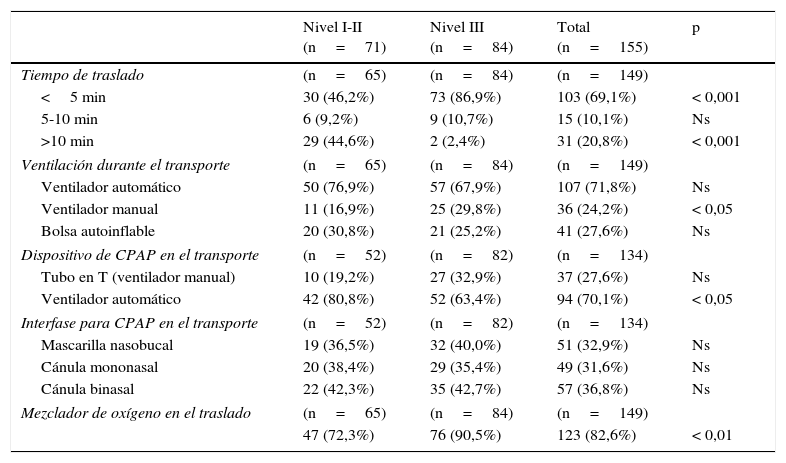
Traslado del recién nacido de paritorio a la Unidad de Cuidados Intensivos NeonatalesLos datos referentes al traslado de RN desde paritorio a la Unidad Neonatal se detallan en la tabla 4. En centros de nivel iii el tiempo de traslado es más corto (p<0,001) y se utilizan más frecuentemente el ventilador manual (p<0,05) y el mezclador de gases (p<0,01); en cambio, en los de nivel i-ii el ventilador de transporte es más común como dispositivo de CPAP (p<0,05).
Traslado desde el paritorio a la Unidad Neonatal
| Nivel I-II (n=71) | Nivel III (n=84) | Total (n=155) | p | |
|---|---|---|---|---|
| Tiempo de traslado | (n=65) | (n=84) | (n=149) | |
| <5 min | 30 (46,2%) | 73 (86,9%) | 103 (69,1%) | < 0,001 |
| 5-10 min | 6 (9,2%) | 9 (10,7%) | 15 (10,1%) | Ns |
| >10 min | 29 (44,6%) | 2 (2,4%) | 31 (20,8%) | < 0,001 |
| Ventilación durante el transporte | (n=65) | (n=84) | (n=149) | |
| Ventilador automático | 50 (76,9%) | 57 (67,9%) | 107 (71,8%) | Ns |
| Ventilador manual | 11 (16,9%) | 25 (29,8%) | 36 (24,2%) | < 0,05 |
| Bolsa autoinflable | 20 (30,8%) | 21 (25,2%) | 41 (27,6%) | Ns |
| Dispositivo de CPAP en el transporte | (n=52) | (n=82) | (n=134) | |
| Tubo en T (ventilador manual) | 10 (19,2%) | 27 (32,9%) | 37 (27,6%) | Ns |
| Ventilador automático | 42 (80,8%) | 52 (63,4%) | 94 (70,1%) | < 0,05 |
| Interfase para CPAP en el transporte | (n=52) | (n=82) | (n=134) | |
| Mascarilla nasobucal | 19 (36,5%) | 32 (40,0%) | 51 (32,9%) | Ns |
| Cánula mononasal | 20 (38,4%) | 29 (35,4%) | 49 (31,6%) | Ns |
| Cánula binasal | 22 (42,3%) | 35 (42,7%) | 57 (36,8%) | Ns |
| Mezclador de oxígeno en el traslado | (n=65) | (n=84) | (n=149) | |
| 47 (72,3%) | 76 (90,5%) | 123 (82,6%) | < 0,01 | |
CPAP: presión positiva continua de la vía aérea; Ns: no significativo.
Esta encuesta sobre reanimación neonatal es la más amplia que se ha realizado en España y es la segunda que ha publicado el GRN-SENeo desde su inicio. En el año 2011 hubo 470.553 RN vivos en nuestro país15; los centros participantes en este trabajo suman un total de 347.210 partos, lo que representa alrededor del 74% del total de nacimientos anuales. En relación con la encuesta anterior14, han participado 43 centros más, lo que representa un incremento del 14% en cuanto al número de partos anuales. El número de RNMBP que se asisten en los centros participantes se estima en unos 4.900 anuales, cifra superior a los 2.700 del informe de morbimortalidad SEN1500 del año 201116. Estos datos ilustran que los resultados son representativos de las prácticas asistenciales de nuestro país.
Los límites de viabilidad en RN prematuros varían de unos países a otros y en el nuestro el GRN-SENeo recomienda iniciar la reanimación a partir de las 23-24 semanas de gestación (SG) de forma individualizada, valorándose la opinión de los padres y las cifras de morbimortalidad de cada centro6. Según datos propios, el 78% de los centros participantes inician la reanimación a las 23-24 SG. Este hecho contrasta con otros países, como Japón o Alemania, que fijan las 22-23 SG como límites de viabilidad17,18.
No existe unanimidad en el momento de interrumpir la reanimación cuando el latido cardíaco es indetectable. La mitad de los centros participantes lo hacen a los 10 min de vida, siendo este hecho más frecuente en los de nivel iii. A pesar de que ILCOR2 considera interrumpir la reanimación a los 10 min de ausencia de latido cardíaco y afirma que no hay datos suficientes para establecer recomendaciones cuando persiste bradicardia intensa (FC<60 lpm) a los 10-15min de vida, en la práctica clínica puede ser difícil decidir el momento de interrumpirla. Estudios de seguimiento en la era de la hipotermia relativizan esta afirmación, ya que uno de cada 5 RN con Apgar 0/0/0 está libre de secuelas moderadas y graves a la edad de 18-22 meses19 y 6-7 años20. En un editorial se aborda este aspecto y se concluye que con los datos disponibles en la era de la hipotermia es necesario reflexionar sobre cuál es el mejor momento para decidir si mantener o retirar el soporte vital en el RN con puntuaciones de Apgar muy bajas. Se afirma que demorar esta decisión permitiría precisar más el pronóstico y conocer mejor la opinión de los padres21.
La localización física presencial de un mínimo de dos reanimadores para atender a un RN de riesgo en la sala de partos durante cualquier momento del día es una recomendación del Neonatal Resuscitation Program (NRP) de la Academia Americana de Pediatría22. En nuestro medio, el 94% de los centros de nivel iii disponen de al menos 2 reanimadores las 24 h del día, porcentaje que se ha mantenido estable en los últimos 5 años7, siendo los neonatólogos (94%) y pediatras generales (93%) los profesionales que predominan en centros de nivel iii y i-ii, respectivamente. En una encuesta implementada en los EE. UU.8, el 31% de los programas estaban compuestos de forma usual por 2 reanimadores, por lo que en este sentido nuestros datos son alentadores.
Múltiples estudios muestran el beneficio de NRP en la formación de los profesionales que atienden al RN en el momento del nacimiento, tanto en países desarrollados, en vías de desarrollo como en emergentes22-24. La formación, aparte de mejorar los conocimientos, habilidades y eficiencia de los profesionales24, puede incidir positivamente en diferentes indicadores (test de Apgar, duración de la hospitalización y mortalidad neonatal)22-23. En 2011 en nuestro país, 5.304 profesionales habían superado los cursos de Reanimación Neonatal acreditados por el GRN-SENeo y el colectivo de instructores sumaba 392 efectivos6. Según datos de la encuesta, la realización de cursos en el hospital o las áreas de influencia supera el 90% (97% en nivel iii) y la presencia de instructores acreditados por el GRN-SENeo es del 84% en los centros encuestados (94% en nivel iii), hechos que han mostrado un incremento sostenido en los últimos años. Estos cursos se basan en la práctica de técnicas de simulación como son dinámicas de grupo, distracción, práctica de oportunidades y feedback integrado, metodología altamente efectiva25.
La dotación de equipamiento en el paritorio es un buen indicador de las prácticas en reanimación neonatal. En una encuesta japonesa26 se observan diferencias de equipamiento en diferentes países desarrollados. En nuestro medio, se objetiva una disponibilidad más alta de algunos dispositivos en centros de nivel iii (tabla 2).
En las recomendaciones del 2010, se afirma que el uso de detectores de CO2 junto a la valoración clínica es el método más fiable para confirmar la intubación en neonatos con circulación espontánea2,4,27. Un punto de reflexión y de mejora en un futuro es la baja dotación de medidores de CO2 en los paritorios españoles (7,7%), cifras inferiores a las de otros países, como EE. UU.8 (32%), Austria10 (36%) Japón26 (45%) o Canadá13 (87%).
La atención del trabajo de parto en el agua es una alternativa al parto tradicional que va aumentando su cuota de popularidad en muchos países28. En nuestro medio, la disponibilidad de bañeras de agua para asistir el trabajo de parto es del 17,4%, siendo más frecuente en los de nivel i-ii, hecho que explicaría la apuesta por parte de los centros a esta modalidad de parto. En EE. UU.29 y en Reino Unido30 se objetivó que al menos 143 y 295 maternidades, respectivamente, disponían de bañera.
En RN a término y casi término con EHI moderada o grave antes de las 6 h de vida, el enfriamiento terapéutico es una práctica clínica aceptada2-4. En nuestro medio se inicia hipotermia pasiva en el paritorio en el 79,4% de los centros (90,5% de nivel iii), siendo la desconexión de la cuna térmica tras estabilizar al RN la medida más frecuente (80,6%).
La utilización de aire al inicio de la reanimación en un RN a término es una indicación aceptada en las recomendaciones del 20102-4, basándose en estudios que demostraban que el uso de concentraciones altas de O2 era más perjudicial y no aportaba ninguna ventaja sobre el uso de aire31-33. Con el objetivo de aportar un uso racional de O2, diferentes algoritmos2-6 utilizan adaptaciones de los valores normales de pulsioximetría34, incluyendo la SpO2 diana durante los primeros 10 min de reanimación.
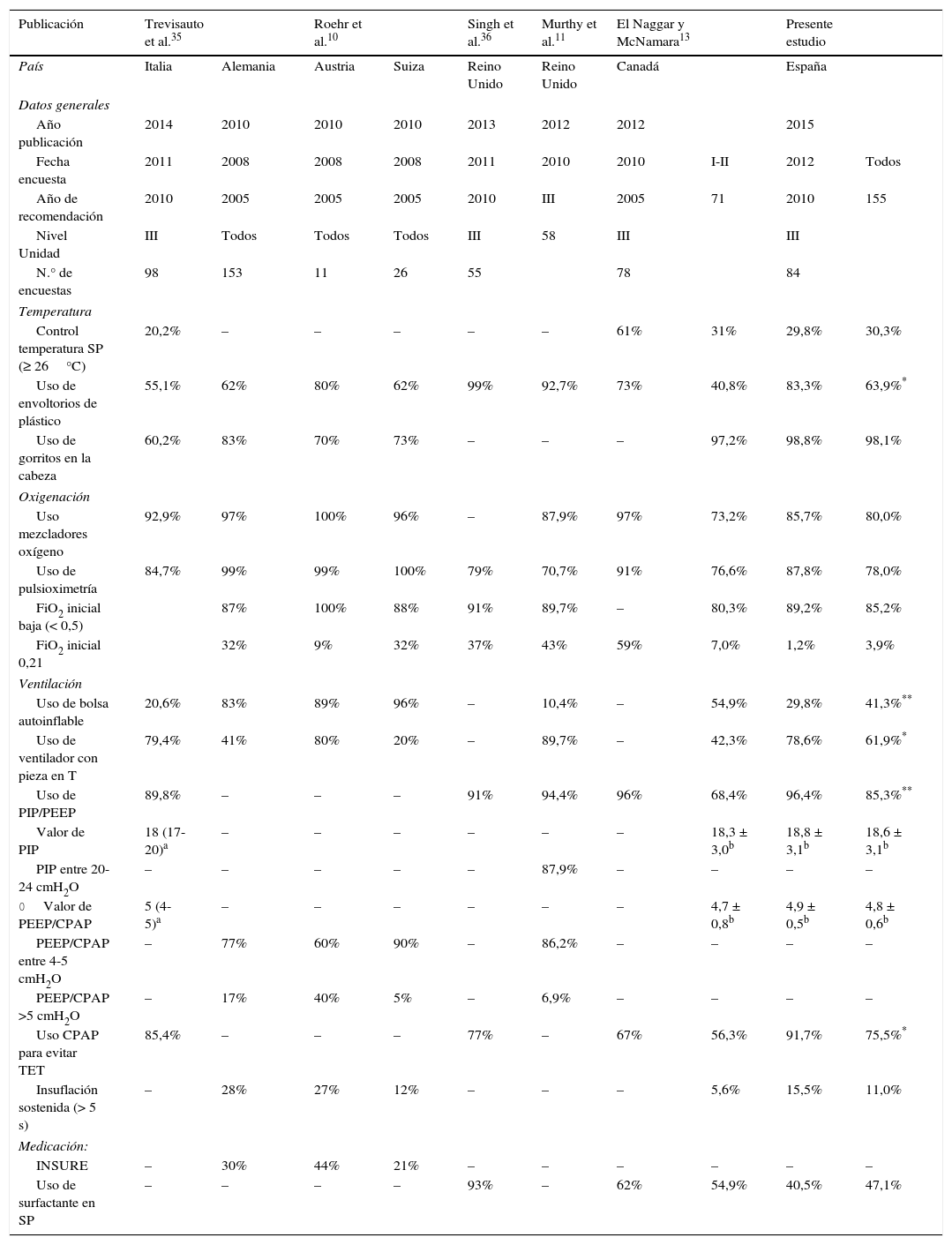
Prácticas clínicas en la reanimación de RN prematuros en diferentes países se muestran en la tabla 510,11,13,35,36. La preservación de la temperatura (tª) corporal en RN<28 semanas gestacionales incluye diferentes medidas, siendo las más novedosas el uso de envoltorios de plástico y la tª ambiental en el paritorio de al menos 26°C2,37. En nuestro medio, el uso de cunas térmicas y gorrito son casi universales; en cambio, la tª ambiental alta (30%) y la utilización de envoltorios de polietileno son mejorables. En la mayor parte de los países, la utilización de envoltorios de plástico oscila entre el 55 y el 80%; en cambio, en Reino Unido actualmente es más alta. La FiO2 inicial en prematuros no está definida2 y la mayoría de los países, incluido el nuestro, utilizan concentraciones de O2<50%. En relación con la ventilación de RN prematuros existe variabilidad en el uso de dispositivos, predominando la PIP y la PEEP controladas (tubo en T) y la utilización de CPAP para evitar la intubación traqueal. Los límites de presión utilizados (PIP, PEEP y CPAP) cada vez son más homogéneos. Actualmente, la insuflación sostenida es una práctica minoritaria.
Resumen de encuestas sobre equipamiento y prácticas clínicas en la reanimación de RN prematuros en sala de partos
| Publicación | Trevisauto et al.35 | Roehr et al.10 | Singh et al.36 | Murthy et al.11 | El Naggar y McNamara13 | Presente estudio | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| País | Italia | Alemania | Austria | Suiza | Reino Unido | Reino Unido | Canadá | España | ||
| Datos generales | ||||||||||
| Año publicación | 2014 | 2010 | 2010 | 2010 | 2013 | 2012 | 2012 | 2015 | ||
| Fecha encuesta | 2011 | 2008 | 2008 | 2008 | 2011 | 2010 | 2010 | I-II | 2012 | Todos |
| Año de recomendación | 2010 | 2005 | 2005 | 2005 | 2010 | III | 2005 | 71 | 2010 | 155 |
| Nivel Unidad | III | Todos | Todos | Todos | III | 58 | III | III | ||
| N.° de encuestas | 98 | 153 | 11 | 26 | 55 | 78 | 84 | |||
| Temperatura | ||||||||||
| Control temperatura SP (≥ 26°C) | 20,2% | – | – | – | – | – | 61% | 31% | 29,8% | 30,3% |
| Uso de envoltorios de plástico | 55,1% | 62% | 80% | 62% | 99% | 92,7% | 73% | 40,8% | 83,3% | 63,9%* |
| Uso de gorritos en la cabeza | 60,2% | 83% | 70% | 73% | – | – | – | 97,2% | 98,8% | 98,1% |
| Oxigenación | ||||||||||
| Uso mezcladores oxígeno | 92,9% | 97% | 100% | 96% | – | 87,9% | 97% | 73,2% | 85,7% | 80,0% |
| Uso de pulsioximetría | 84,7% | 99% | 99% | 100% | 79% | 70,7% | 91% | 76,6% | 87,8% | 78,0% |
| FiO2 inicial baja (< 0,5) | 87% | 100% | 88% | 91% | 89,7% | – | 80,3% | 89,2% | 85,2% | |
| FiO2 inicial 0,21 | 32% | 9% | 32% | 37% | 43% | 59% | 7,0% | 1,2% | 3,9% | |
| Ventilación | ||||||||||
| Uso de bolsa autoinflable | 20,6% | 83% | 89% | 96% | – | 10,4% | – | 54,9% | 29,8% | 41,3%** |
| Uso de ventilador con pieza en T | 79,4% | 41% | 80% | 20% | – | 89,7% | – | 42,3% | 78,6% | 61,9%* |
| Uso de PIP/PEEP | 89,8% | – | – | – | 91% | 94,4% | 96% | 68,4% | 96,4% | 85,3%** |
| Valor de PIP | 18 (17-20)a | – | – | – | – | – | – | 18,3 ± 3,0b | 18,8 ± 3,1b | 18,6 ± 3,1b |
| PIP entre 20-24 cmH2O | – | – | – | – | – | 87,9% | – | – | – | – |
| 0Valor de PEEP/CPAP | 5 (4-5)a | – | – | – | – | – | – | 4,7 ± 0,8b | 4,9 ± 0,5b | 4,8 ± 0,6b |
| PEEP/CPAP entre 4-5 cmH2O | – | 77% | 60% | 90% | – | 86,2% | – | – | – | – |
| PEEP/CPAP >5 cmH2O | – | 17% | 40% | 5% | – | 6,9% | – | – | – | – |
| Uso CPAP para evitar TET | 85,4% | – | – | – | 77% | – | 67% | 56,3% | 91,7% | 75,5%* |
| Insuflación sostenida (> 5 s) | – | 28% | 27% | 12% | – | – | – | 5,6% | 15,5% | 11,0% |
| Medicación: | ||||||||||
| INSURE | – | 30% | 44% | 21% | – | – | – | – | – | – |
| Uso de surfactante en SP | – | – | – | – | 93% | – | 62% | 54,9% | 40,5% | 47,1% |
CPAP: presión positiva continua de la vía aérea; FiO2: fracción inspiratoria de oxígeno; INSURE: intubación-administración surfactante-extubación precoz; PEEP: presión espiratoria final positiva; PIP: presión positiva inspiratoria; SP: sala de partos; TET: tubo endotraqueal.
En relación con el transporte del RN desde paritorio a la UCIN, el sistema de ventilación más utilizado es el ventilador automático y se ha objetivado en nuestro medio un incremento del uso de CPAP y mezcladores de O2.
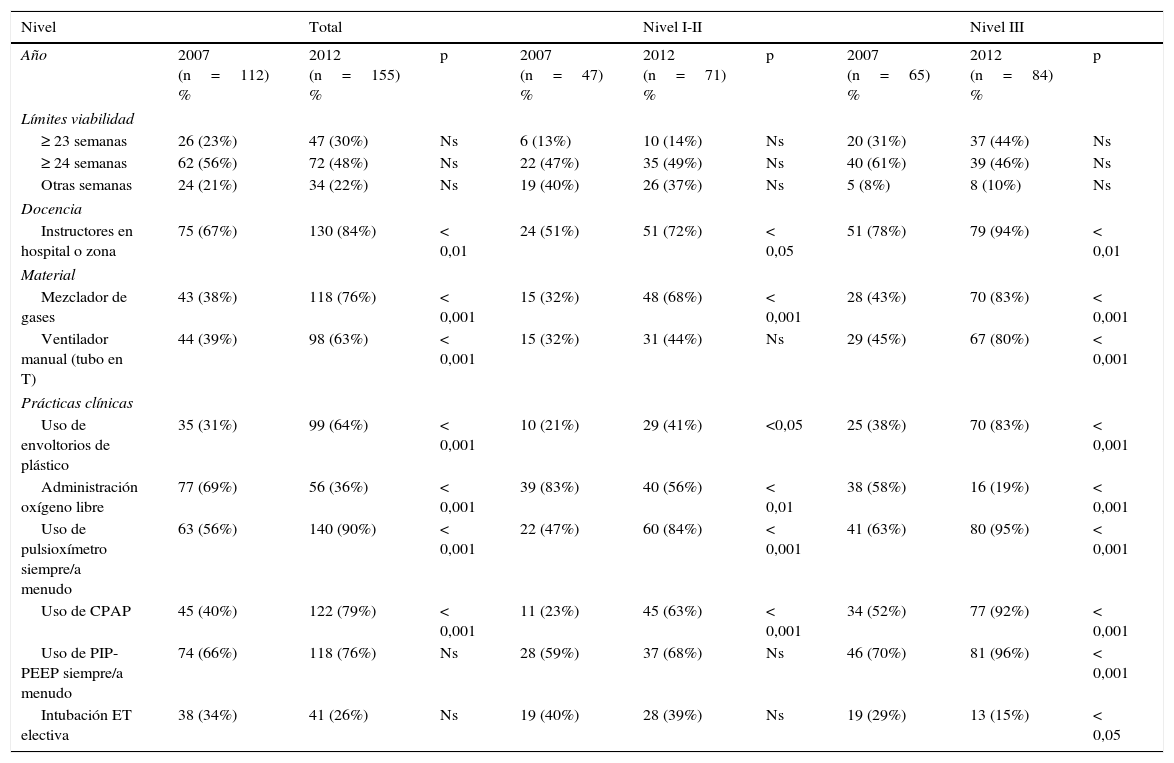
La tabla 6 muestra datos comparativos de equipamiento y prácticas de reanimación de la última encuesta de reanimación neonatal española7 y el presente estudio. Entre los años 2007 y 2012 se ha observado un incremento en la dotación de mezcladores de gases, ventiladores manuales (tubo en T), ha aumentado el empleo de la pulsioximetría como método para ajustar la FiO2 y ha disminuido la administración de O2 libre. Asimismo se evidencia un aumento en el uso de sistemas de presión controlada en unidades de nivel iii y de CPAP precoz para favorecer el reclutamiento alveolar.
Datos comparativos de las encuestas de la SENeo de los años 2007a y 2012 (estudio actual)
| Nivel | Total | Nivel I-II | Nivel III | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Año | 2007 (n=112) % | 2012 (n=155) % | p | 2007 (n=47) % | 2012 (n=71) % | p | 2007 (n=65) % | 2012 (n=84) % | p |
| Límites viabilidad | |||||||||
| ≥ 23 semanas | 26 (23%) | 47 (30%) | Ns | 6 (13%) | 10 (14%) | Ns | 20 (31%) | 37 (44%) | Ns |
| ≥ 24 semanas | 62 (56%) | 72 (48%) | Ns | 22 (47%) | 35 (49%) | Ns | 40 (61%) | 39 (46%) | Ns |
| Otras semanas | 24 (21%) | 34 (22%) | Ns | 19 (40%) | 26 (37%) | Ns | 5 (8%) | 8 (10%) | Ns |
| Docencia | |||||||||
| Instructores en hospital o zona | 75 (67%) | 130 (84%) | < 0,01 | 24 (51%) | 51 (72%) | < 0,05 | 51 (78%) | 79 (94%) | < 0,01 |
| Material | |||||||||
| Mezclador de gases | 43 (38%) | 118 (76%) | < 0,001 | 15 (32%) | 48 (68%) | < 0,001 | 28 (43%) | 70 (83%) | < 0,001 |
| Ventilador manual (tubo en T) | 44 (39%) | 98 (63%) | < 0,001 | 15 (32%) | 31 (44%) | Ns | 29 (45%) | 67 (80%) | < 0,001 |
| Prácticas clínicas | |||||||||
| Uso de envoltorios de plástico | 35 (31%) | 99 (64%) | < 0,001 | 10 (21%) | 29 (41%) | <0,05 | 25 (38%) | 70 (83%) | < 0,001 |
| Administración oxígeno libre | 77 (69%) | 56 (36%) | < 0,001 | 39 (83%) | 40 (56%) | < 0,01 | 38 (58%) | 16 (19%) | < 0,001 |
| Uso de pulsioxímetro siempre/a menudo | 63 (56%) | 140 (90%) | < 0,001 | 22 (47%) | 60 (84%) | < 0,001 | 41 (63%) | 80 (95%) | < 0,001 |
| Uso de CPAP | 45 (40%) | 122 (79%) | < 0,001 | 11 (23%) | 45 (63%) | < 0,001 | 34 (52%) | 77 (92%) | < 0,001 |
| Uso de PIP-PEEP siempre/a menudo | 74 (66%) | 118 (76%) | Ns | 28 (59%) | 37 (68%) | Ns | 46 (70%) | 81 (96%) | < 0,001 |
| Intubación ET electiva | 38 (34%) | 41 (26%) | Ns | 19 (40%) | 28 (39%) | Ns | 19 (29%) | 13 (15%) | < 0,05 |
CPAP: presión positiva continua de la vía aérea; ET: endotraqueal; NS: no significativo; PEEP: presión espiratoria final positiva; PIP: presión positiva inspiratoria.
Como conclusiones, debemos resaltar las mejoras en equipamiento y prácticas de reanimación neonatal en los paritorios españoles. Puntos de mejora serían minimizar las diferencias entre niveles de centros, incrementar la tª ambiental, un mayor uso de envoltorios plásticos, mezcladores de gases, pulsioximetría y detectores de CO2. Esta encuesta puede ser útil para planificar el equipamiento de paritorios y mejorar las prácticas profesionales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El GRN-SENeo agradece a todos los neonatólogos y pediatras que amablemente han aceptado en participar en este estudio como representantes de los siguientes hospitales: Hospital Belén (A Coruña); Hospital Juan Canalejo (A Coruña); Complejo Hospitalario Universitario de Albacete (Albacete); Hospital Príncipe de Asturias (Alcalá de Henares); Hospital Comarcal de Alcoy (Alcoy); Hospital San Juan (Alicante); Hospital General Universitario de Alicante (Alicante); Hospital General de Almansa (Almansa); Complejo Hospitalario Torrecárdenas (Almería); Hospital de Aranda de Duero (Burgos); Hospital del Tajo (Aranjuez); Hospital Sanitas La Zarzuela (Aravaca); Hospital del Sureste (Arganda del Rey); Hospital del Oriente de Asturias (Arriondas); Hospital Nuestra Señora de Sonsoles (Ávila); Hospital de San Agustín (Ávilés); Hospital Universitari Germans Trias i Pujol (Badalona); Hospital Universitario de Cruces (Barakaldo, Bilbao); Hospital Universitari Sant Joan de Déu (Barcelona); Hospital Universitari Vall d’Hebron (Barcelona); Hospital Barcelona (SCIAS) (Barcelona); Hospital de la Santa Creu i Sant Pau (Barcelona); Hospital Clínic Seu Maternitat (Barcelona); Hospital Universitari Quirón Dexeus (Barcelona); Hospital Quirón (Barcelona); Clínica Corachan (Barcelona); Hospital del Mar (Barcelona); Clínica del Pilar (Barcelona); Clínica Delfos (Barcelona); Hospital Quirón Teknon (Barcelona); Hospital Universitario de Basurto (Bilbao); Hospital Universitario Montepríncipe (Boadilla del Monte, Madrid); Hospital Da Costa (Burela); Hospital Universitario (Burgos); Hospital La Mancha Centro (Ciudad Real); Hospital Infanta Margarita (Cabra); Hospital San Pedro de Alcántara (Cáceres); Hospital Universitario Puerta del Mar (Cádiz); Fundación Hospital Calahorra (Calahorra); Hospital Sant Jaume (Calella) Hospital General Universitario Santa Lucía (Cartagena); Hospital General Universitari de Castelló (Castellón); Hospital General Universitario Ciudad Real (Ciudad Real); Hospital Universitario Reina Sofía (Córdoba); Hospital del Vendrell (El Vendrell); Hospital General de Elche (Elche); Hospital de Elda Virgen de la Salud (Elda); Hospital García Orcoyen (Estella); Complejo Universitario Marcide-Profesor Novoa Santos (Ferrol); Hospital de Figueres (Figueres); Hospital Universitario de Fuenlabrada (Fuenlabrada); Hospital Universitario de Getafe (Getafe); Hospital de Cabueñes (Gijón); Hospital Universitari Dr. Josep Trueta (Girona); Clínica Girona (Girona); Hospital Universitario Virgen de las Nieves (Granada); Hospital General de Granollers (Granollers); Hospital General de l’Hospitalet (L’Hospitalet de Llobregat); Hospital Juan Ramón Jiménez (Huelva); Hospital Can Misses (Ibiza); Hospital General d’Igualada (Igualada); Complejo Hospitalario de Jaén (Jaén); Hospital Universitario de Canarias (La Laguna, Tenerife); Hospital SAS de la Línea de la Concepción (La Línea, Cádiz); Fundació Sant Hospital de La Seu d’Urgell (La Seu d’Urgell); Hospital Universitario Insular de Gran Canaria (Las Palmas de Gran Canaria); Hospital Universitario Severo-Ochoa (Leganés); Hospital de León (León); Hospital Universitari Arnau de Vilanova (Lleida); Hospital San Pedro (Logroño); Hospital Universitario 12 de Octubre (Madrid); Hospital Universitario Gregorio Marañón (Madrid); Hospital Clínico San Carlos (Madrid); Hospital Universitario La Paz (Madrid); Hospital Capio Alcorcón Sur (Madrid); Hospital Nuevo Belén (Madrid); Hospital Universitario Infanta Leonor (Madrid); Hospital Infanta Elena (Madrid); Hospital Universitario Puerta de Hierro (Mahadahonda. Madrid); Hospital Carlos Haya (Málaga); Hospital de Manresa (Manresa); Hospital Costa del Sol (Marbella); Hospital Sant Joan de Déu (Martorell); Hospital de Medina del Campo (Medina del Campo); Hospital de Mendaro (Mendaro, Guipúzcoa); Hospital Mateu Orfila (Menorca); Hospital de Mérida (Mérida); Hospital General de Riotinto (Minas de Riotinto); Hospital de Mollet (Mollet); Hospital Alto Deba (Mondragón-Arrasate); Hospital de Monforte (Monforte de Lemos); Hospital de Montilla (Montilla); Hospital Comarcal de Mora d’Ebre (Mora d’Ebre); Hospital Universitario de Móstoles (Móstoles); Hospital Rey Juan Carlos (Móstoles); Hospital Clínico Universitario Virgen de la Arrixaca (Murcia); Hospital de Sant Jaume (Olot); Hospital General d’Ontinyent (Ontinyent); Hospital de Orihuela (Orihuela); Hospital Comarcal de Osuna (Osuna); Hospital Universitario Central de Asturias (Oviedo); Hospital de Palamós (Palamós); Hospital Universitari Son Espases (Palma de Mallorca); Hospital de Son Llàtzer (Palma de Mallorca); Hospital Quirón Palma Planas (Palma de Mallorca); Hospital de Pamplona (Pamplona); Clínica Universidad de Navarra (Pamplona); Hospital del Bierzo (Ponferrada); Complejo Hospitalario de Pontevedra (Pontevedra); Hospital Valle de Los Pedroches (Pozoblanco); Fundació Hospital de Puigcerdà (Puigcerdà); Hospital Sant Joan de Reus (Reus); Hospital do Barbanza (Ribeira); Hospital General de Catalunya (Sant Cugat del Vallés); Corporació Sanitària Parc Taulí (Sabadell); Hospital de Sagunto (Sagunto); Complejo Asistencial Universitario de Salamanca (Salamanca); Hospital Santa Caterina (Salt); Hospital El Escorial (San Lorenzo del Escorial); Hospital Universitario Donostia (San Sebastián); Policlínica Guipúzcoa (San Sebastián); Parc Sanitari Sant Joan de Déu (Sant Boi de Llobregat); Hospital de l’Espèrit Sant (Santa Coloma de Gramanet); Hospital Universitario Marqués de Valdecilla (Santander); Hospital Clínico Universitario (Santiago de Compostela); Hospital Universitario Virgen del Rocío (Sevilla); Hospital Universitario Virgen Macarena (Sevilla); Hospital Universitario de Valme (Sevilla); Hospital Santa Bárbara (Soria); Hospital Universitari Joan XXIII (Tarragona); Hospital Mútua de Terrassa (Terrasa); Hospital Virgen de la Salud (Toledo); Hospital Universitario de Torrejón (Torrejon de Ardoz); Hospital Universitario HM Torrelodones (Torrelodones); Hospital Verge de la Cinta (Tortosa); Hospital Comarcal del Pallars (Tremp); Hospital San Juan de la Cruz (Úbeda); Hospital Universitario Infanta Elena (Valdemoro); Hospital Universitari Doctor Peset (Valencia); Hospital Universitari La Fe (Valencia); Hospital Quirón Valencia (Valencia); Hospital del Río Hortega (Valladolid); Hospital Clínico Universitario de Valladolid (Valladolid); Consorci Hospitalari de Vic (Vic); Complexo Hospitalario Universitario de Vigo H-Xeral (Vigo); Hospital Nuestra Señora de Fátima (Vigo); Hospital Comarcal Alt Penedès (Vilafranca del Penedès); Hospital do Salnes (Vilagarcía de Arousa); Hospital de La Plana (Vila-Real); Hospital Comarcal de Vinaros (Vinaroz); Hospital Vitoria (Vitoria); Complejo Asistencial de Zamora (Zamora); Hospital Universitario Miguel Servet (Zaragoza); Hospital Clínico Universitario Lozano Blesa (Zaragoza); Hospital de Zumarraga (Zumárraga).
Elena Burón (Hospital Clínico Universitario de Valladolid), Juana Guzmán (Hospital Universitario Reina Sofía de Córdoba), Eva González (Hospital Álvaro Cunqueiro de la Estructura Organizada de Xestión Integrada de Vigo), César Ruiz (Hospital Vall d’Hebron de Barcelona), Dolores Elorza (Hospital Universitario La Paz de Madrid), Gonzalo Zeballos (Hospital Universitario Gregorio Marañón de Madrid), Miguel Sánchez (Hospital Universitario Puerta de Hierro de Mahadahonda, Madrid).