Los objetivos de este estudio fueron describir las notificaciones de sospechas de reacciones adversas relacionadas con las vacunas frente a rotavirus y valorar la sensibilidad de la notificación para invaginación intestinal.
Material y métodosEstudio descriptivo, a partir de las notificaciones de sospechas de reacciones adversas relacionadas con las vacunas frente a rotavirus, ocurridas en niños menores de diez meses, registradas en el Centro de Farmacovigilancia de la Comunidad Valenciana durante el periodo 2007-2011.
Se comparó la tasa de notificación de invaginaciones con la tasa de invaginaciones en vacunados obtenida utilizando la base de datos de altas hospitalarias (CMBD) y el registro nominal de vacunaciones autonómico.
ResultadosLa tasa de notificación de eventos adversos fue de 20 por 100.000 dosis administradas. El 74% de las notificaciones se clasificaron como no graves, siendo la fiebre, los vómitos y la diarrea las sospechas más frecuentes. Dos casos de invaginación, ocurridos en los siete primeros días tras la vacunación, fueron notificados como asociados temporalmente a la vacunación. La sensibilidad de la notificación de invaginación intestinal para el periodo de riesgo de uno a siete días fue del 50%.
ConclusionesLos resultados sugieren que las vacunas frente a rotavirus presentan un perfil de seguridad en general adecuado, y que el Centro de Farmacovigilancia de la Comunidad Valenciana, comparado con otros sistemas de vigilancia pasiva, es igualmente sensible para detectar señales de posible asociación con invaginación intestinal. Este riesgo requiere ser investigado con estudios epidemiológicos bien diseñados y comparado con los evidentes beneficios que estas vacunas proporcionan.
The aims of this study were to describe the reports of suspected adverse events due to rotavirus vaccines, and assess the reporting sensitivity for intussusception.
Material and methodsDescriptive study performed using the reports of suspected adverse events following rotavirus vaccination in infants aged less than 10 months, as registered in the Pharmacovigilance Centre of the Valencian Community during 2007-2011.
The reporting rate for intussusception was compared to the intussusception rate in vaccinated infants obtained using the hospital discharge database (CMBD), and the regional vaccine registry.
ResultsThe adverse event reporting rate was 20 per 100,000 administered doses, with the majority (74%) of the reports being classified as non-serious. Fever, vomiting, and diarrhea were the adverse events reported more frequently. Two intussusception cases, which occurred within the first seven days post-vaccination, were reported as temporarily associated to vaccination. The reporting sensitivity for intussusception at the Pharmacovigilance Centre in the 1-7 day interval following rotavirus vaccination was 50%.
ConclusionsOur results suggest that rotavirus vaccines have, in general, a good safety profile. Intussusception reporting to the Pharmacovigilance Centre shows sensitivity similar to other passive surveillance systems. The intussusception risk should be further investigated using well-designed epidemiological studies, and evaluated in comparison with the well-known benefits provided by these vaccines.
La primera vacuna frente a rotavirus, Rotashield®, fue autorizada en Estados Unidos en 1998, no obstante, fue retirada a los pocos meses1 al confirmarse, con estudios epidemiológicos de base poblacional2,3, la alarma generada por la notificación de 15 casos de invaginación intestinal al sistema de vigilancia pasiva Vaccine Adverse Events Reporting System (VAERS) tras 1,8 millones de dosis distribuidas4.
Dos nuevas vacunas, ambas orales vivas atenuadas: una monovalente humana, Rotarix®, y otra pentavalente humano-bovina, RotaTeq®, fueron autorizadas varios años después tras amplios ensayos clínicos preautorización diseñados para excluir esta asociación5,6. Estas vacunas, disponibles en España desde 2006 y 2007 respectivamente, no fueron incluidas en el calendario de vacunaciones, pero son recomendadas por pediatras y financiadas por los padres. En 2010 se detectó una contaminación viral y ambas fueron retiradas del mercado7,8. Meses más tarde, tras comprobar que el hallazgo no generaba problemas de seguridad ni de eficacia, se autorizó nuevamente la distribución de RotaTeq®9, y se espera la liberación de los lotes de Rotarix®. Las fichas técnicas de ambas vacunas recomendaron iniciar la pauta vacunal a partir de las 6 semanas de edad y finalizarla antes de la semana 24 (Rotarix®) y de la semana 26 (RotaTeq®). En 2012 se amplió el límite superior de edad de los vacunados con RotaTeq® a 32 semanas10.
Los ensayos clínicos y la vigilancia postautorización no han mostrado evidencia de reacciones adversas graves asociadas a estas vacunas5,6, excepto en el caso de invaginación intestinal, asociación que ha sido cuidadosamente monitorizada. Estudios postautorización mostraron un aumento del riesgo tras la primera dosis en México (Rotarix®)11 y Australia (RotaTeq®)12, y tras la segunda dosis (Rotarix®) en Brasil11, aunque considerablemente menor que el observado con Rotashield®. En Estados Unidos ni con datos disponibles del sistema de vigilancia pasiva VAERS13, ni con datos procedentes de estudios observacionales iniciales14–17 se había encontrado asociación de RotaTeq® con la invaginación. Sin embargo, datos del VAERS con mayor número de dosis distribuidas sugirieron la plausibilidad de esta asociación18, que ha sido recientemente confirmada19,20.
En España la vigilancia postautorización se basa fundamentalmente en la vigilancia pasiva. No obstante, la infranotificación es conocida en estos sistemas. Su grado depende fundamentalmente de la gravedad del evento, su proximidad temporal con la administración, el conocimiento previo de la asociación y de la obligación de notificar21. Por otra parte, la notificación puede verse aumentada en los primeros años tras la autorización de un nuevo medicamento22, o ser estimulada cuando el medicamento es objeto de exposición a los medios, bien porque se trata de una asociación conocida o porque las autoridades reguladoras han emitido alguna advertencia23. Estimar el grado de infranotificación o de exceso de un sistema de vigilancia pasiva permite evaluar su validez para la detección de reacciones adversas, y en consecuencia, su utilidad, pero se requiere disponer de un adecuado estándar de referencia21.
Los objetivos de este estudio fueron describir las notificaciones de sospechas de reacciones adversas relacionadas con las vacunas frente a rotavirus registradas por el Centro de Farmacovigilancia de la Comunidad Valenciana (CFCV) y valorar la sensibilidad en la notificación de este sistema de vigilancia pasiva para un evento grave y raro como la invaginación intestinal.
Material y métodosDiseñoEstudio descriptivo retrospectivo realizado a partir de las notificaciones de sospecha de reacciones adversas relacionadas con las vacunas frente a rotavirus registradas en la base de datos del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) desde el CFCV entre el 1 de enero de 2007 y el 31 de diciembre de 2011.
La comparación de la tasa de notificación de casos de invaginación intestinal al CFCV con un estándar de referencia se realizó utilizando los datos de un estudio observacional retrospectivo diseñado para estimar la asociación entre la invaginación intestinal y la administración de las vacunas frente a rotavirus. Este estudio incluyó la confirmación de todos los casos de invaginación intestinal en niños residentes menores de 10 meses de edad ingresados en hospitales públicos de la Comunidad Valenciana en el mismo periodo.
Ambos estudios fueron autorizados por el Comité Ético de Investigación Clínica de la Dirección General de Salud Pública-Centro Superior de Investigación en Salud Pública.
Fuentes de datosLa notificación de sospechas de reacciones adversas en España se realiza a través del Programa de Notificación Espontánea de Reacciones Adversas a Medicamentos. Los profesionales sanitarios, los laboratorios farmacéuticos titulares de los medicamentos, y desde enero de 2013 también los ciudadanos24, comunican estas sospechas al correspondiente centro autonómico de farmacovigilancia25. El CFCV recibe las notificaciones, las analiza, codifica e integra en la base de datos del Gestor de Reacciones Adversas de Medicamentos del Sistema de Información de Control y Ordenación de Medicamentos y Productos Sanitarios, que de forma telemática las registra en FEDRA, la base de datos del SEFV-H26.
Las dosis de vacunas administradas en centros sanitarios públicos y privados de la Comunidad Valenciana son registradas en el Sistema de Información Vacunal (SIV), que permite además a los profesionales sanitarios notificar las sospechas de reacciones adversas a vacunas, que telemáticamente son enviadas al CFCV27.
El conjunto mínimo básico de datos (CMBD) es el registro de altas de los hospitales generales del Sistema Nacional de Salud28. Todos los episodios de invaginación intestinal en niños menores de 10 meses de edad hospitalizados durante el periodo de estudio fueron identificados en esta base de datos, a través del código CIE-9-MC específico (560.0) en cualquier posición diagnóstica. Estos casos fueron revisados y confirmados siguiendo la definición estandarizada de caso de invaginación intestinal de la Brighton Collaboration (BC)29 (tabla 1). Su estado vacunal frente a rotavirus, y en su caso la fecha de vacunación, fueron obtenidos de SIV. En los casos con datos inconsistentes la fecha de vacunación y el número de dosis fueron confirmados por los padres o representantes legales.
Definición estandarizada de caso de la Brighton Collaboration para el diagnóstico de invaginación intestinal aguda en lactantes y niños pequeños
| Nivel 1Criterios quirúrgicos y/o criterios radiológicos* y/o criterios basados en la autopsia*Enema de aire o de líquido de contraste o la demostración de una masa intraabdominal a través de ecografía abdominal, signo de diana o donut en la sección transversa o signo de pseudo-riñón o sándwich en la sección longitudinal, y que se demuestra que ha sido reducida por enema hidrostático en la ecografía abdominal posreducción |
| Nivel 2Criterios clínicos****Dos criterios mayores (evidencia de obstrucción intestinal, característica de invaginación intestinal o evidencia de compromiso intestinal vascular o congestión venosa) o uno de los criterios mayores y 3 criterios menores (edad menor de un año y sexo masculino, dolor abdominal, vómitos, aletargamiento, palidez, shock hipovolémico, radiografía simple de abdomen que muestra un patrón de gases anormal pero no específico) |
| Nivel 3Criterios clínicos****Cuatro o más criterios menores (edad menor de un año y sexo masculino, dolor abdominal, vómitos, aletargamiento, palidez, shock hipovolémico, radiografía simple de abdomen que muestra un patrón de gases anormal pero no específico) |
| Insuficiente evidenciaSi la evidencia disponible para un evento es insuficiente porque no se dispone de suficiente información |
| No es un casoSi se detecta un criterio de exclusión o si la investigación revela un hallazgo negativo de un criterio necesario para la clasificación de los niveles 1-3, en este caso el evento debe ser clasificado como «No, no es un caso de invaginación». |
Fuente: Bines et al.29.
*Clasificación podría ser por criterios quirúrgicos, radiológicos o basados en la autopsia y el asterisco define cuáles son estos criterios radiológicos.
**Se refiere a los criterios clínicos que aplican en cada caso.
Las sospechas de reacciones adversas notificadas fueron descritas en función de su gravedad30 y de acuerdo con la clasificación MedDRA de órganos y sistemas afectados31. Para cada evento la latencia fue calculada como el intervalo entre la fecha de inicio de síntomas y la fecha de vacunación, y la duración como el intervalo entre la fecha de inicio y la fecha de fin de los síntomas. Se realizó un análisis descriptivo utilizando el paquete estadístico Stata/SE 12 (StataCorp. LP Texas, EE. UU.).
Las frecuencias esperadas de sospechas de reacciones adversas distintas a invaginación intestinal descritas en las fichas técnicas fueron calculadas usando como denominador el número total de dosis de vacunas de rotavirus registradas en el SIV (20 de diciembre de 2012).
La sensibilidad de la notificación21 al CFCV para detectar invaginación intestinal fue calculada dividiendo la tasa de notificación de invaginación intestinal al CFCV por la tasa de invaginaciones confirmadas en niños vacunados frente a rotavirus (nivel 1 o 2 de certeza diagnóstica de la clasificación de la BC) hallada en el estudio observacional.
ResultadosDurante el periodo 2007-2011 fueron administradas en la Comunidad Valenciana al menos 185.654 dosis de las 2 vacunas disponibles frente a rotavirus, y fueron notificadas un total de 37 sospechas de reacciones adversas. La tasa de notificación fue de 20 por 100.000 dosis administradas.
Descripción de las notificacionesFueron realizadas 3 notificaciones de sospecha de reacciones adversas en 2007, 6 en 2008, 18 en 2009, 5 en 2010 y 5 en 2011. Las tasas de notificación fueron, respectivamente, 17, 14. 34. 18 y 11 por 100.000 dosis administradas.
Las 37 notificaciones incluyeron un total de 91 sospechas de reacciones adversas, con una mediana de 2 reacciones por notificación, una media de 2,5 (DE: 2,0) y un rango de entre 1 y 10.
Tres de las notificaciones declararon fallos vacunales, por lo que fueron descritas por separado.
En las 34 restantes el 65% de los niños eran varones. En las 33 notificaciones de las que se dispone del dato la mediana y media de edad fue de 4 meses (DE: 1,7), con un rango de 2 a 10 meses de edad. En 19 (56%) de las notificaciones la vacuna frente a rotavirus fue administrada concomitantemente con otras vacunas.
Notificaciones de sospechas de reacciones adversas no gravesUn total de 25 de las 34 notificaciones (74%) fueron clasificadas como no graves e incluyeron 35 sospechas de reacciones adversas. Las sospechas notificadas con más frecuencia fueron fiebre (n=16), diarrea (n=8; incluye diarrea y gastroenteritis) y vómitos (n=5). El resto correspondieron a hipertermia, irritabilidad, dolor abdominal, heces anormales, eritema generalizado y urticaria.
La mediana del periodo de latencia correspondió al día de la vacunación, apareciendo los síntomas como máximo a los 3 días. En las 23 notificaciones de las que se dispone de esta información la duración de las sospechas de reacciones adversas no se prolongó más de 7 días, siendo la mediana de un día.
Notificaciones de sospechas de reacciones adversas gravesNueve de las 34 notificaciones (26%) fueron clasificadas como graves e incluyeron un total de 36 sospechas de reacciones adversas.
Los 2 casos de invaginación intestinal notificados ocurrieron en una niña de 4 meses cuyos síntomas, que incluyeron melenas, hiperhidrosis y trombocitopenia comenzaron 6 días después de la vacunación, y en un niño de 3 meses cuyos síntomas, incluyendo diarrea hemorrágica y llanto, se presentaron 7 días tras la vacunación. Ambos cuadros se resolvieron, aunque no se dispone de información sobre los procedimientos utilizados.
También fueron notificados un trastorno gastrointestinal acompañado de diarrea con heces mucosas y sangre que describía empeoramiento de la enfermedad (sin especificar), una pérdida de conciencia acompañada de hipotonía, apnea y boca espumosa, una convulsión febril con disminución de la movilidad, un broncoespasmo acompañado de bronquiolitis, fiebre, vómitos y diarrea, una infección urinaria con fiebre, distensión abdominal, apetito disminuido y aerofagia, y 2 casos de taquicardia, una supraventricular y otra no especificada acompañada de fiebre, irritabilidad, hipotonía, palidez y vómitos.
En las 7 notificaciones en las que se dispone de esta información la mediana del periodo de latencia fue de un día, apareciendo los síntomas entre el día de la vacunación y los 113 días siguientes. La duración de la enfermedad en las sospechas graves no se prolongó más de 6 días en las 3 notificaciones de las que se dispone de esta información, siendo la mediana de 5 días.
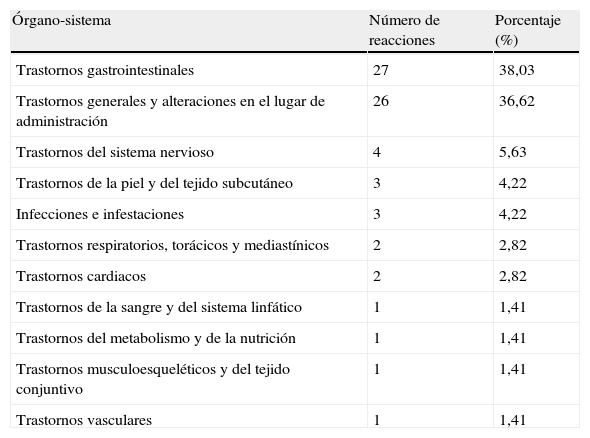
Frecuencia de sospechas de reacciones adversas notificadas según la clasificación MedDRA de órganos y sistemas afectadosLas 34 notificaciones relacionadas con la seguridad de las vacunas frente a rotavirus describieron un total de 71 sospechas de reacciones adversas, de las que 27 (38%) correspondían a trastornos gastrointestinales y 26 (37%) a trastornos generales y alteraciones en el lugar de administración. El resto de sospechas fueron clasificadas como trastornos del sistema nervioso, de la piel y del tejido subcutáneo, infecciones e infestaciones, trastornos respiratorios, torácicos y mediastínicos, cardiacos, de la sangre y del tejido linfático, del metabolismo y de la nutrición, vasculares y musculoesqueléticos y del tejido conjuntivo (tabla 2).
Sospechas de reacciones adversas notificadas según la clasificación MedDRA de órganos y sistemas afectados
| Órgano-sistema | Número de reacciones | Porcentaje (%) |
| Trastornos gastrointestinales | 27 | 38,03 |
| Trastornos generales y alteraciones en el lugar de administración | 26 | 36,62 |
| Trastornos del sistema nervioso | 4 | 5,63 |
| Trastornos de la piel y del tejido subcutáneo | 3 | 4,22 |
| Infecciones e infestaciones | 3 | 4,22 |
| Trastornos respiratorios, torácicos y mediastínicos | 2 | 2,82 |
| Trastornos cardiacos | 2 | 2,82 |
| Trastornos de la sangre y del sistema linfático | 1 | 1,41 |
| Trastornos del metabolismo y de la nutrición | 1 | 1,41 |
| Trastornos musculoesqueléticos y del tejido conjuntivo | 1 | 1,41 |
| Trastornos vasculares | 1 | 1,41 |
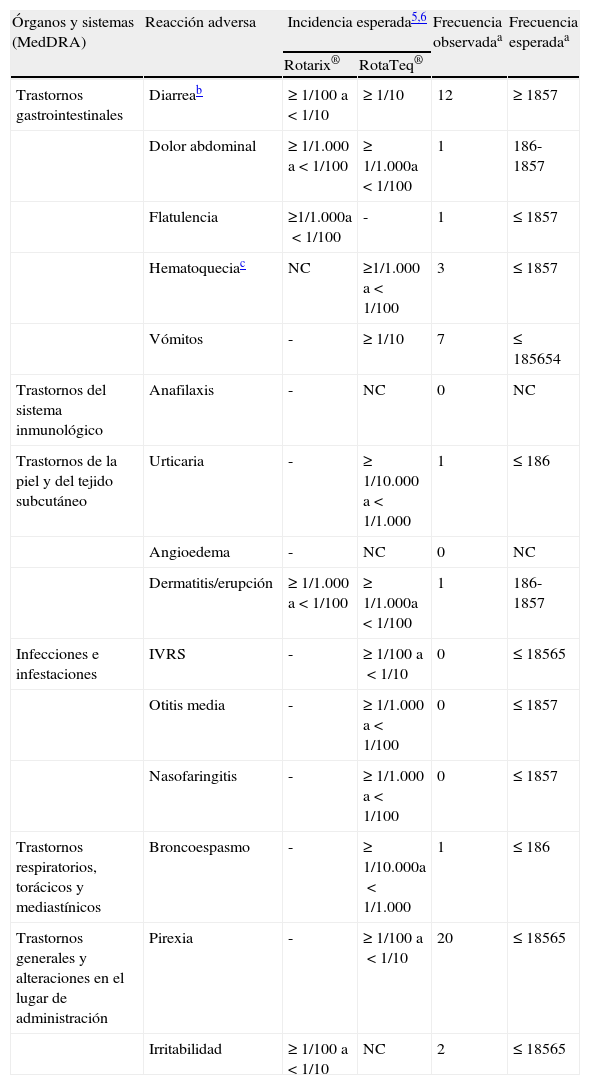
La comparación entre las frecuencias observadas de sospecha de reacciones adversas (distintas a la invaginación intestinal) descritas en las fichas técnicas, con las frecuencias esperadas, basadas en datos de los ensayos clínicos y de la vigilancia postautorización, muestra que en todos los casos en los que la comparación fue posible las frecuencias observadas (basadas en las notificaciones) fueron muy inferiores a las esperadas (tabla 3).
Sospechas de reacciones adversas distintas a invaginación intestinal descritas en las fichas técnicas de las vacunas frente a rotavirus: frecuencias observadas y esperadas por dosis administradas
| Órganos y sistemas (MedDRA) | Reacción adversa | Incidencia esperada5,6 | Frecuencia observadaa | Frecuencia esperadaa | |
| Rotarix® | RotaTeq® | ||||
| Trastornos gastrointestinales | Diarreab | ≥1/100 a<1/10 | ≥1/10 | 12 | ≥1857 |
| Dolor abdominal | ≥1/1.000 a<1/100 | ≥1/1.000a<1/100 | 1 | 186-1857 | |
| Flatulencia | ≥1/1.000a<1/100 | - | 1 | ≤1857 | |
| Hematoqueciac | NC | ≥1/1.000 a<1/100 | 3 | ≤1857 | |
| Vómitos | - | ≥1/10 | 7 | ≤185654 | |
| Trastornos del sistema inmunológico | Anafilaxis | - | NC | 0 | NC |
| Trastornos de la piel y del tejido subcutáneo | Urticaria | - | ≥1/10.000 a<1/1.000 | 1 | ≤186 |
| Angioedema | - | NC | 0 | NC | |
| Dermatitis/erupción | ≥1/1.000 a<1/100 | ≥1/1.000a<1/100 | 1 | 186-1857 | |
| Infecciones e infestaciones | IVRS | - | ≥1/100 a<1/10 | 0 | ≤18565 |
| Otitis media | - | ≥1/1.000 a<1/100 | 0 | ≤1857 | |
| Nasofaringitis | - | ≥1/1.000 a<1/100 | 0 | ≤1857 | |
| Trastornos respiratorios, torácicos y mediastínicos | Broncoespasmo | - | ≥1/10.000a<1/1.000 | 1 | ≤186 |
| Trastornos generales y alteraciones en el lugar de administración | Pirexia | - | ≥1/100 a<1/10 | 20 | ≤18565 |
| Irritabilidad | ≥1/100 a<1/10 | NC | 2 | ≤18565 | |
185.654 dosis administradas en el periodo 2007-2011. La frecuencia esperada fue calculada en función de la incidencia mínima y máxima hallada en los ensayos clínicos de ambas vacunas.
IVRS: infección de las vías respiratorias superiores; NC: no conocida.
aSe refiere a 185.654 dosis hallada en los ensayos clínicos de ambas vacunas.
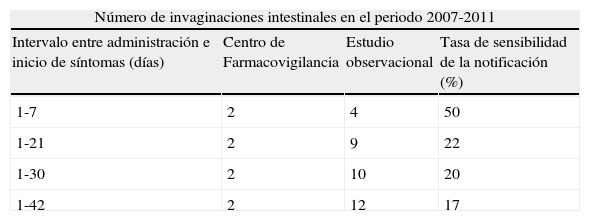
Fueron notificados al CFCV 2 casos de invaginación diagnosticados hasta 7 días después de la administración de alguna de las dosis de las vacunas frente a rotavirus. Durante el mismo periodo a través del estudio observacional fueron detectados, para la misma ventana de riesgo (1-7 días posvacunación), 4 casos confirmados como nivel 1 o 2 de certeza diagnóstica de la definición de caso estandarizada de invaginación intestinal de la BC. En consecuencia, la tasa de sensibilidad de la notificación al CFCV calculada para esta ventana de riesgo fue del 50%. La sensibilidad para ventanas de riesgo de 1-21, de 1-30 y de 1-42 días fueron del 22, 20 y 17% respectivamente (tabla 4).
Número de invaginaciones intestinales notificadas al Centro de Farmacovigilancia y número de invaginaciones intestinales observadas a través del estudio observacional: tasa de sensibilidad en la notificación de invaginación intestinal
| Número de invaginaciones intestinales en el periodo 2007-2011 | |||
| Intervalo entre administración e inicio de síntomas (días) | Centro de Farmacovigilancia | Estudio observacional | Tasa de sensibilidad de la notificación (%) |
| 1-7 | 2 | 4 | 50 |
| 1-21 | 2 | 9 | 22 |
| 1-30 | 2 | 10 | 20 |
| 1-42 | 2 | 12 | 17 |
Las 3 notificaciones que describían fallos vacunales fueron clasificadas como graves. Los 3 casos correspondieron a un niño de 6 meses que presentó síntomas de sospecha de infección por rotavirus 75 días después de la vacunación, una niña de 19 meses que los presentó a los 435 días y un niño de edad no conocida que los presentó aproximadamente 3 meses tras la vacunación. Con los datos disponibles no resulta posible conocer si habían completado la pauta de vacunación o si el diagnóstico fue confirmado por laboratorio.
DiscusiónLos datos de vigilancia pasiva procedentes del CFCV, tras más de 185.000 dosis declaradas a SIV durante un periodo de 5 años, sugieren que las vacunas disponibles frente a rotavirus presentan un perfil de seguridad en general adecuado, ya que las sospechas de reacciones adversas más frecuentemente notificadas fueron fiebre, diarrea y vómitos, coincidiendo con los resultados de los ensayos clínicos preautorización; el 74% de las notificaciones fueron clasificadas como no graves y la frecuencia de notificaciones observadas en relación con las esperadas para reacciones adversas distintas a invaginación intestinal fue muy baja.
La invaginación intestinal, notificada en 2 ocasiones dentro de los 7 días tras la vacunación frente a rotavirus, ha sido asociada con la administración de ambas vacunas11,19. Dado que además, la replicación del virus vacunal en el intestino en los primeros 7 días tras la vacunación18, particularmente tras la primera dosis, le confiere plausibilidad biológica, resulta necesario evaluar cuidadosamente este riesgo en la Comunidad Valenciana. Cabe destacar que, en estos primeros 7 días tras la vacunación, el CFCV presenta una sensibilidad para detectar invaginación intestinal del 50%, muy próxima a la estimación realizada para el VAERS durante la comercialización de Rotashield®32. Esta relativa alta tasa de sensibilidad en la notificación obtenida para la invaginación no es necesariamente aplicable a otros eventos adversos graves, ya que la invaginación intestinal se manifiesta en estrecha proximidad temporal con la vacunación, y la experiencia con Rotashield®, sumada a la estrecha vigilancia a la que se ha sometido a las nuevas vacunas, añade conocimiento de la posible asociación21,32. No obstante, el hecho de que no haya sido notificado ningún caso de enfermedad de Kawasaki tras la administración de al menos 118.996 dosis de RotaTeq® (SIV, 20 de diciembre de 2012), que en los ensayos preautorización había sido notificada, aunque sin diferencias significativas6, resulta tranquilizador. Esta posible asociación tampoco ha sido sugerida por la vigilancia pasiva en el VAERS33 ni establecida en un estudio observacional34.
La detección de eventos adversos graves en los sistemas de vigilancia pasiva puede resultar imprecisa, particularmente si las notificaciones no proporcionan suficiente información. Las sospechas de reacciones adversas notificadas no descritas en las fichas técnicas fueron taquicardia, infección urinaria y trombocitopenia. No obstante, estas notificaciones no sugieren que se trata de nuevas señales que requieran investigarse exhaustivamente, ya que además de la baja tasa de notificación, la taquicardia supraventricular suele aparecer en lactantes menores de 1 año por razones no asociadas con la vacunación35, la taquicardia no especificada iba acompañada de fiebre, la infección urinaria es una condición no asociada con la vacunación36 y la trombocitopenia fue descrita como parte de una notificación de invaginación intestinal en la que no se sugiere que sea un caso de púrpura trombocitopénica inmune (PTI). Además, la PTI, aunque asociada en frecuencia muy baja con la vacuna triple vírica y de forma anecdótica con otras vacunaciones virales, no ha sido asociada con las vacunas frente a rotavirus37. De cualquier modo, la relación temporal y la sospecha de la asociación con la vacuna es suficiente razón para notificar23, y es importante que los profesionales sanitarios recuerden la obligación de notificar las sospechas de reacciones adversas a medicamentos y vacunas, especialmente si se trata de eventos graves.
En cuanto a la administración concomitante con otras vacunas, resulta complicado atribuir la sospecha a una vacuna en particular, especialmente si se trata de trastornos descritos en común para más de una vacuna. La administración de Rotarix® o RotaTeq® con otras vacunas como difteria-tétanos-pertussis acelular, inactivada de polio, conjugada de Haemophilus influenzae B, hepatitis B y vacuna frente a neumococo conjugada han mostrado no interferir de forma significativa ni en la respuesta inmunitaria ni en el perfil de seguridad de las respectivas vacunas38.
Una importante limitación de nuestro estudio es que al no disponer de la marca, ni del número de dosis de la vacuna en las notificaciones a farmacovigilancia, no resulta posible asociar las sospechas de reacciones adversas o calcular las frecuencias esperadas por marca y dosis de vacuna administrada. Sin embargo, aunque la composición de las 2 vacunas es diferente5,6, el mecanismo de acción es similar39, aunque no ocurre así particularmente con respecto a la invaginación intestinal con el número de dosis administrada18.
A pesar de que SIV está disponible en todos los centros públicos y en algunos de los centros privados en los que se administran vacunas, debido a que las vacunas frente a rotavirus no están incluidas en el calendario de vacunaciones, el número de dosis declaradas al SIV podría ser inferior al número de dosis administradas. Al comparar el número de dosis distribuidas (IMS Health) con el número de dosis registradas en el SIV durante 2008-2010, determinamos que aproximadamente el 83% de las vacunas distribuidas estaban registradas como administradas en el SIV.
Los resultados de este estudio sugieren que las vacunas frente a rotavirus presentan un perfil de seguridad en general adecuado y que el CFCV, comparado con otros sistemas de vigilancia pasiva, dispone de sensibilidad suficiente para detectar señales de posible asociación con invaginación intestinal. Este riesgo requiere ser investigado con estudios epidemiológicos bien diseñados y comparado con los evidentes beneficios5,6,40 que estas vacunas proporcionan.
Conflicto de interesesJDD, JPB, MSC y SPV trabajan en el Área de Investigación en Vacunas de FISABIO-Salud Pública. Esta institución ha participado y participa en ensayos clínicos y estudios epidemiológicos financiados por GSK, MSD y SP-MSD.
Marian Martín-Navarro, Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunitat Valenciana FISABIO-Salud Pública y Alexandra C. Pacurari, Erasmus University Medical Center.
Presentación previa en reuniones, congresos o simposios: aceptado resumen (contenido parcial del original) en el 7th Vaccine and ISV Congress, 27-29 octubre de 2013, Sitges, España.