Analizar variabilidad glucémica, el estrés oxidativo y la relación entre ambos en un grupo de en niños y adolescentes con diabetes tipo 1 (DM1) que asistieron a un campamento.
Pacientes y métodoEstudio transversal que incluyó a 54 niños con DM1 entre 7 y 16 años de edad que asistieron a un campamento de verano de 7 días. Se recogieron datos sociodemográficos, clínicos y valores de glucemia capilar medidos con un glucómetro Accu-Chek Nano®. Se calcularon los marcadores de variabilidad glucémica: desviación estándar (DE), índice de glucemia baja (LBGI), índice de glucemia elevada (HBGI), amplitud media de las excursiones glucémicas (MAGE) y media de las diferencias diarias (MODD). El estrés oxidativo fue evaluado mediante la medición de 8-iso-prostaglandina F2 alfa (PGF2α) en una muestra de orina de 24 h recogida en 14 niños al final del campamento.
ResultadosLa mediana de DE, MAGE y MODD se encontraron en un rango elevado (61, 131 y 59mg/dl, respectivamente), LBGI en la categoría de riesgo moderado (3,3) y HBGI en la categoría de riesgo bajo (4,5). La media de HbA1c fue del 7,6%. La media de la tasa de excreción urinaria de 8-iso-PGF2α fue 864,39pg/mg creatinina. No se encontraron correlaciones estadísticamente significativas entre marcadores de variabilidad glucémica y 8-iso PGF2α urinario.
ConclusionesSe ha objetivado una alta variabilidad glucémica en niños y adolescentes con DM1 asistentes a un campamento de verano. Sin embargo, no se han encontrado correlaciones entre marcadores de variabilidad glucémica y de estrés oxidativo medido por 8-iso-PGF2α urinario.
To assess glycemic variability, oxidative stress and their relationship in children and adolescents with type 1 diabetes (T1DM) attending a summer camp.
Patients and methodCross-sectional study that included 54 children and adolescents with T1DM aged 7-16, attending a 7 day summer camp. Sociodemographic information, clinical data, and blood glucose values measured using an Accu-Chek Nano® glucose meter were recorded. Glucose variability markers (standard deviation [SD], low blood glucose index [LBGI], high blood glucose index [HBGI], mean amplitude of glycemic excursions [MAGE] and mean of daily differences [MODD]) were calculated. Oxidative stress was assessed by the measurement of 8-iso-prostaglandin F2 alpha (PGF2α) in a 24-hour urine sample collected at the end of the camp in 14 children.
ResultsThe Median SD, MAGE and MODD indexes were in the high range (61, 131 and 58mg/dl, respectively), LBGI in the moderate range (3.3), and HBGI in the low range (4.5). The mean HbA1c was 7.6% and the median urinary excretion rate of 8-iso-PGF2α was 864.39pg/mg creatinine. The Spearman correlation coefficients between markers of glycemic variability (SD, HBGI, MAGE, MODD) were significant. Non-significant correlations were found between markers of glycemic variability and urinary 8-iso-PGF2α.
ConclusionsHigh glycemic variability was observed in children and adolescents attending a summer camp. However, no correlations were found between markers of glycemic variability and oxidative stress measured by urinary 8-iso-PGF2α. Further studies are needed to address the relationship between oxidative stress and glycemic variability in children with T1DM.
Tras la publicación del estudio Diabetes Control and Complications Trial, la HbA1c se ha considerado el principal parámetro para evaluar el control metabólico tanto en niños como en adultos con diabetes mellitus tipo 1 (DM1)1. Sin embargo, estudios recientes con sistemas de monitorización continua de glucosa (MCG) han puesto de manifiesto la existencia de amplias fluctuaciones en los valores de glucosa en niños con DM1, incluso en aquellos con excelentes niveles de HbA1c2,3. De modo que el interés por estudiar el impacto de estas fluctuaciones glucémicas ha aumentado4-6. El concepto de variabilidad glucémica engloba la variabilidad intradía (fluctuaciones de glucosa dentro de un mismo día) e interdía (fluctuaciones de glucosa entre un día y el siguiente). La variabilidad intradía puede ser estimada mediante la desviación estándar (DE) alrededor de la media de los valores de glucosa en un día y mediante la amplitud media de las excursiones glucémicas (mean amplitude of glycemic excursions) (MAGE)7. La media de las diferencias diarias (mean of daily differences [MODD])8 es un marcador de la variabilidad interdía. Otros parámetros que evalúan el riesgo de presentar valores glucémicos extremos son el índice de glucemia baja (low blood glucose index [LBGI]) que es una medida del riesgo de hipoglucemia9, y el índice de glucemia elevada (high blood glucose index [HBGI]), que es una medida del riesgo de hiperglucemia10.
Recientemente, se ha asociado la variabilidad glucémica con el incremento en la producción de radicales libres y el estrés oxidativo11. Los isoprostanos se consideran buenos indicadores del estrés oxidativo, ya que son productos estables derivados del proceso de oxidación del ácido araquidónico por radicales libres de oxígeno y han demostrado que se elevan con el daño oxidativo12,13. Los isoprostanos pueden estimarse a través de la medida de la excreción en orina de 24h de 8-iso-prostaglandina F2 alfa (8-iso-PGF2α).
Los objetivos de este estudio son evaluar la variabilidad glucémica y el estrés oxidativo estimado por la tasa de excreción urinaria de 8-iso-PGF2α en un grupo de niños y adolescentes con DM1 que asistieron a un campamento de verano, y analizar la relación entre ambos.
Pacientes y métodosPacientes y diseño del estudioEstudio transversal en el que se incluyó a 54 niños y adolescentes con DM1 con edades comprendidas entre los 7 y los 16 años, que asistieron a un campamento de verano de 7 días de duración en Málaga durante julio del 2009. El campamento de verano estaba organizado por una asociación de diabetes local.
Todos los niños dieron consentimiento verbal para participar en el estudio y sus padres firmaron un consentimiento informado.
MedidasSe recogieron datos sociodemográficos y clínicos que incluían información acerca del tiempo de evolución de la diabetes, el tratamiento para la diabetes y la presencia de complicaciones crónicas relacionadas con la diabetes. Se consideró que había retinopatía diabética si existían antecedentes de haber recibido coagulación con láser; se consideró que había nefropatía diabética si existía microalbuminuria positiva que precisaba tratamiento con inhibidores de la enzima convertidora de angiotensina o antagonistas del receptor de angiotensina ii, y se consideró neuropatía diabética si existía una alteración o disminución de la sensibilidad de las manos y/o pies.
Durante el campamento se recogieron 7 mediciones diarias de glucemia capilar (una medición antes de cada comida —desayuno, almuerzo y cena—, una medición 2 h después de cada comida —desayuno, almuerzo y cena— y una medición a las 3 de la madrugada) de todos los participantes utilizando el glucómetro Accu-Chek Aviva Nano® (Roche Diagnostic). Los datos de glucemia almacenados en los glucómetros se transfirieron a un ordenador utilizando el dispositivo Accu-Chek Smart Pix® (Roche Diagnostic). El software Accu-Chek Smart Pix® Data Management System (Roche Diagnostic) calculó automáticamente para cada participante el porcentaje de tiempo en hipoglucemia (glucemia<70mg/dl [3,9mmol/l]), normoglucemia (glucemia 70-180mg/dl [3,9-10,0mmol/l]) e hiperglucemia (glucemia ≥ 180mg/dl [10,0mmol/l]); glucemia media, DE, LBGI y HBGI.
Se recogieron datos sobre la dosis diaria de insulina, el número de episodios de hipoglucemia (glucemia<70mg/dl [3,9mmol/l] con o sin síntomas de hipoglucemia14), número de episodios de hipoglucemia severa (hipoglucemia en la que se requiere asistencia de otras personas14), número de episodios de cetosis (cetonuria medida con las tiras urinarias Ketostik® Bayer en los niños en tratamiento con múltiples inyecciones al día de insulina [MIDI] y cetonemia determinada por MediSense Optium Xceed Meter® Abbott en niños con sistemas de subcutáneos de infusión continua de insulina [ISCI]) y número de episodios de cetoacidosis que ocurrieron durante el campamento.
Se midieron el peso y la talla el primer día del campamento según métodos estandarizados. El índice de masa corporal (IMC) se calculó como el peso (medido en kilogramos) dividido entre la talla al cuadrado (medida en metros). Se ha calculado el Z-score para el peso y el IMC utilizando tablas de crecimiento españolas recientemente publicadas15.
Al inicio del campamento se midió la HbA1c en una muestra de sangre capilar utilizando un DCA 2000 Analyzer® (Bayer Corporation, Elkhart, EE. UU.).
La muestra de orina de 24 h fue recogida en casa por cada participante una vez finalizado el campamento. Aunque se solicitó a todos los participantes que recogiesen una muestra de orina, solo 14 niños la entregaron. Se pidió a los participantes que mantuviesen las muestras de orina refrigeradas a 4°C durante el proceso de recogida y que se llevaran al hospital en un periodo inferior a 24h tras finalizar la recogida de la misma. En el hospital, las muestras fueron inmediatamente guardadas a –80°C tras añadir 0,005% BHT, ya que el almacenaje a –20°C era insuficiente para prevenir la formación de 8-isoprostanos. La medida de 8-iso-PGF2α se realizó utilizando método de inmunoanálisis enzimático (Cayman Chemical Company, Ann Arbor, EE. UU.). Los coeficientes de variación intra e interensayo fueron 15,2 y 18,5, respectivamente. El nivel de creatinina urinaria fue determinado usando el método de espectrofotometría enzimática basado en picrato alcalino.
Evaluación de la variabilidad glucémicaLa DE, el LBGI y el HBGI fueron calculados para cada participante automáticamente por el programa Accu-Chek Smart Pix Data Management System®, utilizando los valores de glucemia capilar realizados durante el campamento con el glucómetro Accu-Chek Aviva Nano®. Las fórmulas para calcular el LBGI y el HBGI están publicadas9,10. Las categorías de riesgo son: LBGI: mínimo (LBGI ≤ 1,1), bajo (1,1 < LBGI ≤ 2,5), moderado (2,5<LBGI ≤ 5,0) y alto (LBGI > 5,0), y HBGI: bajo (HBGI ≤ 4,5), moderado (4,5 < HBGI ≤ 9,0) y alto (HBGI > 9,0).
El MAGE es la media de las diferencias absolutas entre el pico y el valle de los valores de glucosa en 24 h, en el que los picos se definen como los valores de glucosa que preceden a un incremento y luego se siguen de un decremento que excede en más de 1 DE la media de la glucemia, y el valle como los valores de glucosa que preceden a un decremento y luego continúan con un ascenso que excede en más de 1 DE la media de la glucemia7. Un valor de MAGE superior a 100mg/dl se consideró elevada variabilidad intradía.
El índice MODD fue estimado como la media absoluta de las diferencias diarias en la glucemia utilizando los valores de glucemia pareados entre días sucesivos8. La media ± DE del MODD fue calculada para cada paciente utilizando las glucemias de 5 días consecutivos. Un valor de MODD superior a 36mg/dl se consideró elevada variabilidad interdía8.
Análisis estadísticoLas variables continuas se presentan como media ± desviación estándar o media y rango intercuartílico, y las variables categóricas como porcentajes. La distribución normal de las variables continuas se ha determinado mediante el test de Shapiro-Wilks. Las comparaciones entre 2 grupos para las variables continuas se han realizado mediante la prueba de la t de Student, o mediante la prueba no paramétrica de Mann-Whitney en los casos necesarios. Para evaluar las correlaciones entre las variables de estudio se calcularon coeficientes de correlación de Spearman. Se ha establecido un nivel de confianza del 95% para las pruebas de contraste de hipótesis de 2 colas.
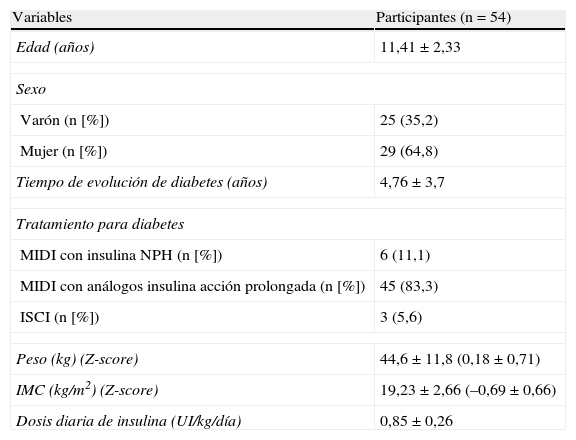
ResultadosEn la tabla 1 se muestran las características sociodemográficas y clínicas de los participantes. Respecto al tratamiento, destacamos que 3 niños eran portadores de ISCI, todos ellos con un análogo de insulina rápida, mientras que en el resto el tratamiento era MIDI. De estos últimos, 45 tenían una combinación de análogos de insulina de acción prolongada (glargina o detemir) con análogos de acción rápida (lispro, aspart o glulisina) y 6 una combinación de insulina neutra protamina de Hagedorn (NPH) con análogos de insulina de acción rápida (lispro, aspart o glulisina). Ninguno de los participantes presentaba complicaciones microvasculares.
Características sociodemográficas y clínicas de la población de estudio
| Variables | Participantes (n=54) |
| Edad (años) | 11,41±2,33 |
| Sexo | |
| Varón (n [%]) | 25 (35,2) |
| Mujer (n [%]) | 29 (64,8) |
| Tiempo de evolución de diabetes (años) | 4,76±3,7 |
| Tratamiento para diabetes | |
| MIDI con insulina NPH (n [%]) | 6 (11,1) |
| MIDI con análogos insulina acción prolongada (n [%]) | 45 (83,3) |
| ISCI (n [%]) | 3 (5,6) |
| Peso (kg) (Z-score) | 44,6±11,8 (0,18±0,71) |
| IMC (kg/m2) (Z-score) | 19,23±2,66 (–0,69±0,66) |
| Dosis diaria de insulina (UI/kg/día) | 0,85±0,26 |
Los datos se expresan como media±desviación estándar, a no ser que se especifique de otro modo.
IMC: índice de masa corporal; ISCI: infusión subcutánea continua de insulina; MIDI: múltiples inyecciones al día de insulina; NPH: neutral protamine Hagedorn.
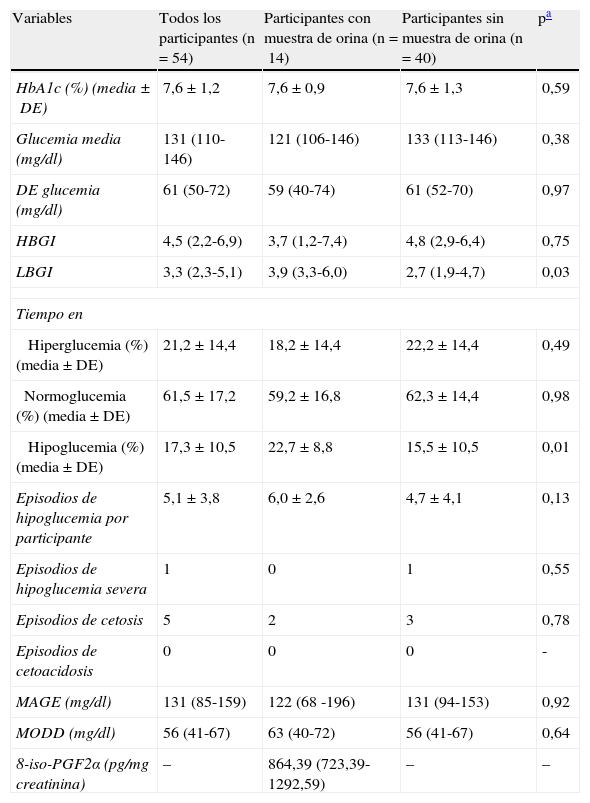
Se objetivó un descenso significativo de las necesidades de insulina durante el campamento (0,85±0,26 UI/kg al inicio del campamento vs. 0,69±0,24 UI/kg al final, p<0,0001). Los parámetros de control glucémico, los marcadores de variabilidad glucémica y los episodios de complicaciones agudas relacionadas con la diabetes se muestran en la tabla 2. La media de episodios de hipoglucemia leve por sujeto durante todo el campamento fue de 5,1 (rango 0-17). Un niño presentó un episodio de hipoglucemia severa que requirió la administración de glucagón intramuscular para su resolución. Se detectaron 5 episodios de cetosis, que fueron tratados en el campamento, y ningún caso evolucionó a cetoacidosis. El 54% de los niños presentaron un valor de HbA1c ≤ 7,5% (58mmol/mol). La mediana de la DE y los índices MAGE y MODD se encontraron en un rango alto, la media de LBGI dentro de la categoría de riesgo moderado y la media de HBGI dentro de la categoría de riesgo bajo. El 74% de los niños presentó un valor de MODD por encima de 36mg/dl. El 26% de los participantes presentaron un valor de LBGI de alto riesgo de hipoglucemia y el 39% de moderado riesgo de hipoglucemia. Solo un 2% presentó un valor de HBGI de alto riesgo de hiperglucemia y el 9% de moderado riesgo de hiperglucemia. La mediana de la excreción urinaria de 8-iso-PGF2α medida en 14 niños al final del campamento fue 864,39pg/mg creatinina.
Marcadores de control glucémico, variabilidad glucémica, episodios de complicaciones agudas y tasa de excreción urinaria de 8-iso-prostaglandina F2 alfa en toda la población de estudio y en grupos, en función de si se entregó o no muestra de orina de 24 h
| Variables | Todos los participantes (n=54) | Participantes con muestra de orina (n=14) | Participantes sin muestra de orina (n=40) | pa |
| HbA1c (%) (media±DE) | 7,6±1,2 | 7,6±0,9 | 7,6±1,3 | 0,59 |
| Glucemia media (mg/dl) | 131 (110-146) | 121 (106-146) | 133 (113-146) | 0,38 |
| DE glucemia (mg/dl) | 61 (50-72) | 59 (40-74) | 61 (52-70) | 0,97 |
| HBGI | 4,5 (2,2-6,9) | 3,7 (1,2-7,4) | 4,8 (2,9-6,4) | 0,75 |
| LBGI | 3,3 (2,3-5,1) | 3,9 (3,3-6,0) | 2,7 (1,9-4,7) | 0,03 |
| Tiempo en | ||||
| Hiperglucemia (%) (media±DE) | 21,2±14,4 | 18,2±14,4 | 22,2±14,4 | 0,49 |
| Normoglucemia (%) (media±DE) | 61,5±17,2 | 59,2±16,8 | 62,3±14,4 | 0,98 |
| Hipoglucemia (%) (media±DE) | 17,3±10,5 | 22,7±8,8 | 15,5±10,5 | 0,01 |
| Episodios de hipoglucemia por participante | 5,1±3,8 | 6,0±2,6 | 4,7±4,1 | 0,13 |
| Episodios de hipoglucemia severa | 1 | 0 | 1 | 0,55 |
| Episodios de cetosis | 5 | 2 | 3 | 0,78 |
| Episodios de cetoacidosis | 0 | 0 | 0 | - |
| MAGE (mg/dl) | 131 (85-159) | 122 (68 -196) | 131 (94-153) | 0,92 |
| MODD (mg/dl) | 56 (41-67) | 63 (40-72) | 56 (41-67) | 0,64 |
| 8-iso-PGF2α (pg/mg creatinina) | – | 864,39 (723,39-1292,59) | – | – |
Los datos se expresan como mediana y rango intercuartílico, a no ser que se especifique de otro modo.
DE: desviación estándar; HbA1c: hemoglobina A1c; HBGI: índice de glucemia elevada (high blood glucose index); LBGI: índice de glucemia baja (low blood glucose index), tiempo en hipoglucemia (glucemia<70mg/dl), normoglucemia (glucemia entre 70 y 180mg/dl) e hiperglucemia (glucemia ≥ 180mg/dl); MAGE: media de la amplitud de las excursiones glucémicas (mean amplitude of glycemic excursions); MODD: media de las diferencias diarias (mean of daily differences); 8-iso-PGF2α: 8-iso-prostaglandina F2 alfa.
No se han encontrado diferencias estadísticamente significativas entre los marcadores de variabilidad glucémica (DE, MAGE, MODD y HBGI), la HbA1c, el tiempo de duración de la diabetes (4,79±3,28 años vs. 4,75±3,18 años; p=0,98), la edad (11,86±1,91 años vs. 11,25±2,46 años; p=0,33) y el sexo (50% varones vs. 42,5% varones, p=0,63) entre los niños que entregaron la muestra de orina de 24 h y los que no lo hicieron (tabla 2). El LBGI y el tiempo en hipoglucemia fueron significativamente inferiores en el grupo de niños que no entregaron la muestra de orina (tabla 2).
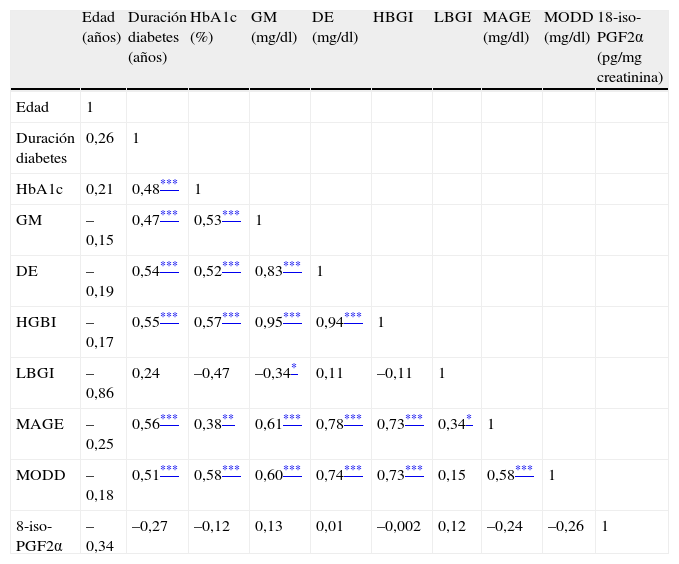
En la tabla 3 se muestran las correlaciones positivas y estadísticamente significativas que se han objetivado entre el tiempo de evolución de la diabetes, la HbA1c, la glucemia media, la DE y los índices HBGI, MAGE y MODD. El LBGI se correlacionó positivamente con MAGE y negativamente con la glucemia media. Sin embargo, ni la edad ni el excreción urinaria de 8-iso-PGF2α se correlacionaron con los marcadores de variabilidad glucémica (tabla 3).
Coeficientes de correlación de Spearman entre la tasa de excreción urinaria de 8-iso-prostaglandina F2 alfa, marcadores de control y parámetros de variabilidad glucémica
| Edad (años) | Duración diabetes (años) | HbA1c (%) | GM (mg/dl) | DE (mg/dl) | HBGI | LBGI | MAGE (mg/dl) | MODD (mg/dl) | 18-iso-PGF2α (pg/mg creatinina) | |
| Edad | 1 | |||||||||
| Duración diabetes | 0,26 | 1 | ||||||||
| HbA1c | 0,21 | 0,48*** | 1 | |||||||
| GM | –0,15 | 0,47*** | 0,53*** | 1 | ||||||
| DE | –0,19 | 0,54*** | 0,52*** | 0,83*** | 1 | |||||
| HGBI | –0,17 | 0,55*** | 0,57*** | 0,95*** | 0,94*** | 1 | ||||
| LBGI | –0,86 | 0,24 | –0,47 | –0,34* | 0,11 | –0,11 | 1 | |||
| MAGE | –0,25 | 0,56*** | 0,38** | 0,61*** | 0,78*** | 0,73*** | 0,34* | 1 | ||
| MODD | –0,18 | 0,51*** | 0,58*** | 0,60*** | 0,74*** | 0,73*** | 0,15 | 0,58*** | 1 | |
| 8-iso-PGF2α | –0,34 | –0,27 | –0,12 | 0,13 | 0,01 | –0,002 | 0,12 | –0,24 | –0,26 | 1 |
DE: desviación estándar; GM: glucemia media; HbA1c: hemoglobina A1c; HBGI: índice de glucemia elevada (high blood glucose index); LBGI: índice de glucemia baja (low blood glucose index); MAGE: media de la amplitud de las excursiones glucémicas (mean amplitude of glycemic excursions); MODD: media de las diferencias diarias (mean of daily differences); 8-iso-PGF2α: 8-iso-prostaglandina F2 alfa.
Este estudio muestra que existe una gran variabilidad glucémica en niños y adolescentes con DM1 que asisten a un campamento de verano. Sin embargo, no se han encontrado correlaciones entre la elevada variabilidad glucémica y el estrés oxidativo medido a través de la tasa de excreción urinaria de 8-iso-PGF2α.
Entre los objetivos del estudio se encontraban, por un lado, evaluar la variabilidad glucémica en niños con DM1, y concretamente durante un campamento de verano. Es conocido que los niños y adolescentes con DM1 son muy susceptibles de presentar valores glucémicos extremos, debido principalmente a las variaciones en la sensibilidad a la insulina, el nivel de actividad física y la ingesta de alimentos16,17. Los campamentos especializados para niños y jóvenes con DM1 nos ofrecen una oportunidad para estudiar las excursiones glucémicas fuera del ambiente hospitalario18. Así, Choelau et al.19 evaluaron la variabilidad glucémica interdía, estimada por el índice MODD, que fue calculado con las determinaciones de glucemia capilar, en un grupo de 100 niños con DM1 en tratamiento con MIDI asistentes a un campamento de verano, describiendo la mediana del índice MODD en 77mg/dl y que un 99% de los participantes el valor de MODD se encontraba por encima de 36mg/dl. En otro estudio reciente20, en el que se incluyó a 48 niños y adolescentes con DM1 que realizaron una MCG ambulatoria durante 3 días, se objetivó también una alta variabilidad glucémica interdía (MODD 63mg/dl en el grupo de niños con MIDI y MODD 61mg/dl en el grupo de ISCI) e intradía, fundamentalmente en el grupo de niños tratados con MIDI (MAGE 117mg/dl en el grupo de niños con MIDI y MAGE 88mg/dl en el grupo de ISCI). Nuestros resultados en cuanto a variabilidad glucémica son concordantes con los datos mostrados previamente, e incluso son superiores a los encontrados en trabajos que evalúan a niños en su día a día, poniendo de manifiesto la situación peculiar que representan los campamentos de verano incluso estando bajo la vigilancia de un equipo médico especializado.
Por otro lado, hemos querido estudiar el estrés oxidativo y su relación con la variabilidad glucémica. Cerriello e Ihnat pusieron de manifiesto que la variabilidad glucémica podía contribuir a la formación acelerada de radicales libres21 y, además, Giacco et al.22 mostraron que el estrés oxidativo podía desempeñar un papel fundamental en el desarrollo de las complicaciones microvasculares y macrovasculares relacionadas con la diabetes, de modo que estas evidencias apuntaban a que la variabilidad glucémica podría tener un mayor efecto deletéreo en el desarrollo de complicaciones que la hiperglucemia mantenida23. Sin embargo, el debate alrededor del significado de la variabilidad glucémica como un resultado clínico en diabetes todavía continúa. De hecho, en un trabajo reciente realizado en niños con DM1 no se encontró relación entre la variabilidad glucémica evaluada con MCG y la disfunción vascular24. Monnier et al.25 mostraron una relación estrecha entre la variabilidad glucémica y el estrés oxidativo medido a través de la excreción urinaria de 8-iso-PGF2α en 21 sujetos con diabetes tipo 2 (DM2). Sin embargo, existen dificultades para replicar estos resultados. Así, el grupo de DeVries no ha sido capaz de demostrar dicha asociación en un grupo de pacientes adultos con DM126, ni tampoco en otro grupo de pacientes con DM2 tratados con antidiabéticos orales (ADO)27. Una posible explicación para estos resultados discordantes es que la metodología utilizada para medir la excreción urinaria de 8-iso-PGF2α difiere entre los 2 grupos, de modo que de DeVries26,27 utilizó la espectrometría en tándem masa, que es menos susceptible de presentar interferencias que la técnica de inmunoanálisis enzimático que utilizó Monnier14. Otro factor que podría influir es el potencial efecto de la insulina sobre el estrés oxidativo. En un estudio reciente28 que evalúa a sujetos con DM1 y DM2 tratados con diferentes regímenes hipoglucemiantes (ADO solamente, ADO e insulina y solo insulina), se ha encontrado que los pacientes que reciben tratamiento con insulina, sola o en combinación con ADO, presentan una excreción urinaria de 8-iso-PGF2α más reducida que los pacientes tratados solo con ADO.
Nuestros resultados de excreción urinaria de 8-iso-PGF2α difieren de aquellos publicados por otros autores y que se han comentado anteriormente, ya que describen valores inferiores de 8-iso-PGF2α urinario en población adulta con DM1 o DM225-28. Sin embargo, en población infantil existen menos estudios que evalúen el estrés oxidativo y su relación con la DM1. Glesiner et al.29, en un grupo de niños con DM1 de menos de 5 años de evolución, describieron una tasa de excreción urinaria de 8-iso-PGF2α de 1.672±1.706pg/mg creatinina, medida mediante inmunoanálisis enzimático. Sin embargo, no encontraron diferencias estadísticamente significativas entre la tasa de excreción urinaria de 8-iso-PGF2α en estos niños con DM1 y 13 controles sanos pareados por edad y sexo. Schreiver et al.20, en su estudio con 48 niños y adolescentes con DM1, encontraron una tasa de excreción urinaria de 8-iso-PGF2α de 2.530±240pg/mg, creatinina medida mediante espectrometría en tándem masa, y no pudieron demostrar ninguna correlación entre parámetros de variabilidad glucémica y la excreción urinaria de 8-iso-PGF2α. Los datos de 8-iso-PGF2α urinario que describimos en nuestro trabajo también son inferiores a los encontrados en estos 2 estudios en población pediátrica. En este caso, aunque todos los sujetos de estudio tienen DM1 y están en tratamiento exclusivamente con insulina, la metodología utilizada para medir 8-iso-PGF2α urinario también difiere (inmunoanálisis enzimático en el presente trabajo y en el de Gleisner vs. espectrometría en tándem masa en el de Schreiver), y otros factores, como el tiempo de evolución de la diabetes y el tipo de tratamiento (MIDI vs. ISCI), también son distintos en este estudio y en los trabajos arriba comentados, y podrían influir en los resultados. En cualquier caso, serían necesarios estudios que evalúen, por un lado, los valores de 8-iso-PGF2α urinario en población pediátrica sana para contar con valores de referencia y, por otro, en grupos homogéneos y con mayor número de niños con DM1.
Entre las limitaciones de nuestro estudio, se encuentran su diseño transversal y el alto porcentaje de participantes que no recogieron la muestra de orina, de modo que la relación entre la variabilidad glucémica y el estrés oxidativo no puede evaluarse correctamente. Los parámetros de variabilidad glucémica fueron estimados a partir de los datos de determinaciones de glucemia capilar y no de un sistema de MCG; sin embargo, un estudio reciente demostró que el índice MODD calculado a partir de 4 medidas de glucemia capilar en un grupo de niños con DM1 tenía una buena correlación (r=0,87) con el índice MODD calculado a partir de la información recogida por un sistema de MCG, y concluía que las determinaciones de glucemia capilar también podían ser utilizadas para calcular el índice MODD19.
En resumen, existe una elevada variabilidad glucémica intra e interdía y cifras de 8-iso-PGF2α urinaria moderadamente elevadas en niños y adolescentes con DM1 que asisten a un campamento de verano. Sin embargo, no hemos encontrado correlaciones entre los marcadores de variabilidad glucémica y el estrés oxidativo medido por la tasa de excreción urinaria de 8-iso-PGF2α. Son necesarios más estudios que evalúen el estrés oxidativo y su relación con la variabilidad glucémica en niños con DM1.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría agradecer la colaboración de la Asociación de Diabéticos de Málaga (ADIMA), especialmente a José Sánchez.
Presentaciones previas en congresos y reuniones: XXI Congreso de la Sociedad Española de Diabetes (Barcelona, del 15 al 17 de abril del 2010): Elevada variabilidad glucémica en niños con diabetes tipo 1 asistentes a un campamento de verano. 3rd International Conference on advanced technologies and treatment for diabetes (Bassel, Suiza, del 10 al 13 de febrero del 2010). Standardized analysis of glycemia and glycemic variability in children with type 1 diabetes attending a summer camp. 34.° Congreso de la Sociedad Andaluza de Endocrinología y Nutrición (Granada, del 5 al 7 de noviembre del 2009). Análisis estandarizado de las glucemias y de la variabilidad glucémica en niños con diabetes tipo 1 asistentes a un campamento de verano.