La malnutrición fetal (MF) traduce una pérdida o fallo de adquisición intrauterina de la cantidad adecuada de grasa y masa muscular, asociando connotaciones pronósticas a corto y largo plazo. Siendo el diagnóstico de MF esencialmente clínico, el objetivo de este trabajo es detectar la incidencia MF mediante el Clinical Assessment of Nutritional Status score (CANS score), y comparar los resultados con los parámetros antropométricos clásicos.
Pacientes y métodosEstudio retrospectivo poblacional de recién nacidos a término entre 2003 y 2014 (n=14.477). Se clasificaron en recién nacidos de peso adecuado, pequeño y grande para la edad gestacional. Se realizó el CANS score y se calculó el índice ponderal (IP) a todos los recién nacidos incluidos, considerándose MF los puntos de corte: CANS score <25 e IP<2,2g/cm3.
ResultadosMediante el CANS score el 7,6% (n=1.101) de la población presentó MF, el 50,3% (n=538) de los recién nacidos de peso pequeño para la edad gestacional, el 76,2% (n=193) del subgrupo <p3 y el 4,67% (n=559) de los recién nacidos de peso adecuado para la edad gestacional. El CANS score fue <25 en el 7,26% (n=1.043) de los recién nacidos con IP ≥2,2g/cm3 (n=14.356), y el CANS score fue >24 en el 49% con IP<2,2g/cm 3 (n=109).
ConclusionesEs conveniente identificar todos aquellos recién nacidos con MF por los riesgos que pueden presentar a corto y largo plazo. La valoración mediante CANS score permite una mejor identificación del estado nutricional de los recién nacidos que empleando únicamente las curvas de peso según la edad gestacional.
Foetal malnutrition (FM) is the result of a loss or failure of intrauterine acquisition of the correct amount of fat and muscle mass, with short and long term implications. As the diagnosis of FM is essentially clinical, the aim of this study is to detect the incidence of FM using the Clinical Assessment of Nutritional Status (CANS) score, and compare the results with the classic anthropometric parameters.
Patients and methodsRetrospective population of term infants was studied between 2003 and 2014 (n=14,477). They were classified into adequate weight (AGA), small weight (SGA) and large weight (LGA) for gestational age newborns. The CANS score was performed on all infants enrolled in the study, and the ponderal index (PI) was calculated, considering an FM cut off value of a CANS score <25 and PI <2.2g/cm3.
ResultsUsing the CANS score, 7.6% (n 1,101) of the population showed FM, 50.3% (n=538) of SGA, 76.2% (n=193) subgroup=559) of AGA. The CANS score was <25 in 7.26% (n=1,043) of newborns with PI ≥2.2g/cm3 (n=14.356), and the CANS score was >24 in 49% with PI <2.2g/cm3 (n=109)
ConclusionsIt is worthwhile identifying all newborns with FM due to the risks they may have in the short and long term.
CANS score assessment allows a better identification of nutritional status of infants than only using the curves of weight for gestational age.
La malnutrición fetal (MF) es un estado clínico que traduce una pérdida o fallo de acreción intrauterina de la cantidad adecuada de grasa y de masa muscular. Su identificación debería constar en la valoración de todos los recién nacidos, independientemente de la clasificación según el peso por la edad gestacional, ya que el peso al nacer por sí solo es un mal indicador de su estado nutricional1.
En los últimos años se ha observado que los niños con MF muestran puntuaciones inferiores de coeficiente intelectual, mayor necesidad de educación especial, discapacidad neurológica, retraso mental, alteraciones del aprendizaje y convulsiones en la infancia tardía, respecto a aquellos que no la presentan1–5. Las alteraciones neurológicas pueden verse agravadas por diferentes situaciones en el periodo neonatal inmediato, en especial por la presencia de hipoglucemia y/o dificultades en la alimentación. Además, la MF se asocia, con mayor frecuencia, a problemas cardiovasculares, endocrinológicos y metabólicos en etapas más tardías6–8.
La MF puede obedecer a diferentes causas, siendo la insuficiencia placentaria la más frecuente en los países desarrollados. En la última década han aumentado, de forma significativa, las gestaciones de madres añosas, las técnicas de reproducción asistida y las gestaciones en mujeres con enfermedades sistémicas y/o crónicas, que se asocian a un mayor número de partos prematuros y recién nacidos de bajo peso, motivo por el cual surge de nuevo gran interés en evaluar, de la forma más precisa posible, la presencia de MF. Clásicamente, se ha evaluado el estado de nutrición fetal en el recién nacido mediante diferentes índices antropométricos, como la ratio perímetro cefálico respecto de la longitud (PC/L) y la ratio circunferencia del brazo respecto del perímetro cefálico (CB/PC) y el índice ponderal de Rohrer (IP), siendo este último el más utilizado1,6,9,10.
Existe también un score clínico, poco referenciado en la literatura, Clinical Assesment of Nutritional Status (denominado con el acrónimo CANS) validado por Metcoff en 1994. Es de rápida realización y fácil aprendizaje, y consiste en evaluar 9 signos clínicos superficiales que diferencian los recién nacidos bien o mal nutridos11.
El objetivo de este estudio es conocer, en nuestro medio, la incidencia de MF de los niños a término mediante el CANS score, y objetivar si la valoración según el peso por edad gestacional y el IP son suficientes para valorarla.
Pacientes y métodoEstudio poblacional retrospectivo de recién nacidos a término (37-41 semanas de edad gestacional) sin exclusiones, durante el periodo comprendido entre marzo de 2003 y marzo de 2014. La edad gestacional se determinó por la fecha de la última regla y/o ecografía del primer trimestre, contando siempre en semanas cumplidas. Se recogieron los siguientes parámetros: peso al nacer, longitud y perímetro cefálico antes de las 24h de vida. El peso se determinó con el recién nacido desnudo, con una báscula electrónica digital SECA®, con un intervalo de lectura de 0,1-15kg y un margen de error de ±5g; la longitud se realiza midiendo la distancia vértice-talón, utilizando un tallímetro rígido Maciá® con intervalo de lectura de 0-80cm y precisión de 0,5cm y el perímetro cefálico (occípito-frontal máximo) con una cinta métrica no rígida con precisión de 0,5cm. Se introdujeron las medidas antropométricas citadas en la base de datos Neosoft®, cuya versión utiliza los datos de las curvas de referencia DGPS, Generalitat de Catalunya 200812, para clasificar a los recién nacidos en: recién nacido de peso adecuado (AEG) (p10-90), grande (GEG) (>p90) o pequeño (PEG) (<p10) para la edad gestacional, con un subgrupo en los PEG de los <p3. El índice ponderal se calculó al finalizar el estudio a todos los recién nacidos incluidos mediante la fórmula descrita por Rohrer en 1921: IP=peso (g)×100/longitud3 (cm). El IP aumenta a lo largo de la gestación, permaneciendo constante su valor al llegar a término y correspondiendo el IP 2,3g/cm3 al p10 y el IP 2,2g/cm3 al p3. Se consideraron los valores<2,2g/cm3 como índice de malnutrición1,4,13, a partir del resultado de este índice se clasificaron los PEG también en PEG tipo i (simétrico) los que presentaron un IP>2,2g/cm3 y en PEG tipo ii (asimétrico) los que presentaron un IP<2,2g/cm3. La valoración mediante CANS score se realizó en las primeras 24h de vida a todos los recién nacidos incluidos, evaluando los 9 signos clínicos descritos por Metcoff (tabla 1). Cada parámetro se puntúa entre 1 y 4, siendo la puntuación final posible entre 9 y 36, considerándose MF una puntuación <25.
Descripción CANS score
| Puntuación | |||||
|---|---|---|---|---|---|
| Signo | 4 | 3 | 2 | 1 | |
| Cabello | Calidad y docilidad del pelo | Abundante, cubre todo el cuero cabelludo. Se peina con facilidad | Moderada cantidad. Algunos lisos, se peina con facilidad | Escasa cantidad. Cabello liso, se peina con dificultad | Escasa cantidad, áreas sin pelo. Cabello liso, no se puede peinar |
| Mejillas | Forma de la cara y adiposidad en los carrillos | Redonda. Abundante adiposidad | Cuadrada. Moderada adiposidad | Ovalada. Escasa adiposidad | Triangular. Sin adiposidad |
| Barbilla y cuello | Perfil de la barbilla y el cuello | Pliegues adiposos doble o triple, sin cuello | Un solo pliegue. Se insinúa cuello sin arrugas | Sin pliegues. Cuello bien definido | Sin pliegues. Cuello con piel laxa y arrugas |
| Brazos | Coger con ambas manos el brazo y el codo, mirando la zona del tríceps, comprimir hacia el centro y observar arrugas | Sin arrugas | Escasas arrugas superficiales | 3 a 5 arrugas gruesas | Arrugas en acordeón |
| Tórax | Observar prominencias del tórax y espacio intercostal | Tórax lleno, no se aprecian las costillas | Se insinúan algunas costillas y leves espacios intercostales debajo de las mamilas | Se aprecian costillas y espacios intercostales debajo de las mamilas | Costillas prominentes con pérdida del tejido intercostal |
| Pliegues de la pared abdominal | Observar adiposidad y consistencia de la piel | Abdomen lleno, redondo sin piel laxa | Abdomen plano sin piel laxa con uno o 2 pliegues en la región supraumbilical | Abdomen delgado. Pliegues en todo el abdomen | Abdomen distendido o excavado con piel laxa, fácil de levantar, pliegues en acordeón |
| Espalda | Pinzar suavemente con el pulgar e índice la zona interescapular o subescapular intentando elevar la piel y el tejido subcutáneo | Difícil de sujetar y elevar | Elevación de 5-10mm. Pliegue grueso | Elevación de 10-20mm. Pliegue delgado | Elevación <20mm. Pliegue delgado y laxo |
| Glúteos | Observar glúteos y zona posterosuperior del muslo | Cojinetes adiposos redondos y llenos | Cojinetes aplanados, sin arrugas en glúteos ni muslos | Tejido subcutáneo delgado. Arrugas no profundas en glúteos y muslos | Tejido subcutáneo escaso, con piel laxa y arrugas profundas |
| Piernas | Coger con ambas manos, mirando la región anterior de la pierna. Fijar el pie y comprimir desde la rodilla con la finalidad de formar arrugas | Sin arrugas | Escasas arrugas y no profundas | 3 a 5 arrugas gruesas | Múltiples arrugas en acordeón |
Durante todo el periodo de estudio el CANS score fue realizado por 6 pediatras que se entrenaron en su uso; se observó una variabilidad interindividual de ±1 punto en el período de entrenamiento, en el que se evaluaron las primeras 400 valoraciones.
El análisis de los datos se realiza con el paquete estadístico R Core Team 2013. Se utilizaron tablas de contingencia 2×2 para valorar la asociación entre los diferentes parámetros sometidos a estudio. Se realizó el coeficiente de correlación de Pearson y la recta de regresión para valorar la correlación entre la puntuación de CANS score y el peso según la edad gestacional.
ResultadosDurante el periodo estudiado se incluyeron 14.477 recién nacidos y se obtuvo una incidencia de MF del 7,6% mediante la valoración del CANS score, con una puntuación<25 en 1.101 recién nacidos.
Según el percentil de peso se observó una puntuación de CANS score<25 en el 76,2% (n=193) de los recién nacidos con peso<p3, el 42,3%(n=345) de los recién nacidos con peso p3-10, el 4,67% (n=559) de los AEG y el 0,28% (n=4) de los GEG. Según la clasificación por el IP de los PEG se observó un CANS score<25 en el 49% (n=491) de los PEG tipo i y en el 73% (n=47) de los PEG tipo ii (tabla 2).
Distribución de malnutrición fetal clínica, usando el CANS score, con relación al peso por edad gestacional
| CANS score<25 | CANS score≥25 | Total | ||
|---|---|---|---|---|
| PEG | Tipo I | 491 (49%) | 510 | 1.004 |
| Tipo II | 47 (73,4%) | 17 | 64 | |
| AEG (p10-90) | 559 (4,67%) | 11.414 | 11.973 | |
| GEG (>p90) | 4 (0,28%) | 1.432 | 1.436 | |
| Total | 1.101 (7,6%) | 13.377 | 14.477 | |
AEG: peso adecuado para la edad gestacional; GEG: peso grande para la edad gestacional; PEG: peso pequeño para la edad gestacional.
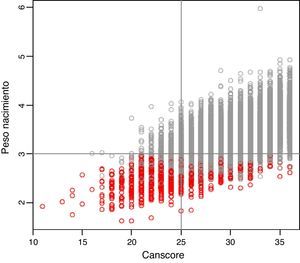
La figura 1 muestra la incidencia de MF según la puntuación del CANS score por semanas de gestación y percentil de peso, apreciándose puntuaciones inferiores a 25 en todos los grupos de peso y edad gestacional.
En la figura 2 se observa una correlación positiva entre el CANS score y el peso al nacer (r=0,625) (p<0,0001), destacando que los PEG se concentran en su mayoría por debajo de una puntuación de 25 del CANS score, y que la proporción de PEG disminuye a medida que aumenta la puntuación de CANS score. Hay recién nacidos clasificados como PEG, según las curvas de peso para la edad gestacional, en los que clínicamente no se objetivó MF, y al contrario clasificados como AEG o GEG con signos clínicos de MF.
El cálculo del IP identificó a 109 recién nacidos con resultado<2,2g/cm3, de los que el CANS score resultó>24 en el 49%. En los que el IP fue≥2.2g/cm3 (n=14.356) la puntuación del CANS score resultó<25 en el 7,26% (n=1.043). Entre la valoración del CANS score y el IP se observa una correlación positiva (r=0,4172) (p<0,0001).
DiscusiónLa MF, descrita por Scott y Usher en 1966, se define como un fallo para adquirir una adecuada cantidad de masa magra y grasa durante el crecimiento intrauterino1,4,7,13. Existen diferentes terminologías para intentar catalogar o identificar una nutrición fetal deficiente: PEG, restricción del crecimiento intrauterino e insuficiencia placentaria, aunque ninguna de ellas es sinónimo de MF2,4,14,15.
Es conocido que la MF predispone a una mayor morbimortalidad perinatal, secundaria a distrés fetal, aspiración de meconio, asfixia, hipoglucemia neonatal y síndrome de hiperviscosidad7,16. Se asocia también, a medio-largo plazo, con un riesgo superior respecto a la población general de presentar alteraciones neurológicas o mentales (alteraciones cognitivas y de aprendizaje), complicaciones endocrinológicas, metabólicas y cardiovasculares3,6–8,14,17–19, por lo que sería conveniente identificar estos recién nacidos con MF en una época precoz de la vida para poder facilitar una vigilancia e intervención adecuadas.
El crecimiento intrauterino es uno de los signos más importantes de bienestar fetal. El feto que sufre MF puede adaptarse a esta alterando su producción hormonal o variando la sensibilidad de los tejidos a diferentes hormonas, siendo la insulina la que tiene una función central en la regulación del crecimiento fetal. Las adaptaciones que realiza el feto pueden llevar a cambios permanentes en la estructura, en la función de los órganos y en diferentes vías metabólicas, hecho conocido como «re-programación fetal»2,8,18,20. Los recién nacidos que realizan este proceso de adaptación intraútero se beneficiarían de una intervención posnatal para evitar, en la medida de lo posible, las complicaciones que pueden presentar en el periodo neonatal inmediato, ya que esta adaptación se mantiene durante las primeras semanas de vida2. Al nacimiento muestran una disminución del tejido graso subcutáneo y de los músculos subyacentes, siendo especialmente más evidente en los brazos, las piernas, los codos y las rodillas y la región interescapular9.
Para la valoración del crecimiento intrauterino, la antropometría ha sido y es muy utilizada por ser un método económico y eficaz. El peso, la longitud y el perímetro cefálico, y los diferentes índices derivados de la combinación de estos, cuando se relacionan con la edad gestacional, proporcionan mayor información. Los más referenciados son la ratio perímetro cefálico respecto la longitud (PC/L), la ratio circunferencia del brazo respecto del perímetro cefálico (CB/PC) y el índice ponderal de Rohrer (P/L3×100), siendo este el más utilizado en neonatología, ya que es más sensible que el peso al nacer en identificar riesgos neonatales de morbilidad relacionada con alteraciones del crecimiento intrauterino, siendo independiente del género y de la etnia10. Sin embargo, hay claras dudas de que estos índices sean suficientemente sensibles para identificar a todos los niños con malnutrición ya que, por ejemplo, el IP no tiene buena correlación con medidas de masa grasa subcutánea4,14. El score clínico CANS validado por Metcoff sí valora de forma indirecta la grasa subcutánea, siendo capaz de detectar MF en todos los recién nacidos, sin mostrarse superior a él el resto de medidas antropométricas que valoran el grosor del tejido subcutáneo13. Es sistemático, resulta de fácil aprendizaje y utilización, y aunque consume algo más de tiempo el incluirlo en la valoración sistemática del recién nacido, este no es significativo tras un periodo de entrenamiento. Podría ser muy útil como cribado rutinario de la MF y facilitar información para realizar cuidados de forma anticipada. Resultaría especialmente útil en maternidades con menos personal especializado, así como en zonas rurales con mal control obstétrico en las que no se conoce con certeza la edad gestacional de los recién nacidos, en las que es necesario detectar de forma fácil y válida el estado nutricional del recién nacido.
La clasificación del peso según la edad gestacional es habitualmente utilizada en la gran mayoría de hospitales o maternidades, mediante la cual se deciden las intervenciones a realizar. No obstante, no tiene en consideración el potencial de crecimiento fetal (peso que habría alcanzado el recién nacido en condiciones de adecuada nutrición fetal), pudiendo clasificar como PEG a recién nacidos sin MF y, por otro lado, otros ser clasificados como AEG y presentar signos clínicos de MF9. En nuestro estudio se pudo observar que, de los recién nacidos catalogados como AEG, el 4,67% presentaron signos clínicos de MF, por lo que si solo usáramos las curvas de peso según la edad gestacional, se infradiagnosticarían una proporción no despreciable de recién nacidos con MF en los que, probablemente, una intervención dirigida en este aspecto podría ser beneficiosa, tanto a corto como a largo plazo. Por el contrario, se observó que de los clasificados como PEG tipo i que representan el 94% de los PEG, el 51% no presentaron signos de MF por lo que, en estos, quizás sería más beneficioso distinguir la causa por la que fueron más pequeños que el resto de la población, es decir, si eran pequeños constitucionales, sin sospechar enfermedad asociada, o sería necesario descartar alguna causa genética, malformativa, tóxica o infecciosa.
Se han publicado un gran número de estudios sobre los riesgos a corto y largo plazo que presentan los recién nacidos con restricción del crecimiento intrauterino y/o con signos de MF. Por contra, existe muy poca información sobre cuál es la mejor manera de detectar a estos recién nacidos en el periodo neonatal inmediato, utilizando la mayoría de ellos solo la clasificación de peso según la edad gestacional. Son escasos los estudios que, como el nuestro, realizan la clasificación según el CANS score y analizan su validez para detectar MF, casi todos ellos de países en vías de desarrollo1,4,9,20. Y aunque la incidencia de MF es superior en esos países (17-28%), no se debe olvidar que en los países desarrollados hasta un 10,9% la pueden presentar11. En nuestro estudio encontramos una tasa de MF del 7,6% según la puntuación de CANS, y un porcentaje de PEG del 7,37%, ambos porcentajes son semejantes, aunque no coincidentes, puesto que dependiendo del tipo de PEG se encuentran diferentes porcentajes de MF clínica, siendo del 49% en los PEG tipo i y del 73% en el caso de los PEG tipo ii. De mayor interés y trascendencia, y que debe resaltarse, es que de los recién nacidos con signos clínicos de MF (7,6%) el 50,8% pertenecen al grupo AEG. Tras los resultados obtenidos en este estudio se considera necesario identificar la MF mediante el CANS score en todos los recién nacidos, también en países desarrollados, ya que en estos el alta, cada vez más precoz tras el nacimiento para facilitar el vínculo, no sería beneficiosa.
En cuanto a la detección de MF mediante el uso del IP, dada su amplia utilización, se comprueba que, aunque presenta mejores resultados en la detección de la MF que la clasificación del peso según la edad gestacional, un 7,26% de los evaluados que tuvieron un IP≥2,2g/cm3 mostraron MF clínica, por lo que también se infra o «maldiagnosticaría» un porcentaje no despreciable de la población.
ConclusionesEl peso según la edad gestacional, como único indicador, no es suficiente para identificar la MF en todos los recién nacidos. Considerando la MF como un estado clínico, el CANS score podría ser útil para su identificación en el recién nacido. Sin embargo, sería conveniente poder alcanzar su validación absoluta mediante parámetros bioquímicos. Por el momento, la combinación de ambos, IP y CANS score, permitiría una mejor valoración del estado nutricional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.