El Streptococcus pyogenes es la causa bacteriana más importante de faringoamigdalitis aguda. Se analizó la validez de una prueba antigénica rápida para su diagnóstico, en consultas de atención primaria; asimismo se identificó el perfil clínico con mejor rendimiento diagnóstico, se cuantificó el uso innecesario de antibióticos cuando se utilizaba la prueba o solamente diagnóstico clínico y se determinó la sensibilidad microbiana a penicilina, eritromicina y clindamicina.
Pacientes y métodosEstudio descriptivo transversal a niños/as entre 2-14 años con amigdalitis y/o faringitis aguda atendidos en 5 consultas, desde enero de 2008 hasta mayo de 2010. Tras el diagnóstico clínico se realizó frotis faringoamigdalar con 2 hisopos: con el primero se realizó una prueba antigénica rápida y con el segundo cultivo y sensibilidad antibiótica, siendo su análisis ciego al resultado de la prueba. Se ha previsto una muestra de 546 personas y muestreo consecutivo.
ResultadosSe incluyó a 192 pacientes. La prevalencia de Streptococcus pyogenes fue del 38,7% (IC del 95%: 31,4-45,7). La odinofagia y el exantema escarlatiniforme fueron más probables con cultivo positivo. En el 100% hubo sensibilidad a la penicilina, en el 97,3% a eritromicina y en el 86,3% a clindamicina. La especificidad de la prueba fue del 91,5% y el valor predictivo negativo del 91,5%. El 49,2% de quienes recibirían antibióticos por sospecha clínica serían tratados innecesariamente, disminuyendo al menos un 29,5% con la prueba.
ConclusionesLa prueba permitió un uso más adecuado de antibióticos. Parece recomendable su uso en pediatría de atención primaria, sin necesidad de confirmación con cultivo cuando resulte negativa, en los centros con difícil acceso al laboratorio.
Streptococcus pyogenes is the most frequent bacterial cause of acute tonsillopharyngitis. The validity of the rapid antigen test was analysed for its diagnosis in a Paediatric Primary Care setting. The clinical profile with better diagnostic yield was also identified. The unnecessary use of antibiotics was quantified when the rapid antigen test or only the clinical diagnosis was used. The sensitivity of the assay to penicillin, erythromycin and clindamycin was also determined.
Patients and methodsCross-sectional study was conducted on children between 2 to 14 years with acute tonsillitis and/or pharyngitis seen in five Primary Care Centres, from January 2008 to May 2010. After a clinical diagnosis, two swabs were taken for pharyngotonsillar smears: the first was used for a rapid antigen test, and the second one for a culture and a study of antibiotic sensitivity, with its analysis being blind to the rapid test result. A total sample of 546 consecutive was envisaged and with consecutive sampling.
ResultsA total 192 patients were included. The prevalence of Streptococcus pyogenes was 38.7% (95% CI: 31.4-45.7). Odynophagia and scarlatiniform rash were most likely with positive cultures, the Streptococcus pyogenes was sensitive to penicillin in 100%, to erythromycin in 97.3% and to clindamycin in 86.3%. The specificity of the rapid antigen test was 91.5% and with a Negative Predictive Value of 91.5%. About half (49.2%) of those who would have receive antibiotics for clinical suspicion would have been treated unnecessarily, with this decreasing to at least in 29.5% when using the rapid antigen test.
ConclusionsThe rapid antigen test can lead to a better use of antibiotics. Its use in Paediatric Primary Health Care could be useful when, as when the result is negative, there would be no need to confirm by a culture, in those Health Centres with difficult access to laboratory.
La faringoamigdalitis aguda (FA) es una inflamación de las mucosas y estructuras subyacentes de la garganta. La mayoría de las FA infantiles están causadas por virus y su evolución es benigna. El estreptococo beta hemolítico del grupo A (EGA) o Streptococcus pyogenes es la causa bacteriana más importante, aislándose en un 15-35% de los cultivos de exudado faríngeo y es muy raro como verdadero patógeno en menores de 3 años1–6. Sin embargo, más del 50% de las FA diagnosticadas clínicamente se tratan con antibióticos. Esto se debe tanto a la dificultad para realizar estudios microbiológicos extrahospitalarios como al temor de una causa estreptocócica de la FA con sus posibles complicaciones3.
Las estrategias diagnósticas de las FA tratan de diferenciar si la infección se debe al EGA o no1,5. Los datos clínicos pueden ayudarnos a sospechar o descartar un posible origen estreptocócico5–8. La utilización de pruebas microbiológicas (prueba antigénica rápida [PAR] y/o cultivo) aumenta la fiabilidad diagnóstica1,5,6,8,9. Aunque ninguna prueba puede diferenciar exactamente a los pacientes con FA estreptocócica de los portadores asintomáticos, el empleo selectivo de estudios microbiológicos (en niños mayores de 3 años con clínica probable de origen estreptocócico) aumenta la fiabilidad de la prueba1,8.
Conocer la sensibilidad de las PAR es fundamental para determinar su perfil coste-efectividad en el diagnóstico y tratamiento de la FA por EGA10. Los fabricantes de las PAR comunican sensibilidades del 80-90% y especificidades iguales o mayores del 95%, lo que no siempre ocurre en la práctica2,5,8,9. La sensibilidad varía según la probabilidad preprueba de FA por EGA de los pacientes testados. Algunos autores recomiendan realizar un cultivo si el resultado de la PAR es negativo2,5,7 y otros no3,10. Para usar una PAR como única prueba diagnóstica, su sensibilidad en la práctica debería ser igual o superior a la del cultivo8–11, aunque las medidas más útiles para la práctica clínica son los valores predictivos. El cultivo de exudado faríngeo y amigdalar, prueba estándar para el diagnóstico de infección por EGA, tiene en condiciones ideales una sensibilidad del 90-95% y una especificidad que llega al 99%1,5.
Es difícil comparar las sensibilidades de las PAR de estudios diferentes1, porque suelen evaluar el rendimiento de una única PAR con un cultivo estándar y existe gran variabilidad de diseños de estudio y de técnicas de cultivo. La mayoría de los trabajos son de ámbito hospitalario donde la prevalencia de FA bacteriana puede ser mayor. Estudios realizados en atención primaria (AP) concluyen que las PAR mejoran la exactitud del diagnóstico etiológico de las FA1–4.
Este estudio se planteó: analizar la validez de una PAR (el test Strep A) en consultas de pediatría de AP, identificar el perfil clínico que genera mejor rendimiento de la prueba, cuantificar el uso de antibióticos cuando se utiliza el test o se hace solamente diagnóstico clínico y determinar la sensibilidad del EGA a penicilina, eritromicina y clindamicina.
Pacientes y MétodosSe realizó un estudio descriptivo transversal desde enero 2008 hasta mayo de 2010 en 5 consultas de pediatría de 2 centros de salud que abarcan un medio rural ubicado en el Área Sanitaria II del Servicio de Salud del Principado de Asturias.
La población de estudio la constituían los niños y las niñas de 2 a 14 años que consultaban por tener clínica de FA. Fueron criterios de exclusión: las segundas consultas por el mismo episodio, haber recibido tratamiento antibiótico en la semana previa a la consulta y la clínica compatible con faringitis no estreptocócica. Se calculó un tamaño de muestra de 546 personas para una prevalencia de la enfermedad del 20,3%, la previsión de un valor mínimo de la sensibilidad del 83% (precisión del 6%) y de la especificidad del 93% (precisión del 2%). El muestreo previsto era consecutivo.
En las semanas previas al comienzo del estudio, se llevó a cabo en las consultas un aprendizaje en la realización del test rápido de identificación de EGA, siguiendo las normas del fabricante. Se evaluó la concordancia interobservador, estimando para ello una muestra de 29 participantes, para una discordancia esperada del 5%, una precisión del 7,5% y una confianza del 95%.
El proyecto fue aprobado por la Fiscalía de Menores y por el Comité Ético de Investigación Clínica de Asturias. Los pediatras, después de explicar a los familiares las características del estudio y obtenido el consentimiento informado por escrito, realizaban la valoración clínica y recogían una muestra faringoamigdalar a cada paciente, mediante un escobillado de amígdalas y retrofaringe con 2 hisopos (Copan Innovation Italy). Con el primero, se realizó el test rápido de detección de antígeno de EGA mediante inmunocromatografía (Test Pack+Plus, Inverness Medical), que identifica el carbohidrato de su pared celular. El segundo hisopo se remitió al Servicio de Microbiología del Hospital Carmen y Severo Ochoa para un cultivo convencional en placas de agar CNA (Becton Dickinson) que se incubaron a 35-37°C en una atmósfera enriquecida de CO2 al 5%. Se realizaron 2 lecturas, una transcurridas 24 horas de incubación y otra lectura final a las 48 horas, en la que se buscaron colonias beta hemolíticas compatibles con EGA (catalasa negativas). Una vez detectadas y aisladas estas colonias, se confirmó el grupo A utilizando una técnica de detección de antígeno mediante aglutinación frente a antisueros específicos Slidex Strepto Plus (Biomerieux, Francia). También se hizo un estudio de sensibilidad en disco-placa empleando placas de agar sangre (Becton Dickinson) para testar los antibióticos penicilina, bacitracina, eritromicina y clindamicina (Oxoid, Reino Unido).
La PAR y las aglutinaciones se consideraron positivas siguiendo las instrucciones del fabricante. La sensibilidad a los antibióticos testados se determinó utilizando los criterios establecidos por el CLSI (Clinical and Laboratory Standards Institute).
Las variables recogidas fueron el sexo, fecha de nacimiento, el lugar de la consulta, la presencia o ausencia de los síntomas/signos de FA, los resultados del test y del cultivo, la sensibilidad del EGA a los antibióticos testados, la impresión diagnóstica clínica (FA bacteriana o de etiología dudosa) y la intención de tratar con antibióticos según la clínica y antes de conocer el resultado de la PAR.
El análisis del resultado del cultivo fue ciego al resultado del test. Para analizar la concordancia interobservador se utilizó el índice Kappa. Se determinaron a nivel global, por sexo y resultado del cultivo, las frecuencias absolutas y los porcentajes de todas las variables excepto de la edad y del número de síntomas/signos que se determinó la media ± desviación estándar (DE). La prevalencia de la FA por EGA equivale al porcentaje de pacientes con cultivo positivo. Una versión modificada de los criterios de Centor et al.12 (fiebre y/o ausencia de tos y/o presencia de exudados faringoamigdalinos y/o de adenopatías cervicales), se utilizó para agrupar a los pacientes según el riesgo de presentar una FA por EGA, considerando riesgo elevado la presencia de 3-4 criterios.
La comparación de proporciones se realizó mediante la prueba exacta de Fisher y la de medias mediante la prueba de la t para muestras independientes. Se estableció un nivel de significación α bilateral de 0,05.
Del test Strep A, al compararlo con los resultados del cultivo, se determinaron la sensibilidad, la especificad, los valores predictivos positivo (VPP) y negativo (VPN), y las razones de verosimilitud de una prueba positiva (RV+) y negativa (RV–), con IC del 95%. El análisis del efecto del espectro clínico8–10,13–15 se realizó según la impresión diagnóstica inicial. El análisis estadístico se efectuó con el SPSS 12.0 y el índice Kappa y las medidas de efectividad del test Strep A con el EPIDAT 3.1.
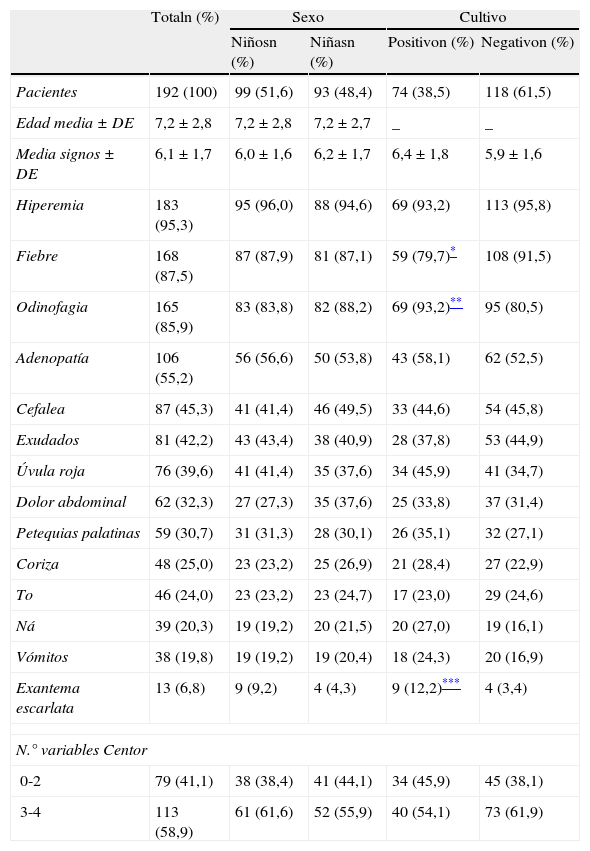
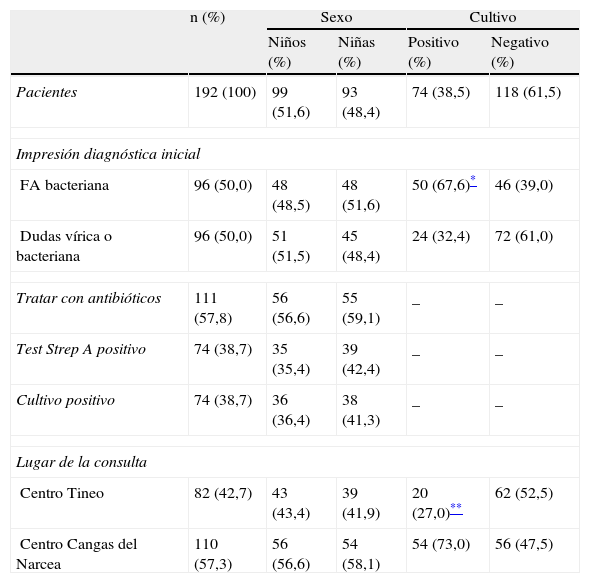
ResultadosLa concordancia interobservador se midió en 19 pacientes, obteniendo un índice Kappa de 0,68 (IC del 95%: 0,28-1). El test Strep A y el cultivo se realizaron a 192 pacientes. El 70,3% tenía entre 5 y 10 años, el 51,6% eran niños y no hubo diferencias por sexo en la media de edad (7,2 años) ni en la de signos/síntomas presentados (6,1). La hiperemia faríngea, la fiebre y la odinofagia fueron los tres signos/síntomas más habituales. El 58,9% de la muestra presentaba 3-4 variables Centor, sin diferencias entre sexos (p=0,465) (tabla 1). Por sospecha clínica, se diagnosticaría de FA bacteriana a la mitad de los pacientes y en el resto habría dudas sobre la etiología. Se prescribirían antibióticos al 57,8% de los pacientes (todas las sospechas de infección bacteriana y el 15,6% de los casos dudosos). El 57,3% de los pacientes pertenecía a uno de los centros de salud (tabla 2).
Edad (años) y presencia de signos/síntomas de las FA, por sexo y por el resultado del cultivo
| Totaln (%) | Sexo | Cultivo | |||
| Niñosn (%) | Niñasn (%) | Positivon (%) | Negativon (%) | ||
| Pacientes | 192 (100) | 99 (51,6) | 93 (48,4) | 74 (38,5) | 118 (61,5) |
| Edad media±DE | 7,2±2,8 | 7,2±2,8 | 7,2±2,7 | _ | _ |
| Media signos±DE | 6,1±1,7 | 6,0±1,6 | 6,2±1,7 | 6,4±1,8 | 5,9±1,6 |
| Hiperemia | 183 (95,3) | 95 (96,0) | 88 (94,6) | 69 (93,2) | 113 (95,8) |
| Fiebre | 168 (87,5) | 87 (87,9) | 81 (87,1) | 59 (79,7)* | 108 (91,5) |
| Odinofagia | 165 (85,9) | 83 (83,8) | 82 (88,2) | 69 (93,2)** | 95 (80,5) |
| Adenopatía | 106 (55,2) | 56 (56,6) | 50 (53,8) | 43 (58,1) | 62 (52,5) |
| Cefalea | 87 (45,3) | 41 (41,4) | 46 (49,5) | 33 (44,6) | 54 (45,8) |
| Exudados | 81 (42,2) | 43 (43,4) | 38 (40,9) | 28 (37,8) | 53 (44,9) |
| Úvula roja | 76 (39,6) | 41 (41,4) | 35 (37,6) | 34 (45,9) | 41 (34,7) |
| Dolor abdominal | 62 (32,3) | 27 (27,3) | 35 (37,6) | 25 (33,8) | 37 (31,4) |
| Petequias palatinas | 59 (30,7) | 31 (31,3) | 28 (30,1) | 26 (35,1) | 32 (27,1) |
| Coriza | 48 (25,0) | 23 (23,2) | 25 (26,9) | 21 (28,4) | 27 (22,9) |
| To | 46 (24,0) | 23 (23,2) | 23 (24,7) | 17 (23,0) | 29 (24,6) |
| Ná | 39 (20,3) | 19 (19,2) | 20 (21,5) | 20 (27,0) | 19 (16,1) |
| Vómitos | 38 (19,8) | 19 (19,2) | 19 (20,4) | 18 (24,3) | 20 (16,9) |
| Exantema escarlata | 13 (6,8) | 9 (9,2) | 4 (4,3) | 9 (12,2)*** | 4 (3,4) |
| N.° variables Centor | |||||
| 0-2 | 79 (41,1) | 38 (38,4) | 41 (44,1) | 34 (45,9) | 45 (38,1) |
| 3-4 | 113 (58,9) | 61 (61,6) | 52 (55,9) | 40 (54,1) | 73 (61,9) |
FA: faringoamigdalitis aguda.
Características de las FA referidas al diagnóstico por sospecha clínica o por pruebas diagnósticas, intención de tratar con antibióticos por sospecha clínica y lugar de la consulta, por sexo y por el resultado del cultivo
| n (%) | Sexo | Cultivo | |||
| Niños (%) | Niñas (%) | Positivo (%) | Negativo (%) | ||
| Pacientes | 192 (100) | 99 (51,6) | 93 (48,4) | 74 (38,5) | 118 (61,5) |
| Impresión diagnóstica inicial | |||||
| FA bacteriana | 96 (50,0) | 48 (48,5) | 48 (51,6) | 50 (67,6)* | 46 (39,0) |
| Dudas vírica o bacteriana | 96 (50,0) | 51 (51,5) | 45 (48,4) | 24 (32,4) | 72 (61,0) |
| Tratar con antibióticos | 111 (57,8) | 56 (56,6) | 55 (59,1) | _ | _ |
| Test Strep A positivo | 74 (38,7) | 35 (35,4) | 39 (42,4) | _ | _ |
| Cultivo positivo | 74 (38,7) | 36 (36,4) | 38 (41,3) | _ | _ |
| Lugar de la consulta | |||||
| Centro Tineo | 82 (42,7) | 43 (43,4) | 39 (41,9) | 20 (27,0)** | 62 (52,5) |
| Centro Cangas del Narcea | 110 (57,3) | 56 (56,6) | 54 (58,1) | 54 (73,0) | 56 (47,5) |
FA: faringoamigdalitis aguda.
Cuando hubo sospecha clínica de FA bacteriana, fueron más frecuentes la ausencia de coriza (89,6 vs 60,4%) y la presencia de úvula roja (56,3 vs 22,9%), petequias palatinas (43,8 vs 17,7%), exantema escarlatiniforme (12,8 vs 1,0%) y la presentación de 3-4 variables Centor (66,7 vs 51,05%) (p=0,040), que cuando hubo dudas etiológicas.
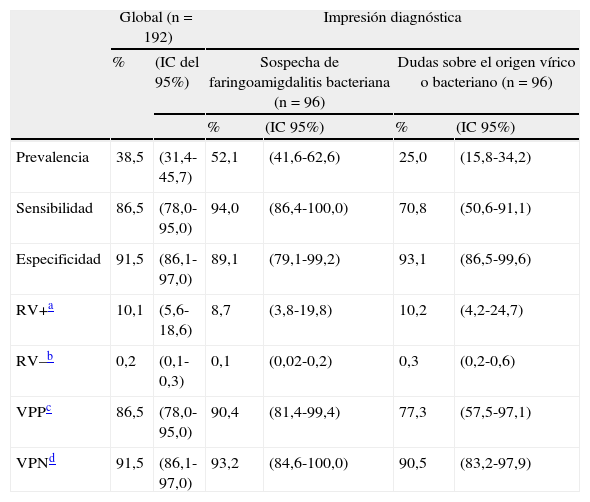
La prevalencia de EGA fue del 38,7% (IC del 95%, 31,4-45,7) y el test Strep A resultó positivo en la misma proporción. Los resultados positivos en ambas pruebas fueron algo mayores en las niñas, sin diferencias significativas respecto a los niños (tabla 2). Entre los centros del estudio, hubo diferencias en la prevalencia de cultivo positivo (49,1% y 24,4%) (p=0,0009) y no en la presentación de 3-4 criterios Centor (61,0 vs 57,3%) (p=0,357).
La odinofagia y el exantema escarlatiniforme fueron más probables cuando el cultivo resultó positivo, mientras que la fiebre lo fue con el cultivo negativo. No hubo diferencias significativas en el número de criterios Centor según el resultado del cultivo (tabla 1). Hubo una sospecha clínica inicial de FA bacteriana en el 67,6% de los cultivos positivos, mientras que hubo dudas etiológicas en el 61,0% de los negativos (tabla 2). El EGA resultó sensible a penicilina en el 100% de los casos, a eritromicina en el 97,3% y a clindamicina en el 86,3%.
Los mejores resultados globales de efectividad del test Strep A fueron la especificidad (91,5%) y el VPN (91,5%). Al analizar el efecto de espectro en los resultados del test, se observó que la sensibilidad y el VPP fueron mayores en quienes se sospechaba una FA bacteriana (94,0% y 90,4%) y menores cuando existían dudas etiológicas (70,8% y 77,3%), al igual que la RV– y el VPN. Ante un resultado negativo del test, la probabilidad de estar ante una FA bacteriana resultó del 6,8% en los casos de sospecha clínica de una etiología bacteriana y del 9,5% en los casos con dudas etiológicas (tabla 3).
Prevalencia de FA por Streptococcus pyogenes y medidas de efectividad del test Strep A, globales y por impresión diagnóstica inicial
| Global (n=192) | Impresión diagnóstica | |||||
| % | (IC del 95%) | Sospecha de faringoamigdalitis bacteriana (n=96) | Dudas sobre el origen vírico o bacteriano (n=96) | |||
| % | (IC 95%) | % | (IC 95%) | |||
| Prevalencia | 38,5 | (31,4-45,7) | 52,1 | (41,6-62,6) | 25,0 | (15,8-34,2) |
| Sensibilidad | 86,5 | (78,0-95,0) | 94,0 | (86,4-100,0) | 70,8 | (50,6-91,1) |
| Especificidad | 91,5 | (86,1-97,0) | 89,1 | (79,1-99,2) | 93,1 | (86,5-99,6) |
| RV+a | 10,1 | (5,6-18,6) | 8,7 | (3,8-19,8) | 10,2 | (4,2-24,7) |
| RV–b | 0,2 | (0,1-0,3) | 0,1 | (0,02-0,2) | 0,3 | (0,2-0,6) |
| VPPc | 86,5 | (78,0-95,0) | 90,4 | (81,4-99,4) | 77,3 | (57,5-97,1) |
| VPNd | 91,5 | (86,1-97,0) | 93,2 | (84,6-100,0) | 90,5 | (83,2-97,9) |
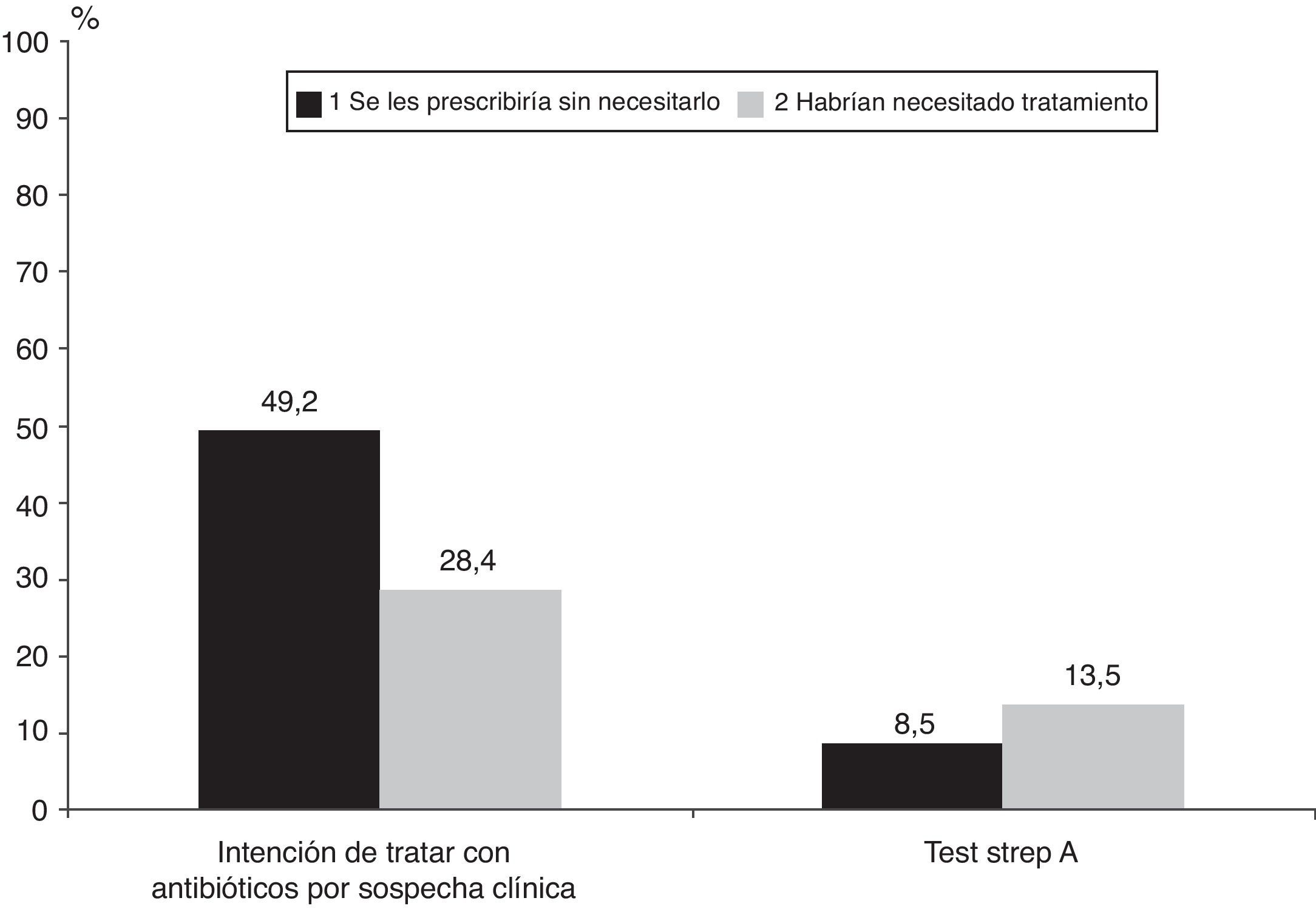
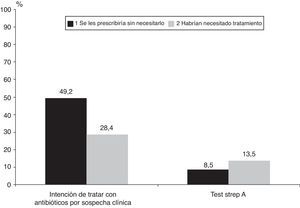
La figura 1 valora el tratamiento inapropiado con antibióticos según el juicio clínico y el resultado del test Strep A: no recibirían antibióticos el 28,4 y el 13,5%, respectivamente (IC 95% de la diferencia, 0,6-29,1), de los pacientes con un cultivo positivo, mientras que recibirían antibióticos sin necesitarlos el 49,2 y el 8,5%, respectivamente (IC 95% de la diferencia, 29,5-51,9), de los pacientes con cultivo negativo. Serían tratados adecuadamente el 89,6% (IC 95%, 85,0-94,2) según el resultado del test y el 58,9% (IC 95%, 51,6-66,1) según el juicio clínico.
DiscusiónAunque el diseño del estudio estimó una muestra de 546 personas, la muestra final ha sido de 192, lo que supone una baja precisión de los parámetros estimados y poco poder estadístico para detectar diferencias significativas entre grupos de pacientes. Alguno de los pediatras recoge una menor tasa de consultación por FA durante el periodo del estudio.
También debe comentarse un posible sesgo de selección, ya que aunque el diseño del estudio estableció un muestreo consecutivo, no siempre fue posible realizarlo en los días de mayor presión asistencial en la consulta. Este sesgo puede llevar a una sobreestimación de las medidas de efectividad del test evaluado16. Además, la validez externa puede estar limitada por un posible sesgo en la representatividad de la edad, ya que el 70,3% de la muestra tenía entre 5 y 10 años quedando poco representadas el resto de edades.
La clínica predominante en las FA por EGA de estudios precedentes es variada12,17. En este estudio prevalecieron la odinofagia y el exantema escarlatiniforme, observados también por Contessotto et al.3, que añadía la presencia de adenopatías. Hace más de una década que Centor et al.18 y McIsaac et al.19 validaron la presentación de 4 síntomas/signos para estratificar a los pacientes con FA en niveles de riesgo de una infección bacteriana. Desde entonces, varios estudios han asociado la presentación de más de dos criterios con una mayor probabilidad de FA estreptocócica8,12,20. Sin embargo, esta asociación no se observó en nuestro estudio, quizá por incluir una población seleccionada que excluía a los pacientes con clínica sugestiva de viriasis.
Bisno21 menciona que la prescripción antibiótica basada sólo en la clínica resulta excesiva por miedo tanto a complicaciones locales como a la aparición de fiebre reumática aguda (FRA). Así se observó en este estudio, pues la mitad de quienes recibirían antibióticos por sospecha clínica serían tratados innecesariamente. La situación mejoró mucho al emplear el test Strep A, ya que esta prescripción disminuiría entre un 29,5 y un 51,9%. Además, el 28,4% de quienes por sospecha clínica no recibirían tratamiento, necesitarían los antibióticos, disminuyendo entre un 0,6 y un 29,1% cuando se utilizó el test diagnóstico. Por lo tanto, igual que en otros estudios, parece evidente la mejora en la prescripción antibiótica cuando se utiliza el test respecto a sólo la sospecha clínica17,22.
La capacidad diagnóstica global del test, al compararla con una revisión sistemática y metaanálisis de Ruiz-Aragón et al.2, resultó en una sensibilidad similar (86,7 vs 85,0%), una menor especificidad (91,5 vs 96,0%) y respecto a los valores predictivos, coinciden en los mejores resultados para el VPN.
La prevalencia de la enfermedad observada en el estudio fue más elevada que en otro estudio23 también realizado en AP, pero con una población de estudio no seleccionada (38,5 vs 25%). Resultó aún más elevada (52,1%) en el grupo con sospecha clínica de FA bacteriana, siendo en esta circunstancia cuando la sensibilidad y el VPP fueron mejores. Algunos autores24,25 indican un mejor rendimiento de los parámetros del test cuando la prevalencia es más elevada, y que un uso selectivo del test aumenta su tasa de positividad y el VPP, reduciéndose los test positivos de los portadores crónicos.
No hubo diferencias en el número de criterios Centor entre los centros del estudio, pero sí distintas prevalencias de la enfermedad, que podrían estar condicionadas por diferencias en la altitud y parámetros climáticos entre las dos zonas básicas de salud. Estas diferencias en la prevalencia inciden sobre todo en el VPP de cada centro (89,3% y 77,9%) y suponen una limitación que se debe considerar en la aplicación de los valores predictivos globales en la práctica clínica.
Aunque algún autor24 refiere que, debido a las resistencias bacterianas, el tratamiento innecesario con antibióticos ha llegado a tener igual importancia que no tratar con antibióticos cuando se necesitan, se continúa poniendo el énfasis en la prevención de la FRA y las complicaciones supurativas locales. Actualmente existe una gran controversia sobre la necesidad o no de realizar cultivo a todo resultado negativo del test2,3,8,12,22. La Asociación Española de Pediatría en un reciente consenso25 lo recomienda en: antecedentes de FRA o glomerulonefritis postestreptocócica, mayor incidencia en la comunidad de enfermedad estreptocócica invasiva, alta sospecha de origen bacteriano de la FA y baja sensibilidad de la PAR en el centro que la realiza.
En este estudio, se observó que un 13,5% de los tests con resultados negativos tuvieron un cultivo positivo. Este valor puede estar sobreestimado por defectos en la realización del frotis faríngeo3,26, por la obtención de exudado faringoamigdalar insuficiente para un resultado positivo del test, aunque en este estudio se intentó minimizar con un aprendizaje previo de la técnica, obteniéndose una moderada/buena concordancia interobservador.
La mayoría de los resultados de las PAR a nivel ambulatorio son negativos, el 61,3% en este estudio. La necesidad de verificarlos mediante cultivo desincentivaría y aumentaría los costes del test3,20, especialmente si los centros de salud no pueden enviar diariamente las muestras al laboratorio de referencia, como ocurre en el medio donde se desarrolló este estudio. En este sentido, algún autor26 ha expresado que las recomendaciones sobre la necesidad de cultivo de todo test negativo pueden variar dependiendo del lugar de trabajo.
En nuestro medio, las complicaciones supurativas se presentan en el 1-2% de FA por EGA25 y la incidencia de FRA ha declinado considerablemente en Occidente, incluso desde antes del uso de la penicilina27, quedando reducida en España a casos esporádicos, con una incidencia anual inferior a 1 caso por cada 100.000 habitantes3,25. Por ello, la autoría de este estudio coincide con Tanz et al.8 en que se debería poner el énfasis en limitar la utilización de los antibióticos más que en maximizar la identificación de FA estreptocócica.
En conclusión:
- -
En este estudio se ha verificado la mejora en la adecuación del tratamiento con antibióticos, cuando se utiliza el test respecto a diagnosticar sólo con la sospecha clínica. Con los parámetros observados, al menos el 85,0% de los pacientes serían tratados adecuadamente, aumentando la utilidad del test en los casos en que hay una sospecha clínica previa de FA bacteriana.
- -
Desde el punto de vista económico, el incremento en los costes directos por la aplicación del test (0,90€ a 4,5€, por determinación dependiendo del fabricante), podrían compensarse por la reducción en el uso de antibióticos, menor incidencia de efectos secundarios y aparición de resistencias3,4,22,28,29. Otro beneficio indirecto es el grado de satisfacción que aporta a los padres disponer de un resultado en pocos minutos, proporcionando al pediatra un criterio objetivo y rápido para restringir la antibioterapia a los casos de etiología estreptocócica3.
- -
Por todo lo expuesto, y porque además es una técnica sencilla de aplicar, a pesar de las limitaciones del estudio, parece recomendable el uso del test Strep A en las consultas de pediatría de AP del medio rural. En aquellos centros de salud/consultorios con difícil acceso al laboratorio de microbiología, no parece necesario realizar cultivo cuando el resultado del test sea negativo, especialmente en los casos con sospecha clínica de FA bacteriana por presentar el VPN más elevado (93,2%).
Este trabajo ha sido financiado por el Instituto de Salud Carlos III y Fondos FEDER. N.° de expediente: P107/90596.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Martín Caicoya Gómez-Morán, por su asesoría en el diseño del proyecto. Al José Francisco Ordás Álvarez, por su participación en el diseño del proyecto y por los cultivos que realizó que, muy a su pesar y de todo el grupo, no pudo completar. A Ángela Gutiérrez Puebla y María Fernández Francés por su trabajo en la captación, realización del frotis faringoamigdalar y la recogida de información.