Introducción
La sepsis neonatal precoz tiene una incidencia variable de 1 a 10 casos por 1.000 recién nacidos vivos, y es una causa importante de ingresos y de mortalidad neonatal. Existen una serie de factores obstétricos que aumentan el riesgo de un recién nacido de presentar un cuadro infeccioso (principalmente colonización por estreptococo del grupo B [SGB], signos y síntomas de corioamniotitis y rotura prolongada de membranas > 18 h)1, y por eso a estos pacientes se les debe someter a una vigilancia clínica y, en ocasiones, a pruebas diagnósticas con intención de anticipar el inicio del tratamiento antibiótico al deterioro clínico del recién nacido2.
El recién nacido responde a una gran variedad de estímulos nocivos con un limitado número de respuestas sistémicas y metabólicas que sirven para restaurar la homeostasis, pero que son inespecíficas para el diagnóstico. Además, la valoración microbiológica de los líquidos biológicos arroja resultados de forma diferida, por lo que ante la sospecha clínica, ésta debe ser confirmada con pruebas de laboratorio lo más sensibles y rápidas posible2,3.
En los trabajos sobre valoración de la utilidad de pruebas diagnósticas es fundamental definir correctamente el método de certeza o patrón de referencia (gold standard). En el caso de la sepsis, la prueba de referencia es el hemocultivo, pero en la sepsis neonatal no es el mejor patrón de referencia, pues la escasa muestra de sangre, la presencia de bacteriemias intermitentes o el uso de antibióticos maternos hace que, en ocasiones, el número de casos con alta sospecha de sepsis, pero cultivos negativos, sea el doble que el de casos probados2. En la práctica clínica, el tratamiento diagnóstico-terapéutico de la infección bacteriana neonatal es complejo y está lleno de incertidumbres: la inespecificidad de la clínica, unida al resultado diferido en el tiempo de los estudios microbiológicos, hacen que deban ser usadas pruebas de laboratorio que permitan iniciar de forma precoz el tratamiento antibiótico. Y mención aparte merecen aquellos recién nacidos que sin tener clínica de sepsis están en riesgo de presentarla: debido a que la sepsis neonatal precoz es una condición de baja incidencia pero muy grave, lo más importante es no perder casos (alta sensibilidad [Se]) y descartarla con seguridad cuando verdaderamente no la hay (alto VPN). El interés de estas pruebas de diagnóstico precoz es que sean usadas con intención de descartar la eventual aparición de un cuadro séptico, sin aumentar el número de pacientes que deban ser tratados con antibióticos de forma innecesaria.
Un marcador de sepsis neonatal debería, por un lado, permitir un diagnóstico precoz de forma sensible (diferenciar entre causa infecciosa o no ante una inflamación) y, si es posible, informar acerca del pronóstico.
Entre estos marcadores, cabe considerar el recuento leucocitario, la determinación de los reactantes de fase aguda y los mediadores de inflamación. Pero son la determinación de la proteína C reactiva (PCR) y la cuantificación de la procalcitonina (Pct) los más usados hoy en día. Al comparar la Pct con la PCR, se ha visto que tras la infusión de endotoxinas en voluntarios sanos, la Pct aumenta de 12 a 36 veces sus valores normales a las 2-6 h, con una meseta a las 6 h y una normalización a las 25-30 h; en el caso de la PCR este aumento es de 3 a 8 veces a las 12-18 h, con una meseta a las 20-72 h y una normalización a los 3-7 días4,5. La PCR no supera valores de sensibilidad del 60 % con VPN superiores al 90 % sólo después de las primeras 24 h de vida y, por ello, exige determinaciones seriadas de la misma. La Pct ha demostrado elevarse de forma clara en casos de inflamación de causa infecciosa de manera más precoz que la PCR, correlacionándose con la gravedad y la mortalidad; sin embargo, su uso diagnóstico se ve limitado por la existencia de un pico fisiológico de este péptido en recién nacidos normales durante las primeras 24-48 h de vida, con lo que la especificidad en ocasiones no supera el 65 % con malos resultados en VPP5-7.
La medición de los valores de Pct en sangre se puede practicar por luminometría (LUMITEST® PCT BRAHMS), que mide tanto la concentración de Pct como los de la calcitonina unida a la catacalcina, pero existe una prueba colorimétrica semicuantitativa (Pct-Q BRAHMS) que si bien es menos sensible, permite de forma más rápida (30 min) la valoración de Pct con un límite inferior de detección de 0,5 ng/ml. El objetivo de este estudio es demostrar la utilidad de la determinación de la Pct (por técnica semicuantitativa) en las primeras 6-12 h de vida para descartar la presencia de sepsis neonatal en recién nacidos asintomáticos con factores de riesgo (obstétricos y perinatales) de infección.
Material y métodos
Población de estudio
Para cubrir nuestro objetivo se diseñó un estudio observacional y longitudinal prospectivo en todos los recién nacidos ingresados de forma consecutiva en dos años (junio de 2003-mayo de 2005) en nuestra unidad neonatal con factores de riesgo de infección neonatal.
Los criterios de inclusión fueron todos los recién nacidos en cuya historia clínica (obstétrica y perinatal) figure al menos un factor de riesgo de infección (madre portadora de SGB, bacteriuria durante la gestación por SGB, rotura prolongada de membranas > 18 h, prematuridad, fiebre intraparto significativa, signos y síntomas de corioamnionitis o hijo previo con sepsis por SGB) y que la madre hubiera recibido una profilaxis antibiótica incompleta (menos de dosis de antibiótico en las 4 h previas al parto) y a los que se practica, de forma sistemática, una determinación de Pct en las primeras horas de vida (prueba validada).
Protocolo de estudio
Se diseñó un protocolo de recogida de datos que fue probado durante un mes antes del inicio del estudio (fase preprueba). Al finalizar este período se revisó toda la información disponible, que fue valorada y analizada en relación con la realidad de la unidad neonatal y con ella se elaboró el protocolo definitivo.
La sistemática de estudio fue la siguiente: se ingresa en observación al recién nacido que cumple los criterios de inclusión y al nacimiento se recogen tres muestras de frotis periférico (que incluyan jugo gástrico, frotis ótico y al menos otra localización a criterio del facultativo). Entre las 2 y 6 h de vida se extrae una muestra de sangre para hemocultivo (contenedores pediátricos de hemocultivo Bactec®) y 1 ml de sangre que se centrifuga para determinar la Pct usando una técnica semicuantitativa (Pct-Q BRAHMS Diagnostica®, Berlín, Alemania) en la misma unidad neonatal. La Pct-Q BRAHMS Diagnostica® ofrece un resultado colorimétrico semicuantitativo con cuatro valores: < 0,5; 05-1,99; 2-9,99 y ≥ 10 ng/ml.
La catalogación definitiva del caso como infección en el recién nacido o no (método de certeza) resultó en las siguientes clasificaciones: a) sepsis neonatal confirmada a germen conocido, si presentaba clínica de infección con parámetros analíticos sugestivos y hemocultivo positivo (si presentara también alteración hemodinámica se cataloga con shock séptico); b) sepsis neonatal posible a germen conocido, si presentaba clínica y analítica patológica, el hemocultivo es negativo, pero crece un mismo germen en tres localizaciones de frotis periféricos, y c) sepsis neonatal sin confirmación bacteriológica, si presentaba clínica y analítica patológica, pero el hemocultivo y los frotis periféricos son negativos. Otros posibles diagnósticos al alta fueron: a) bacteriemia, si presentaba hemocultivo positivo, pero sin clínica de infección ni alteración analítica; b) colonización bacteriana, si presentaba frotis periféricos positivos, con hemocultivo negativo y sin clínica de infección, ni analítica sugestiva, y c) riesgo de infección, finalmente, serían aquellos recién nacidos asintomáticos con analítica normal y estudios microbiológicos negativos a pesar de factores de riesgo de infección.
El tratamiento antibiótico se inicia en caso de clínica sugestiva de infección con independencia de los resultados de Pct o hemocultivo (ante un resultado patológico de la Pct o un hemocultivo positivo, es la presencia de clínica la que marca el inicio del tratamiento).
Análisis estadístico
Se confeccionó una base de datos para los cálculos estadísticos en EpiInfo (versión 3.3). Los indicadores de validez (sensibilidad y especificidad) y seguridad (VPP y VPN) de la Pct (con distintos puntos de corte: 0,5 ng/ml, 2 ng/ml y 10 ng/ml) se calcularon elaborando tablas de contingencia 2 × 2, considerando como prueba de referencia bien el hemocultivo positivo exclusivamente o bien la catalogación definitiva del caso (en función de datos clínico-analíticos-microbiológicos) en sepsis neonatal (confirmada a germen conocido, posible a germen conocido o sin confirmación bacteriológica). También se realizaron los cálculos de los siguientes índices, clínicamente relevantes y que no dependen de la prevalencia de la enfermedad en la población que se va a estudiar: probabilidad posprueba del resultado positivo (Ppos+) y del resultado negativo (Ppos), así como los cocientes de probabilidad (CP) positivo (CP+) o negativo (CP), que se interpreta en función de los datos proporcionados por el Evidence-Based Medicine Working Group8,9. De todos los estimadores se calculó la precisión por medio del intervalo de confianza (IC) del 95 %.
Resultados
De los 123 recién nacidos incluidos en el estudio, el 50,2 % eran varones. La edad gestacional media (registrada en 119 casos) fue de 38,8 ± 1,96 semanas (con un intervalo comprendido entre 29 y 42 semanas); 13 casos fueron pretérminos (< 37 semanas) y 4, postérminos (≥ 42 semanas). El peso medio de nacimiento (registrado en 103 casos) fue de 3.234 ± 474 g (con un intervalo entre 2.100 y 4.280 g); 7 casos fueron de bajo peso (< 2.500 g) y 4, de peso elevado (> 4.000 g). El parto fue eutócico en el 74 % de los casos, y distócico en el resto (cesárea en el 17 % e instrumental en el 9 %). La puntuación de Apgar al primer minuto fue superior a 7 en el 97 % de los recién nacidos.
Los factores de riesgo obstétricos y perinatales más importantes de nuestra muestra fueron: hijo de madre portadora de SGB (63 %), amniorrexis de más de 18 h (23 %) y fiebre materna intraparto (7 %). Del total de la muestra, el 72 % de las madres habían recibido una dosis de antibiótico preparto, y fue la penicilina el más usado (75 %). En todos ellos se determinan los valores de Pct entre las 2 y 18 h de vida (media = 6,2 ± 2,2 h y mediana = 6 h), y en las primeras 12 h de vida en el 95 % de los casos. Los resultados de los valores de Pct por colorimetría semicuantitativa fueron: < 0,5 ng/ml = 65 casos (53 %), 0,5-1,99 ng/ml = 28 casos (23 %), 2-9,99 ng/ml = 19 casos (15 %) y ≥ 10 ng/ml = 11 casos (9 %).
El hemocultivo se extrajo en 113 pacientes, y resultó positivo en cinco: finalmente dos casos se correspondían al diagnóstico de sepsis neonatal (por SGB) y en tres casos al diagnóstico de bacteriemia. Los diagnósticos finales al alta de los recién nacidos fueron: sepsis neonatal confirmada a germen conocido en 2 casos, sepsis neonatal posible a germen conocido en 5 casos, bacteriemia en 3, colonización en 12 y riesgo de infección en el resto. Se inició antibioterapia en 11 casos: los 7 casos de sepsis neonatal confirmada o posible a germen conocido, en los que se completó un ciclo de 7-10 días; en los restantes 4 casos se retiró precozmente el antibiótico tras conocer los resultados analítico-microbiológicos y la evolución del paciente.
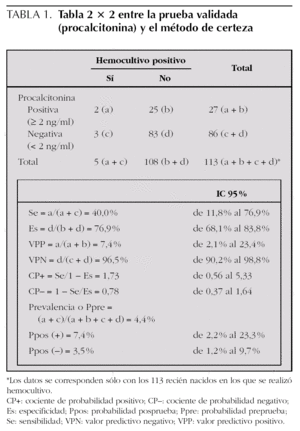
Las tablas de 2 × 2 entre la prueba que se valida (Pct) y los métodos de certeza, bien hemocultivo positivo exclusivamente o bien la catalogación definitiva del caso (en función datos clínico-analíticos-microbiológicos) en sepsis neonatal confirmada a germen conocido, sepsis posible a germen conocido o sepsis sin confirmación bacteriológica, se expresan en la tablas 1 y 2. Se refieren los datos con un punto de corte de 2 ng/ml (Pct+ si ≥ 2 ng/ml y Pct si < 2 ng/ml), pues cuando utilizamos otros puntos de corte (0,5 ng/ml o 10 ng/ml) empeora los indicadores de validez y seguridad de la prueba diagnóstica y, por tanto, también empeora el área bajo la curva ROC.
En nuestro estudio, el mejor punto de corte de la Pct, realizada en las primeras 12 h de vida (media y mediana de 6 h), se estableció en 2 ng/ml y comparándolo con el diagnóstico final de sepsis (con datos clínico-analítico-microbiológicos) como mejor patrón de referencia (tabla 2), ya que el hemocultivo no es una buena prueba de referencia en la infección neonatal (tabla 1). Una sensibilidad del 100 % (IC 95 %: 64,6-100) (con ningún falso negativo) y un VPN del 100 % (IC 95 %: 96,1-100) la convierten en una buena prueba de cribado en esta población de riesgo para descartar la sepsis neonatal de forma precoz; sin embargo, una especificidad del 81,9 % (IC 95 %: 73,9-87,8) y un VPP del 25 % (IC 95 %: 12,7-42,4) no la convierten en una buena prueba diagnóstica, y tendremos que confirmar el resultado con una prueba en serie, con mejor especificidad y VPP, como la PCR, útil a partir de las 12-24 h de vida en el recién nacido.
Discusión
En las fases de proceso diagnóstico intervienen la historia clínica, la exploración física y la realización de pruebas complementarias (bien en paralelo o en serie). Es evidente que una buena prueba diagnóstica es la que ofrece resultados positivos en enfermos y negativos en sanos, y cuyas condiciones exigidas son: validez, seguridad, reproductividad, sencillez, mínimos efectos adversos y ser económicamente soportable (o una buena relación coste-beneficio en relación con otras pruebas conocidas).
En el proceso diagnóstico de la sepsis neonatal los signos clínicos suelen ser inespecíficos y, a menudo, se manifiestan sin constancia de un hemocultivo positivo. Esto es especialmente importante en la probable sepsis neonatal precoz con factores de riesgo perinatales de infección, en las que la aplicación de antibióticos a la madre es una práctica común10. De ahí el interés de disponer de pruebas de diagnóstico rápido en el período neonatal precoz (como la Pct), que diferencien entre recién nacidos infectados y no infectados.
En nuestro estudio, el diseño longitudinal realizado sobre la práctica clínica en nuestra unidad neonatal a los recién nacidos que cumplen los criterios de inclusión del estudio permite cumplir la mayoría de los requisitos sobre la validez, importancia y aplicabilidad de pruebas diagnósticas, ya que:
La comparación de la prueba (Pct) con el patrón de referencia (catalogación de sepsis neonatal en función de datos clínico-analítico-microbiológicos) fue independiente y a ciegas, ya que, a pesar de tener una alta sospecha diagnóstica en todos los recién nacidos (con factores de riesgo de infección), no se conoció con certeza quién tenía sepsis hasta la confirmación definitiva posterior, pues se recibieron los resultados microbiológicos y analíticos que permitieron clasificar la sepsis (sin utilizar el valor de Pct para ello) de forma diferida (generalmente más allá de las 12 h de vida).
Se ha incluido un espectro adecuado de pacientes para el motivo del estudio (cualquier factor de riesgo de infección obstétrico y perinatal sin una adecuada cobertura antibiótica preparto a la madre), con una prevalencia de la enfermedad (probabilidad preprueba) de 5,7 %.
En todos los pacientes se realizó el método de certeza (en el caso del hemocultivo sólo se obtuvo en 113 pacientes), se describieron los métodos con suficiente detalle para permitir su reproducción, se calcularon los CP, la prueba de la Pct es razonablemente asequible (si bien su precio es unas cuatro veces superior al de la PCR) y correcta y los resultados son aplicables a nuestro entorno asistencial.
La principal limitación de nuestro estudio es el reducido tamaño muestral, con el diagnóstico final de sepsis (confirmada, posible o sin confirmación bacteriológica) en sólo siete pacientes. Asimismo, la validez (sensibilidad y especificidad) y seguridad (VPP y VPN) de una prueba diagnóstica varían según los estudios, el punto de corte, el momento de su realización y la prueba de referencia utilizada. Blommendahl et al6 calcularon sobre 169 recién nacidos, para un punto de corte de Pct de 1 ng/ml, una sensibilidad del 77 % con una especificidad del 62 %, frente al 58 y 84 %, respectivamente, para la PCR. En este estudio, si bien el VPP de la Pct fue del 16 %, el VPN fue del 97 %. En otros trabajos4,7,11, realizados en distintas poblaciones de recién nacidos (con clínica de infección o sólo con factores de riesgo) y con distintos puntos de corte de Pct (de 1 a 2 ng/ml) también encontraron baja especificidad de la prueba con altos falsos positivos (FP), pero con una sensibilidad en torno al 60-70 % y VPN superiores al 80 %. También influye el momento de la realización de la prueba; así, durante las primeras 48 h de vida y con un punto de corte de 0,5 a 1 ng/ml, se aportan oscilaciones de sensibilidad de 68-100 %, especificidad de 73-100 %, VPN de 79-96 % y VPP de 40-94 %12. Y, finalmente, cabe considerar la técnica de determinación de la Pct: estudios recientes en nuestro país sobre el valor diagnóstico de la Pct en la sepsis neonatal de transmisión vertical13 y de origen nosocomial14 se han realizado con determinación de la Pct por luminometría.
Es importante evaluar las consecuencias de los FP y falsos negativos (FN): si la enfermedad es grave y el pronóstico mejorara con un diagnóstico precoz, los FN serían dramáticos; pero los FP pueden plantear problemas de sobrediagnóstico y sobretratamiento, que pueden resolverse si definimos una segunda fase con una prueba con mejores características, principalmente con mucha especificidad (con FP bajos y, por tanto, un VPP alto)15,16. Los casos de FP de la Pct se describen en algunas situaciones neonatales como hipoxemia, asfixia, preeclampsia y diabetes materna y la administración de agente tensiactivo intratraqueal; se sabe que la especificidad en las primeras 24 h desciende debido a que los precursores de la calcitonina aumentan de forma transitoria hasta valores de 4 ng/ml6,7,12,16. En este sentido, se han elaborado nomogramas de valores de la Pct en los primeros días de vida, tanto en recién nacidos a término17 como pretérminos18, y también hay estudios sobre el valor de la Pct en sangre de cordón umbilical19.
En resumen, para tener una buena prueba diagnóstica se requieren especificidad y VPP elevados; estos datos hacen referencia al SpPin: cuando una prueba tiene una alta especificidad (specificity), los resultados positivos (positive results) son muy indicativos de enfermedad (rules IN diagnosis); esto se debe a que una prueba con alta especificidad tiene muy pocos FP, es decir, si la prueba es positiva puede creerse. En contraste, para tener una buena prueba de cribado es muy importante que cuente con una sensibilidad y VPN elevados; estos datos hacen referencia al SnNout: cuando una prueba tiene una sensibilidad muy elevada (sensitive), los resultados negativos (negative results) descartan el diagnóstico con alta probabilidad (rules OUT diagnosis). Esto se debe a que una prueba con alta sensibilidad tiene muy pocos FN, es decir, si la prueba es negativa, puede creerse13. Según los resultados de nuestro estudio, la Pct realizada en las primeras horas de vida en recién nacidos asintomáticos con factores de riesgo de infección tiene un buen SnNout (podemos descartar sepsis neonatal con seguridad si la prueba es < 2 ng/ml), pero no un adecuado SpPin (no podemos confirmar sepsis neonatal si la prueba es ≥ 2 ng/ml, y para ello se realizará, posteriormente, otra prueba diagnóstica en serie, preferentemente la PCR).
Traducido en CP podemos ver en nuestros resultados (tabla 2) que tiene mayor valor el CP = 0 (lo que genera cambios concluyentes desde una probabilidad preprueba de 5,7 % a una probabilidad posprueba de 0 %; IC 95 %: 0,0-3,9 %) que el CP+ = 5,52 (lo que genera cambios moderados desde una probabilidad preprueba de 5,7 % a una probabilidad posprueba de 25 %; IC 95 %: 12,7-45,4 %). El CP nos permite tomar la decisión terapéutica del alta hospitalaria precoz, con seguridad respecto a la ausencia de potenciales FN de sepsis; el CP+ nos permite sospechar el diagnóstico, pero la presencia de 18,1 % de FP (IC 95 %: 12,2-26,1 %) aconseja apoyar con una prueba con mejor especificidad y VPP (como la PCR) para conseguir un adecuado umbral terapéutico.
Como comentarios finales a nuestro estudio cabe plantear que: a) la determinación de la Pct por técnica semicuantitativa en las primeras 6-12 h de vida es una prueba de laboratorio útil en la valoración de los recién nacidos asintomáticos con riesgo de infección, válida y segura como una buena prueba de cribado de sepsis neonatal, y b) el inconveniente del mayor precio de la Pct (unos 11 € por kit de Pct-Q BRAHMS), respecto a otros reactantes de fase aguda (como la PCR), debe valorarse en relación con las ventajas de permitir períodos de observación en la unidad neonatal inferiores a 6-12 h, con los beneficios económicos y sociales de ello derivados, a través de un adecuado estudio de rentabilidad.
Correspondencia: Dr. J.A. Pastor Peidró.
Servicio de Pediatría. Hospital Universitario San Juan.
Ctra. Alicante-Valencia, s/n. 03550 San Juan de Alicante. Alicante. España.
Correo electrónico: jgdedios@telefonica.net
Recibido en octubre de 2005.
Aceptado para su publicación en junio de 2007.