El síndrome antifosfolípido (SAF) es una enfermedad autoinmune definida por la coexistencia de trombosis —arteriales o venosas— o pérdidas fetales recurrentes y presencia de anticuerpos antifosfolípidos en la circulación en 2 ocasiones separadas al menos por 12 semanas. Puede ser primario, sin asociación con otras enfermedades o secundario a procesos subyacentes, destacando el lupus eritematoso sistémico. Los anticuerpos antifosfolípidos son autoanticuerpos dirigidos contra proteínas plasmáticas con afinidad por fosfolípidos aniónicos, señalando por su relevancia clínica el anticoagulante lúpico y los anticuerpos anticardiolipina y anti-β2-glicoproteína I1.
En 1999 se establecieron los Criterios de Sapporo para la clasificación del SAF, no siendo criterios diagnósticos. Fueron actualizados en 2006 y, aunque se ha sugerido su adaptación a la edad pediátrica suprimiendo el criterio obstétrico2, dicha propuesta está pendiente de validación (tabla 1).
Adaptación pediátrica de los actuales criterios de clasificación del síndrome antifosfolípido en adultos
| Criterios clínicos |
| Trombosis vascular: – ≥1 episodio clínico a nivel arterial, venoso o pequeño vaso en cualquier tejido u órgano confirmado objetivamente mediante criterios validados |
| Criterios de laboratorio |
| – Anticuerpos anticardiolipina IgG o IgM en suero o plasma, presentes a título medio o alto (más de 40 unidades de IgG o IgM mayor del percentil 99) en 2 o más ocasiones separados al menos 12 semanas – Anticoagulante lúpico en plasma en 2 o más ocasiones separados por 12 semanasa – Anti-2-glicoproteína IgG y/o IgM isotipo en suero o plasma (>percentil 99) en 2 o más ocasiones, con al menos 12 semanas de diferencia |
Síndrome antifosfolípido: si al menos cumple un criterio clínico y un criterio analítico. No se puede diagnosticar si el criterio analítico y la manifestación clínica están separados por menos de 12 semanas o más de 5 años.
Detectados según las guías de la Sociedad Internacional en Trombosis y Hemostasia:
– Alargamiento de la coagulación dependiente de fosfolípidos demostrado por un test de screening (TTPa, tiempo de caolín, test de veneno de víbora de Russell diluido, TP, tiempo de texarina).
– No se corrige el alargamiento de los tiempos de coagulación mezclándolo con plasma normal pobre en plaquetas.
– Se corrige el alargamiento de los tiempos de coagulación con el test de screening que añade fosfolípidos.
– Exclusión de otras coagulopatías (por ejemplo, inhibidor del factor VIII o heparina).
Fuente: tomada de Aguiar et al.2.
Presentamos los casos de 2 pacientes con trombocitopenia refractaria al tratamiento convencional y títulos muy elevados de anticuerpos antifosfolípidos, que respondieron rápida y persistentemente a la administración de rituximab (RTX).
Paciente 1Adolescente mujer de 13 años de edad con antecedentes de trombocitopenia extremadamente córtico-dependiente refractaria a gammaglobulina intravenosa (GGIV), que asociaba intermitentemente neutropenia (valor mínimo: 600 neutrófilos/μl) y linfopenia (valor mínimo: 500/μl). El medulograma, estudio de autoinmunidad y cuantificación del complemento fueron normales. Al décimo mes de evolución presentó, además de trombocitopenia, prolongación significativa del TTPa (78s, valores de referencia: 26-38s) con anticoagulante lúpico, anticardiolipina IgG (>160U/ml) y anti-ß2-GPI IgG positivos (>160U/ml), confirmándose 12 semanas después. Como clínica asociada presentó artralgias y cefalea, siendo su exploración física, neurológica y pruebas de imagen normales.
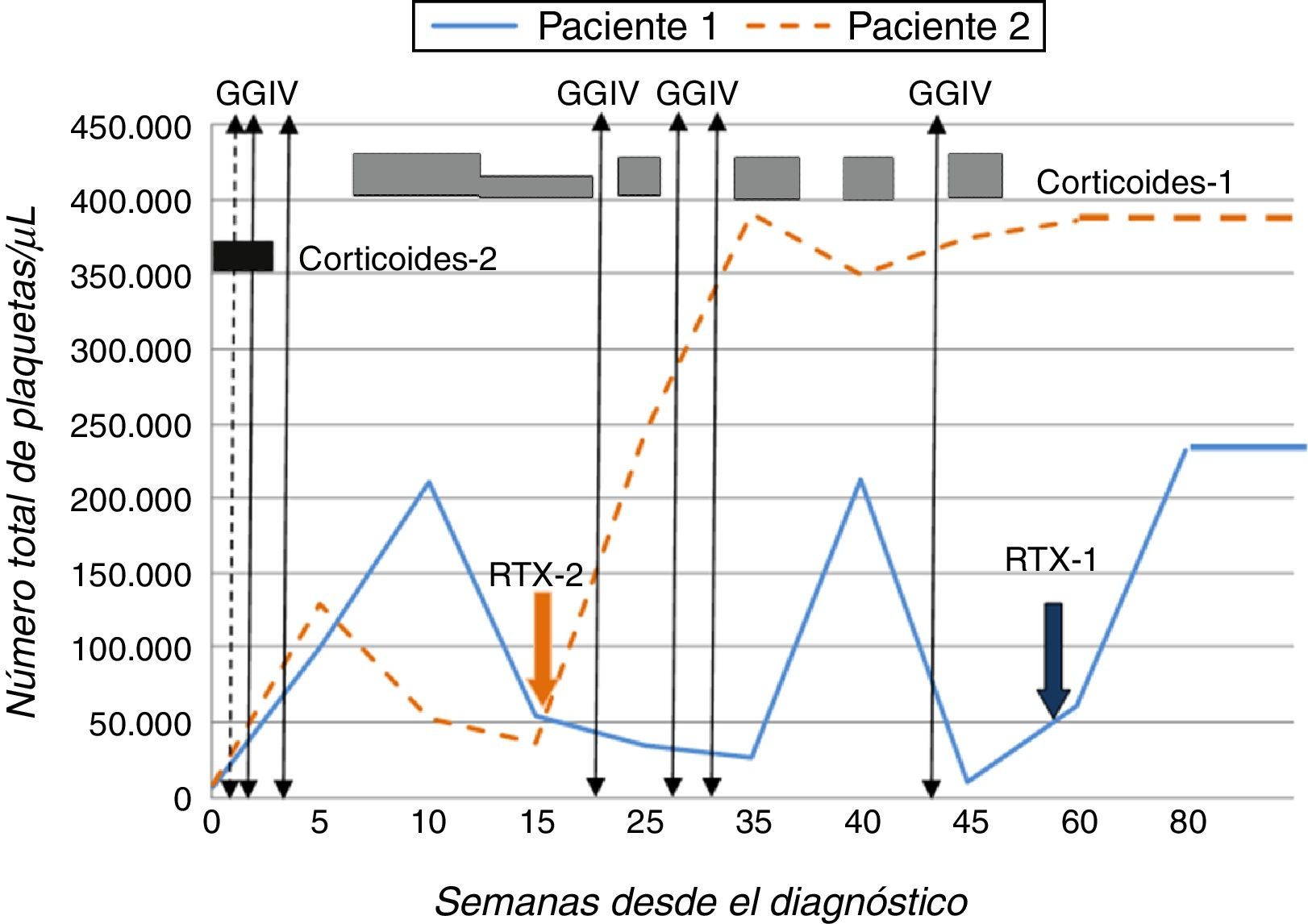
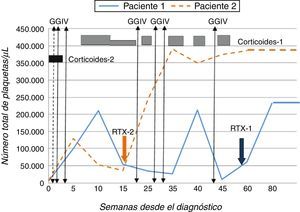
Dada la refractariedad a la terapia convencional se inició, partiendo de 10.000 plaquetas/μl, RTX3 a 375mg/m2/semana durante 4 semanas, con buena tolerancia. Desde la tercera semana de tratamiento se objetivó normalización de la cifra de plaquetas (>140.000/μl) (fig. 1).
Paciente 2Adolescente varón de 14 años de edad que presentó púrpura y equimosis en contexto de trombocitopenia (8.000 plaquetas/μl), prolongación del TTPa (>100s) y presencia de anticoagulante lúpico y anticuerpos anticardiolipina IgG (>160U/ml) y anti-ß2-GPI IgG (>160U/ml) confirmados transcurridas 12 semanas. Se administraron 2 dosis de prednisona sin respuesta, recibiendo posteriormente GGIV con elevación plaquetaria transitoria. Dada la evolución y experiencia previa, y objetivando cifras de 30.000 plaquetas/μl se inició RTX a la dosis empleada anteriormente, obteniendo adecuada respuesta (fig. 1).
Ninguno de los pacientes presentó eventos trombóticos, livedo reticularis, fenómeno de Raynaud, síntomas o signos compatibles con lupus eritematoso sistémico u otra enfermedad autoinmune sistémica, ni tuvieron complicaciones hemorrágicas en su evolución. La valoración cardiológica, oftalmológica y ecografía abdominal realizadas antes de recibir RTX fueron asimismo normales.
Una vez se confirmó que las plaquetas se mantenían en cifras estables se inició antiagregación con ácido acetilsalicílico (100mg/día) en ambos pacientes, dado el riesgo de presentar fenómenos trombóticos2,4. Tras un seguimiento de 20 y 10 meses, respectivamente y habiendo recibido un único ciclo de tratamiento con RTX, los 2 pacientes continúan manteniendo recuentos plaquetarios normales, sin asociar efectos adversos, y con títulos decrecientes de anticuerpos antifosfolípidos.
Aunque la característica más distintiva del SAF son las trombosis, especialmente la trombosis venosa recurrente, otras manifestaciones clínicas denominadas «no clásicas»4, no incluidas en los criterios de clasificación, han sido bien definidas. Estas incluyen alteraciones neurológicas (migraña, corea), manifestaciones dermatológicas (livedo reticularis, fenómeno de Raynaud), alteraciones valvulares cardiacas, microangiopatía renal y trastornos hematológicos (trombocitopenia inmune, anemia hemolítica), siendo estos hallazgos «no clásicos» más frecuentes en la población pediátrica que en adultos1, al contrario que las manifestaciones trombóticas2.
La primera línea de tratamiento de la trombocitopenia inmune, corticoides asociados o no a GGIV, resulta eficaz en el 60-80% de los pacientes. Cuando no se obtiene respuesta se han propuesto como tratamientos alternativos inmunoglobulina anti-D (pacientes Rh+) o esplenectomía, que presentan limitaciones y hacen necesaria la búsqueda de nuevas opciones terapéuticas3,5.
RTX es un anticuerpo monoclonal quimérico que se une al antígeno CD20. Provoca una rápida y duradera eliminación de linfocitos B periféricos, pudiendo utilizarse en el tratamiento de trastornos del sistema inmune, mediados por autoanticuerpos, incluyendo la trombocitopenia autoinmune6. Se desconoce si en caso de repoblación de linfocitos B sería necesario repetir el procedimiento.
Hasta la fecha ha presentado una adecuada eficacia y seguridad, siendo preciso una estrecha vigilancia por sus posibles efectos adversos5,6, que aunque infrecuentes, son graves como la leucoencefalopatía multifocal progresiva.
En conclusión, según aumenta la utilización de RTX en el tratamiento de trombocitopenias refractarias asociadas a anticuerpos antifosfolípidos en pacientes pediátricos, se aprecia que es una alternativa efectiva5,6. Su empleo precoz podría evitar, entre otros, los efectos adversos derivados del uso prolongado de esteroides.