Evaluar la prevalencia de prescripciones en condiciones no autorizadas (off-label y unlicensed) en una Unidad de Cuidados Intensivos Neonatales (UCIN) y definir qué características de los neonatos se asocian a un mayor uso de fármacos en estas condiciones.
Material y métodosEstudio observacional prospectivo en una UCIN nivel III-C durante un periodo de 6 meses. Se evaluó la condición de uso de cada fármaco, tomando como referencia su ficha técnica. Se utilizó un algoritmo secuencial para la clasificación de las prescripciones en: aprobadas, unlicensed u off-label (por edad, por indicación, por vía de administración, y por dosis).
ResultadosSe incluyeron 84 pacientes y 564 prescripciones. Un total de 127 prescripciones fueron consideradas off-label y 45 unlicensed; lo cual supuso el 22,5% y el 8% del total, respectivamente. El 59,5% de los pacientes recibieron al menos un fármaco en una de estas condiciones, ascendiendo este porcentaje al 100% en los grandes prematuros y en los pacientes quirúrgicos (p<0,001). Se encontró una correlación lineal positiva entre la estancia en UCIN y el número de prescripciones off-label (coeficiente de correlación 0,6 p<0,001).
ConclusionesLa prescripción de fármacos en condiciones no autorizadas es habitual en UCIN, siendo especialmente frecuente en los pacientes con mayor vulnerabilidad. Estos resultados ponen de manifiesto la necesidad de avanzar en la investigación y homogeneizar la información existente sobre los fármacos en neonatología, con el objetivo de realizar una prescripción eficaz y segura.
To evaluate the prevalence of non-approved prescriptions (off-label and unlicensed) in a Neonatal Intensive Care Unit (NICU), and to describe factors of the neonate associated with its use.
Materials and methodsObservational prospective study in a level III NICU during a 6-month period. Every prescription was analysed using the summary of product characteristics as a reference. A sequential algorithm was used to create a classification of prescriptions based on current status: approved, unlicensed, off-label (by age, route of administration, dosage, or indication).
ResultsThe study included 84 patients and 564 prescriptions. A total of 127 (22.5%) prescriptions were considered off-label, and 45 (8%) were considered unlicensed. More than half (59.5%) of the patients received at least one of these drugs, and this increases to 100% among very preterm neonates and surgical patients (P<.001). A positive linear correlation was found between duration of NICU stay and the number of off-label prescriptions (correlation coefficient 0.6; P<.001).
ConclusionsNon-licensed drugs are frequently prescribed in NICU, especially in the most vulnerable patients. Our results show the need to move forward on clinical research in order to homogenise the existing data about neonatology drugs, with the aim of making an efficient and safe prescription.
Los recién nacidos son un grupo de pacientes especialmente vulnerable, sobre todo aquellos que precisan cuidados intensivos, que son además los que requieren un mayor número de tratamientos farmacológicos1–3. Sin embargo, el uso de medicamentos en población neonatal frecuentemente no está respaldado por ensayos clínicos específicos, sino por extrapolaciones de la evidencia conocida sobre seguridad y eficacia en adultos o en series de casos pediátricos4–6.
El acceso a medicamentos en situaciones especiales está contemplado por el Real Decreto 1015/2009 en tres circunstancias: uso en investigación, acceso a medicamentos extranjeros, y uso en condiciones diferentes a las autorizadas7. Dentro de este último grupo, tanto el uso off-label (fuera de ficha técnica) como determinadas condiciones de los fármacos unlicensed (sin licencia) como la modificación de la fórmula farmacéutica aprobada o el uso de fórmulas magistrales, son especialmente frecuentes en Pediatría8,9, pero los estudios específicos en población neonatal son más escasos. La prescripción de fármacos en condiciones no aprobadas tiene importancia desde el punto de vista legal y clínico, dado que se ha relacionado con un aumento de riesgo de efectos adversos tanto en adultos como en población pediátrica10,11.
Diseñamos un estudio observacional prospectivo con el objetivo principal de estudiar la prevalencia de prescripciones fuera de ficha técnica (FFT) en una Unidad de Cuidados Intensivos Neonatales (UCIN). Como objetivo secundario planteamos buscar qué características de los neonatos predisponen al uso de medicamentos off-label y unlicensed.
Material y métodosSe realizó un estudio observacional de seguimiento prospectivo en una UCIN nivel III-C (el de mayor complejidad según los estándares de la Sociedad Española de Neonatología) de un hospital universitario de la red pública española.
El estudio se llevó a cabo durante seis meses consecutivos (abril a septiembre de 2018), recogiendo los datos de todos aquellos pacientes ingresados en UCIN de los cuales sus padres/madres/tutores firmaron el consentimiento informado. Obtuvimos un 100% de participación, con lo que la muestra fue de 564 prescripciones de 85 fármacos diferentes en 84 pacientes. Este tamaño muestral permite estimar la prevalencia de prescripciones FFT con una seguridad del 95% y una precisión de±4%, para el total de la población de neonatos atendidos en UCIN. Todas las variables fueron registradas en dos cuadernos de recogida de datos, usando como fuente las historias clínicas digitales.
La consideración de una prescripción como off-label o unlicensed se realizó en base a la ficha técnica aprobada por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) y/o Agencia Europea del Medicamento (EMA)12. En aquellos casos en los que la ficha técnica no estaba disponible o su información resultaba ambigua, se consultaron otras bases de datos, principalmente Pediamecum®, del Comité de Medicamentos de la Asociación Española de Pediatría13 y Botplus®, del Consejo General de Colegios Farmacéuticos, llegando a un acuerdo entre el equipo investigador para la clasificación de cada fármaco.
Según un consenso previo14, se consideró unlicensed el uso de cualquier medicamento sin autorización de comercialización europea como producto medicinal de uso en humanos. También determinamos, al igual que otros estudios previos15, que esto incluía las fórmulas magistrales de preparación hospitalaria. Se consideró off-label el uso de cualquier fármaco comercializado en condiciones no autorizadas en la ficha técnica (teniendo en cuenta la indicación, el grupo de edad, la vía de administración y la dosis). Para su clasificación de utilizó un algoritmo secuencial previamente descrito15.
Cada fármaco se codificó según la clasificación Anatomical Therapeutic Chemical Classification system (ATC) de la Organización Mundial de la Salud16. No se incluyeron en el estudio los hemoderivados, la nutrición parenteral y/o enteral, el oxígeno ni la sueroterapia.
Dentro de los fármacos off-label o unlicensed, se recogió si existe actualmente un Plan de Investigación Pediátrico de la EMA, lo que consiste en planes de desarrollo aprobados por el Comité Pediátrico de la EMA destinados a garantizar que se obtengan los datos necesarios para respaldar la autorización de un medicamento para niños mediante estudios específicos en esta población.
Previo al inicio del estudio, se solicitó la clasificación del estudio por la AEMPS y se obtuvo la aprobación por parte del Comité de Ética de Investigación de referencia.
Se realizó un análisis descriptivo de todas las variables, expresando las variables cuantitativas como media±desviación típica y mediana; y las variables cualitativas como valor absoluto y porcentaje. Se determinó la prevalencia de prescripciones FFT junto con su 95% intervalo de confianza (IC). Se estudió la asociación de variables cualitativas con el test chi cuadrado. Se realizó la comparación de medias, tras comprobar la normalidad con el test de Kolmogorov-Smirnov, entre 2 grupos con el test U de Mann-Whitney. La comparación de medias para más de 2 grupos se realizó con el test de Kruskall-Wallis. Se estudió la asociación de variables cuantitativas con el coeficiente de correlación de Spearman. Se consideraron significativos valores de p<0,05, con un planteamiento bilateral. Todos los análisis se realizaron con el programa estadístico SPSS v.19.0.
ResultadosSe analizaron 564 prescripciones de 85 fármacos diferentes en 84 pacientes. Las características basales de los pacientes se reflejan en la tabla 1.
Análisis descriptivo de los pacientes n=84
| Variable | n (%) |
|---|---|
| Sexo | |
| Varón | 52 (61,9) |
| Mujer | 32 (38,1) |
| Edad gestacional | |
| <32 semanas | 17 (20,2) |
| ≥ 32 semanas y <37 semanas | 30 (35,7) |
| ≥ 37 semanas | 37 (44) |
| Diagnóstico principal | |
| Prematuridad | 35 (41,7) |
| Distrés respiratorio | 13 (15,5) |
| Cardiopatía congénita | 10 (11,9) |
| Patología digestiva | 4 (4,8) |
| Patología neurológica | 2 (2,4) |
| Sepsis | 5 (6) |
| Enfermedad hemolítica | 3 (3,6) |
| Malformación urológica | 3 (3,6) |
| Otros | 9 (10,7) |
| Tipo de paciente | |
| Médico | 70 (83,3) |
| Quirúrgico | 14 (16,7) |
| Estancia | |
| <7 días | 51 (60,7) |
| >7 días | 33 (39,3) |
| Éxitus | 1 (1,2) |
El número medio de prescripciones por paciente fue de 6,7±6,3 (mediana 4). El mínimo de prescripciones por paciente fue uno y el máximo 43.
Del total de las prescripciones (FFT y aprobadas), los fármacos utilizados más frecuentemente fueron el gluconato cálcico (12,4% de las prescripciones totales), calcio oral (8,7%), ampicilina (7,6%) y gentamicina (7,1%).
Atendiendo a la condición de uso de los fármacos, 127 (22,5%) prescripciones (95% IC=19%-26%) de 35 fármacos diferentes fueron off-label. La media de prescripciones off-label por paciente fue de 1,5±2,4 (mediana=1). Mientras que 45 (8%) prescripciones (95% IC=5,6-10,3%) de 15 fármacos distintos se clasificaron como unlicensed. La media de prescripciones sin licencia por paciente fue de 0,6±1 (mediana=0). Esto supone que el 59,5% de los pacientes (n=50; 95% IC=48,4-70,6%) recibió alguna prescripción en condiciones diferentes a las aprobadas (el 57,1% de ellos recibe al menos una prescripción off-label y el 32,1% al menos una unlicensed).
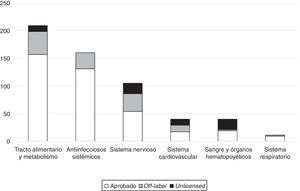
La principal causa por la que una prescripción fue off-label fue la edad (55,1%), seguido de la indicación (41,7%). Únicamente 3 prescripciones lo fueron por dosis (el 2,4%); y solamente una (el 0,8%) se consideró off-label por vía de administración. Los fármacos más frecuentemente prescritos en condiciones off-label y unlicensed están reflejados en la tabla 2. La clasificación de los fármacos off-label según el grupo ATC se refleja en la figura 1. Un 34,6% de prescripciones off-label y un 20% de las unlicensed correspondían a fármacos que sí tienen Plan de Investigación Pediátrico de la EMA.
Fármacos más utilizados en UCIN por condición de uso
| Condición de uso | Fármacos | Vía de administración | Total de prescripcionesn (%)* | Motivo de uso off-label/unlicensed |
|---|---|---|---|---|
| Off-label | Fentanilo | Intravenosa | 18 (14,2) | Edad |
| Vitamina E | Oral | 17 (13,4) | Indicación | |
| Cefazolina | Intravenosa | 15 (11,8) | Edad | |
| Ranitidina | Intravenosa | 13 (10,2) | Indicación(6)/ edad(7) | |
| Paracetamol | Intravenosa | 10 (7,9) | Edad | |
| Fluconazol | Intravenosa | 9 (7,1) | Indicación(6)/ edad(3) | |
| Dopamina | Intravenosa | 7 (5,5) | Edad | |
| Meropenem | Intravenosa | 3 (2,4) | Edad | |
| Dexametasona | Intravenosa | 3 (2,4) | Indicación | |
| Adrenalina | Intravenosa | 3 (2,4) | Indicación | |
| Fibrinógeno | Intravenosa | 2 (1,6) | Indicación | |
| Insulina | Intravenosa | 2 (1,6) | Indicación | |
| Biotina | Oral | 2 (1,6) | Indicación | |
| Piridoxina | Oral | 2 (1,6) | Indicación | |
| Unlicensed | Cafeína | Oral | 14 (31,1) | Fórmula magistral |
| Espironolactona | Oral | 5 (11,1) | Fórmula magistral | |
| Fosfato | Oral | 5 (11,1) | Fórmula magistral | |
| Ranitidina | Oral | 5 (11,1) | Fórmula magistral | |
| Morfina | Oral | 3 (6,7) | Fórmula magistral | |
| Propranolol | Oral | 2 (4,4) | Fórmula magistral | |
| Hidrato de cloral | Rectal | 2 (4,4) | Fórmula magistral | |
| AAS | Oral | 2 (4,4) | Fórmula magistral |
En la tabla 3 se presenta el análisis bivariado de los factores asociados a la prescripción off-label. El hecho de ser un paciente quirúrgico o gran prematuro, así como tener un ingreso en UCIN mayor o igual a una semana, se asoció significativamente a una mayor frecuencia de prescripciones off-label. No se encontraron diferencias entre el sexo y la frecuencia de prescripciones en condiciones off-label. Además, se encontró una correlación lineal positiva entre la estancia en UCIN y la frecuencia de prescripciones off-label (coeficiente de correlación 0,6 p<0,001).
Análisis de las prescripciones off-label en función de las características de los pacientes
| Número de pacientes con al menos una prescripción off-labeln (%)* | p-valor | Número prescripciones off-label por pacienteMedia±DE | p-valor | |
|---|---|---|---|---|
| Edad gestacional | ||||
| <32 semanas | 17 (100) | <0,001 | 2,47±1,59 | <0,001 |
| ≥32 semanas y <37 semanas | 7 (23,3) | 0,40±1,33 | ||
| <37 semanas | 24 (64,9) | 1,84±3,17 | ||
| Sexo | ||||
| Varón | 28 (53,8) | 1,54±2,85 | ||
| Mujer | 20 (62,5) | 0,5 | 1,31±1,59 | 0,2 |
| Tipo de paciente | ||||
| Médico | 34 (48,6) | <0,001 | 1,01±1,56 | |
| Quirúrgico | 14 (100) | 3,64±4,34 | <0,001 | |
| Estancia | ||||
| <7 días | 18 (35,3) | 0,65±1,20 | ||
| ≥7 días | 30 (90,9) | <0,001 | 2,70±3,26 | <0,001 |
DE: desviación estándar.
El presente estudio pone de manifiesto que el uso de medicación en condiciones no aprobadas (off-label y unlicensed) es frecuente en la población neonatal crítica, ya que más de la mitad de los neonatos recibieron al menos una prescripción en condiciones diferentes a las autorizadas. Este porcentaje ascendió hasta el 100% en los pacientes grandes prematuros y en los pacientes quirúrgicos.
El hecho de usar un medicamento FFT no solo dificulta su conocimiento y uso clínico, sino que trae consigo un aumento del riesgo de eventos adversos. Esto ocurre tanto en población pediátrica, con un aumento del riesgo relativo de 3,44 en relación con el uso autorizado10, como en adultos11. Es probable que este efecto se observe también en población neonatal. A pesar de que existen pocos estudios en una población tan concreta como la de los pacientes neonatales críticos, todos reflejan que el uso de fármacos en condiciones diferentes de las autorizadas es muy común en estos pacientes. En los distintos estudios, el porcentaje de prescripciones off-label osciló entre el 12% y el 87%; y entre el 4% y el 19% en las unlicensed5,6,17–28,29.
La metodología usada en cada estudio para clasificar una prescripción como off-label no es un tema menor, y muy probablemente sea uno de los motivos por los cuales la literatura muestra resultados tan distintos en estudios aparentemente similares. En el año 2017, García-López et al., publicaron en Anales de Pediatría su estudio sobre una muestra de 42 pacientes pediátricos críticos en el cual usaron un algoritmo secuencial para clasificar las prescripciones según el motivo que los convierte en off-label o unlicensed15. La publicación de ese interesante estudio supuso el estímulo que nos llevó a analizar los datos de una forma similar en población neonatal, por lo que en nuestra muestra usamos el mismo esquema escalonado de clasificación de los fármacos.
En la clasificación de los fármacos como off-label por edad, nuestros criterios fueron probablemente más laxos que otros estudios previos. Lass et al.19 (Estonia, 2011), Neubert et al.22 (Alemania, 2010), Dell’Aera et al.27 (Italia, 2007) consideraron aprobadas aquellas prescripciones para las que la ficha técnica especificaba su uso en neonatos o prematuros, según el caso; y si no lo especificaba las consideraron off-label por edad. Nosotros, sin embargo, consideramos solo off-label por edad los casos en los que la ficha técnica contraindicaba su uso en neonatos, o aquellos en los que se hacía especificaciones por grupos de edad y no se incluía la edad neonatal, pero cuando se referían a «población pediátrica» sin hacer más distinciones lo consideramos como aprobado.
Otro dato a tener en cuenta es que, si únicamente hubiésemos utilizado la ficha técnica de la AEMPS para la clasificación de los fármacos, el porcentaje de prescripciones no aprobadas hubiera sido mayor; ya que fármacos frecuentemente prescritos no disponen de una ficha técnica en la base de datos CIMA. En otras ocasiones, los datos eran ambiguos en la ficha técnica de la AEMPS, lo que nos obligó a consultar otras bases de datos como Pediamecum® o Botplus® y, en algunas ocasiones, a tomar una decisión de consenso dentro del equipo investigador acerca de la condición de las prescripciones. Por citar algún ejemplo controvertido, la ficha técnica de la furosemida parenteral dice, textualmente: «En lactantes y en niños menores de 15 años, la administración parenteral de furosemida (eventualmente perfusión lenta) solo se efectuará en casos que comporten riesgo vital». Consideramos que el término «riesgo vital» es muy ambiguo, ya que los pacientes que recibieron este fármaco no estaban en una situación de riesgo de muerte inminente si no se les administraba el fármaco, pero sí lo necesitaban de algún modo para alcanzar una evolución favorable en el contexto de una situación crítica, bajo esta premisa nuestro equipo investigador lo consideró como aprobado. Otro ejemplo es el caso de la amikacina, para la cual la ficha técnica de la AEMPS recoge la sepsis neonatal como indicación aprobada y no hace ninguna limitación por edad, pero sin embargo en Pediamécum® dice expresamente que su uso debe ser considerado off-label en todos los neonatos. Ciñéndonos a la ficha técnica lo consideramos aprobado, pero es destacable el hallazgo de información contradictoria al buscar en dos bases de datos frecuentemente utilizadas en la práctica habitual.
Estos ejemplos, y otros no mencionados, ponen de manifiesto las grandes dificultades que nos hemos encontrado para la clasificación de los fármacos según su condición de uso. Tras comparar nuestro trabajo con otros similares, hemos observado que la sistemática que se utiliza es determinante con respecto a los resultados que se obtienen. Creemos que esta es una gran limitación en nuestro estudio y en cualquier otro trabajo parecido que pueda llevarse a cabo en nuestro medio, pero al mismo tiempo es un hallazgo de gran interés, ya que refleja la necesidad de estandarizar las fichas técnicas y hacer hincapié en que estas recojan la información concerniente a la población pediátrica –y en concreto, la neonatal–, de manera más clara y ordenada.
En el ámbito internacional, los resultados de los estudios muestran porcentajes generalmente más altos de prescripciones no aprobadas. En los trabajos de Avenel et al. (Francia)6 y Conroy et al. (Reino Unido)23, ambos llevados a cabo en 1998, se registraron unos porcentajes de 64% off-label y 10% unlicensed; y 55% off-label y 10% unlicensed, respectivamente. La diferencia de dos décadas entre la realización de estos estudios y el nuestro, dificulta la comparación de resultados. Por otra parte, la menor edad gestacional de la población de algunos estudios también es otro factor que probablemente haya reflejado un mayor número de prescripciones no aprobadas en sus resultados finales6,20,24,25. Por ejemplo, O’Donnell et al.20 (Australia en el año 2001) encontraron que un 47% de las prescripciones eran utilizadas de forma off-label y un 11% unlicensed, pero sus pacientes tenían una mediana edad gestacional de 31 semanas, versus 35+6 semanas en nuestro estudio.
A nivel nacional, en 2016 Blanco-Reina et al.30 publicaron los resultados de su estudio realizado en una Unidad de Cuidados Intensivos Neonatales y Pediátricos de Granada, en el que encontraron un 52% de prescripciones off-label sobre una muestra de 601 prescripciones y 81 pacientes. En 2017, como ya se ha mencionado, García-López et al.15 analizaron 696 prescripciones en 42 pacientes en una Unidad de Cuidados Intensivos Pediátricos de un hospital de Madrid; observando unas proporciones de 54% off-label y 9% unlicensed. La principal diferencia con nuestra muestra es el hecho de que ambos estudios incluyen pacientes de edades hasta los 14 y 18 años, poco comparables con el perfil exclusivamente neonatal del nuestro. Arocas-Casañ et al.29 en 2017 (UCIN Hospital de Murcia, 41 pacientes y 273 prescripciones), obtuvo un 41% de prescripciones off-label y 5,5% unlicensed, aunque existen algunas diferencias en la consideración de algunas prescripciones como no aprobadas respecto a nuestro estudio.
Un hallazgo común a la mayoría de los estudios es que el grupo más frecuentemente utilizado en condiciones off-label fueron los antiinfecciosos17–19,22,23,26,29, sin embargo en nuestro estudio el mayor porcentaje corresponde a fármacos pertenecientes al tracto alimentario y metabolismo (el 32% de las prescripciones off-label). Este hallazgo probablemente se deba al importante porcentaje que ocupan fármacos como la vitamina E (considerada off-label por indicación en nuestro grupo y ampliamente usada en prematuros) y la ranitidina (considerada off-label por indicación o por edad según las condiciones y de uso frecuente en población neonatal), ambos tratamientos incluidos dentro de este grupo farmacológico. Otros de los fármacos que con más frecuencia se consideraron FFT fueron aquellos con acción sobre el sistema nervioso central17,20,22,26, los cuales también representan un porcentaje importante en nuestro estudio (la cuarta parte del total de prescripciones off-label), solamente superados por fármacos del tracto alimentario y metabolismo.
Un aspecto interesante es el hecho de que el uso de fármacos en condiciones no aprobadas sea más frecuente en situaciones de mayor vulnerabilidad, como en grandes prematuros (ya reflejado en estudios previos18,22) o pacientes sometidos a una cirugía mayor durante su ingreso, lo cual constituye un fenómeno frecuente en neonatología, en el que los pacientes más graves son además los que reciben tratamientos de mayor riesgo.
De forma general, los estudios analizados expresan la problemática del uso no autorizado de medicamentos en neonatos. Las diferencias encontradas probablemente se deban a la heterogeneidad de los estudios en cuanto a las razones ya expuestas (diferencias de clasificación de los fármacos como no aprobados, variaciones en la edad gestacional, desiguales momentos históricos…etc.), pero también hay que tener en cuenta la variabilidad causada por la zona geográfica, ya que esta influye en las fichas técnicas consultadas y en las patologías que presentan mayoritariamente los pacientes de cada estudio (prematuridad en Francia6,24 –igual que en nuestro estudio–, hiperbilirrubinemia en Estonia19, y distrés respiratorio y sepsis en India26).
LimitacionesNuestro estudio presenta algunas limitaciones. La más relevante es la ausencia de una forma universal de clasificar los fármacos como off-label ya comentada con anterioridad, y sobre todo la falta de concreción en las fichas técnicas de muchos fármacos a la hora de especificar las indicaciones, grupos de edad o dosis aprobadas para su uso. Otra limitación es el hecho de que el estudio se ha llevado a cabo en una sola unidad neonatal, que además presenta unas características diferenciadoras en cuanto a la mayor presencia de pacientes con cardiopatías congénitas complejas al ser nuestro hospital centro de referencia en Cirugía Cardiaca neonatal (esto podría suponer una sobrerrepresentación de este tipo de pacientes de mayor riesgo, y conllevar un sesgo del estudio). Por otro lado, nuestro trabajo se planteó como una exploración inicial de la prevalencia de prescripciones off-label, por lo que no se analizaron los efectos adversos asociados a la utilización de fármacos no aprobados ni la posibilidad de que estas prescripciones fuesen sustituidas por otras en condiciones aprobadas, datos que podrían resultar de interés y que se tendrán en cuenta para nuevas investigaciones.
ConclusionesUn importante porcentaje de las prescripciones realizadas en cuidados intensivos neonatales son realizadas en condiciones no aprobadas (off-label o unlicensed), lo que supone que más de la mitad de los pacientes reciben algún tratamiento en estas condiciones, siendo especialmente frecuente en poblaciones más vulnerables como los grandes prematuros. Creemos que resulta imprescindible aclarar y homogeneizar la información existente sobre los fármacos en población neonatal, así como la necesidad de monitorizar reacciones adversas y establecer registros de calidad para poder garantizar tratamientos seguros y eficaces en un adecuado marco ético y legal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.