El análisis del líquido sinovial (LS) es una herramienta importante en el diagnóstico de pacientes con artritis idiopática juvenil (AIJ).
Pacientes y métodosAnálisis retrospectivo de las características citológicas del LS obtenido de pacientes con AIJ en el periodo 2008-2016.
ResultadosSe analizaron 102 LS de 59 pacientes. El 66% fueron mujeres y la forma clínica más frecuente fue la AIJ oligoarticular persistente (52,5%). La mediana de edad al inicio fue de 5 años (RIC 2,4-11,8). El LS generalmente era de características inflamatorias (mediana leucocitos 11.757/mm3; RIC 4.543-18.800) con predominio de polimorfonucleares (PMN, 61%; RIC 30-75). Ocho pacientes (14%) presentaron recuentos inferiores a 2.000cél/mm3, con predominio de mononucleares (80%), mientras que 3 pacientes (5%) presentaron recuentos superiores a 50.000cél/mm3, con predominio de PMN (90%). No se encontraron diferencias en los recuentos celulares entre las distintas formas de AIJ. La mediana del recuento de leucocitos de pacientes positivos para ANA fue un 20% inferior a la de niños negativos para ANA (9.340 vs. 11.600/mm3; p=0,23). La proporción de PMN en LS tendía a aumentar conforme se incrementaba la VSG (p<0,001) y/o la PCR (p=0,03). No existe correlación del índice JADAS-10 con el recuento en LS (p=0,4). El LS en artrocentesis simultáneas de diferentes articulaciones mostró una correlación significativa (p=0,001).
ConclusionesEl LS de pacientes con AIJ generalmente tiene características inflamatorias, aunque un 19% presentó recuentos inferiores a 2.000 o superiores a 50.000cél/mm3. Los recuentos en pacientes positivos para ANA tendían a ser menores que en los negativos para ANA (no significativo). La proporción de PMN aumentaba con los reactantes.
Synovial fluid (SF) analysis is an important tool for the diagnosis of patients with juvenile idiopathic arthritis (JIA).
Patients and methodsA retrospective analysis was carried out of cytological features of SF samples obtained from patients with JIA during the period 2008-2016.
ResultsA total of 102 SF samples from 59 patients were analysed. JIA was more common in females (66%). The most frequent form was persistent oligoarticular JIA (52.5%). The median age at onset was 5 years (IQR 2.4-11.8). SF usually showed an inflammatory pattern (median white blood cells count 11,757/mm3; IQR 4,543-18,800), with a predominance of polymorphonuclear (PMN) cells (61%; IQR 30-75). Eight patients (14%) had white blood cells counts of less than 2,000 cells/mm3, with predominance of mononuclear cells (80%), whereas 3 patients (5%) had white blood cells counts higher than 50,000 cells/mm3, with a predominance of PMN cells (90%). Synovial white blood cells count did not show significant differences among the different forms of JIA. The median synovial white blood cells count in ANA-positive patients was 20% lower than in ANA-negative (9,340 vs. 11,600/mm3; P=.23). The proportion of PMN increased with increasing levels of ESR (P<.001) and/or CRP (P=.03). No significant correlation was found between JADAS-10 and synovial white blood cells count (P=.4). SF obtained from different joints in simultaneous arthrocentesis showed a significant correlation P=.001).
ConclusionSF from JIA patients usually had inflammatory characteristics, although 19% of the patients showed white blood cells counts below 2,000cells/mm3 or higher than 50,000cells/mm3. SF cell count was non-significantly lower in ANA-positive patients, and the proportion of PMN increased with increasing levels of ESR/CRP.
La artritis idiopática juvenil (AIJ) es la enfermedad reumática crónica más frecuente en Pediatría. El término AIJ engloba todas las formas de artritis crónica pediátrica, por lo que comprende un grupo heterogéneo de entidades con distintas características clínicas e inmunogenéticas. Estas diferencias determinan que tanto el tratamiento como el pronóstico o la evolución a largo plazo de las distintas formas clínicas sean diferentes1,2.
La Liga Internacional de Asociaciones de Reumatología propuso en 1994 unos nuevos criterios de clasificación de las artritis pediátricas para evitar la confusión generada por la utilización de distintos criterios para referirse a la misma enfermedad a un lado del Atlántico (artritis crónica juvenil) u otro (artritis reumatoide juvenil), acuñando el nuevo término de AIJ. Estos criterios se han revisado en 2 ocasiones, la última en 20013. La Liga Internacional de Asociaciones de Reumatología estableció 7 categorías: forma sistémica, oligoarticular (afectación de 4 o menos articulaciones), poliarticular (inflamación de 5 o más articulaciones, clasificada a su vez según la presencia de factor reumatoide [FR] en FR positivo o negativo), artritis psoriásica, artritis relacionada con entesitis (ArE) y artritis indiferenciada.
El análisis del líquido sinovial (LS) y, en concreto, el recuento celular constituye una herramienta importante para la caracterización de la artritis, permitiendo diferenciar procesos inflamatorios de no inflamatorios con base en la cifra total de leucocitos y de su porcentaje diferencial4,5. Los pacientes con AIJ, sin embargo, pueden presentar cierta variabilidad en las características del LS en función del número de articulaciones afectadas6.
El objetivo del estudio es definir las características citológicas del LS en pacientes diagnosticados de AIJ. Se analizó también si existían diferencias en las características del LS: 1) de acuerdo con el número de articulaciones afectadas; 2) entre líquidos obtenidos el mismo día de distintas articulaciones del mismo paciente, y 3) entre LS obtenidos en distintas fechas en los mismos pacientes.
Pacientes y métodosSe realizó un estudio retrospectivo, observacional, descriptivo y transversal de todos los pacientes diagnosticados de AIJ en el Hospital Universitario 12 de Octubre en quienes se obtuvo suficiente LS en el momento del diagnóstico y/o en las recaídas para permitir realizar un estudio citológico completo durante el periodo comprendido entre el 1 de marzo de 2008 y el 28 de febrero de 2016. El diagnóstico de AIJ se realizó siguiendo los criterios de la Liga Internacional de Asociaciones de Reumatología3,7.
Para el estudio se revisaron las historias clínicas de estos pacientes, recogiendo datos demográficos (sexo, edad al inicio), clínicos (forma clínica de AIJ, número de articulaciones afectadas, curso clínico, valoración de la enfermedad por el médico y la familia) y analíticos (presencia de anticuerpos antinucleares [ANA], FR y del antígeno HLA-B27, reactantes de fase aguda y características del LS). Con esta información se calculó el índice Juvenile Arthritis Disease Activity Score (JADAS) 10, un índice sintético de actividad de la enfermedad que recoge el número de articulaciones inflamadas, la evaluación global del médico de la actividad de la AIJ medida en una escala visual analógica de 0-10, la evaluación global de la enfermedad según los padres medida en una escala visual analógica de 0-10 y la velocidad de sedimentación globular (VSG)8,9.
Para el análisis de LS se remitieron todas aquellas muestras en las que se obtuvo un mínimo de 2ml para recuento celular, estudio bioquímico y, cuando se consideró indicado, para microbiología. La muestra que se enviaba para citología se remitía en un tubo que contenía ácido etilendiaminotetraacético, realizándose el recuento en las primeras horas para evitar la degeneración celular. En todos aquellos pacientes en los que se obtuvo menos cantidad de LS, principalmente aquellos con monoartritis de tobillo, muñeca y codo, solo se remitió la muestra para microbiología.
En todos los LS se recogieron las características citológicas (número total de leucocitos, porcentaje de polimorfonucleares [PMN] y de mononucleares [MN]), así como la concentración de glucosa y proteínas.
Para la clasificación del LS se siguieron los criterios de la Academia Americana de Reumatología: normal=leucocitos<200/mm3; no inflamatorio o traumático=leucocitos 200-2.000/mm3; inflamatorio=leucocitos 2.000-50.000/mm3, y séptico=leucocitos>50.000/mm310,11.
Se realizó un análisis descriptivo de los datos presentando las variables cuantitativas como valores absolutos, mediana y rango intercuartílico (RIC), mientras que para las variables categóricas se emplearon frecuencias y porcentajes. La normalidad de las variables cuantitativas se comprobó mediante el análisis gráfico de los datos unido al test de Shapiro-Wilk. Para el análisis de las diferencias entre grupos de las variables cuantitativas, se empleó la prueba t de Student o la U de Mann-Whitney, según presentaran o no una distribución normal. Se exploró la relación entre las variables cuantitativas mediante el coeficiente de correlación de Pearson y la rho de Spearman en función de la normalidad de las variables y del análisis gráfico de los datos. Para el estudio estadístico se utilizaron los programas STATA 12.1 (StataCorp, Texas, EE. UU.) y SPSS versión 22.0 (SPSS, Inc., IBM).
ResultadosCaracterísticas demográficas de la población estudiadaDurante el periodo de estudio se obtuvieron un total de 102 LS de 59 pacientes diagnosticados de AIJ.
La enfermedad fue más frecuente en mujeres, 39/59 (66%), excepto en las formas sistémica y ArE (tabla 1). La mediana de edad al inicio de los síntomas fue de 5 años (RIC 2,4-11,8) y al diagnóstico, de 5,1 años (RIC 2,6-12,1). La forma oligoarticular extendida fue la de inicio más temprano, seguida de la indiferenciada; por el contrario, la forma clínica de inicio más tardío fue la ArE.
Características demográficas y analíticas de los pacientes de la serie acuerdo a las distintas categorías de artritis idiopática juvenil
| Categoría ILAR | n (%) | Mujeres (%) | Edad al inicio en años, mediana (RIC) | ANA positivos | FR positivo | HLA-B27 positivo |
|---|---|---|---|---|---|---|
| Oligoarticular persistente | 31 (52,5) | 70,9 | 5 (2,5-10,6) | 3 | - | - |
| Oligoarticular extendida | 4 (6,7) | 100 | 3 (1,9-3,5) | 1 | - | 1 |
| Poliarticular FR negativo | 7 (12) | 71,4 | 11,9 (2-13,6) | 1 | - | - |
| Artritis relacionada con entesitis | 5 (8,7) | 40 | 13,2 (11,1-13,4) | - | - | 5 |
| Artritis psoriásica | 4 (6,7) | 75 | 5,9 (3,2-8,2) | - | - | - |
| Artritis sistémica | 4 (6,7) | 25 | 7,4 (2,8-13) | - | - | - |
| Artritis indiferenciada | 4 (6,7) | 50 | 2,8 (1,3-8,2) | 2 | - | 4 |
| Serie global | 59 (100) | 66,1 | 5 (2,4-11,7) | 7 (12%) | 0 | 10 (17%) |
La forma clínica más frecuente fue la oligoarticular persistente (n=31; 52,5%), seguida por la poliarticular con FR negativo (n=7; 12%). En 7 pacientes (12%) se detectó uveítis anterior crónica (tabla 1).
Un total de 7 pacientes (12%) presentaron ANA en el suero a títulos≥1:160 en 2 muestras separadas al menos por 12 semanas; todos ellos eran menores de 6 años (mediana 24 meses, RIC 18-29). Otros 10 pacientes presentaron positividad para el antígeno HLA-B27, 5 de los cuales presentaban la forma ArE (tabla 1).
Características citológicas del líquido sinovial de la serie y por curso clínicoEl LS de los pacientes con AIJ presentaba una mediana de leucocitos de 11.757/mm3 (RIC 4.543-18.800) con una mediana de PMN del 61% (RIC 30-75). En lo que respecta a sus características bioquímicas, la mediana de glucosa fue de 78,5mg/dl (RIC 65-91) y la de proteínas, de 4,7g/dl (RIC 3,9-5,28).
Ocho de los 59 pacientes (14%) presentaron un recuento celular en la artrocentesis inicial inferior a 2.000cél/mm3 (mediana 739, RIC 374-1.001). Las formas clínicas correspondían a oligoartritis en 5, poliartritis en 2 y ArE en uno. En 7/8 la proporción de MN fue superior al 75%. En todos los casos se realizó Mantoux, siendo la induración de 0mm a las 72h, y se remitió LS para tinción BAAR y cultivo para aerobios, anaerobios y micobacterias, que resultó estéril.
En el otro lado del espectro, 3 pacientes (5%) presentaron recuentos superiores a 50.000 leucocitos/mm3 en el momento del diagnóstico de la enfermedad, todos ellos con un claro predominio de PMN (90%). Cada paciente tenía una forma clínica de AIJ diferente, AIJ de inicio sistémico sin clínica sistémica pero con una poliartritis muy severa persistente, ArE en un varón HLA-B27+ de curso también poliarticular y AIJ oligoarticular. Hay que destacar que los 3 pacientes presentaban, en el momento de la artrocentesis, una gran elevación de reactantes de fase aguda (PCR 12-25mg/dl, VSG 74-120mm).
Al analizar las características del LS de acuerdo con el curso clínico de la AIJ (tabla 2) se observó que los pacientes con oligoartritis presentaban menores recuentos de leucocitos (mediana de 10.310/mm3) que aquellos con poliartritis, cuya mediana era de 15.005/mm3, aunque las diferencias no fueron significativas. Tampoco se detectaron diferencias en la relación de PMN/MN (tabla 2), que era de 2 en la AIJ oligoarticular y de 2,1 en la poliarticular.
Características citológicas de los líquidos sinoviales de acuerdo con el número de articulaciones afectadas y en el global de la serie
| Variable | Curso oligoarticular(n=41) | Curso poliarticular(n=18) | Serie global(n=59) |
|---|---|---|---|
| Leucocitos/mm3, mediana (RIC) | 10.310 (4.300-16.374) | 15.005 (4.862-21.842) | 11.757 (4.543-18.800) |
| PMN %, mediana (RIC) | 60 (30-80) | 68 (30-75) | 61 (30-75) |
| Glucosa (mg/dl), mediana (RIC) | 78 (66-89) | 81 (66,5-97,5) | 78,5 (65-91) |
| Proteínas (g/dl), mediana (RIC) | 4,7 (4,2-5,2) | 4,1 (3,6-5,3) | 4,7 (3,9-5,3) |
Los pacientes con curso oligoarticular presentaron artritis en 4 articulaciones o menos; aquellos con curso poliarticular, en 5 articulaciones o más.
Los pacientes con artritis sin ANA en el suero (ANA negativo) presentaban un recuento de leucocitos en LS un 20% superior al de los pacientes con ANA positivos (mediana 11.600/mm3, RIC 4.340-20.573 vs. 9.340/mm3, RIC 6.840-12.694), aunque esta diferencia no era estadísticamente significativa. Tampoco se encontraron diferencias en la relación PMN/MN según la positividad de los ANA.
En cuanto a la presencia de HLA-B27, el recuento de leucocitos era un 50% superior en pacientes HLA-B27 positivos (18.841/mm3) con respecto a pacientes HLA-B27 negativos (10.253/mm3), aunque estas diferencias, como la relación PMN/MN (2,9 vs. 1,7, respectivamente), no resultaron significativas.
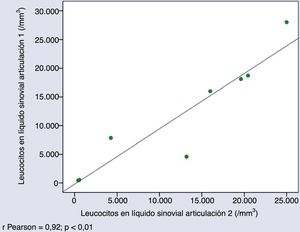
Características citológicas del líquido sinovial en artrocentesis simultáneasLos recuentos de leucocitos en LS obtenidos de distintas articulaciones del mismo paciente el mismo día eran muy similares (r de Pearson 0,927; p=0,001) (fig. 1).
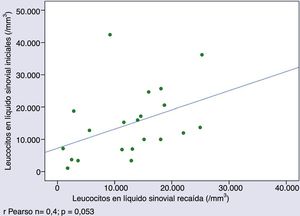
Características citológicas del líquido sinovial en la evoluciónEn 21 pacientes que presentaron recaídas se observó una tendencia a la correlación entre los leucocitos en LS extraídos en cada episodio (r de Pearson 0,4; p=0,053) (fig. 2).
La artrocentesis se repitió en 3 de 8 pacientes con recuentos en el momento del diagnóstico inferiores a 2.000cél/mm3 después de una mediana de 12 meses (RIC 7-16), persistiendo en todos los casos unos recuentos inferiores a 2.000 células con predominio de MN.
Relación entre los recuentos celulares en líquido sinovial y la actividad de la enfermedadPor último, se estudió la relación existente entre el nivel de actividad de la enfermedad, valorado mediante el índice JADAS-10, y los diferentes parámetros del LS, incluyendo leucocitos, subtipos celulares y proteínas mediante la rho de Spearman, no encontrándose correlación.
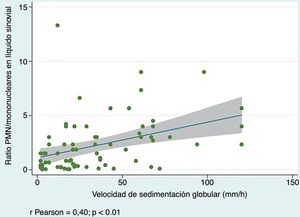
Sí se observó una correlación positiva entre la proporción PMN/MN en LS, y los valores tanto de la VSG (r de Pearson 0,40; p=0,0005) (fig. 3) como de la PCR (r de Pearson 0,25; p=0,03), indicando que la proporción de PMN en LS tiende a aumentar según se elevan los reactantes.
DiscusiónEl análisis del LS es una herramienta fundamental para el estudio de las artritis, ya que orienta al diagnóstico de manera rápida y sencilla. A pesar de ello, pocos estudios han analizado si características clínicas, como la categoría de AIJ o el número de articulaciones inflamadas, o analíticas, como la presencia de ANA o del antígeno de histocompatibilidad HLA-B27, modifican el LS en pacientes con AIJ.
Las características demográficas de los pacientes estudiados en nuestra serie eran similares a las descritas en la literatura, incluyendo la mayor frecuencia de mujeres afectadas en todos los grupos, excepto en las formas sistémicas y en las ArE2,12,13, el predominio de la forma oligoarticular o la mayor frecuencia de positividad para ANA en pacientes con menor edad al diagnóstico2,14,15.
Aunque el análisis de LS solo es diagnóstico cuando se cultiva un germen o se detectan cristales3, el recuento de leucocitos en LS es el estudio más utilizado para clasificar un proceso articular como inflamatorio o no inflamatorio. Shmerling et al. comunicaron que un recuento de leucocitos superior a 2.000/mm3 tiene una sensibilidad y una especificidad para el diagnóstico de artritis inflamatoria del 84%5,16. En lo que respecta a la AIJ, si bien no existen muchas series con las que comparar nuestros resultados, estas también coinciden en que el LS de pacientes con AIJ tiene características inflamatorias6,17,18.
En lo referente a la influencia del número de articulaciones inflamadas sobre los recuentos, nuestros pacientes con formas poliarticulares presentaron mayor celularidad en el LS que los pacientes con oligoartritis; estas diferencias, también observadas por Punzi et al.6 y por Kunnamo y Pelkonen19, no alcanzaron niveles de significación estadística.
Sin embargo, nuestro estudio ha detectado que el análisis del recuento celular en pacientes con AIJ tiene algunas limitaciones que es necesario conocer. Así, 11 de nuestros pacientes, esto es, prácticamente uno de cada 5, presentaron cifras de leucocitos en el LS al diagnóstico superiores a 50.000 (3/11) o inferiores a 2.000/mm3 (8/11), por lo que podrían haber sido diagnosticados erróneamente de artritis séptica o de artritis no inflamatoria, respectivamente. El resultado de los cultivos, la evolución de la enfermedad y la respuesta al tratamiento confirmaron el diagnóstico de AIJ en todos los casos. Este hecho también ha sido observado por otros autores en pacientes con artritis juvenil17,18,20. Por tanto, el recuento en el LS debe ser considerado como una herramienta más en la valoración de las artritis pediátricas y debe ser interpretado en el contexto clínico de cada paciente.
La información que proporciona el recuento celular no se limita solo al número de células, sino que también incluye el recuento diferencial. El porcentaje de PMN suele ser superior al 85% en la artritis séptica16, mientras que en procesos inflamatorios no infecciosos oscila entre el 50-90%5,6,16,20. Generalmente se considera que el LS de pacientes con AIJ tiene un predominio de PMN, como sucedió en nuestra serie, aunque otros autores han comunicado una mayor proporción de células MN21. En cuanto al efecto del número de articulaciones inflamadas sobre el recuento diferencial en LS, varias series han descrito un mayor porcentaje de PMN en las formas poliarticulares5,6,16,18, no confirmado en nuestro estudio.
Dentro de la heterogeneidad que caracteriza a la enfermedad hay un subgrupo de pacientes, los ANA positivos, que comparten tales peculiaridades clínicas22,23 e inmunológicas24 que algunos autores proponen su reconocimiento como una categoría propia dentro de la AIJ. Estos pacientes suelen tener un inicio precoz de la enfermedad (antes de los 6 años), pertenecer al sexo femenino, cursar con afectación articular asimétrica, tanto oligoarticular como poliarticular, y tener un mayor riesgo de desarrollar uveítis anterior crónica22. Estos sujetos, además de reunir las peculiaridades clínicas mencionadas, también comparten un perfil de citocinas muy similar24.
El análisis de las características del LS de acuerdo con la presencia o ausencia de ANA en el suero reveló que los recuentos de leucocitos en el LS de pacientes ANA positivos eran inferiores a los de niños ANA negativos, aunque la diferencia no alcanzaba el umbral de significación estadística. Esta observación no se había realizado con anterioridad, por lo que tendría mucho interés estudiar en series más amplias si se replica este hallazgo.
Al estudiar los recuentos de los sujetos en función de su positividad para el antígeno HLA-B27, se observó que los pacientes HLA-B27 positivos tenían recuentos claramente más altos y con mayor proporción de PMN, aunque, a diferencia de Kunnamo y Pelkonen19, en nuestra serie estas diferencias no fueron significativas. Asimismo, no se encontraron diferencias en las características de los LS entre pacientes de distintas categorías de AIJ, aunque, como sucedió en el estudio de los pacientes ANA o HLA-B27 positivos, estos análisis podrían están limitados por el tamaño de la muestra analizada.
Nuestro estudio reveló que los recuentos de leucocitos en LS obtenidos en la misma sesión de artrocentesis eran muy similares, independientemente de la articulación estudiada. Asimismo, aunque se ha descrito que el tratamiento disminuye tanto la concentración de VSG y PCR como el número de articulaciones activas25,26, no se encontraron descensos en los recuentos en LS en las recaídas.
Varios autores27,28 han demostrado que existe una estrecha correlación en el índice JADAS cuando se emplea PCR en lugar de VSG, siendo una herramienta válida para medir la actividad de la enfermedad. En nuestra serie, aunque encontramos que la proporción de PMN en LS tiende a aumentar según se elevan ambos reactantes, no se hallaron diferencias en los distintos parámetros del LS estudiados en función de la actividad de la AIJ valorada mediante el índice JADAS.
Finalmente, el análisis bioquímico en LS de la concentración de glucosa y proteínas confirma que son marcadores poco precisos de inflamación y que resultan menos informativos que otros estudios realizados en LS10. A diferencia de otros líquidos orgánicos como el ascítico, el cefalorraquídeo o el pleural, estos estudios en LS tienen escasa utilidad.
El estudio presenta limitaciones. La más importante es que se trata de un estudio monocéntrico con un número limitado de pacientes que se reduce con la estratificación.
En resumen, es de destacar que el análisis del LS es una herramienta diagnóstica de primer orden en el estudio de los sujetos con artritis, aunque en el caso de los pacientes con AIJ tiene unas limitaciones que hay que tener presentes a la hora de interpretar sus resultados. El análisis del LS obtenido de distintas articulaciones en el mismo brote no resulta útil, ya que presentan características muy similares. De las variables estudiadas del LS, las que proporcionan más información son el recuento celular y el recuento diferencial. Estos recuentos no se modifican con la actividad de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.