La trombocitopenia inmune primaria (PTI) es la causa más frecuente de trombocitopenia de presentación aguda en un niño previamente sano. Se trata de una enfermedad adquirida con disminución transitoria o persistente de la cifra de plaquetas (< 100.000). Diversos factores se han relacionado con la PTI, como el antecedente de enfermedad viral o ciertas vacunas. Además, está descrita una mayor incidencia en invierno y primavera1.
La gravedad se define en función de las manifestaciones hemorrágicas, que no siempre se relacionan con el recuento plaquetar. Para valorar la gravedad disponemos de la Clasificación de Reino Unido2 (asintomática, síntomas leves, moderados o graves).
Existen varias alternativas de tratamiento, que dependen de la cronicidad y gravedad de la PTI. Según el Grupo de Trabajo de la PTI de la Sociedad Española de Hematología y Oncología Pediátricas (SEHOP)3, las opciones de tratamiento para la PTI de reciente diagnóstico, en función de gravedad y factores de riesgo, son: observación, corticoterapia (prednisona por vía oral o metilprednisolona IV) e inmunoglobulina IV. En caso de PTI crónica, se pueden utilizar agonistas del receptor de trombopoyetina, entre los que se encuentra el eltrombopag (por vía oral).
Durante 2017 se observó un aumento de la prevalencia de PTI en nuestro Departamento de Salud, con tendencia a la recaída en determinados pacientes. Dado que no hay publicado ningún registro exclusivo de niños españoles con PTI, consideramos interesante revisar las características epidemiológicas y clínicas de nuestros pacientes. Por tanto, realizamos un estudio descriptivo retrospectivo, en el que los casos se reclutaron a través de ALUMBRA (Plataforma de Análisis Corporativa de la Conselleria de Sanitat) mediante los códigos CIE-9 287 y CIE-10 D69. La fuente de las variables fue la historia clínica, de la que se extrajo la información necesaria y se codificó en una base de datos anonimizada.
La población de estudio incluyó a niños de 0 a 15 años diagnosticados de «púrpura trombopénica idiopática» o «trombocitopenia inmune primaria» entre los años 2002 y 2017, en nuestro Departamento. Se excluyó a aquellos diagnosticados en época neonatal.
Se consideraron como variables independientes: infección o vacunación en el mes previo al diagnóstico, edad, mes del inicio y sexo.
Las variables resultado fueron: incidencia, prevalencia, recuento plaquetario al diagnóstico, tiempo de evolución, estancia hospitalaria, gravedad2, número de recaídas durante el seguimiento hasta 2018, y tratamiento (observación, corticoides, gammaglobulina, eltrombopag).
El estudio fue aprobado por el Comité Ético correspondiente y por la Comisión de Investigación del Departamento de Salud para su realización en nuestro centro.
El análisis estadístico consistió en estadística descriptiva, mediante el programa SPSS. Las variables se describen mediante medias y DE cuando siguen distribución normal, y como mediana y rango en el resto de los casos. La normalidad de las variables cuantitativas se comprobó mediante el test de Kolmogorov-Smirnov.
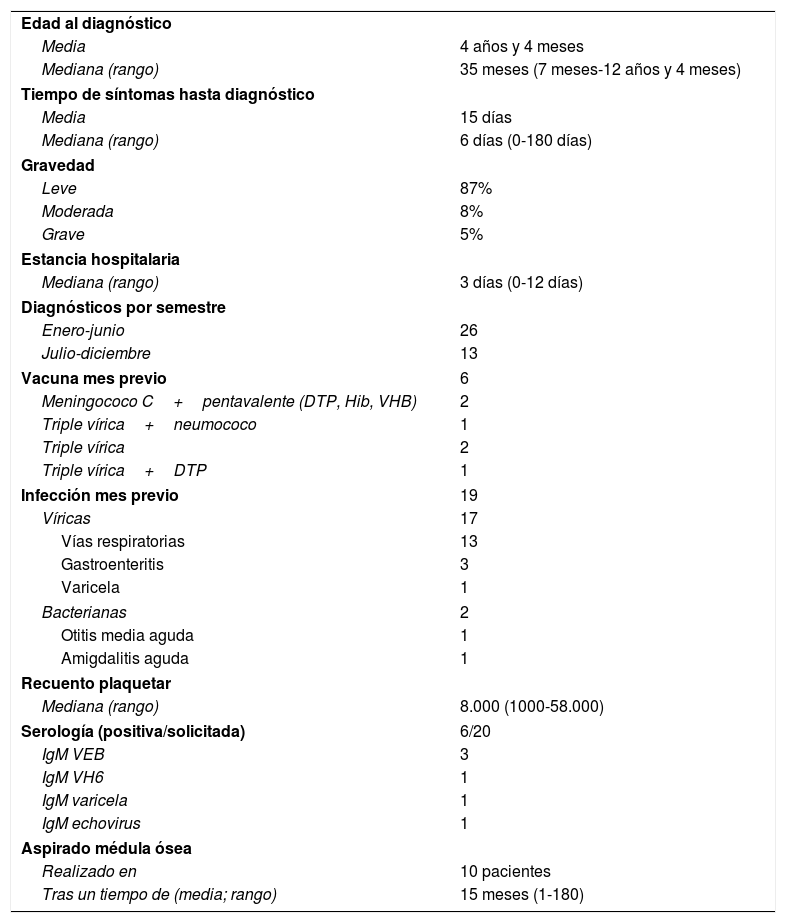
La incidencia fue de 9,23/100.000 habitantes en edad pediátrica/año, con una prevalencia de 24,87/100.000 en 2017. Se diagnosticaron 39 pacientes de PTI (51% niñas y 49% niños). Las características de los pacientes en cuanto a epidemiología y pruebas complementarias solicitadas y sus resultados aparecen en la tabla 1.
Epidemiología y pruebas complementarias solicitadas
| Edad al diagnóstico | |
| Media | 4 años y 4 meses |
| Mediana (rango) | 35 meses (7 meses-12 años y 4 meses) |
| Tiempo de síntomas hasta diagnóstico | |
| Media | 15 días |
| Mediana (rango) | 6 días (0-180 días) |
| Gravedad | |
| Leve | 87% |
| Moderada | 8% |
| Grave | 5% |
| Estancia hospitalaria | |
| Mediana (rango) | 3 días (0-12 días) |
| Diagnósticos por semestre | |
| Enero-junio | 26 |
| Julio-diciembre | 13 |
| Vacuna mes previo | 6 |
| Meningococo C+pentavalente (DTP, Hib, VHB) | 2 |
| Triple vírica+neumococo | 1 |
| Triple vírica | 2 |
| Triple vírica+DTP | 1 |
| Infección mes previo | 19 |
| Víricas | 17 |
| Vías respiratorias | 13 |
| Gastroenteritis | 3 |
| Varicela | 1 |
| Bacterianas | 2 |
| Otitis media aguda | 1 |
| Amigdalitis aguda | 1 |
| Recuento plaquetar | |
| Mediana (rango) | 8.000 (1000-58.000) |
| Serología (positiva/solicitada) | 6/20 |
| IgM VEB | 3 |
| IgM VH6 | 1 |
| IgM varicela | 1 |
| IgM echovirus | 1 |
| Aspirado médula ósea | |
| Realizado en | 10 pacientes |
| Tras un tiempo de (media; rango) | 15 meses (1-180) |
En 4 pacientes inicialmente se optó por observación, aunque solo 2 de ellos remitieron espontáneamente. El 74% de los pacientes recibió Ig IV y el 56% corticoides (en total, un 41% de los pacientes precisó ambas terapias). Los tratados con Ig IV lo hicieron una mediana de 2 veces (rango 1-15). Por la evolución a PTI crónica, 2 pacientes recibieron tratamiento con eltrombopag.
Entre los 39 pacientes, 7 evolucionaron a PTI crónica, 2 a persistente y hubo un fallecimiento por hemorragia intracraneal con resultados discordantes entre el aspirado de médula ósea y la biopsia de calota (necropsia) en cuanto a origen central o periférico.
En nuestro estudio destaca la menor estancia hospitalaria en el grupo de sintomatología moderada respecto al de leve, que podría deberse a un sesgo por traslado a hospital terciario. Además, se confirma el acúmulo de casos en invierno-primavera, así como el antecedente de vacunación o infección el mes previo al inicio.
En cuanto al tratamiento y evolución de la PTI, nuestro estudio tiene varias limitaciones. Por una parte, al tratarse de un estudio retrospectivo, inicialmente la recaída, la respuesta al tratamiento y su indicación se basaban en el criterio del facultativo responsable, y en los últimos años, se basan en los consensos internacionales4. Por otra parte, la muestra de estudio es pequeña por lo que es complicado extraer conclusiones al respecto.
Es evidente el diferente tratamiento de los pacientes con PTI en distintos hospitales, por lo que existe una necesidad de homogeneizar su manejo.