Introducción
En 1976 Herbst et al1 describieron 3 niños con hernia hiatal, reflujo gastroesofágico (RGE), esofagitis grave, acropaquías, hipoalbuminemia y anemia ferropénica. La singularidad de la aportación radicaba en dos aspectos: la presentación de acropaquías en ausencia de neumopatía crónica asociada al reflujo y en el desarrollo de hipoproteinemia como consecuencia de la pérdida digestiva de albúmina. Desde entonces son escasísimas las aportaciones bibliográficas sobre este complejo sindrómico2,3 y anecdóticas las relacionadas con situaciones clínicas próximas o incompletas4,5.
Casuística
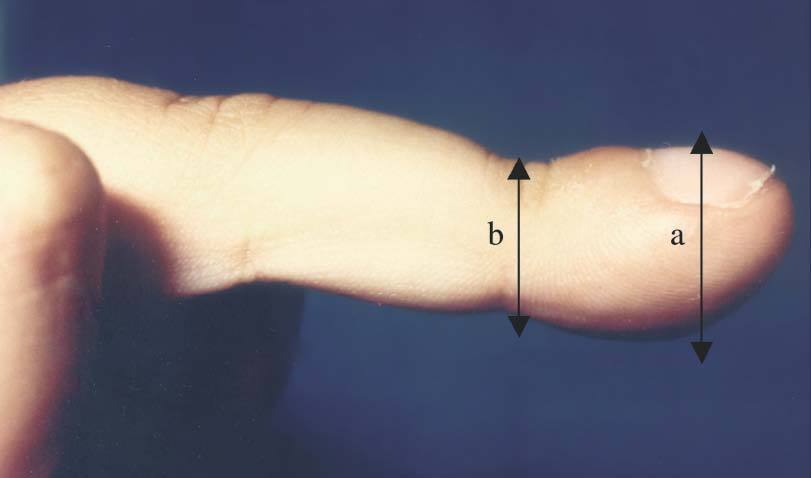
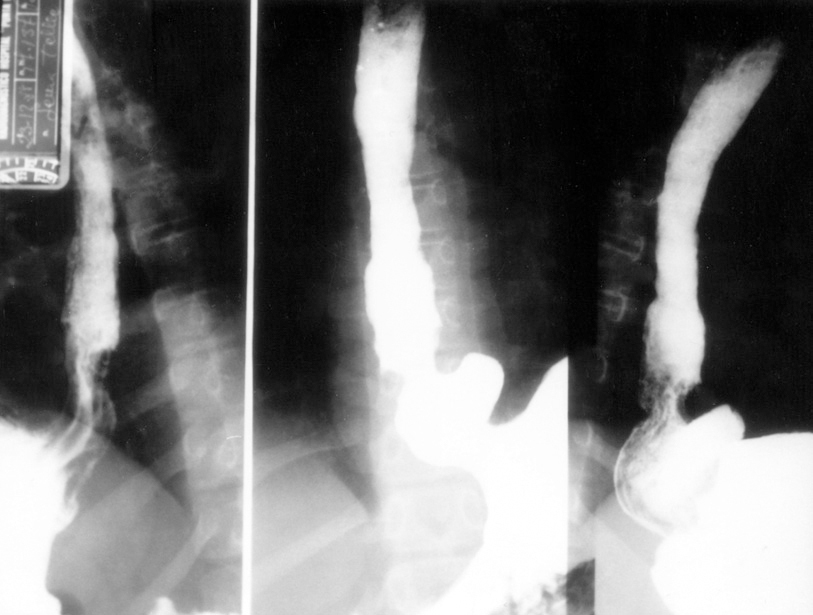
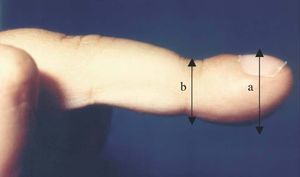
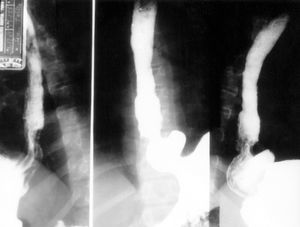
Niña de 6 años enviada para estudio por sospecha de fibrosis quística no refiriéndose antecedentes familiares, gestacionales o perinatales de interés. Desde las primeras semanas de vida había presentado vómitos alimenticio-mucosos y procesos catarrales recurrentes. Al año de edad era evidente el hipocratismo digital. Desde entonces los vómitos fueron atenuándose hasta "desaparecer", siendo sustituidos por episodios de tos acompañados de la emisión de secreciones mucosas de aspecto herrumbroso surcadas, ocasionalmente, por estrías sanguinolentas. A los síntomas citados se añaden, sólo en el mes precedente a la consulta, dolor epigástrico y pirosis. Examen físico. Excelente estado general con manifiesta obesidad (percentiles de peso y talla > 97), discreta palidez cutaneomucosa, dedos hipocráticos con un cociente entre la altura de la falange distal del dedo medio a nivel de la base ungueal y la altura interfalángica distal (AFD/AIF) de 1,25 (normal ≤ 1) (fig. 1), ausencia de alteraciones osteoarticulares y normalidad de la auscultación cardiopulmonar y de la inspección rinofaríngea. Exámenes complementarios: hemoglobina 8,2 g/dl con hipocromía y microcitosis; sideremia 15 μg/dl, ferritina 7 ng/l; recuento plaquetario, curva de distribución del volumen de las plaquetas y niveles del factor Von Willebrand, normales; proteínas totales 5,1 g/dl, albúmina 55 %; hemorragias ocultas en heces positivo en distintas ocasiones; test del sudor repetidamente negativo; parámetros de función pancreática y respiratoria normales; radiografía y tomografía computarizada de tórax, normales; radiografía de la mano, articulaciones mayores y huesos largos, sin artritis ni periostitis; esofagograma: severo RGE asociado a hernia hiatal (fig. 2); esofagoscopia: cardias permanentemente abierto y signos de intensa esofagitis confirmada en el estudio histológico. Los padres rechazaron la realización de pH-metría esofágica y de investigaciones radioisotópicas para detectar la sospechada enteropatía pierde proteínas y a tal efecto se consideró improcedente la realización de un aclaramiento fecal a 1-antitripsina dada la existencia de una hemorragia digestiva en actividad.
Figura 1. Acropaquía con índice a/b: 1,25.
Figura 2. Severo reflujo gastroesofágico asociado a hernia hiatal.
Comprobada la ineficacia de las medidas conservadoras (médicas y posturales), se procedió a la corrección quirúrgica (fundoplicatura de Nissen) tras la cual se asistió a una rápida remisión de la sintomatología y a la mejoría de los parámetros analíticos. Cinco meses más tarde las acropaquías habían desaparecido (cociente AFD/AIF 0,8) y normalizado los niveles de hemoglobina, proteínas y albúmina así como los relacionados con el metabolismo del hierro.
Comentarios
En 1990 Sacher y Staufer acuñaron el término de "tríada de Herbst" para definir la excepcional situación en la que el RGE se asocia a hipoproteinemia, anemia ferropénica y acropaquías2. Honraban con ello a los autores que por primera vez habían descrito tal agrupación patológica1. Es ésta una circunstancia en la que no extraña el hallazgo de hipoproteinemia y anemia dado que el origen de ambas tiene fácil explicación en la pérdida del efecto barrera de la mucosa esofágica inflamada (esofagitis por reflujo)1,2,4, pero sorprende el desarrollo de acropaquías si el RGE no se ha complicado con una neumopatía crónica como resultado de las microaspiraciones recurrentes a las que el reflujo da origen.
Centrando la atención en esta deformidad digital, que es tan llamativa como clásica (dedos hipocráticos), debe comentarse que las acropaquías se asocian a una tan variada relación de situaciones patológicas que resulta difícil imaginar un proceso patogénico común a todas ellas6-8.
Como premisa puede asumirse que las acropaquías no son más que una forma incompleta o abortiva de la osteoartopatía hipertrófica (OAH)3,9,10, cuadro éste en el que la citada dismorfia digital se acompaña de la proliferación perióstica de los huesos tubulares3,7-10.
Se ha venido admitiendo que el sustrato anatómico de las acropaquías es la hipertrofia e hiperplasia del tejido conjuntivo asociadas a hipervascularidad en las falanges distales6 aunque está por precisar si existe un verdadero incremento de la vascularidad8. Históricamente se ha considerado que el desarrollo de estas alteraciones puede relacionarse con diversos mecanismos (neurogénico, vascular, hormonal) y/o con la acción de sustancias mediadoras (ferritina, prostaglandinas, bradicinina, nucleótidos purínicos, serotonina, factor de necrosis tumoral y hormona de crecimiento)6,8,11-13. En la actualidad se postula que las alteraciones óseas que observamos en el complejo acropaquías-OAH son el resultado de la activación del binomio plaquetas/endotelio vascular en las zonas más distales de la circulación sistémica; de esta interacción resultaría la liberación de sustancias promotoras del crecimiento de los fibroblastos14,15. El desarrollo de estos acontecimientos sería imposible en condiciones fisiológicas en las que los megacariocitos originados en la médula ósea e incorporados a la circulación sanguínea se fragmentan en el árbol arterial pulmonar altamente ramificado hasta producir plaquetas. En situaciones patológicas, de las que el paradigma serían los cortocircuitos vasculares derecha-izquierda, los megacariocitos se incorporarían sin fragmentar o insuficientemente fragmentados al torrente sanguíneo y viajarían con otros elementos formes de la sangre en el flujo axial lo que les permitiría alcanzar las zonas más distales de la circulación sistémica. Allí impactarían provocando la liberación de factores de crecimiento de los fibroblastos y la activación de las células endoteliales14,15. Idéntica secuencia final podría desencadenarse en caso de padecer procesos capaces de generar por sí mismos tales factores en áreas que por su ubicación eluden la labor de filtro pulmonar6-8,10-15. Sigue especulándose acerca de la naturaleza de estas sustancias promotoras del crecimiento de los fibroblastos: podrían corresponderse con el denominado factor de crecimiento derivado de las plaquetas (platelet-derived growth factor, PDGF)15 y/o con el más recientemente descrito factor de crecimiento del endotelio vascular (vascular endotelial growth factor, VEGF)10,16 que es una citocina también de origen plaquetario. La candidatura de este último se ve reforzada por la comprobación de que se trata de un agente angiogénico con acción específica sobre las células endoteliales y que es producido en variadas circunstancias patológicas asociadas frecuentemente al desarrollo de acropaquías: cortocircuitos cardíacos o pulmonares, hipoxia, tumores malignos y otras8,16.
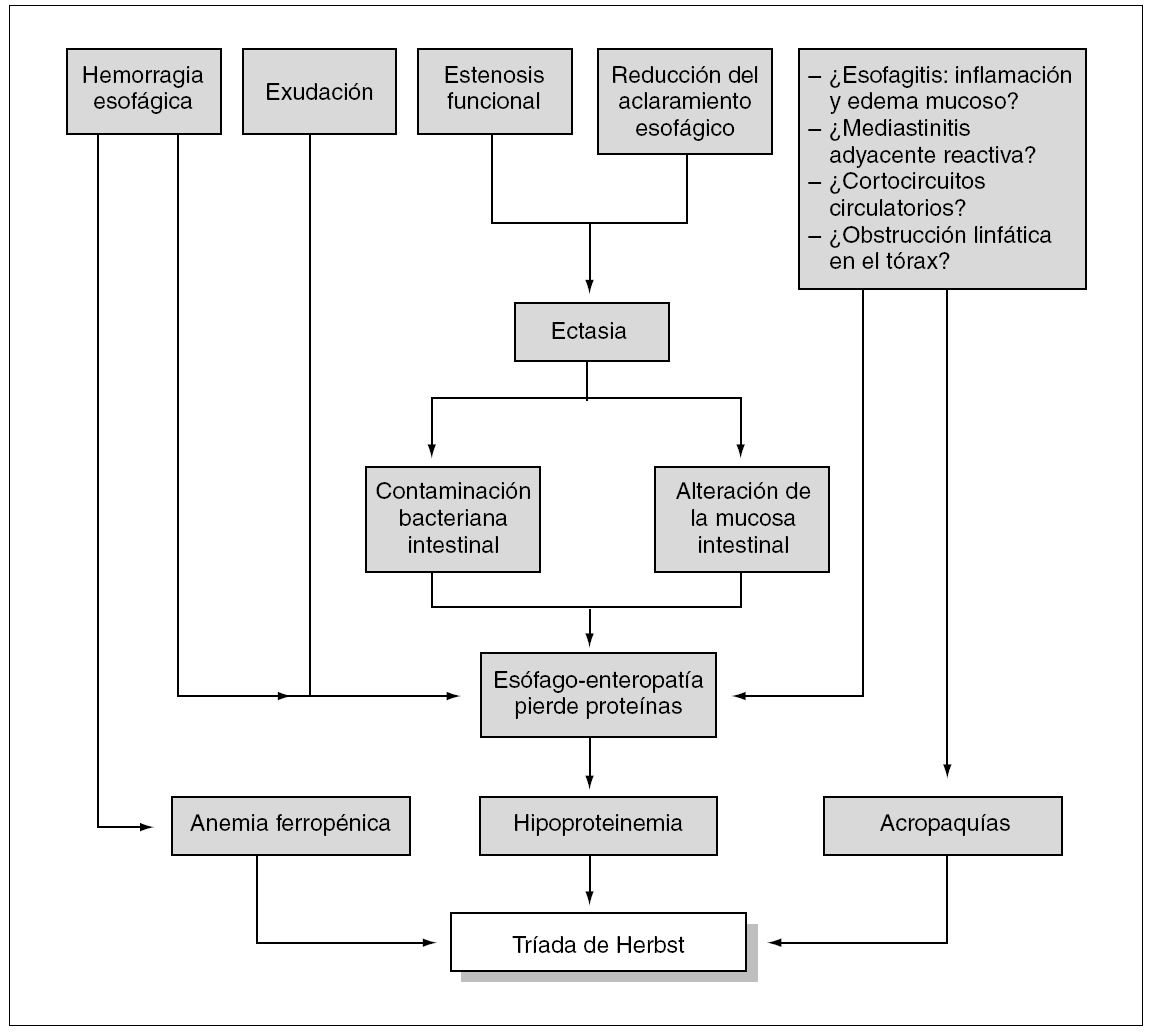
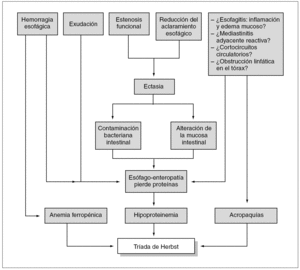
Sin embargo, ninguna de las hipótesis propuestas permite explicar todas las modalidades de acropaquías de origen esofágico. Éstas se han descrito en relación con tumores esofágicos malignos17 y benignos18, acalasia19, estenosis por ingestión de álcalis20, OAH3 y RGE asociado o no a hernia hiatal1,2,5. Centrándonos en el último grupo, que es al que puede adscribirse la paciente objeto de esta presentación, debe resaltarse que patogénicamente la asociación de patología esofágica y acropaquías parece lógica cuando el reflujo se complica con una neumopatía crónica de naturaleza broncoaspirativa10,21, pero no se ha ofrecido una explicación plausible para las acropaquías de origen esofágico constituyentes de la tríada de Herbst en ausencia de patología pulmonar crónica, cortocircuitos venoarteriales o hipoxemia. Algunos autores han apuntado la posibilidad de que en su génesis podrían intervenir fenómenos "neurogénicos", incluyendo estimulación vagal3, pequeños cortocircuitos interauriculares que se abrirían al elevarse la presión en la aurícula derecha (C.J. Dikinson: comunicación personal), y mediastinitis reactiva por contigüidad con el esófago inflamado (esofagitis)1, pero son especulaciones no basadas en datos concluyentes (fig. 3).
Figura 3. Hipótesis patogénica de la tríada de Herbst.
Revisando las escasas aportaciones publicadas en las que las acropaquías surgen en el curso de un RGE severo asociado a anemia e hipoproteinemia1-3, resulta que de los tres descritos por Herbst et al1, uno padecía síndrome de Sandifer y los otros dos rumiación; de los 2 casos de Sacher y Stauffer, el primero antecedentes de rumiación y el segundo síndrome de Sandifer2. La última aportación hallada en la literatura médica se refiere a una niña de 9 años de edad con parálisis espástica cerebral por anoxia perinatal y OAH plenamente desarrollada3. Merece destacarse que la paciente descrita en esta presentación no sufría ninguna de estas patologías asociadas.
Cabe concluir que la tríada de Herbst es una situación clínica excepcional relacionada con el RGE cuya singularidad radica, por una parte, en el desarrollo de acropaquías en ausencia de la esperable neumopatía crónica broncoaspirativa y, por otra, en que su desaparición tras la cirugía correctora permite atribuir su desarrollo a la esofagitis. Por último, subrayar que la esofagitis secundaria a un RGE severo, asociado o no a hernia hiatal, debe ser incluida en el diagnóstico diferencial de las acropaquías1,2 así como en el de las hipoproteinemias e hipogammaglobulinemias por enteropatía pierde proteínas4.
Correspondencia: Dr. J. Guerrero Vázquez.
Servicio de Pediatría. Hospital Punta Europa.
Avda. Virgen del Carmen, 23, 3.º C. 11201 Algeciras. Cádiz. España.
Correo electrónico: jguerrerovqz@yahoo.es
Recibido en agosto de 2006.
Aceptado para su publicación en diciembre de 2006.