Introducción
En 1999, Kure llamó la atención acerca del hecho de que algunos pacientes con hiperfenilalaninemia por déficit de fenilalanina hidroxilasa respondían a la administración de una dosis elevada de alrededor de 20 mg/kg, de tetrahidrobiopterina (BH4) por vía oral con una disminución importante de sus niveles de fenilalanina en sangre, abriendo con ello nuevas posibilidades terapéuticas para los individuos afectados 1. La BH4 es el cofactor natural de las hidroxilasas de los aminoácidos ramificados y de la sintasa del óxido nítrico; y pronto se confirmó que un elevado porcentaje de fenilcetonurias moderadas y de hiperfenilalaninemias medias, es decir de formas clínicas con concentraciones de fenilalanina inferiores a 1.200 nmol/ml (20 mg %) eran sensibles a un test de sobrecarga con BH4 y, por tanto, eran teóricamente tributarias de recibir tratamiento continuado con este cofactor con la esperanza de poder liberalizar notablemente o incluso prescindir de la dieta con ingesta limitada de fenilalanina 2-6. Como era de esperar, se comprobó que algunas mutaciones del gen de la fenilalanina hidroxilasa se repetían con frecuencia en los pacientes sensibles a BH4 7; pero, por desgracia no existe en todos los casos una correlación definitiva entre el genotipo y la respuesta al test de BH4 3,4,8,9. Tampoco se conoce el motivo exacto, seguramente multifactorial, por el que unas determinadas mutaciones responden a la administración de BH4. Esto se ha relacionado con una afinidad disminuida de la proteína mutada por la BH4, con su capacidad para inducir una modificación de su sitio de enlace a la estructura terciaria de la proteína, con su capacidad de aumentar la expresión del gen de la PHA y con su capacidad para estabilizar el ARNm o de actuar como chaperona, protegiendo a la enzima de su degradación 10-13. De cualquier manera, la respuesta depende de la dosis y puede variar entre distintos pacientes con el mismo genotipo. La respuesta al test de sobrecarga se viene utilizando para seleccionar los pacientes tributarios de tratamiento, pero un test positivo no se correlaciona siempre con exactitud con el grado de respuesta al tratamiento a largo plazo. Tampoco existe consenso universal acerca de la técnica ideal para el test de sobrecarga con BH4 ni para la interpretación de los resultados obtenidos. Finalmente, no se conocen los posibles efectos secundarios tras un tratamiento con BH4 de por vida.
Todo ello hace que la decisión de tratar una hiperfenilalaninemia con BH4 exija una elección acertada del paciente, un adecuado consentimiento informado y un minucioso seguimiento para identificar cuanto antes los posibles efectos secundarios.
Desde esta perspectiva se evalúa la experiencia derivada de la realización del test de sobrecarga de BH4 y del posterior tratamiento prolongado de un grupo de niños de diversas edades con hiperfenilalaninemia.
Pacientes y métodos
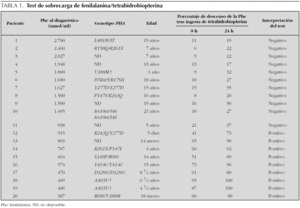
El test de sobrecarga combinada con fenilalanina y con BH4 se ha realizado en 20 pacientes con hiperfenilalaninemia por déficit de fenilalanina hidroxilasa, sometidos a tratamiento dietético con estricto control de la ingesta de fenilalanina, proteínas, calorías, vitaminas y minerales y con buena cumplimentación personal o familiar 14. Todos se mantenían en unas concentraciones plasmáticas estables de fenilalanina inferiores a 360 nmol/ml por debajo de los 10 años de vida e inferiores a 500 nmol/ml por encima de esa edad. En todos los casos se había comprobado la normalidad de la actividad de dihidropterinarreductasa (DHPR) en eritrocitos y del patrón de biopterinas en orina. En la mayoría (en algunos la familia no lo ha deseado por el momento) se practicó el estudio de las mutaciones del gen PAH. Las edades de los niños oscilaban entre los 8 días y los 15 años.
El test se practicó del siguiente modo. Después de un ayuno nocturno se administraron 100 mg/kg de L-fenilalanina (SHS)® en polvo, disueltos en agua o en zumo de naranja natural. Se mantuvo el ayuno, y pasadas 3 h se administraron por vía oral 20 mg/kg de 6R-BH4 Schircks® disuelta en agua y protegida de la luz solar. A los 30 min de la ingesta de BH4 se reanudó la dieta con ingesta limitada en fenilalanina, que habitualmente cada paciente venía realizando. Se tomaron muestras de sangre para cuantificación de aminoácidos mediante cromatografía líquida de alta resolución, justo antes de la sobrecarga de fenilalanina, y a las 3, 7, 11 y 27 h después de ella. La respuesta al test se consideró positiva cuando se obtenía un descenso de la fenilalanina (a partir del máximo nivel tras la sobrecarga de fenilalanina) del 30 % a las 8 h o del 50 % a las 24 h de la administración de la BH4.
Con el fin de encontrar la mínima dosis efectiva en cada caso, el tratamiento se inició con una dosis de 5 mg/kg/día, repartida en tres tomas. En función de la respuesta obtenida se incrementó gradualmente la dosis de BH4 y la ingesta diaria de fenilalanina (en partes de 50 o 100 mg) a la vez que se disminuía también de forma gradual el suplemento proteico sin fenilalanina, que se suprimía del todo cuando el aporte de proteínas naturales cubría las recomendaciones dietéticas para cada edad. El objetivo final fue en todos los casos mantener niveles de fenilalanina plasmáticos inferiores a 360 nmol/ml con dieta libre; pero como los niños españoles suelen recibir en su dieta habitual un exceso de proteínas absoluto y porcentual, se ha mantenido un control de la dieta libre para que ésta cumpliera las recomendaciones dietéticas adecuadas 15. Este objetivo se ha alcanzado lentamente y en tiempo diverso en función de la respuesta de cada niño.
Durante este proceso se ha practicado control de aminoácidos plasmáticos con una frecuencia que ha oscilado entre 8 y 15 días en función de las circunstancias de cada niño.
Simultáneamente se han continuado los controles antropométricos, bioquímicos, electrofisiológicos y de desarrollo intelectual habituales en los niños con hiperfenilalaninemia.
Resultados
El test de sobrecarga (tabla 1) fue positivo en 9 pacientes con una concentración máxima de fenilalanina en el momento del diagnóstico inferior a 815 nmol/ml, y fue negativo en todos aquellos en los que ese nivel había sido superior a 938 nmol/ml al diagnóstico. Todos los niños con respuesta positiva al test eran portadores de mutaciones identificadas como respondedoras a BH4 en doble heterocigosidad (R68S, R261X, A403V, R261X, S349P, V388M, R243Q) o en hemicigosidad (D129G, Y414C). Desconocemos por el momento el genotipo de uno de los pacientes con respuesta positiva al test. Pero es destacable que algunos de los pacientes no respondedores y con concentraciones de fenilalanina muy elevadas al diagnóstico, son portadores también en doble heterocigosidad o en hemicigosidad de mutaciones (L48S, I65T, V388M, R158Q, R261X, R243Q) identificadas en niños respondedores de nuestro grupo o de otros grupos de pacientes 16.
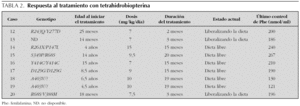
Todos los pacientes respondedores han aceptado el ensayo terapéutico con BH4 y este se ha instaurado según las pautas descritas tras cumplimentar el formulario de consentimiento informado para medicación de uso compasivo, en completa sintonía con los deseos de los padres y con la aprobación del comité de ética del hospital. Se inició una dosis de 5 mg/kg/día repartida en tres tomas, control bioquímico regular y aumento de la ingesta de fenilalanina y de la dosis de BH4 de un modo progresivo.
En la actualidad 6 pacientes están con dieta libre que aporta alrededor de 100 mg/kg/día de fenilalanina y con dosis diarias de BH4 que oscilan entre 7 y 15 mg/kg/día. Los otros tres están todavía en tratamiento mixto con BH4 y dieta limitada en fenilalanina, pero en función de la respuesta obtenida es de suponer que en un breve plazo de tiempo estarán bajo monoterapia con BH4 (tabla 2).
No hemos identificado por ahora efectos secundarios de los descritos con el uso terapéutico de BH4 y seguramente por ello la cumplimentación y la adherencia al tratamiento por parte de los pacientes han sido excelentes.
Discusión
No cabe duda de que un número muy elevado de pacientes con hiperfenilalaninemia por déficit de fenilalanina hidroxilasa, que hasta el momento actual tenían como única posibilidad terapéutica la dieta limitada en fenilalanina de por vida, pueden beneficiarse notablemente del tratamiento con BH4. Tres aspectos importantes que todavía resultan algo confusos, deben ser mejor definidos para conseguir la máxima eficacia terapéutica con los mínimos riesgos: la elección de los pacientes tributarios de este tratamiento, la dosis que emplear en cada caso y la detección precoz de los posibles efectos secundarios.
El genotipo de los pacientes puede ayudar a priori a la identificación de pacientes respondedores al tratamiento con BH4, pero desgraciadamente el genotipo aislado no tiene suficiente sensibilidad ni especificidad en este sentido. Una misma mutación puede ser aparentemente respondedora en algunos pacientes y ser no respondedora en otros; y pacientes con el mismo genotipo tienen una respuesta diferente al tratamiento. En nuestros pacientes algunas mutaciones (L48S, I65T, V388M, R158Q, R261X, R243Q) de los no respondedores con fenotipo PKU clásico están presentes en diversas combinaciones en pacientes respondedores con PKU moderada de nuestro grupo o de otros de la literatura. Es bien conocido que las diferentes combinaciones de las mutaciones del gen PAH entre sí y la interacción con el resto de la dotación génica condicionan de un modo definitivo el fenotipo de los individuos afectados. Desde esta perspectiva el examen de las mutaciones es fundamental para aumentar nuestro conocimiento acerca de los mecanismos de respuesta al tratamiento con BH4 y al conocimiento general de la enfermedad 12,13 pero esta información debe ser complementada con otra que permita una mejor individualización de cada hiperfenilalaninemia.
El breath test que mide la conversión de L(1- 13C)fenilalanina en 13CO2 parece ser una buena herramienta para el diagnóstico de los pacientes sensibles e incluso puede resultar útil para identificar la dosis de BH4 necesaria en cada caso y en cada momento 17. Esto permitiría un seguimiento más estricto del tratamiento, pero todavía no existe mucha experiencia en su utilización.
Habitualmente la selección de los pacientes ha venido realizándose con buenos resultados en función de la respuesta a una sobrecarga oral con BH4, a pesar de que no existe consenso unánime acerca de la metodología del test o de su interpretación.
La mayoría de los centros utilizan el test combinado con una sobrecarga de fenilalanina de 100 mg/kg, seguida a las 3 h de una dosis única de BH4, de 20 mg/kg. En este caso el resultado depende del descenso de la fenilalanina a las 8 o 24 h de la ingesta de BH4. Pero otros centros han usado, al parecer también con éxito, dosis de 10 mg/kg de BH4 o han prolongado el test administrando la BH4 durante tres o incluso 7 días consecutivos, porque es posible que algunas hiperfenilalaninemias que no responden a la dosis única de BH4 puedan hacerlo cuando ésta se administra durante más tiempo. En este caso la respuesta se considera positiva cuando la fenilalanina plasmática se estabiliza en concentraciones inferiores a las consideradas tributarias de tratamiento dietético 18.
Administrar durante 3 o 7 días una dosis elevada de BH4 más que un test de sobrecarga es propiamente un ensayo terapéutico. Se trata de un planteamiento que parece razonable porque lo que verdaderamente interesa es comprobar la respuesta individual del paciente al tratamiento mantenido a largo plazo; teniendo en cuenta, además, que se desconoce todavía la exacta correlación entre una sobrecarga de fenilalanina/BH4 positiva y el tipo de respuesta al tratamiento continuado con BH4.
En nuestros pacientes el test combinado fenilalanina/ BH4 en dosis única, ha sido útil para identificar a los niños teóricamente respondedores, puesto que no se han producido respuestas dudosas y no ha existido tampoco solapamiento de los resultados entre los casos positivos y los negativos. No hemos efectuado cuantificación de biopterinas en orina con objeto de confirmar la absorción de la BH4; pero con independencia de que su ingesta ha tenido lugar siempre en nuestra presencia, no parece que exista una buena correlación entre la respuesta al test y concentración de biopterinas en orina tras la sobrecarga 16. En todo caso, la interpretación del test se beneficia notablemente de una escrupulosa cumplimentación de las dosis utilizadas y del horario de lectura de los resultados (tabla 3).
Hemos observado que todos los niños con un valor máximo de fenilalanina al diagnóstico de más de 838 nmol/ml han tenido un test de fenilalanina/BH4 negativo, y que todos los que tuvieron un nivel máximo inferior a 815 nmol/ml al diagnóstico tuvieron un test positivo, y lo que es más significativo, que han tenido además una buena respuesta al tratamiento a largo plazo. Este es un hecho que con pequeñas variaciones en los valores de corte de fenilalanina ha sido puesto en evidencia por otros grupos de trabajo 3,16.
Como la práctica del test de sobrecarga supone alguna molestia física al paciente, dedicación horaria de los padres y gasto económico, parece razonable evitarlo en los pacientes en los que sea posible.
Desde este punto de vista creemos que la cifra máxima de fenilalanina al diagnóstico es un buen marcador biológico para identificar los pacientes que a priori deben ser sometidos a un ensayo terapéutico. Los niños con concentraciones de fenilalanina máximos al diagnóstico, inferiores a 800 nmol/ml pueden ser sometidos de entrada al ensayo terapéutico con BH4 sin necesidad de practicar test de sobrecarga previo. El test de sobrecarga combinado fenilalanina/BH4 antes de ensayar el tratamiento prolongado con BH4 puede reservarse de este modo para los niños con cifras al diagnóstico superiores de 800 nmol/ml, porque no puede descartarse en ningún caso la presencia de algún paciente respondedor dentro de este rango de hiperfenilalaninemias.
No existe experiencia suficiente acerca de los posibles efectos secundarios del tratamiento mantenido con dosis farmacológicas de BH4 en estos niños y no deben ser extrapolados los observados tras su administración en las deficiencias de BH4: poliuria, diarrea y trastornos del sueño, fundamentalmente. Por el momento, no parece que a corto plazo se hayan detectado efectos nocivos, pero no ha pasado tiempo suficiente para poder descartarlos. La BH4 es cofactor de las hidroxilasas de fenilalanina, tirosina y triptófano y desde esta perspectiva su ingesta puede tener efectos beneficiosos para regular la síntesis y función de neurotransmisores en este tipo de pacientes 19; pero también puede desencadenar trastornos del funcionamiento del sistema nervioso central por la repercusión que una dosis alta y continuada puede tener en la síntesis y en el efecto de catecolaminas y aminas biógenas en las células neuronales 20. La BH4 tiene también un gran protagonismo en la actividad del sistema inmunitario, en la síntesis de NO y en la función endotelial vascular. Tampoco se conoce la repercusión que sobre todo ello puede tener un tratamiento continuado con BH4 21,22.
Se ha iniciado siempre el tratamiento con una dosis de BH4 de 5 mg/kg/día repartida en tres tomas de acuerdo con su farmacocinética 23, con la esperanza de identificar la mínima dosis efectiva y evitar en lo posible efectos secundarios a largo plazo. Esta conducta terapéutica con aumento lento y progresivo de la dosis de BH4 y de la ingesta de fenilalanina tiene el inconveniente de su complejidad frente a opción de iniciar simultáneamente una dosis de 10 o 20 mg/kg/día de BH4 y dieta libre, pero tiene la ventaja de que es más segura, más barata y permite clasificar al paciente en función de la dosis necesaria para tolerar una dieta sin restricción de fenilalanina. La dosis mínima que nos ha permitido instaurar una dieta libre está entre 7 y 10 mg/kg/día en la mayoría de nuestros niños. Uno ha precisado 15 mg/kg/día para alcanzar una dieta libre y los tres que están en fase de introducción del tratamiento reciben en la actualidad 7 y 7,5 mg/kg/día. Estas dosis son superponibles a las que han precisado otros grupos de pacientes y confirman que la respuesta al tratamiento con BH4 es individual y dependiente de la dosis 7,24,25, por lo que el cuidado de cada niño debe ser estrictamente individualizado.
Ninguno de los niños ha tenido problemas para su ingesta ni ha manifestado efectos secundarios de ningún tipo. Todas las familias han referido una mejoría muy notable en el comportamiento de los niños en tratamiento, pero se puede deber al efecto psicológico que sobre el entorno familiar tiene la eliminación de la dieta. Aunque fuera así, sería otro argumento para intentar el tratamiento en los niños tributarios.
Lo que no sabemos y también es algo que habrá que aclarar en el futuro, es cuál es la dosis máxima de BH4 que puede emplearse sin peligro en estos pacientes y si este tratamiento es efectivo en todas las situaciones (procesos infecciosos intercurrentes, ingesta dietética inadecuada, etc.) que pueden presentarse a lo largo de la vida del niño. Esto es muy importante porque el tratamiento con BH4 sólo podrá ser considerado una alternativa efectiva a la dieta limitada en fenilalanina en todas las edades de la vida, cuando puede utilizarse con seguridad, tanto en condiciones normales como patológicas; y se conozca el modo de controlar las variaciones de la fenilalanina plasmática mediante las correspondientes variaciones de la dosis. Mientras no sea así, hay que ser muy prudentes en el uso terapéutico alternativo de la BH4, utilizarla sólo en pacientes o familias con buena cumplimentación, y en caso contrario no utilizarla durante los primeros años de la vida en los que el sistema nervioso es más sensible a cualquier aumento transitorio de la fenilalanina por encima de los límites considerados patógenos.
Conclusión
El tratamiento con BH4 es una alternativa real al tratamiento con dieta limitada en fenilalanina, de la hiperfenilalaninemia por déficit de fenilalanina hidroxilasa.
Una concentración de fenilalanina máxima al diagnóstico inferior a 800 nmol/ml justifica de entrada el ensayo terapéutico prolongado. Los pacientes con concentraciones más elevadas deben ser sometidos al test de sobrecarga combinado fenilalanina/BH4 para identificar a los posibles respondedores.
Para definir la dosis mínima efectiva en el tratamiento continuado, es adecuado iniciar una dosis de 5 mg/kg/día en tres tomas y aumentar progresivamente la ingesta de fenilalanina y la dosis de BH4 en función de la respuesta del paciente.
En los niños que no puedan ser sometidos a un control estricto, especialmente durante la época de máxima vulnerabilidad del sistema nervioso central, es necesario valorar cuidadosamente la oportunidad de este tratamiento y no debe iniciarse sin estar seguros de que podrá efectuarse el adecuado seguimiento del paciente.
En todos los casos es obligado un minucioso control clínico y analítico, con el fin de identificar cuanto antes los posibles efectos secundarios del tratamiento.
Recursos informáticos
http://www.pahdb.mcgill.ca
http://www.bh4.org
Trabajo realizado con la ayuda G03/054 de la Red de Grupos de investigación REDEMETH.
Correspondencia: Dr. A. Baldellou Vázquez.
Unidad de Enfermedades Metabólicas. Hospital Infantil Miguel Servet.
P.º Isabel la Católica, 3. 50009 Zaragoza. España.
Correo electrónico: abaldellou@salud.aragon.es
Recibido en mayo de 2005.
Aceptado para su publicación en septiembre de 2005.