Introducción
Es un hecho reconocido que la instauración de un tratamiento precoz resulta fundamental en el pronóstico de los niños con infección del tracto urinario (ITU). Por ello, considerando el retraso que implican los estudios microbiológicos, es frecuente tener que recurrir inicialmente a un tratamiento empírico. La elección de antibiótico, vía y pauta de administración va a depender de múltiples factores, entre los que tienen especial importancia la situación clínica del paciente, las preferencias locales o individuales y el patrón regional de resistencia de los uropatógenos. La existencia en España de amplias resistencias a antimicrobianos1, clásicamente empleados en ensayos clínicos, limitará la aplicabilidad de muchos de los estudios de eficacia disponibles.
Habitualmente se opta por diferenciar el tratamiento de las ITU en función de que éstas afecten o no al parénquima renal. Sin embargo, la información clínica y las exploraciones complementarias empleadas en la práctica clínica no permiten diferenciar con seguridad las ITU de vías altas y bajas2. Los estudios realizados3-15 son de pequeño tamaño muestral y presentan importantes limitaciones metodológicas. Tanto la presencia de síntomas o signos (p. ej., fiebre), como las pruebas de laboratorio (proteína C reactiva [PCR], beta-2-microglobulina, N-acetil-beta-glucosaminidasa, procalcitonina, interleucinas), carecen de la suficiente sensibilidad y especificidad como para sustentar la toma de decisiones en ellas, de forma exclusiva; la procalcitonina, el parámetro con mayor rendimiento diagnóstico, puede ofrecer información válida, pero todavía existen dudas en lo que se refiere a la utilidad clínica real de la misma (esta información se analiza con más detalle en el documento sobre indicaciones de ingreso hospitalario).
La realización de una gammagrafía con ácido dimercaptosuccínico marcado con tecnecio 99 (DMSA) es el procedimiento de referencia para el diagnóstico de pielonefritis, pero su empleo sistemático no es viable ni está justificado. Por ello, en la práctica, se opta por diferenciar las ITU como de alto o bajo riesgo, en función de la edad (neonatos y lactantes pequeños) y de la existencia o no de fiebre y/o afectación general. Con esta estrategia, la mayoría de las pielonefritis serán incluidas, a expensas de tratar, como tales, muchas ITU que no lo son. Así, tanto la elección de antibiótico como la vía de administración y duración, van a estar supeditadas al grado de riesgo estimado.
Bases para la toma de decisiones
Disponemos de numerosos ensayos clínicos que han evaluado la eficacia clínica y microbiológica de distintas pautas terapéuticas. Sin embargo, muchos de esos estudios son antiguos o realizados en regiones con patrones de resistencia diferentes a los nuestros. En el informe técnico de la American Academy of Pediatrics publicado en 199916, se realizó una síntesis de los trabajos que habían estudiado la eficacia de distintas pautas de antibioterapia oral, en ITU mayoritariamente de bajo riesgo. Bloomfield et al17 publicaron en 2005 una revisión sistemática de ensayos clínicos que han comparado diferentes pautas de tratamiento de las pielonefritis agudas en la infancia. Otra revisión sistemática18 previa había evaluado las pautas de administración de aminoglucósidos en ITU19-22 y otras infecciones pediátricas, contrastando la eficacia de dosis únicas diarias con la de dosis múltiples.
Con respecto a la vía de administración del tratamiento antibiótico, diversos trabajos han analizado si en las ITU de alto riesgo (pielonefritis e ITU febriles) la vía intravenosa ofrece ventajas sobre la oral. Esta cuestión ha sido analizada en varios ensayos clínicos, algunos de ellos incluidos en la revisión Bloomfield et al17 y en dos estudios de costes23,24. Finalmente, la duración del tratamiento antibiótico (pautas cortas frente a largas) también ha sido objeto de estudio en diversos ensayos clínicos, en su mayoría incluidos en varias revisiones sistemáticas25-28.
Como se ha comentado anteriormente, toda esta información debe quedar supeditada a los patrones de resistencia de los uropatógenos en España. Disponemos de varios trabajos realizados en territorio nacional, que presentan el perfil etiológico y de resistencia en distintas series pediátricas, así como amplia información sobre el patrón de resistencia general de los uropatógenos en estudios nacionales, que recogen en algún caso amplias series multicéntricas1. A diferencia de la ITU del adulto, en la infancia es habitual la realización de urocultivo. Por ello, parece asumible la representatividad de los datos de resistencia publicados. Los resultados de los trabajos aludidos han sido analizados en un documento específico, por lo que en esta revisión sólo se comentarán de forma resumida.
Eficacia de distintas pautas terapéuticas
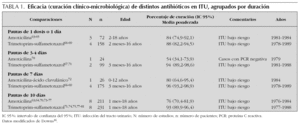
En la tabla 1 se presentan los resultados agrupados de los trabajos que comparan distintas pautas de tratamiento antibiótico oral en ITU de bajo riesgo, incluidos en el informe técnico de Downs16. Podemos observar como existe una tendencia a mayor eficacia en las pautas de mayor duración y en las que emplean cotrimoxazol con respecto a amoxicilina. No obstante, si observamos los años en los que se realizaron y los antibióticos que se emplearon (con altas resistencias en España de Escherichia coli), se entiende que la aplicabilidad de los resultados de estos estudios se vea muy comprometida.
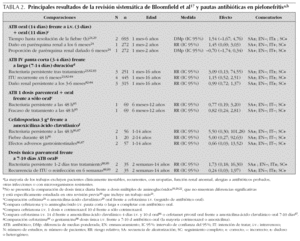
En cuanto al tratamiento de las pielonefritis o ITU de alto riesgo, en la tabla 2 se presentan los principales resultados de la revisión de Bloomfield et al17. No se encontraron diferencias significativas entre las pautas comparadas, tanto para medidas de efecto inmediatas (es muy poco frecuente el fracaso clínico-bacteriológico con las pautas comparadas) como para las diferidas (el riesgo de daño renal crónico apenas varía con el tratamiento elegido). El tratamiento inicialmente oral no es menos eficaz que el intravenoso, mientras que las pautas intravenosas de corta duración parecen ser igual de seguras que las largas.
El ensayo clínico con mayor rigor metodológico, el de Hoberman et al24, ha tenido una gran repercusión en el tratamiento de las ITU de alto riesgo, al mostrar que cefixima oral era tan eficaz como cefotaxima intravenosa. Sólo al considerar el subgrupo de casos con reflujo de alto grado se encontró un mayor riesgo de daño renal con el tratamiento oral (8/24 casos frente a 1/22; riesgo relativo [RR]: 7,33; intervalo de confianza [IC] 95 %: 1,00-54,01; número de pacientes que será necesario tratar [NNT]: 3; IC 95 % 2-12). También el tratamiento inicial con amoxicilina-ácido clavulánico oral ha mostrado una eficacia similar a la ceftriaxona intravenosa, aunque en un estudio de menor calidad29. Otros estudios no incluidos en la revisión de Bloomfield, que han comparado cefalosporinas de tercera generación orales y parenterales, han mostrado resultados comparables30.
Además de la eficacia del tratamiento oral, también se ha valorado su rentabilidad, y se ha estimado que su uso como tratamiento inicial24, o bien como tratamiento de continuación tras unos días de antibioterapia parenteral23, reduce de forma importante los costes asistenciales de las pielonefritis, sin perder efectividad.
La utilización de dosis única diaria de aminoglucósidos o dosis fraccionadas ha sido analizada por Contopoulos-Ioannidis et al18. El análisis de los trabajos sobre ITU pediátrica19-22 mostró que no existían diferencias en cuanto a eficacia clínico-microbiológica (RR: 1,43; IC 95 %: 0,24-8,43; 1/261 casos con dosis única frente a 0/256 casos con dosis fraccionada). Tampoco había diferencias en cuanto a nefrotoxicidad primaria, nefrotoxicidad secundaria u ototoxicidad. El análisis que incluyó otras infecciones pediátricas mostró que la nefrotoxicidad secundaria (excreción urinaria de proteínas o fosfolípidos) era menor con la dosis única diaria (4,4 % frente a 15,9 %), pero no había diferencias en otros resultados. Otros estudios no incluidos en la revisión han mostrado similares resultados31. Por otro lado, las dosis únicas diarias pueden facilitar el tratamiento ambulatorio asistido de algunos pacientes32.
En consonancia con los resultados de la anterior revisión, en un estudio realizado en España con lactantes de 1 a 20 meses con pielonefritis, tratados con dosis única diaria de gentamicina, no se encontraron diferencias en cuanto a eficacia clínico-bacteriológica o toxicidad, en relación con los controles históricos previamente tratados con tres dosis diarias33.
A continuación, resumimos los resultados de otros estudios no incluidos en revisiones sistemáticas:
Se ha comparado la eficacia de distintas cefalosporinas de tercera generación oral (ceftibuteno, cefixima) con la de cotrimoxazol en ITU febriles34, complicadas o recurrentes35, mostrando similar y alta eficacia clínica. Otras cefalosporinas de tercera generación oral se han valorado también como tratamiento de ITU en lactantes, y han mostrado una alta eficacia36.
Se ha comparado cefixima oral con amoxicilina-ácido clavulánico en ITU sugerentes de pielonefritis37. En este estudio, todas las cepas eran sensibles a cefixima, por un 69 % a amoxicilina-ácido clavulánico. Sólo se analizó la eficacia clínica de los casos con cepas sensibles a ambos antibióticos, sin encontrarse diferencias.
La eficacia de amoxicilina-ácido clavulánico se ha comparado con la de otros tratamientos clásicos (cotrimoxazol, cefaclor, nitrofurantoína)38, y ha mostrado una eficacia alta, con pequeñas diferencias que no eran significativas. En España es un tratamiento frecuentemente empleado por su cobertura microbiológica, eficacia y seguridad39,40.
Se ha comparado la eficacia de ceftriaxona (una dosis diaria) y cefotaxima (3-4 dosis), solas o en combinación con otros antibióticos (aminoglucósidos o ampicilina) en ITU graves, mostrando ambas una alta eficacia41. Por su comodidad de administración, ceftriaxona es frecuentemente utilizada en España, como tratamiento inicial en lactantes con ITU febril42. Otras cefalosporinas parenterales que se han comparado en pielonefritis pediátricas han sido cefepime (4.ª generación) y ceftazidima (3.ª generación), ambas con una alta eficacia43.
Fosfomicina ha sido objeto de estudio en muy pocos trabajos pediátricos44-48, mostrando una eficacia similar a aminoglucósidos en ITU de vías bajas45,47 y a ácido pipemídico en ITU recurrentes46.
Diversos estudios han valorado la eficacia y seguridad de cotrimoxazol49-51, cotrifamol51, pivampicilina52, aminoglucósidos53-55, ampicilina56, amoxicilina57, cefuroxima57 y cefalexina58, aunque los resultados de la mayoría de estos estudios tienen escaso interés clínico actualmente.
La información sobre la eficacia y seguridad de las fluoroquinolonas en la infancia es muy escasa. Se han descrito algunas series de casos de ITU por microorganismos multirresistentes tratados con ciprofloxacino, con una buena respuesta y sin efectos adversos reseñables59.
Sensibilidad a los antimicrobianos de los uropatógenos en España
Como hemos comentado, la sensibilidad en España de los principales uropatógenos va a condicionar la elección empírica de tratamiento. En un documento específico se presenta información detallada sobre el perfil etiológico de la ITU pediátrica y la sensibilidad de los principales patógenos urinarios.
No obstante, para orientar la toma de decisiones en la selección empírica de antibiótico presentamos aquí un resumen de la información más importante:
Escherichia coli sigue siendo el principal agente etiológico de ITU en la infancia (70-90 % de los casos), por lo que su patrón de sensibilidad determinará habitualmente la elección terapéutica empírica.
El predominio de E. coli se ve reducido en algunas circunstancias, en las que otros microorganismos incrementan su presencia. La exposición previa a antibióticos, el antecedente de hospitalización y la existencia de anomalías urinarias incrementan la probabilidad de que otros microorganismos, como Proteus mirabilis, Klebsiella spp. o Pseudomonas aeruginosa, sean los agentes responsables de ITU. Debemos considerar asimismo, especialmente en el niño pequeño, Enterococcus faecalis. Otros microorganismos poco frecuentes son: Enterobacter cloacae, Streptococcus agalactiae, Staphylococcus spp., Serratia marcescens, Morganella morganii, Citrobacter spp. y Acinetobacter spp. La información clínica disponible al diagnóstico no permite predecir con seguridad la etiología; tan sólo la tinción y examen microscópico de la orina puede ayudar a seleccionar un determinado tratamiento. Esta exploración complementaria, habitualmente no disponible, debería considerarse en pacientes con ITU de alto riesgo.
E. coli presenta en España un alto porcentaje de resistencia a ampicilina y cotrimoxazol, por lo que estos antibióticos no resultan adecuados como tratamientos empíricos, a pesar de que la resistencia a cotrimoxazol se ha reducido algo en los últimos años. Entre los antibióticos que en España mantienen una alta actividad frente a E. coli se encuentran las cefalosporinas de segunda y tercera generación, fosfomicina, aminoglucósidos y amoxicilina-ácido clavulánico. No obstante, esta última combinación presenta en algunas áreas porcentajes de resistencia crecientes. Igualmente, la resistencia a las cefalosporinas de primera generación es muy variable, y ha ascendido en algunas áreas hasta niveles que pueden comprometer su uso empírico.
Los datos disponibles sobre fluoroquinolonas, de series de aislamientos de población general y alguna pediátrica, sugieren que se ha producido un importante aumento de la resistencia de E. coli a ciprofloxacino y otras fluoroquinolonas. No obstante, a pesar de que se está extendiendo el uso de estos antimicrobianos en la infancia, por el momento ha quedado limitado al tratamiento de ITU complicadas, dirigido por cultivo y antibiograma.
P. mirabilis ofrece un perfil de sensibilidad similar al de E. coli, excepto para fosfomicina, que tiene una menor sensibilidad. Klebsiella pneumoniae presenta resistencia natural a ampicilina, manteniendo una alta sensibilidad a otros antibióticos habitualmente activos frente a ella. La aparición de cepas de Klebsiella productoras de betalactamasas de espectro ampliado, puede explicar que algunas series, fundamentalmente con casuística hospitalaria, muestren un descenso importante de la sensibilidad a cefalosporinas. Pseudomonas aeruginosa mantiene una buena sensibilidad a carbapenémicos (imipenem y meropenem), piperacilina-tazobactam, ceftazidima, tobramicina y amikacina, mientras que ha descendido algo para ciprofloxacino y gentamicina.
En la elección de tratamiento empírico debemos considerar que aunque las cefalosporinas de segunda y tercera generación presentan un perfil discretamente mejor que amoxicilina-ácido clavulánico para enterobacterias, sólo amoxicilina-ácido clavulánico permite cubrir un eventual, aunque poco frecuente, E. faecalis. Asimismo tenemos que valorar que los antecedentes de antibioterapia, hospitalización o anomalías urinarias incrementan el riesgo de que el agente etiológico sea resistente a los antibióticos de uso habitual.
Por último, teniendo en cuenta que ningún antibiótico garantiza una cobertura al 100 % de todos los posibles microorganismos, en casos de ITU de alto riesgo podemos necesitar asociaciones de antibióticos. Para cubrir un posible enterococo tendremos que incluir en la asociación ampicilina. Por otra parte, si queremos cubrir P. aeruginosa conviene que asociemos antibióticos específicos, ya que combinaciones clásicas, que incluyan gentamicina, pueden resultar insuficientes. Finalmente, resulta excepcional en la infancia tener que recurrir a carbapenémicos para cubrir posibles microorganismos multirresistentes (tales como cepas de Klebsiella con betalactamasas de espectro ampliado, Acinetobacter o Pseudomonas).
Duración del tratamiento
Siempre se ha considerado que las ITU en la infancia debían tratarse con antibióticos durante más de 7 días, por el mayor riesgo de nefropatía subyacente o daño renal, y las dificultades diagnósticas y terapéuticas propias de la edad pediátrica. Sin embargo, en un intento de simplificar la carga asistencial de las ITU, se ha comparado en múltiples trabajos la eficacia y seguridad de las pautas de duración estándar con pautas más cortas o en dosis única. Estos estudios se han realizado fundamentalmente en ITU de bajo riesgo, sobre todo con tratamientos por vía oral y en su mayoría con antibióticos en la actualidad cuestionados en el ámbito español por presentar altos porcentajes de resistencia.
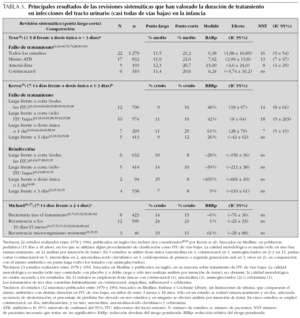
En la tabla 3 se presentan los principales resultados de tres revisiones sistemáticas que han analizado los estudios sobre duración del tratamiento en la edad pediátrica. Las principales diferencias existentes entre estas revisiones se deben a variaciones en los criterios de selección de estudios25-28, fundamentalmente la inclusión o no de trabajos con pautas de antibioterapia en dosis única. Las pautas largas son más eficaces que las cortas, si entre éstas se incluyen tratamientos con dosis única (diferencias absolutas entre el 5 y el 14 %; NNT entre el 7 y el 18). Sin embargo, cuando estas pautas se excluyen, comparando duraciones entre 3 y 4 días con otras más prolongadas, las diferencias desaparecen. Por otra parte, en la revisión de Tran et al28, que incluía tratamientos con dosis únicas, las diferencias entre pautas largas y cortas eran mayores con amoxicilina (diferencias estadísticamente significativas) que con cotrimoxazol.
La revisión sistemática de Michael et al26,27, la que emplea criterios de selección más estrictos, sugiere que las pautas de 3 y 4 días pueden ser igualmente eficaces que las de más de 7 días en el tratamiento de las ITU de vías bajas. Sin embargo, la generalización de estos resultados debe ser mediatizada por las muestras de pacientes que han sido incluidas en los estudios analizados. Todos los estudios excluyen pacientes catalogados clínicamente como pielonefritis o que tuvieran anomalías urinarias, en los que es previsible un mayor riesgo de recurrencias con pautas cortas60. Asimismo, un estudio con gran contribución a la revisión sistemática incluye casos de bacteriuria asintomática61, y todos los trabajos, pacientes con ITU recurrentes; ambos factores han podido influir, incrementando el riesgo de fracaso bacteriológico. Por tanto, todavía existen dudas sobre si las pautas cortas son aplicables a lactantes con ITU febriles o a niños con primeras ITU.
Consideraciones farmacodinámicas y farmacocinéticas
La mayoría de antibióticos son eliminados en su forma activa por vía urinaria, y sus concentraciones urinarias son de 100 a 1.000 veces superiores a las plasmáticas62. Por tanto, las concentraciones de los antibióticos en orina son, a menudo, más elevadas que las concentraciones inhibitorias mínimas (CIM) para los microorganismos patógenos más comunes, incluso para antibióticos que se muestran inactivos in vitro. En cambio, las concentraciones de los antibióticos en el tejido renal son iguales o menores a las plasmáticas para la mayoría de antibióticos, con una excepción importante: los antibióticos aminoglucósidos, que alcanzan concentraciones tisulares renales superiores a las concentraciones plasmáticas, como consecuencia de la reabsorción y la unión a las células del epitelio tubular proximal.
Es importante señalar que las elevadas concentraciones de los antibióticos en orina no implican que tengan una actividad o efecto antimicrobiano frente a los patógenos que causan la infección localizada en la pared vesical; sólo los antibióticos administrados por vía sistémica pueden alcanzar concentraciones adecuadas en el tejido vesical a través de la circulación sanguínea y, por tanto, actuar sobre las bacterias en esta localización.
En un modelo experimental de ITU por E. coli en ratones, se ha comparado el efecto bactericida de cinco antibióticos betalactámicos (mecillinam, amoxicilina-ácido clavulánico, cefuroxima, cefotaxima y ceftriaxona) administrados en dos dosis diarias durante 3 días, y se ha observado que la actividad bactericida se correlacionaba con el tiempo que el antibiótico mantenía concentraciones por encima de la CIM en suero, orina y tejido renal. La ceftriaxona era el antibiótico más efectivo debido a su elevada semivida de eliminación. A diferencia de los betalactámicos, la actividad bactericida de gentamicina y ciprofloxacino se correlacionaba con el área bajo la curva por encima de la CIM62. Este comportamiento tiene relación con los resultados de las pautas de aminoglucósidos con dosis única diaria.
En una revisión de 16 estudios sobre tratamiento de ITU no complicadas con ampicilina o amoxicilina en adultos, se ha estimado que desde el punto de vista farmacocinético, la máxima tasa de curación se obtiene cuando la concentración sérica se mantiene 30 h por encima de la CIM62. Según esta aproximación, la pauta de dosificación óptima de amoxicilina, es decir, la menor dosis posible durante un período de tiempo lo más corto posible y con una máxima tasa de curación bacteriológica, sería la de tres dosis diarias (de 500 mg) durante 4 días.
Recomendaciones de las guías de práctica clínica
En la tabla 4 se presentan las recomendaciones de distintas guías de práctica clínica y protocolos. Puede comprobarse la existencia de una importante heterogeneidad, que en algunos aspectos podría estar justificada (preferencias de antibioterapia en función de distintos patrones de resistencia), pero que, en general, refleja la variabilidad existente en el tratamiento de la ITU pediátrica. Merece la pena destacar que, en su mayoría, ofrecen una visión conservadora: no recomiendan pautas de tratamiento cortas o con dosis únicas, asumen el tratamiento parenteral de las pielonefritis o ITU de alto riesgo y establecen pocas jerarquías en la elección de antibióticos.
En lo que respecta a la clasificación de los pacientes, la mayoría ha optado por emplear criterios operativos como la edad, la presencia de fiebre elevada o la necesidad de ingreso, en vez de diferenciar las ITU como pielonefritis o de vías bajas, para lo que sería necesario emplear pruebas diagnósticas habitualmente no disponibles.
Debemos advertir que diversas guías realizadas fuera de España recomiendan algunos antibióticos que no son adecuados para su uso empírico en nuestro país, especialmente los aplicables a tratamientos por vía oral (cotrimoxazol o amoxicilina). Por otra parte, se echa en falta que las guías establezcan jerarquías concretas para la elección de tratamiento, de manera que contáramos con tratamientos de primera elección y alternativos; este hecho puede deberse a la carencia de estudios que cuantifiquen la relación entre el coste y la efectividad de las distintas estrategias.
En conclusión, la información procedente de ensayos clínicos que han evaluado la eficacia de distintos antimicrobianos resulta poco útil en la toma de decisiones, porque muchos de ellos valoran tratamientos frente a los que existe un alto nivel de resistencia en España. Aunque algunos estudios permiten etiquetar ciertos antibióticos como suficientemente eficaces, no facilitan el establecimiento de jerarquías claras en la elección terapéutica. Sin embargo, sí que disponemos de información, procedente de ensayos clínicos y revisiones sistemáticas, sobre la eficacia de distintas vías o pautas de administración y acerca de la duración del tratamiento, a pesar de que esta información resulta de dudosa aplicación clínica a ciertos grupos de pacientes.
Si excluimos las cistitis del niño mayor, la diferenciación de las ITU, como de vías altas o bajas, resulta poco operativa, y en la práctica se opta por diferenciarlas como de alto o bajo riesgo, en función de la edad del paciente y la presencia de fiebre y/o repercusión general. Ante las dificultades existentes para cuantificar de forma objetiva el nivel de riesgo de un paciente concreto, la utilización de pautas de tratamiento por vía oral o las de corta duración, que se han mostrado equivalentes a las pautas estándar, dependerá de criterios subjetivos. Considerando que esta subjetividad influirá también en la decisión de ingreso hospitalario, es probable que el tratamiento inicial se vea más condicionado por la hospitalización que por la localización teórica de la ITU.
Finalmente, la elección de antibiótico va a depender en gran manera de las resistencias a antimicrobianos que tienen los uropatógenos en España, aunque sin olvidar la eficacia clínica que han mostrado las principales opciones terapéuticas.
Preguntas al panel de expertos
1.¿Debe diferenciarse el tratamiento de la ITU en la infancia en función del nivel de riesgo del paciente? ¿Podemos seleccionar el tipo de tratamiento en función de la clínica del paciente, la edad de éste o la necesidad de hospitalización?
2.¿Qué antibióticos deben ser considerados como de primera elección y alternativos en la ITU en la infancia? ¿Debe diferenciarse en función del nivel de riesgo?
3.¿Cuál es la vía de administración de antibióticos (inicial y de continuación) más apropiada? ¿Debe diferenciarse en función del nivel de riesgo?
4.¿Cuál es la pauta de administración de antibióticos (número de dosis/día) más apropiada? ¿Debe diferenciarse en función del nivel de riesgo?
5.¿Cuál es la duración de la antibioterapia más apropiada? ¿Debe diferenciarse en función del nivel de riesgo?
Miembros del Grupo Investigador del Proyecto "Estudio de la Variabilidad e Idoneidad del Manejo Diagnóstico y Terapéutico de las Infecciones del Tracto Urinario en la Infancia"
C. Ochoa Sangrador (Hospital Virgen de la Concha, Zamora); C. Pérez Méndez y G. Solís Sánchez (Hospital de Cabueñes, Gijón, Asturias); J.C. Molina Cabañero y J. Lara Herguedas (Hospital del Niño Jesús, Madrid); F. Conde Redondo, R. Bachiller Luque, J.M.ª Eiros Bouza, V. Matías del Pozo y B. Nogueira González (Hospital Clínico Universitario, Valladolid); M.ªC. Urueña Leal, J.M. Andrés de Llano, P. Rostami y J.F. Sáenz Martín (Complejo Asistencial de Palencia); E. Formigo Rodríguez, M. Cueto Baelo y M.ªC. González Novoa (Hospital Xeral-Cies, Vigo, Pontevedra); N. Silva Higuero y H. González García (Hospital de Medina del Campo, Valladolid); J. González de Dios (Hospital de Torrevieja, Alicante); M. Brezmes Raposo (Hospital La Fe, Valencia); M.ªM. Urán Moreno y J.M. Gea Ros (Hospital Universitario San Juan, Alicante); M.ªV. Barajas Sánchez, M.ªF. Brezmes Valdivieso y M.ªA. Fernández Testa (Hospital Virgen de la Concha, Zamora).
Financiado parcialmente por una beca de la Gerencia Regional de Salud de la Junta de Castilla y León (año 2006).
Correspondencia: Dr. C. Ochoa Sangrador.
Unidad de Investigación. Hospital Virgen de la Concha.
Avda. Requejo, 35. 49029 Zamora. España.
Correo electrónico: cochoas@meditex.es
Recibido en mayo de 2007.
Aceptado para su publicación en junio de 2007.