Introducción
En los primeros estudios de infección del tracto urinario (ITU) en la infancia se observó una alta frecuencia de reflujo vesicoureteral (RVU) y cicatrices renales en los niños investigados tras un episodio de ITU. Esto llevó a recomendar la realización de estudios de imagen en todos los niños tras una ITU, con el fin de detectar los casos de alto riesgo y prevenir el daño renal. Esta estrategia se basaba en la asunción de que las cicatrices renales eran adquiridas y prevenibles, que la combinación de RVU e infección era la causa del daño renal y que los niños con alto riesgo de daño renal podían ser claramente identificados1. Desde la publicación del trabajo de Normand y Smellie2 en 1965, en el que observaban una disminución en el número de episodios de ITU tras la administración de quimioprofilaxis (2,5 episodios/año antes del tratamiento y 0,37 episodios/año tras el mismo), la comunidad científica asumió que la administración prolongada de antibióticos en dosis bajas sería útil para evitar nuevos episodios de ITU y la aparición de cicatrices renales, y esta asunción se ha convertido en la práctica habitual.
Bases para la toma de decisiones
Contamos con varias revisiones que han analizado los ensayos clínicos en los que se ha valorado la eficacia de la profilaxis antibiótica en población pediátrica3-7, tanto en niños con ITU como en pacientes con RVU. Otros trabajos, ofrecen información suplementaria sobre la eficacia de la profilaxis y las diferencias existentes en función del antibiótico empleado. Por último, varios estudios han valorado la evolución de los pacientes con RVU tratados con profilaxis antibiótica en comparación con los tratados quirúrgicamente.
Profilaxis antibiótica en pacientes con ITU: antibiótico frente a placebo (o no antibióticos)
Se han identificado dos revisiones sistemáticas que evalúan el beneficio de la profilaxis antimicrobiana en la ITU comparada con placebo o no antibióticos en pacientes pediátricos3,5.
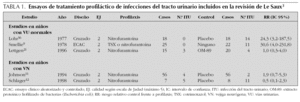
En la revisión de Le Saux3 se analizan cinco estudios que investigan la utilidad de la profilaxis con antibióticos comparada con placebo o no antibióticos para la disminución de la frecuencia de episodios de ITU. Todos los estudios incluyen un número pequeño de niños y su calidad metodológica es baja (intervalo: de 0 a 2 en la escala de Jadad). Tres de los estudios incluyen a niños con tracto urinario normal8-10, y dos a niños con vejiga neurógena sometidos a sondaje intermitente11,12. Los resultados se muestran en la tabla 1. A pesar de que en dos de los estudios se encuentra una significativa reducción de ITU durante la profilaxis, los revisores concluyen que la evidencia disponible sobre el uso de profilaxis antimicrobiana para prevenir ITU en niños con tracto urinario normal o vejiga neurógena es de baja calidad. Además, se sorprenden de la ausencia de datos referidos a los niños con RVU3.
En la tabla 2 se presentan los principales resultados de otra revisión sistemática5 de la Colaboración Cochrane, que también analiza el uso prolongado de antibióticos para la prevención de la ITU. Ofrece cuatro estudios (uno de ellos ya incluido en la anterior revisión) que examinaron el efecto de antibióticos frente a placebo9,13,14 o compararon la profilaxis con dos antibióticos distintos entre sí15; la mayoría de los pacientes en estos ensayos eran niños con tracto urinario normal. En general, la calidad de los estudios fue deficiente, estando expuestos a sesgos que tienden a sobrevalorar el efecto en los ensayos clínicos. En comparación con el placebo o ningún tratamiento, los antibióticos redujeron el riesgo de ITU recurrente (riesgo relativo [RR]: 0,36; intervalo de confianza [IC] 95 %: 0,16 a 0,77; diferencia de riesgos [DR]: 46 %; IC 95 %: 59 % a 33 %; número de pacientes que será necesario tratar [NNT]: 2). Los mismos autores han publicado otro trabajo con una revisión sistemática que presenta algunas variaciones en la inclusión de estudios y el análisis16 con respecto a la revisión Cochrane. Este trabajo incluye un estudio17 no considerado en la revisión Cochrane, que especifica si las ITU eran sintomáticas o no, y encontró que, aunque la frecuencia de ITU sintomática era mayor en el grupo placebo, las diferencias no fueron estadísticamente significativas (RR: 1,93 [IC 95 %: 0,63-5,92]). Los autores de estas revisiones concluyen que el escaso número de estudios y su deficiente calidad no proporcionan pruebas fiables que demuestren la efectividad de los antibióticos para prevenir la ITU recurrente sintomática5,16.
Un ensayo clínico reciente18 analiza la eficacia de la profilaxis con antibióticos en la prevención de las infecciones recurrentes, la recurrencia de pielonefritis y la aparición de nuevas cicatrices renales en niños con y sin RVU. No hubo diferencias significativas entre los grupos respecto a la frecuencia de ITU recurrentes, tipo de recurrencia (cistitis frente a pielonefritis) y desarrollo de cicatrices renales; es llamativo el dato de que, entre los pacientes con RVU, presentaron pielonefritis 7 de los 55 que recibieron profilaxis y sólo uno de los 58 que no la recibieron (p = 0,029). Nuevamente, los autores concluyen que su estudio no apoya el uso de la profilaxis con antibióticos para prevenir la recurrencia de ITU.
En un ensayo clínico realizado en 150 niños con ITU recurrentes, de entre 4 y 36 meses de edad y sin anomalías anatómicas de las vías urinarias, se compararon tres tipos de tratamiento preventivo: profilaxis antibiótica, oxibutinina y la combinación de ambas19. La recurrencia de ITU fue mayor con profilaxis antibiótica (44/50) que con oxibutinina (14/50), y la combinación de ambas resultó la pauta más eficaz (3/50). La posible existencia de cuadros de disfunción vesical entre los pacientes estudiados podría explicar estos hallazgos. No obstante, el estudio no aporta suficiente información para poder valorar la validez de los resultados.
Profilaxis antibiótica en pacientes con ITU: comparación entre distintos antibióticos
Un estudio20, incluido en la revisión sistemática de Williams5, ha comparado nitrofurantoína con trimetoprim para la disminución del número de ITU (sintomáticas y asintomáticas) y demostró que la nitrofurantoína era superior (RR: 0,48 [IC 95 %: 0,25-0,92]; DR: 18 % [IC 95 %: 34 % a 3 %]). Sin embargo, la probabilidad de suspender el tratamiento debido a efectos secundarios digestivos fue tres veces mayor en el grupo que recibió nitrofurantoína que en el grupo que recibió trimetoprim. Otro estudio comparó nitrofurantoína con cefixima, y no se apreciaron diferencias significativas entre los dos tratamientos21. También se ha comparado cefradoxilo con cefprozil y cotrimoxazol en niños con ITU sin anomalías de las vías urinarias, y se han encontrado pequeñas diferencias a favor del cefradoxilo en la incidencia de ITU sintomática, por más que no eran estadísticamente significativas22.
Un ensayo clínico cruzado ha comparado la eficacia de pivmecillinam frente a nitrofurantoína en 35 niños con RVU o ITU recurrentes23, sin encontrar diferencias en la tasa de recurrencias, pero sí en su perfil etiológico. En los tratados con pivmecillinam fueron mayoritariamente debidas a Enterococcus faecalis (sólo el 20 % a E. coli). En otro ensayo clínico, a 30 niños con ITU y RVU sometidos a profilaxis antibiótica, con cirugía o sin ella, se les asignó aleatoriamente a recibir nitrofurantoína o cotrimoxazol; la recurrencia de infecciones fue similar con ambos tratamientos24.
La concentración urinaria es un parámetro importante en la eficacia de la profilaxis antibiótica: cuanta más concentración se produce de la orina, es esperable una mayor inhibición del crecimiento bacteriano. Un estudio en pacientes con RVU que recibían profilaxis antibiótica, a quienes se les recogieron muestras de orina a diferentes horas del día, encontró que la concentración urinaria era más alta en las primeras horas del día y en niños mayores25. Las orinas más concentradas mostraban in vitro una mayor capacidad de inhibición bacteriana. Comparando la capacidad de inhibición de las orinas de los pacientes tratados con diferentes antibióticos, los tratados con cotrimoxazol o cefixima mostraban un efecto bactericida sostenido mayor que los tratados con ácido nalidíxico y cefalexina, llegando incluso a cubrir más del 60 % de las horas del día, por su larga semivida.
Profilaxis antibiótica en pacientes con reflujo vesicoureteral
Una revisión sistemática ha valorado la eficacia de distintas intervenciones para el RVU primario4, y ha hallado un único estudio que comparaba ningún tratamiento frente a dos regímenes de profilaxis antibiótica10. No existían diferencias significativas en el riesgo de ITU entre la profilaxis antibiótica diaria y ninguna profilaxis (RR: 0,25 [IC 95 %: 0,03-1,83]) o entre la profilaxis intermitente y ninguna profilaxis (RR: 0,46 [IC 95 %: 0,10-2,00]). Tampoco existieron diferencias significativas en el riesgo de lesión del parénquima renal entre la profilaxis antibiótica diaria y ninguna profilaxis (RR: 0,40 [IC 95 %: 0,02 a 9,18]) o entre la profilaxis intermitente y ninguna profilaxis (RR: 0,38 [IC 95 %: 0,02-8,59]). No obstante, este estudio incluía sólo 43 niños y no especificaba la edad de los mismos, como tampoco el grado de RVU ni el antibiótico utilizado.
A la hora de valorar la utilidad de la profilaxis antibiótica, puede tener un interés indirecto considerar la información disponible sobre la evolución de los pacientes con RVU que reciben profilaxis antibiótica. Recientemente, Venhola et al7 han publicado una revisión sistemática que incluye tres ensayos clínicos y dos estudios de cohortes que comparaban la eficacia del tratamiento médico del RVU (profilaxis antibiótica) con respecto al quirúrgico (RVU grados III-IV), sin encontrar diferencias en la recurrencia de ITU, desarrollo de cicatrices renales o crecimiento renal. Otra revisión no sistemática6 ha analizado cinco ensayos clínicos aleatorizados que contrastaban la eficacia del tratamiento médico frente al quirúrgico, en RVU de grados III a V, para la prevención de nuevas cicatrices renales; tampoco encontraron diferencias entre ambas opciones, y los porcentajes de casos con nuevas cicatrices fueron del 11,3 y el 12,6 %, respectivamente. En 2006 se han publicado los resultados finales del International Reflux Study26, en el que 252 niños, con RVU de grado III-IV fueron asignados a recibir tratamiento médico o quirúrgico. El seguimiento a 10 años ha mostrado que aunque la recurrencia de ITU febril era mayor en el grupo con tratamiento médico (25 % frente a 14 %; p = 0,03), no hubo diferencias en la aparición de nuevas cicatrices renales o función renal. Otros ensayos clínicos y estudios de cohortes han encontrado hallazgos similares27,28.
Finalmente, varios estudios retrospectivos29,30 han valorado las consecuencias de la retirada de la profilaxis antibiótica en niños con RVU persistente bajo seguimiento prolongado, en su mayoría a partir de los cuatro años de edad, sin encontrar consecuencias de interés en el control evolutivo.
Recomendaciones de las guías de práctica clínica
La tabla 3 recoge las recomendaciones referentes a la profilaxis con antibióticos recogidas en las guías de práctica clínica o protocolos de distintas sociedades científicas o grupos de expertos.
Algunas, como la de la Asociación Española de Pediatría31, la de la American Academy of Pediatrics32 y la Colombiana de Urología33 recomiendan la profilaxis hasta que se completen los estudios de imagen y, aunque dan a entender que en algunos casos estaría indicada su continuación, no especifican cuáles son estos casos, ni durante cuánto tiempo ha de mantenerse.
En general, las guías aconsejan la utilización de profilaxis en niños con RVU (sólo los de mayor grado, como la guía sueca34, o cualquier grado, como la guía india35), cicatrices renales o infecciones frecuentes.
Se ha llegado a la conclusión de que la evidencia que apoya el uso prolongado de antibióticos en la prevención de la ITU y el desarrollo de cicatrices renales es escasa y de baja calidad. La mayoría de los estudios han sido realizados en niños con tracto urinario normal y es sorprendente la escasa información existente respecto a su eficacia en los niños con RVU, precisamente el grupo de niños en los que la mayoría de las guías de práctica clínica recomienda esta intervención terapéutica. Considerando la escasa evidencia disponible, parece necesario replantearse el uso de la profilaxis antibiótica en la infancia.
Preguntas al panel de expertos
1.¿Está indicada la profilaxis con antibióticos en niños con tracto urinario normal tras un primer episodio de infección urinaria?
2.¿Está indicada la profilaxis con antibióticos en niños con RVU tras un primer episodio de infección urinaria?
3.¿Está indicada la profilaxis con antibióticos en niños con cicatrices renales en ausencia de RVU tras un primer episodio de infección urinaria?
4.¿Está indicada la profilaxis con antibióticos en niños con infecciones recurrentes del tracto urinario?
5.Si está indicada la profilaxis, ¿qué antibiótico hay que utilizar y durante cuánto tiempo? ¿Cuáles serían de primera elección y cuáles alternativos?
Miembros del Grupo Investigador del Proyecto "Estudio de la Variabilidad e Idoneidad del Manejo Diagnóstico y Terapéutico de las Infecciones del Tracto Urinario en la Infancia"
C. Ochoa Sangrador (Hospital Virgen de la Concha, Zamora); C. Pérez Méndez y G. Solís Sánchez (Hospital de Cabueñes, Gijón, Asturias); J.C. Molina Cabañero y J. Lara Herguedas (Hospital del Niño Jesús, Madrid); F. Conde Redondo, R. Bachiller Luque, J.M.ª Eiros Bouza, V. Matías del Pozo y B. Nogueira González (Hospital Clínico Universitario, Valladolid); M.ªC. Urueña Leal, J.M. Andrés de Llano, P. Rostami y J.F. Sáenz Martín (Complejo Asistencial de Palencia); E. Formigo Rodríguez, M. Cueto Baelo y M.ªC. González Novoa (Hospital Xeral-Cies, Vigo, Pontevedra); N. Silva Higuero y H. González García (Hospital de Medina del Campo, Valladolid); J. González de Dios (Hospital de Torrevieja, Alicante); M. Brezmes Raposo (Hospital La Fe, Valencia); M.ªM. Urán Moreno y J.M. Gea Ros (Hospital Universitario San Juan, Alicante); M.ªV. Barajas Sánchez, M.ªF. Brezmes Valdivieso y M.ªA. Fernández Testa (Hospital Virgen de la Concha, Zamora).
Financiado parcialmente por una beca de la Gerencia Regional de Salud de la Junta de Castilla y León (año 2006).
Correspondencia: Dr. C. Ochoa Sangrador.
Unidad de Investigación. Hospital Virgen de la Concha.
Avda. Requejo, 35. 49029 Zamora. España.
Correo electrónico: cochoas@meditex.es
Recibido en mayo de 2007.
Aceptado para su publicación en junio de 2007.