Introducción
Se acepta de manera generalizada que los niños diagnosticados de infección del tracto urinario (ITU) deben recibir precozmente tratamiento antibiótico, con el fin de prevenir el desarrollo de cicatrices renales, secundarias a una posible pielonefritis aguda (PA)1-3. En las distintas publicaciones existe amplia coincidencia sobre el tipo de tratamiento que deben recibir los niños con ITU que presentan mal estado general; sin embargo, no existe el mismo consenso con respecto al tratamiento de los niños pequeños con ITU y buen estado general4,5. Hasta hace pocos años, la mayoría de los libros de texto, publicaciones científicas y guías clínicas recomendaban el ingreso hospitalario de los niños pequeños diagnosticados de ITU, con el fin de administrarles tratamiento antibiótico por vía intravenosa, al menos en los primeros días de la enfermedad6-9.
Sin embargo, tras la publicación por Hoberman10 en 1999 de un ensayo clínico (véase más adelante en este documento), en el que se observa que el tratamiento oral con cefixima puede ser igual de efectivo que el tratamiento intravenoso con cefotaxima, muchos pediatras han vuelto a revisar los criterios de ingreso hospitalario en los niños con ITU. Debe tenerse en cuenta que ingresar a un niño de forma innecesaria significa, además del impacto psicológico que supone separarlo de su ambiente familiar, aumentar innecesariamente el riesgo de contraer otra infección, alterar la vida de la familia y aumentar los costes (costes extras del tratamiento hospitalario con respecto al ambulatorio). Frente a este aspecto de la cuestión debe sopesarse que tratar de forma inadecuada a un niño que padece una PA significa aumentar el riesgo de que se produzcan lesiones renales cicatriciales o, más excepcionalmente, el desarrollo de una sepsis de origen urinario.
Bases para la toma de decisiones
Apenas existen publicaciones que estudien específicamente la efectividad o rentabilidad del ingreso hospitalario en los niños con ITU. Para intentar abordar esta cuestión hemos analizado tres aspectos que de manera indirecta puedan aportar suficiente información para tomar la decisión de ingresar o no, en el hospital, a un niño con ITU: 1. indicadores clínico-análiticos de PA y, por tanto, de mayor riesgo de desarrollar cicatrices renales y otras complicaciones; 2. efectividad del tratamiento antibiótico oral comparado con el intravenoso, en caso de que el niño sea enviado a su domicilio, y 3. recomendaciones de las guías de práctica clínica.
Indicadores clínico-analíticos de pielonefritis aguda
La posibilidad de diagnosticar la localización de la ITU en la fase aguda es un aspecto importante de su tratamiento: las infecciones de las vías urinarias altas (pielonefritis aguda) tienen más riesgo de complicaciones y pueden necesitar, posteriormente, estudio y seguimiento más prolongados que las infecciones de vías urinarias bajas (cistouretritis).
El método con mayor fiabilidad para el diagnóstico de la localización de la ITU es la escintigrafía renal 99mTc-DMSA (gammagrafía DMSA)11-13. Se trata de una prueba de imagen que permite el diagnóstico temprano de lesiones en el parénquima renal. De hecho, la mayoría de los trabajos que evalúan otros indicadores de lesión renal utilizan la gammagrafía DMSA como patrón estándar de referencia. El mayor problema de esta técnica es que resulta cara, muchos centros no disponen de ella y utiliza contraste radiactivo.
Indicadores clínicos
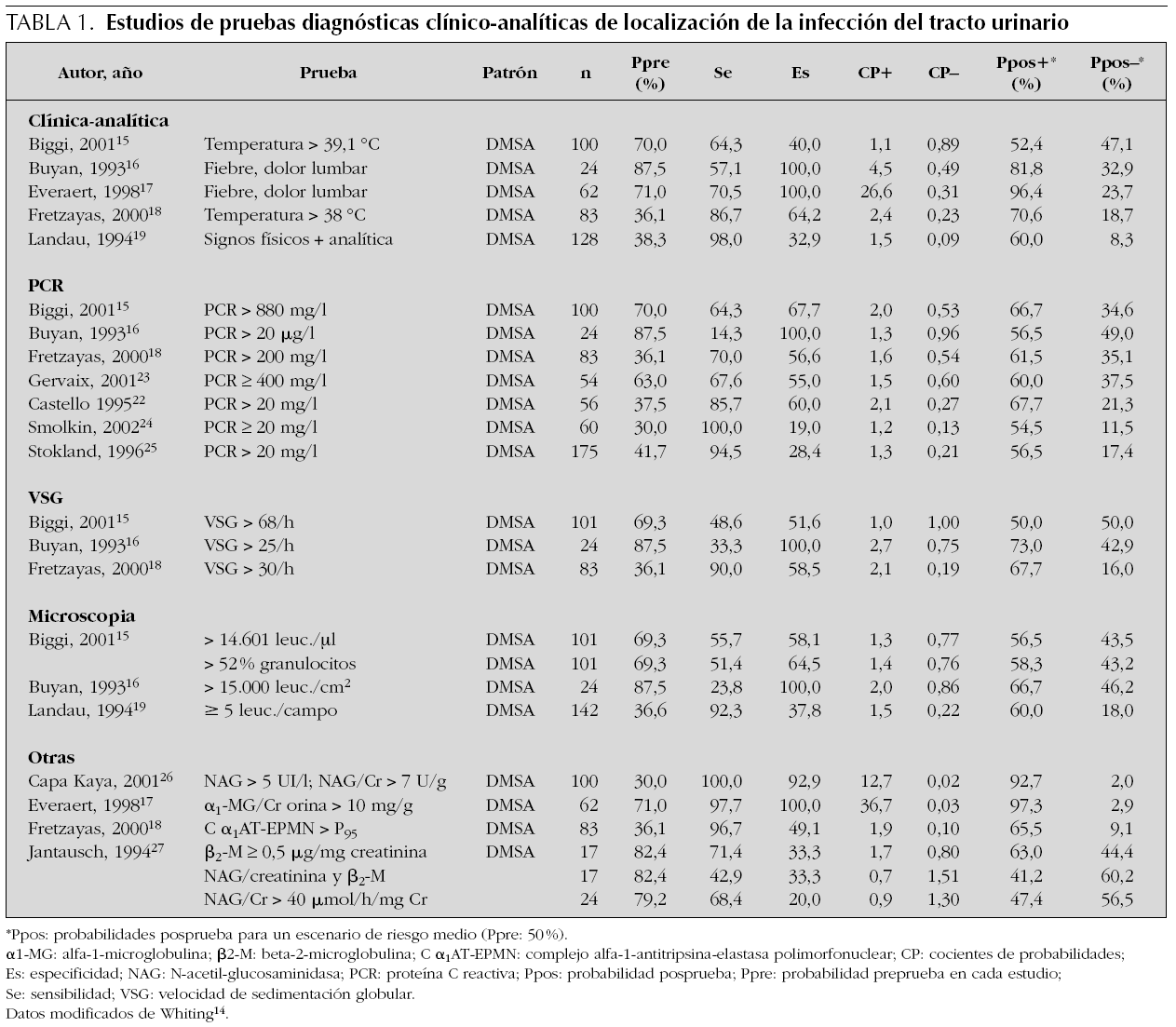
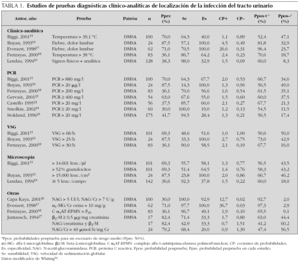
Se han realizado muchos trabajos que estudian variables clínicas que permitan diagnosticar la localización de la ITU; en la tabla 1 aparece una relación de las publicaciones más relevantes. En la revisión sistemática de Whiting et al14 se citan cinco trabajos15-19; en todos se utiliza la gammagrafía DMSA como patrón de referencia. En dos de estas publicaciones se estudia la temperatura como variable para el diagnóstico de PA. El resultado en ambos estudios fue poco satisfactorio: se encontró una sensibilidad del 64 % y una especificidad del 40 % para 39 °C de temperatura como punto de corte y sensibilidad del 87 % y especificidad del 64 % cuando el punto de corte fue de 38 °C. Hubo dos trabajos que evaluaron síntomas clínicos relacionados con PA: los resultados tampoco fueron idóneos, hallaron valores de sensibilidad entre el 57 y el 71 %, aunque la especificidad fue del 100 %. Finalmente, una publicación estudió conjuntamente la existencia de síntomas clínicos o de hallazgos positivos en las variables de laboratorio; en este caso, la sensibilidad encontrada fue muy elevada (98 %), pero la especificidad, muy baja (33 %). En general, en estos trabajos los criterios de selección de los pacientes fueron muy diferentes y la metodología no se describe claramente como para poder sacar conclusiones.
Algunos autores han sugerido que considerar la presencia de fiebre como marcador de ITU de alto riesgo permitiría seleccionar y tratar correctamente la mayoría de las PA aun a expensas de tratar, como tales, muchas ITU que no lo son20,21 (aproximadamente, por cada dos verdaderas PA trataríamos una que no lo sería).
Indicadores analíticos
En la misma revisión de Whiting14 se refieren ocho publicaciones15,16,18,19,22-25 que estudian la proteína C reactiva (PCR) como variable bioquímica relacionada con PA. Todos los estudios utilizaron también la gammagrafía DMSA como referencia estándar. Los resultados fueron diferentes en función del punto de corte adoptado para los valores de la PCR. Tres estudios utilizaron una concentración de 20 mg/l para definir un resultado como positivo; encontraron una alta sensibilidad (85 %) pero una pobre especificidad (19-60 %). El resto de los trabajos fijaron valores de corte de la PCR sorprendentemente muy dispares (entre 20 μg/l y 880 mg/l). Los resultados, lógicamente, también fueron muy desiguales; cuando los valores de PCR adoptados como positivos fueron elevados, la sensibilidad fue entre el 65 y el 70 % y la especificidad, entre el 55 y el 68 %. En un trabajo16 en el que se fijó como positiva una concentración de la PCR tan baja como es 20 μg/l, la especificidad fue del 100 % pero la sensibilidad, del 14 %.
En la revisión de Whiting14 se refieren otras publicaciones que estudian variables de laboratorio en plasma y en orina como indicadores de PA. En el plasma se valoraron la velocidad de sedimentación globular (VSG)15,16,18, N-acetil-β -glucosaminidasa (NAG), NAG/creatinina26,27 y complejo alfa 1 antitripsina-elastasa polimorfonuclear18. En la orina, las variables investigadas fueron el cociente α1-microglobulina/creatinina17 y el análisis microbiológico del sedimento urinario15,16,19,27,28.
El resultado final de todas estas publicaciones no permite extraer conclusiones claras debido al pequeño tamaño de algunos ensayos, a que los indicadores estudiados son muy diversos y al hecho de que las metodologías y los distintos puntos de corte para valores positivos fueron muy diferentes. Si descartamos algún estudio aislado con sorprendentes indicadores de validez, en general el rendimiento diagnóstico de los distintos parámetros es pobre. Además, modificaciones en los puntos de corte elegidos apenas mejoran la validez global de estas pruebas, ya que sólo consiguen altas sensibilidades a expensas de muy bajas especificidades, o viceversa.
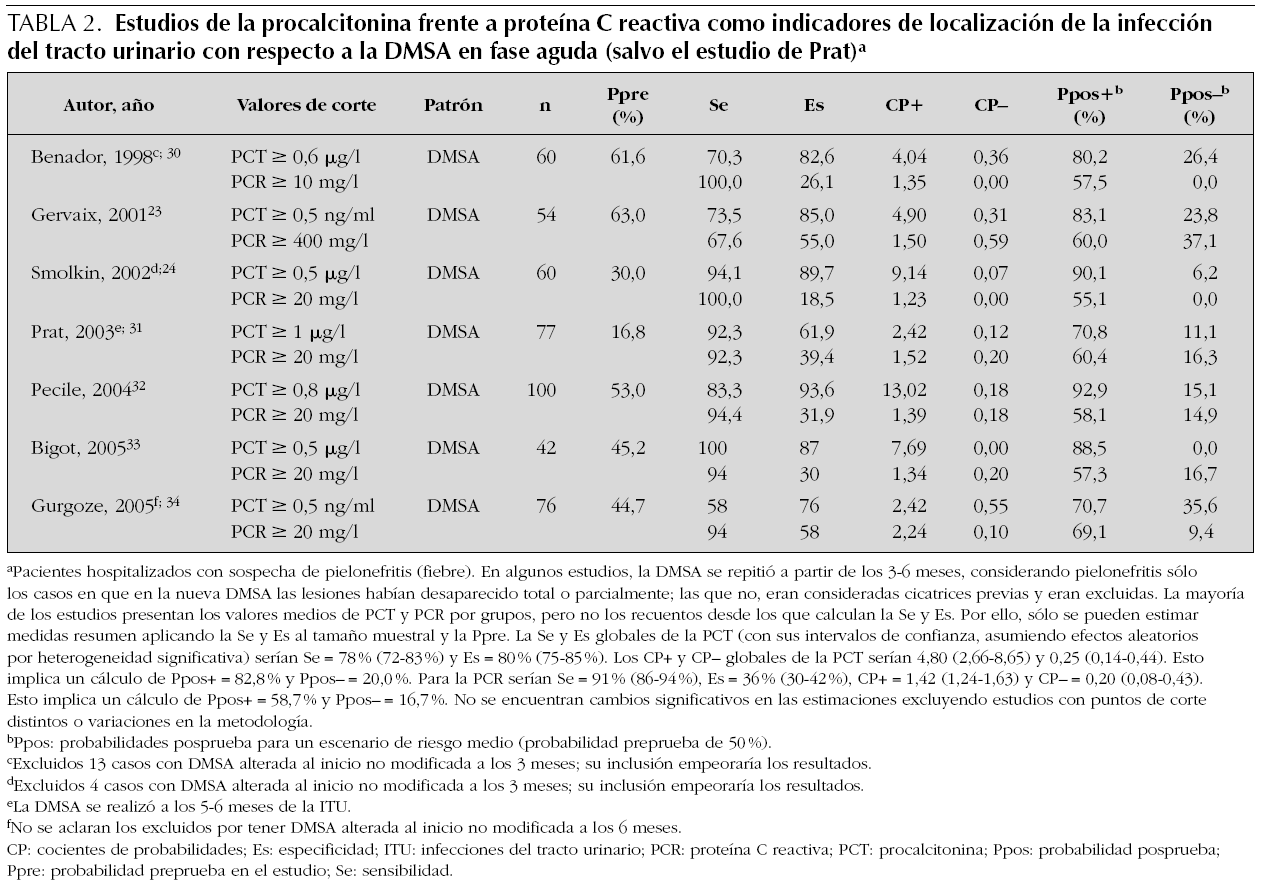
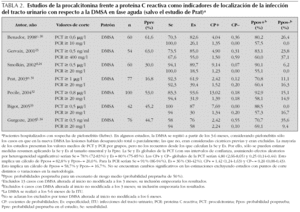
La procalcitonina (PCT) es un propéptido de la calcitonina cuya elevación plasmática está estrechamente relacionada con los cuadros de infección sistémica grave29. En este sentido, muchos investigadores han mostrado un gran interés en determinar si la PCT también puede ser un indicador útil de PA en los niños con ITU. En la tabla 2 figuran resumidos los principales resultados de siete publicaciones: Gervaix23, Smolkin24, Benador30, Prat31, Pecile32, Bigot33 y Gurgoze34, las dos primeras incluidas en la revisión de Whiting14. En estos ensayos se valora la utilidad de la PCT como prueba diagnóstica de PA y se compara con la PCR. El patrón de referencia empleado fue la gammagrafía DMSA, que en todos menos en uno de los estudios se realizó en la fase aguda de la ITU; en varios de ellos se repitió una nueva DMSA a los 3-6 meses, pero sólo a los que la tenían inicialmente alterada.
De los resultados obtenidos no se pueden sacar conclusiones definitivas, debido a la diversa metodología desarrollada y a los distintos puntos de corte utilizados. Además, varios de los trabajos presentan sesgos que pueden afectar a los resultados, por excluir casos inicialmente diagnosticados de PA con lesiones en la DMSA de la fase aguda, que en el control a los 3-6 meses no se atenuaban o desaparecían (consideradas cicatrices previas). No obstante, los datos apuntan a que la PCT mejora los indicadores de validez de la PCR, fundamentalmente su especificidad.
Aunque las estimaciones de los distintos estudios muestran una heterogeneidad significativa, su análisis conjunto puede ofrecernos información útil (véanse los detalles en el pie de la tabla 2). Los cocientes de probabilidades (CP) globales para la PCT serían: CP+ 4,80 y CP 0,25; para la PCR, el CP+ sería 1,42 y el CP 0,20. Aplicando estos CP a un escenario de riesgo medio de PA (el aplicable a muestras de pacientes hospitalizados en España; probabilidad preprueba 50 %), una PCT por encima del punto de corte (habitualmente 0,5 ng/ml) aumentaría la probabilidad de PA hasta un 82,8 %, mientras que una PCT por debajo de esa cifra la bajaría hasta el 20 % (con una probabilidad preprueba de 30 % serían 67,3 y 9,7 %). Para la PCR, si ésta se encuentra por encima del punto de corte (habitualmente 20 mg/l) aumentaría la probabilidad de PA hasta el 58,7 %, mientras que una PCR por debajo de esa cifra la bajaría hasta el 16,7 %. Aunque la PCT mejora el rendimiento de la PCR, su utilidad práctica puede ser escasa, ya que la probabilidad preprueba (50 %) es bastante alta y puede que su incremento apenas afecte a la toma de decisiones (tratar como PA), mientras que su descenso no va a permitir descartar la existencia de PA con ninguno de los parámetros. Una posible ventaja de la PCT como indicador de PA es la precocidad con la que se elevan sus concentraciones plasmáticas; en cuanto a su capacidad para predecir el desarrollo de cicatrices renales, son necesarios más estudios para poder tener información concluyente30,31.
Tratamiento parenteral frente a oral
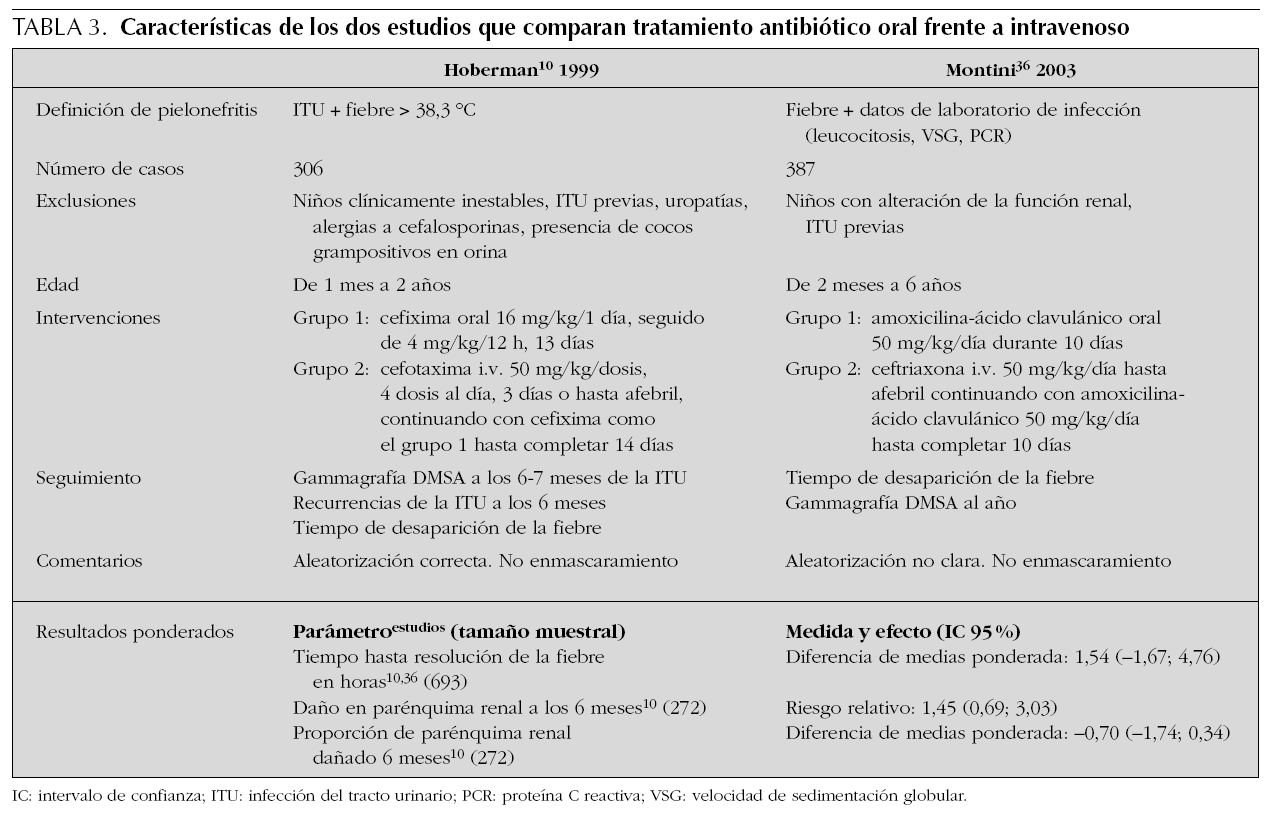
El desarrollo de cefalosporinas orales de tercera generación que muestran actividad contra los microorganismos que más frecuentemente causan ITU ha llevado a la realización de ensayos clínicos que comparen la efectividad del tratamiento antibiótico oral frente al tratamiento intravenoso en los niños con PA. En una revisión sistemática de Bloomfield35 se describen dos ensayos10,36, en los que se compara la efectividad de los antibióticos orales cefixima y amoxicilina-ácido clavulánico durante entre 10 y 14 días, frente a cefotaxima o ceftriaxona intravenosas durante tres días, o hasta la desaparición de la fiebre, seguidas de los antibióticos orales hasta completar el tratamiento. En la tabla 3 aparecen resumidas las principales características de ambos estudios. En los resultados no se encontraron diferencias significativas entre los grupos tratados con antibióticos orales y con antibióticos intravenosos, tanto en el tiempo hasta la resolución de la fiebre como en la tasa de recurrencia de ITU sintomática (seis meses), o en la frecuencia y el tamaño de los trastornos parenquimatosos renales (evaluados mediante DMSA). El coste del tratamiento de los niños que recibieron antibiótico intravenoso fue prácticamente el doble del de los niños que recibieron antibiótico oral.
El ensayo de Hoberman10, metodológicamente bien diseñado (a pesar de la ausencia de enmascaramiento), ha tenido un gran impacto en la práctica clínica de los servicios que atienden niños con ITU; un buen número de protocolos y guías clínicas han modificado los criterios de ingreso basándose en esta publicación. A pesar de todo, en el ensayo de Hoberman existen dos puntos que deben tenerse en cuenta: 1. se encontró que las alteraciones renales parenquimatosas en la gammagrafía DMSA fueron más frecuentes después del tratamiento oral frente al tratamiento intravenoso, entre los niños con reflujo vesicoureteral (RVU) grados III y IV (8/24 casos frente a 1/22; riesgo relativo [RR]: 7,33; intervalo de confianza [IC] 95 %: 1,00-54,01; número de pacientes que será necesario tratar [NNT]: 3; IC 95 % 2-12); 2. desde el punto de vista metodológico, los intervalos de confianza fueron bastante amplios, lo cual implica una cierta imprecisión. Por lo tanto, aún son necesarios más estudios que aclaren estas cuestiones, antes de generalizar el uso de pautas de tratamiento oral entre los niños que sufren PA.
Otros trabajos (Repetto37, Grimwood38) estudian regímenes de tratamiento en los que inicialmente se administra antibiótico intravenoso (cefotaxima, gentamicina) en una dosis única seguido de tratamiento oral (la mayoría, cotrimoxazol o amoxicilina) hasta completar 7 o 10 días. De estas publicaciones no se pueden obtener conclusiones, debido al pequeño número de casos estudiados y a la ausencia de aleatorización y enmascaramiento de la población incluida.
Recomendaciones de las guías de práctica clínica
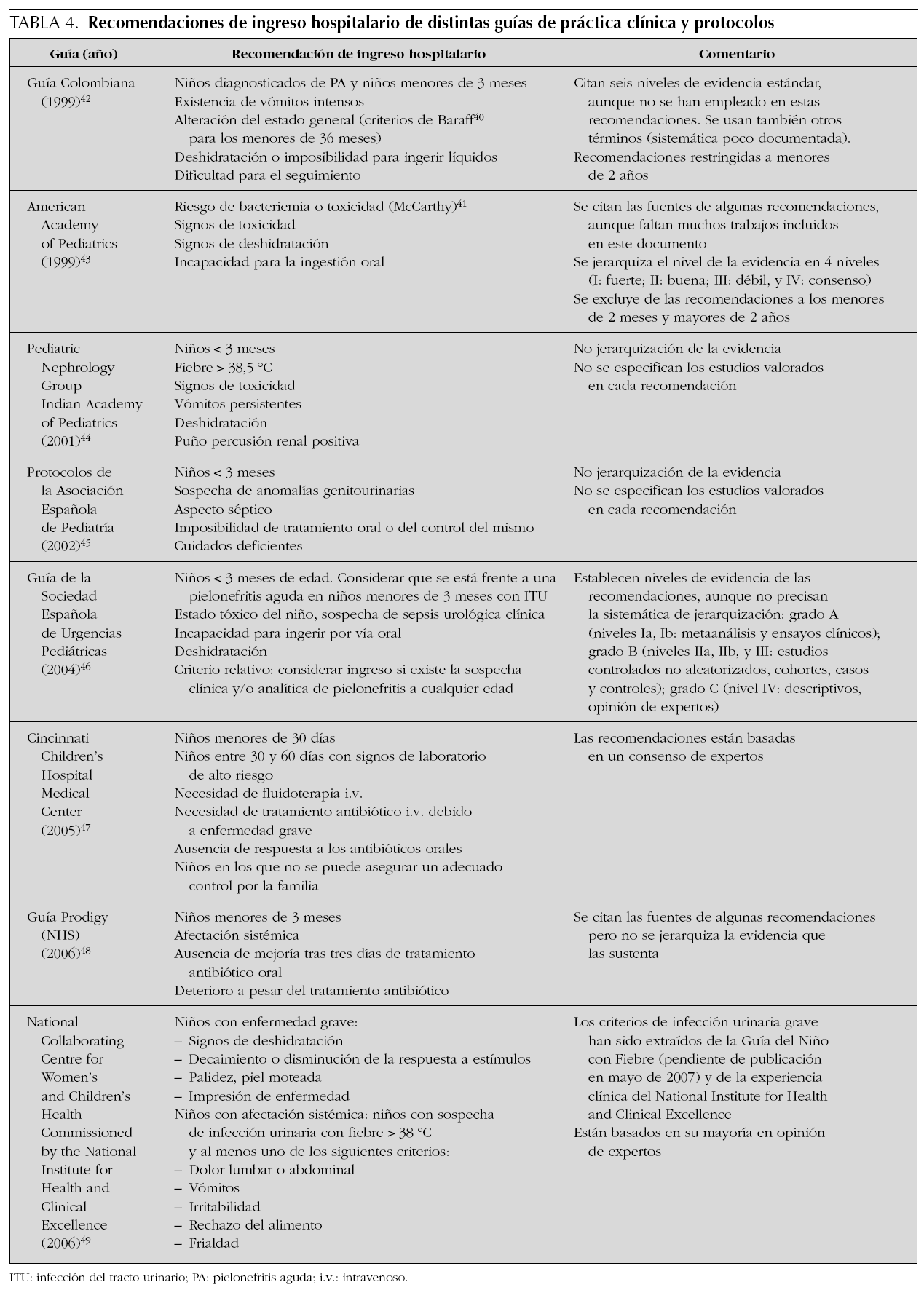
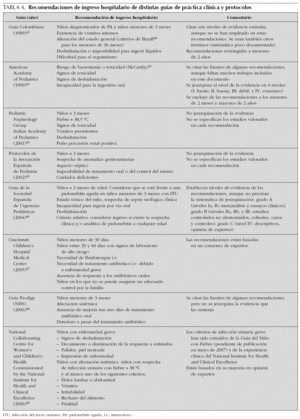
En la tabla 4 figuran las recomendaciones de las principales guías de práctica clínica y protocolos. Existe gran coincidencia entre ellas en que la edad, la alteración del estado general, los vómitos, la deshidratación, la mala respuesta al tratamiento antibiótico previo y la imposibilidad de un seguimiento adecuado son los principales criterios de ingreso hospitalario. Respecto a la edad, la mayoría de las guías recomiendan ingresar a los menores de tres meses (Bachur39 en un trabajo realizado en 354 niños menores de dos años, observó que el riesgo de bacteriemia en los niños con ITU está relacionado inversamente con la edad y que todos los niños que tuvieron una bacteriemia fueron menores de seis meses).
Existe un acuerdo unánime en las guías en ingresar a los niños con "mal estado general", que "impresionan de tan enfermos" o con aspecto "tóxico". Sin embargo, son pocas las guías que definen estos términos, quizás dando por hecho que los criterios para la valoración del estado general de un niño con ITU son similares a los de cualquier niño con un cuadro febril. Otras guías como la de Colombia o la de la American Academy of Pediatrics remiten a los criterios de Baraff40 o a la escala de Yale, recogida en McCarthy41, respectivamente. Es preciso destacar que el principal criterio empleado en la elaboración de recomendaciones de ingreso hospitalario ha sido la opinión de expertos.
En conclusión, realmente no existen publicaciones que valoren de forma específica los criterios de ingreso hospitalario en los niños con ITU. La mayoría de los ensayos tienen como objetivo identificar parámetros clínicos y analíticos que sean buenos indicadores de localización de la infección: es decir, de PA, y, por tanto, de mayor riesgo de desarrollar cicatrices renales. Sin embargo, ninguna variable clínico-analítica ha mostrado la suficiente sensibilidad y especificidad como para sustentar la toma de decisiones en ella, de forma exclusiva; la procalcitonina, el parámetro con mayor rendimiento diagnóstico, puede ofrecer información válida, pero todavía existen dudas sobre la utilidad clínica real de la misma. Todos los autores coinciden en que el único método capaz de evaluar de forma adecuada el desarrollo de cicatrices renales es la gammagrafía DMSA, pero esta técnica es generalmente poco viable en la fase aguda de la infección.
No obstante, en la práctica clínica, estas cuestiones han perdido relativamente su importancia después de que se haya observado que, en los niños mayores de un mes con buen estado general y sin antecedentes de uropatía, se pueden emplear antibióticos por vía oral en el domicilio, sin que se incremente el riesgo de lesiones renales, con respecto al tratamiento intravenoso. A pesar de que estos hallazgos requieren su confirmación en más estudios antes de generalizar su uso, el impacto en la práctica clínica ha sido importante. En este sentido, las guías más recientes coinciden en recomendar el ingreso para tratamiento intravenoso de los niños con ITU menores de tres meses o con mal estado general, criterios más relacionados con el riesgo de complicaciones generales (urosepsis, vómitos, deshidratación), que con la posible localización de la infección.
Preguntas al panel de expertos
1.¿Cuáles son los criterios de ingreso hospitalario en un niño con ITU? ¿Deben estos criterios basarse en la sospecha de pielonefritis? ¿Qué criterios clínicos aconsejan la hospitalización?
2.¿Pueden establecerse límites de edad para aconsejar el ingreso hospitalario de niños con ITU? ¿Deben estos límites tener en cuenta la presencia de fiebre o de signos de pielonefritis?
3.¿Debe considerarse la concentración plasmática de procalcitonina o de otros parámetros en la elección de la vía de administración de antibióticos y, en consecuencia, en la decisión de ingreso hospitalario?
4.¿Pueden ser tratados con antibiótico oral en su domicilio los niños con buen estado general y sospecha de pielonefritis aguda? ¿Debe modificarse este criterio en función de la edad?
Miembros del Grupo Investigador del Proyecto "Estudio de la Variabilidad e Idoneidad del Manejo Diagnóstico y Terapéutico de las Infecciones del Tracto Urinario en la Infancia"
C. Ochoa Sangrador (Hospital Virgen de la Concha, Zamora); C. Pérez Méndez y G. Solís Sánchez (Hospital de Cabueñes, Gijón, Asturias); J.C. Molina Cabañero y J. Lara Herguedas (Hospital del Niño Jesús, Madrid); F. Conde Redondo, R. Bachiller Luque, J.M.ª Eiros Bouza, V. Matías del Pozo y B. Nogueira González (Hospital Clínico Universitario, Valladolid); M.ªC. Urueña Leal, J.M. Andrés de Llano, P. Rostami y J.F. Sáenz Martín (Complejo Asistencial de Palencia); E. Formigo Rodríguez, M. Cueto Baelo y M.ªC. González Novoa (Hospital Xeral-Cies, Vigo, Pontevedra); N. Silva Higuero y H. González García (Hospital de Medina del Campo, Valladolid); J. González de Dios (Hospital de Torrevieja, Alicante); M. Brezmes Raposo (Hospital La Fe, Valencia); M.ªM. Urán Moreno y J.M. Gea Ros (Hospital Universitario San Juan, Alicante); M.ªV. Barajas Sánchez, M.ªF. Brezmes Valdivieso y M.ªA. Fernández Testa (Hospital Virgen de la Concha, Zamora).
Financiado parcialmente por una beca de la Gerencia Regional de Salud de la Junta de Castilla y León (año 2006).
Correspondencia: Dr. C. Ochoa Sangrador.
Unidad de Investigación. Hospital Virgen de la Concha.
Avda. Requejo, 35. 49029 Zamora. España.
Correo electrónico: cochoas@meditex.es
Recibido en mayo de 2007.
Aceptado para su publicación en junio de 2007.