Introducción
El tratamiento actual de la infección del tracto urinario (ITU) pediátrica en España incluye habitualmente la realización de pruebas de imagen para buscar anomalías del tracto urinario, que puedan predisponer al paciente a la aparición de nuevas infecciones o a complicaciones de las mismas. Esta práctica refleja las recomendaciones de la mayoría de las guías y los protocolos clínicos disponibles. En ellas se recomienda realizar ecografías, cistografías o gammagrafías en distintas combinaciones, en función del riesgo estimado, de la edad y sexo del paciente y de los hallazgos de exploraciones previas. Pero la mayoría de estas recomendaciones se basan en la asunción de que, en los pacientes que están en riesgo de daño renal parenquimatoso crónico (fundamentalmente los que tienen reflujo vesicoureteral [RVU]), o en los que ya lo presentan, el tratamiento profiláctico podría prevenir su aparición o progresión, y evitar el desarrollo de hipertensión arterial o fallo renal crónico.
Sin embargo, en el momento actual está surgiendo un debate que cuestiona el fundamento de esa asunción. El RVU de bajo grado (I, II y III) parece un hallazgo más frecuente de lo estimado1, especialmente en lactantes, y tiene escasas implicaciones patológicas, tanto en la génesis de cicatrices2-6 como en el riesgo de recurrencias4,7. Aunque el RVU de alto grado (IV y V) implica un mayor riesgo, es muy poco frecuente8, a menudo es anterior a la ITU, y muchas veces se asocia a nefropatía ya presente en el nacimiento9-11. Asimismo, el tipo de tratamiento del RVU no parece modificar su evolución12-16. Por otra parte, no está clara la eficacia de la profilaxis antibiótica para prevenir la recurrencia de ITU17,18. Existen, pues, dudas razonables que nos obligan a reconsiderar las bases de nuestras actuales recomendaciones.
Bases para la toma de decisiones
Las pruebas de imagen se emplean en la ITU para valorar la estructura renal o la presencia de dilatación de vías urinarias (ecografía), para detectar RVU (cistografía) o para identificar defectos del parénquima renal (gammagrafía DMSA). Aunque contamos con un número razonable de estudios que han cuantificado la validez de estas pruebas para el diagnóstico de anomalías concretas, carecemos de trabajos que hayan evaluado el beneficio sobre los pacientes de tales diagnósticos. Por ello, a la hora de juzgar la utilidad de estas pruebas tendremos que considerar estimaciones de riesgos y costes: riesgo de anomalías urinarias en pacientes con ITU, riesgo de daño renal atribuible a dichas anomalías, riesgo prevenible por intervenciones desencadenas tras el diagnóstico de esas anomalías, costes de las pruebas de imagen, costes de las intervenciones originadas por los citados diagnósticos y costes de los casos de daño renal no diagnosticados o no prevenidos (en ausencia de estudios de imagen).
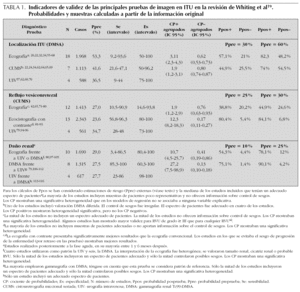
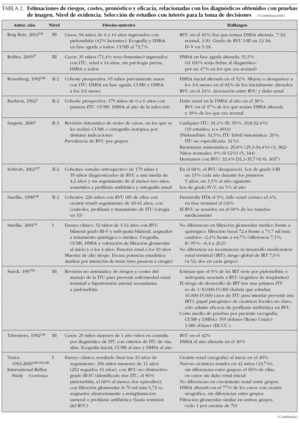
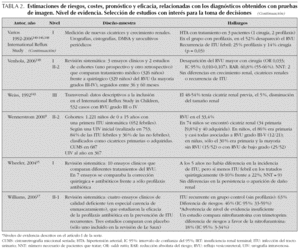
Para evaluar la validez de las distintas pruebas de imagen contamos con una revisión sistemática que ha resumido su capacidad para identificar la localización de las ITU y para diagnosticar RVU, cicatrices u otras anomalías renales19. En la tabla 1 presentamos los principales resultados de esta revisión. Algunas revisiones sistemáticas y no sistemáticas han tratado de estimar el riesgo de RVU y daño renal en diversas circunstancias, valorar la eficacia de la profilaxis antibiótica y comparar las opciones terapéuticas del RVU. Contamos también con algún ensayo clínico, estudios de cohortes y, sobre todo, series de casos retrospectivas que ofrecen estimaciones de los parámetros anteriormente mencionados. Son escasos los estudios de seguimiento a largo plazo sobre el riesgo de hipertensión y/o insuficiencia renal crónica en los pacientes con ITU. Finalmente, se han publicado asimismo algunos trabajos que describen estimaciones teóricas de costes o rentabilidad de distintas estrategias diagnósticas. En la tabla 2 se presentan resumidos una selección de trabajos, que aportan estimaciones de interés en la toma de decisiones diagnósticas.
Localización de la ITU
Sólo las ITU que afectan al parénquima renal entrañan riesgo de ocasionar ulteriormente cicatrices. Por ello, con vistas al tratamiento diagnóstico, resultaría esencial distinguir entre ITU altas y bajas. Sin embargo, la información clínica y las exploraciones complementarias empleadas en la práctica clínica no permiten diferenciarlas con seguridad19. Los estudios realizados20-33 son de pequeño tamaño muestral y presentan importantes limitaciones metodológicas. Tanto la presencia de síntomas o signos (p. ej., fiebre), como las pruebas de laboratorio (p. ej., PCR, beta-2-microglobulina, N-acetil-beta-glucosaminidasa, procalcitonina, interleucinas), carecen de la suficiente sensibilidad y especificidad como para sustentar la toma de decisiones en ellas, de forma exclusiva; la procalcitonina, el parámetro con mayor rendimiento diagnóstico, puede ofrecer información válida, pero todavía existen dudas sobre la utilidad clínica real de la misma (esta información se analiza con más detalle en el documento sobre indicaciones de ingreso hospitalario).
La realización de una gammagrafía con ácido dimercaptosuccínico marcado con tecnecio 99 (DMSA) es el procedimiento de referencia para el diagnóstico de pielonefritis, pero su empleo rutinario no es viable ni está justificado. Además, el hallazgo de alteraciones en la DMSA depende de circunstancias cambiantes, como el retraso en el inicio del tratamiento antibiótico3. Por ello, en la práctica, se opta por diferenciar las ITU entre alto y bajo riesgo, en función de la edad (neonatos y lactantes pequeños) y de la existencia o no de fiebre y/o afectación general. Con esta estrategia, la mayoría de las pielonefritis serán incluidas, a expensas de tratar como tales, muchas ITU que no lo son. Así, la decisión de realizar pruebas de imagen va a estar supeditada al nivel de riesgo estimado de forma subjetiva.
En la tabla 1 podemos ver los indicadores de validez de la ecografía, la cistouretrografía miccional seriada (CUMS) y la urografía intravenosa con respecto a la gammagrafía DMSA. La ecografía presenta un rendimiento muy variado, probablemente relacionado con la subjetividad que implica su interpretación. Otros estudios no incluidos en la revisión de Whiting19 muestran resultados similares34-36. A pesar de la variabilidad observada en los distintos estudios, las estimaciones ponderadas de cocientes de probabilidades (CP) (CP+ 3,11; CP 0,62) parecen fiables y muestran una utilidad diagnóstica media. En la tabla 1 se presentan los CP posprueba para dos probabilidades preprueba distintas: la estimada a partir de los trabajos con una adecuada muestra de pacientes (60 %), que parece aplicable a casos de alto riesgo, en su mayoría hospitalizados, y la estimada a la baja (30 %), aplicable a casos de menor riesgo y que se aproxima a los resultados de trabajos con muestras poblacionales37,38 (en estas estimaciones quedarían excluidos los casos de niños mayores con clínica de cistitis).
La presencia de imágenes sugerentes de pielonefritis incrementa discretamente la probabilidad de que la ITU sea una pielonefritis (para probabilidades preprueba de 60 y 30 % ascendería a 82 y 57 % respectivamente), aunque en los casos con alto riesgo basal, este incremento no tiene relevancia clínica. Asimismo, una ecografía normal no permite excluir la pielonefritis con seguridad (probabilidades de 48 y 21 %). Es, por tanto, posible que, salvo el infrecuente hallazgo de un absceso renal, la ecografía tenga escasa repercusión sobre el tratamiento terapéutico inicial del paciente. No obstante, a pesar del limitado rendimiento diagnóstico de la ecografía en la localización de la ITU, podría interesar llevarla a cabo en la fase aguda, si tenemos en cuenta la inocuidad y la accesibilidad de la exploración, así como su posible contribución al manejo posterior del paciente, ya que esta prueba podría identificar otras anomalías urinarias preexistentes.
Si examinamos el rendimiento diagnóstico de la CUMS, podemos ver que esta prueba tiene menor validez diagnóstica que la ecografía (CP+ 1,9; CP 0,80), por lo que su escasa contribución al diagnóstico de pielonefritis difícilmente justificaría su realización, si consideramos que es una prueba más agresiva. De igual manera, la urografía intravenosa, cuyo rango de sensibilidad es muy bajo, apenas tiene utilidad en el diagnóstico de pielonefritis y no están justificadas la exposición radiológica y a contrastes que su realización implica.
Diagnóstico del reflujo vesicoureteral
Clásicamente se ha considerado necesario descartar la existencia de RVU en los niños con ITU, porque se pensaba que en estos pacientes era más frecuente que en la población general y porque la presencia de RVU incrementaba el riesgo de daño renal y recurrencias. La prueba de referencia para el diagnóstico del RVU es la CUMS; no obstante, esta prueba implica una alta exposición radiológica y requiere la cateterización urinaria, lo que origina molestias y además puede facilitar la entrada de microorganismos en la vía urinaria. Una prueba alternativa es la cistografía isotópica, con la que se reduce drásticamente la exposición radiológica, aunque su definición anatómica es pobre y no es adecuada para la valoración de varones con sospecha de válvulas de uretra posterior. La cistografía isotópica indirecta no precisa la cateterización vesical, pero presenta un mayor grado de errores, por lo que es menos recomendada.
En la tabla 1 se presentan los trabajos, incluidos en la revisión de Whiting19, en que se han evaluado la validez diagnóstica de la ecografía convencional, la ecografía con contraste y la urografía intravenosa, en relación con la CUMS. Podemos ver cómo la ecografía tiene unos rangos de sensibilidad y especificidad muy amplios, y unos cocientes de probabilidades agrupados muy discretos, cercanos a la unidad. Otros trabajos no incluidos en esta revisión muestran resultados compatibles39,40.
Para estimaciones de prevalencia de RVU entre el 25 % (mediana de los trabajos con muestras de pacientes adecuadas) y el 30 % (estimación basada en revisiones1,38,41), la contribución diagnóstica de la ecografía para el RVU es mínima. En algunos estudios se ha visto que la validez de la ecografía mejora cuando el objetivo diagnóstico son los RVU de alto grado (IV-V), a expensas de una mayor sensibilidad42, relacionada con el hecho de que en los pacientes con RVU de alto grado es más probable que la ecografía muestre alguna anomalía. No obstante, para considerar sólo el diagnóstico de RVU de alto grado sería necesario asumir que los de bajo grado no tienen interés patológico.
La ecocistografía con contraste presenta mejor rendimiento diagnóstico que la ecografía convencional, aunque es una prueba poco extendida en España. No evita el sondaje vesical pero sí la radiación ionizante, por lo que facilita la exploración dinámica. La revisión de Whiting incluye 13 estudios, entre los que se encuentran altos intervalos de sensibilidad y especificidad; otros estudios muestran similares resultados43 o pequeñas diferencias44. Los CP agrupados son suficientemente discriminativos (CP+ 12,3; CP 0,17), por lo que la contribución diagnóstica es alta; probabilidades posprueba positiva por encima del 80 % y posprueba negativa por debajo del 7 %, pueden resultar suficientemente útiles. Es evidente que esta prueba no permitirá prescindir de la CUMS cuando se sospeche obstrucción uretral, pero en otras circunstancias puede constituir una alternativa aceptablemente válida. No obstante, algunos aspectos de la prueba, como el de su reproducibilidad, tendrán que ser valorados antes de generalizar su uso.
Diagnóstico de cicatrices y otras anomalías renales
En el seguimiento de los pacientes con ITU se ha considerado necesario la detección de defectos del parénquima renal. Sin embargo, no todos los defectos que identifiquemos corresponderán a cicatrices adquiridas secundarias a pielonefritis, ya que también pueden ser debidos a displasias congénitas preexistentes. Lamentablemente, no contamos con técnicas de imagen que permitan diferenciar si un defecto es congénito o adquirido. Cualquiera de estas lesiones puede manifestarse como defecto focal o bien, como una disminución global del tamaño renal.
La prueba de referencia para el diagnóstico de defectos parenquimatosos es la gammagrafía renal DMSA. La presencia de defectos adquiridos se ha considerado un factor de riesgo de desarrollo de hipertensión o de insuficiencia renal terminal (IRT), por lo que en la mayoría de las guías de práctica clínica se recomienda la realización de una DMSA a los 5-6 meses de la ITU, ya que exploraciones precoces pueden identificar lesiones transitorias.
En la tabla 1 podemos ver los estudios, incluidos en la revisión de Whiting19, que han evaluado la validez de la ecografía, la DMSA y la urografía intravenosa, para la identificación de daño renal. El patrón de referencia empleado en estos estudios ha sido la DMSA y/o la urografía intravenosa. Como era de esperar, la sensibilidad y especificidad de la DMSA son excelentes, dada su condición de patrón de referencia, aunque se haya comparado con otras pruebas, como la urografía, de baja sensibilidad45. Por su parte, la urografía no se emplea actualmente para el diagnóstico de defectos parenquimatosos, y queda circunscrita a la valoración de otras anomalías anatómicas. No presentamos los datos referidos a la resonancia magnética, con la que hay menos experiencia y apenas se emplea en este escenario, aunque presenta una aceptable concordancia con la DMSA46,47.
La ecografía muestra una validez media en el diagnóstico de daño renal (tabla 1). Teniendo en cuenta la subjetiva variabilidad existente en la interpretación de esta prueba, encontramos un amplio rango de sensibilidades, aunque el rango de especificidades es consistentemente alto. Otros estudios no incluidos en la revisión de Whiting tienen resultados similares48,49. Con respecto a las medidas agrupadas, el cociente de probabilidades positivo es bueno, mientras que el negativo es aceptable (CP+ 10,7; CP 0,41). La probabilidad preprueba mediana en los estudios con muestras adecuadas de pacientes era del 25 %. Sin embargo, este riesgo podría ser inferior en la práctica clínica. Una revisión sistemática ha estimado que entre el 5 y el 15 % de los pacientes con una primera ITU tendrán cicatrices renales38; estas estimaciones se han hecho con casos de ITU sintomáticas identificadas en hospitales, en su mayoría primeras, no seleccionadas en función de la presencia de anomalías u hospitalización y con seguimientos de al menos 6 meses. Para escenarios de prevalencia del 10 y el 25 %, la ecografía alterada incrementaría la probabilidad de daño renal hasta el 54,3 y el 78,1 % retrospectivamente. La ausencia de anomalías en la ecografía reduciría la probabilidad hasta un 4,4 y un 12 %, respectivamente. Es previsible que en presencia de anomalías el diagnóstico de daño renal sea aceptable, aunque la ecografía no nos permite cuantificar la función renal y no ofrece el mismo detalle en la identificación de lesiones parciales. Por el contrario, una ecografía normal no descarta la existencia de lesiones, por lo que su utilidad va a depender de la trascendencia clínica que se otorgue a la presencia de pequeños defectos del parénquima renal.
Existen pocos trabajos con un diseño correcto que hayan evaluado la capacidad predictiva de los datos clínico-analíticos y las pruebas de imagen realizadas en la fase aguda de la ITU sobre el desarrollo futuro de daño renal19,35. Los parámetros analizados no mostraban la suficiente validez como para sustituir los estudios posteriores del paciente. Un estudio en el que se valoró la capacidad predictiva de un análisis semicuantitativo de la DMSA realizada en fase aguda, con respecto a la detección de daño renal en una DMSA 8 ± 2 meses después, mostró una sensibilidad y especificidad del 88 y 75 %50. La valoración del flujo renal mediante ecografía renal en la fase aguda también parece presentar una buena correlación con el grado de lesión renal observado mediante DMSA51.
La ecografía es la prueba habitualmente empleada para la detección de otras alteraciones anatómicas de la vía urinaria. No obstante, no contamos con estudios que hayan evaluado la rentabilidad de la ecografía en este cometido19. Si tenemos en cuenta la escasa frecuencia de estas alteraciones11,52, y la inocuidad, accesibilidad y bajo coste de la ecografía, esta prueba parece adecuada como prueba de cribado inicial, y se puede completar el estudio con otras técnicas en función de los hallazgos iniciales.
Estimaciones de riesgos, eficacia y costes relacionadas con los diagnósticos
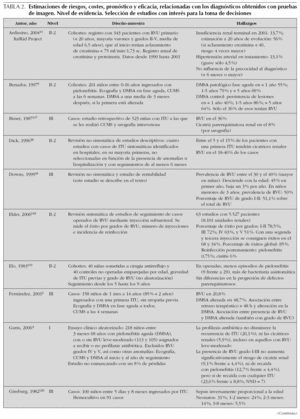
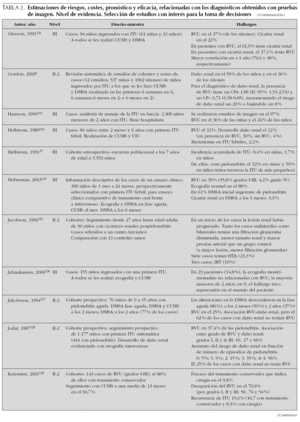
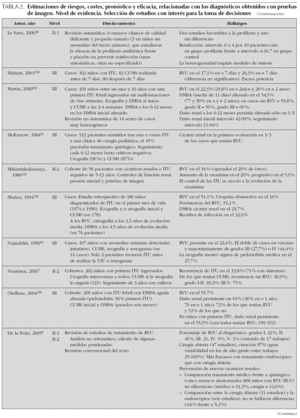
Como se ha comentado anteriormente, carecemos de estudios clínicos que hayan evaluado la utilidad sobre el paciente de distintas estrategias diagnósticas. Por ello, a la hora de juzgar el rendimiento de las pruebas disponibles, tendremos que considerar estimaciones de riesgos, eficacia y costes de los diagnósticos que nos ofrecen esas pruebas, así como de las intervenciones que generan en nuestra práctica clínica. En la tabla 2 se resumen los resultados de una selección de trabajos que ofrecen estimaciones de interés para la toma de decisiones. A continuación revisamos y detallamos sus principales hallazgos.
En un informe de la American Academy of Pediatrics41 se hizo una valoración del coste-efectividad de distintas estrategias de estudio con pruebas de imagen, asumiendo que el diagnóstico y tratamiento de anomalías urinarias (fundamentalmente RVU) implicaría la prevención de casos de hipertensión y/o enfermedad renal terminal (probabilidad de cicatriz renal sin RVU: 7 %; con RVU de grados I-II: 13 %; con RVU de grados III-V: 53 %; riesgo de hipertensión e IRT en presencia de cicatriz: 20 y 5 %, respectivamente). En el estudio se compararon tres estrategias: no hacer ninguna prueba, hacer sólo ecografía y hacer ecografía más CUMS (asumen que la CUMS permitiría diagnosticar RVU de bajo grado no advertidos en la ecografía). Estimaron que hacer ecografía a todos permitiría prevenir 2,8 casos adicionales por 1.000 ITU (sobre la prevención implícita al diagnóstico y tratamiento de ITU) con un coste de 260.000 dólares por caso, mientras que añadir la CUMS permitiría diagnosticar un caso adicional más, con un coste de 353.000 dólares por caso. Los modelos considerados se ven muy influidos por las asunciones de verosimilitud diagnóstica, riesgos y eficacia. Por ejemplo, si un diagnóstico de ITU se considera poco probable (clínica inespecífica, urocultivo recogido con bolsa perineal; estimación de ITU < 49 %), aunque se opte por tratar al paciente, las pruebas de imagen podrían no estar justificadas. Asimismo, cambios en las asunciones empleadas, algunas de ellas de cuestionable verosimilitud (eficacia del tratamiento del RVU de bajo grado en la reducción de daño renal), modificarían de forma importante los cálculos del modelo.
Basándose en la información de registros poblacionales de diálisis y trasplante renal, Starck53 ha estimado que el 9 % de las IRT podrían estar relacionadas con pielonefritis o nefropatía asociada a RVU. Ajustando esta información con la obtenida de otros estudios de incidencia de ITU y sus complicaciones, ha estimado que tras una primera ITU, el riesgo de desarrollar IRT podría ser 1/10.000-1/15.000 casos. Esta cifra no se corresponde con la aplicación de las anteriores asunciones de la American Academy of Pediatrics41 a la prevalencia de RVU y daño renal observado en diversas series.
Otra de las asunciones en las que se basa ese modelo teórico, que en cierto modo refleja la hipótesis patogénica más extendida hasta el momento, es aquella por la que el daño renal en la ITU estaría en gran parte vinculado a la presencia de RVU (y a la denominada nefropatía por reflujo), de manera que el tratamiento médico o quirúrgico de este RVU permitiría prevenir el desarrollo de hipertensión e IRT. Algunos trabajos publicados en los últimos años cuestionan esta hipótesis. La revisión del registro australiano de diálisis y trasplante renal ha permitido observar cómo los cambios históricos en el tratamiento del RVU (profilaxis antibiótica y reimplantación ureteral) no han influido en la creciente tendencia de IRT atribuible a nefropatía por reflujo12. Asimismo, el seguimiento a largo plazo de una serie de niños italianos con RVU primario13 sugiere que el desarrollo de IRT es independiente de la precocidad con la que se estableció el diagnóstico y, consiguientemente, su tratamiento. En ausencia de un ensayo clínico que estudie la eficacia del tratamiento sobre el pronóstico del RVU, cualquier asunción al respecto carece de fundamento. Otros estudios apuntan en la dirección de que gran parte del daño renal está ya presente al diagnosticar ITU13. Es evidente que las incertidumbres existentes en este campo influyen en gran manera en la utilidad clínica que sobre el paciente puedan tener las distintas pruebas diagnósticas empleadas en el momento actual.
A continuación, resumiremos los rangos entre los que se mueven los resultados de otros trabajos, con algunos comentarios sobre los factores que influyen en su heterogeneidad:
La prevalencia de alteraciones en la DMSA, realizada en fase aguda de ITU (considerada patrón diagnóstico de pielonefritis aguda) varía en función de la muestra incluida en un rango entre el 42 y el 99 %. Este amplio intervalo se justifica porque sólo una parte seleccionada de ITU accede a esta prueba, la cual no está disponible ni justificada en la práctica habitual; factores como el retraso terapéutico, la edad de los pacientes o los criterios de hospitalización influirán en la prevalencia. Si consideramos las series de pacientes hospitalizados en España, la prevalencia se situaría en torno al 50 %.
El hallazgo de RVU en pacientes con ITU varía según las series entre el 17 y el 55 %. En general, es más frecuente en niñas y en menores de dos años, con pequeñas diferencias que dependen del retraso en la realización de cistografía desde el inicio de la ITU. La revisión de Downs41 lo sitúa en el 30-40 % (descienden con la edad el 3 % por año), y una revisión sistemática que resume datos de 19 estudios, en el 31,1 % (IC 95 %: 29,8-32,4 %)1. Esta última revisión ofrece información sorprendente sobre la presencia de RVU: es éste un hallazgo más común de lo supuesto hasta ahora (niños normales: 9 %; hermanos de niños con RVU: 33,4 %; bacteriuria asintomática: 29,8 %), con pequeñas diferencias entre tipos de ITU. Por lo tanto, cuantas más CUMS realicemos, más RVU diagnosticaremos, aunque no sepamos la verdadera relevancia clínica de estos diagnósticos.
El riesgo de desarrollo de daño renal se ha estimado tanto con urografías intravenosas (anteriormente) como con DMSA. En función de la muestra de pacientes incluida, de la prueba utilizada y del tiempo transcurrido desde la ITU, la presencia de cicatrices renales se ha observado en un rango entre el 5 y el 64 %. En la revisión de Downs41 se estima que tras una primera ITU, el riesgo estaría entre el 5 y el 15 %. El nivel de riesgo va a depender de la gravedad de las ITU incluidas en cada estudio, por lo que cuando se dispone de DMSA en fase aguda, su resultado va a condicionar en gran manera el riesgo posterior. Se estima que a partir de los 6 meses, tan sólo de una tercera a una quinta parte de los casos con DMSA inicial patológica tendrá daño renal en la DMSA (a mayor tiempo, menor porcentaje).
Múltiples estudios han observado que existe una relación entre la presencia de RVU y de daño renal crónico. Esta relación puede resumirse en que aproximadamente el 60 % de los casos con RVU presentarán daño renal en la DMSA, aunque sólo la tercera parte de los casos con daño renal tendrán simultáneamente RVU. Se ha estimado que la presencia de RVU presenta una capacidad diagnóstica resumida en CP positivo y negativo de 1,96 y 0,71, respectivamente. En consecuencia, el hallazgo de RVU modifica discretamente la probabilidad de encontrar daño renal (su presencia la aumenta un 20 %; su ausencia la desciende un 8 %). Es evidente que a mayor grado de RVU mayor es el riesgo de daño renal, por ello no sorprende que en algunos estudios con muestras de pacientes con RVU, de bajo grado no se observe un aumento del daño renal. Asimismo, la asociación entre RVU y daño renal se sustenta en gran parte en un subgrupo de pacientes mayoritariamente varones con RVU de alto grado, muchos de ellos con daño renal ya presente en el momento del diagnóstico. El antecedente de dilatación de la vías urinarias observado en ecografías prenatales podría constituir un indicador de alto riesgo y un criterio útil para la indicación de pruebas de imagen54.
Se ha demostrado que la recurrencia de ITU se asocia a un incremento progresivo del riesgo de daño renal. De igual manera, el control médico de estas infecciones, en pacientes con afectación renal ya instaurada, se refleja en la evolución de la función renal. Por otra parte, aunque el hallazgo de RVU se asocia a mayor riesgo de recurrencia de ITU, éste se ha observado fundamentalmente con RVU de alto grado. La presencia de un RVU de grado I-III parece aumentar discretamente la incidencia global de ITU (número necesario para dañar = 7), pero no la de pielonefritis y, por tanto, de daño renal.
Los estudios que han evaluado la eficacia de la profilaxis antibiótica son escasos, en general de pequeño tamaño muestral y con importantes deficiencias metodológicas. Aunque alguno de los estudios ha encontrado que la profilaxis reduce discretamente la incidencia de ITU, en general los resultados son heterogéneos y no se traducen en una disminución del riesgo de daño renal (véase el documento sobre profilaxis).
Los ensayos clínicos y estudios de cohortes que han comparado el tratamiento quirúrgico y médico (profilaxis) del RVU han encontrado que, aunque la cirugía reduce la incidencia de ITU, en los casos con tratamiento médico no hay un mayor riesgo de aparición o progresión de cicatrices renales. Estos hallazgos podrían estar en relación con la evolución natural del RVU; en estudios de seguimiento a largo plazo se ha observado que entre el 50 y el 70 % de los casos desaparece, con una tasa del 13 % anual.
Las estimaciones disponibles del riesgo de desarrollo de hipertensión arterial y/o insuficiencia renal crónica en pacientes con daño renal se basan en estudios de seguimiento a largo plazo sobre muestras seleccionadas de pacientes. Estas estimaciones se encuentran en un intervalo del 10-23 % para la hipertensión arterial que precisa tratamiento y entre el 5 y el 10 % para la IRT. La aplicación de estos riesgos a los de daño renal en pacientes con ITU ofrecen cifras discordantes con lo observado en registros poblacionales de diálisis-trasplante, los cuales sugieren un menor riesgo real.
El coste económico directo de las pruebas de imagen presenta grandes diferencias en función de la estrategia que se haya empleado y del entorno sanitario donde se realice. No contamos con estimaciones de costes indirectos, ni de valoraciones de aceptabilidad y utilidad por parte de los pacientes.
Recomendaciones de las guías de práctica clínica
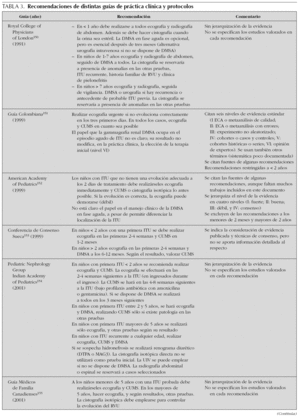
En la tabla 3 se presentan resumidas las recomendaciones de diferentes guías de práctica clínica y protocolos. En la mayoría de ellas se recomienda la realización rutinaria de ecografía, CUMS y DMSA, al menos en los casos de mayor riesgo. Habitualmente, este riesgo se estima en función de la edad, situándose puntos de corte muy diversos: primero, segundo, tercero o quinto año de vida. Algunas diferencian las indicaciones según el sexo, concediendo a las niñas un menor grado de riesgo. Existe una tendencia a restringir la realización de la CUMS, a los casos de más alto riesgo o con hallazgos en pruebas previas. De forma generalizada no se recomienda la realización de DMSA en la fase aguda; sin embargo, la mayoría de las guías la aconsejan a partir de los seis meses de la infección, exceptuando los casos claros de cistitis en niños mayores. A pesar de la limitada capacidad predictiva que tiene la ecografía, en razón de su inocuidad y accesibilidad nadie cuestiona su realización, incluso en los casos de menor riesgo.
En conclusión, contamos con suficiente información sobre la validez técnica de las distintas pruebas de imagen disponibles, que puede ser utilizada, mediante cálculo de probabilidades, en el proceso de toma de decisiones diagnósticas. Sin embargo, el rendimiento de los diagnósticos que estas pruebas nos ofrecen no está claro; algunas de las estimaciones de costes, eficacia y riesgos, permiten asumir que ciertos diagnósticos tienen escasa trascendencia clínica. Es probable que la estrategia actual de uso habitual de pruebas de imagen deba ser sustituida por otra personalizada, en la que las pruebas sean indicadas tras considerar la información disponible en cada momento, la opinión de pacientes o familiares y nuestro juicio sobre la verosimilitud de los diagnósticos y los riesgos y beneficios de cada prueba.
Preguntas al panel de expertos
1.¿Está indicada la realización de ecografía renal después de una primera ITU? ¿Debe realizarse en la fase aguda o bien se puede hacer de forma diferida? ¿Existe algún criterio clínico que permita precisar estas recomendaciones (edad, fiebre, sexo, lugar de asistencia, analítica o evolución)?
2.¿Debe realizarse cistografía de forma sistemática después de una primera ITU? ¿Debe realizarse CUMS o puede sustituirse por pruebas alternativas (ecocistografía, cistografía isotópica indirecta)? ¿En qué momento debe realizarse? ¿Existe algún criterio clínico que permita precisar estas recomendaciones (edad, fiebre, sexo, lugar de asistencia, analítica o evolución)?
3.¿Debe recomendarse la realización de gammagrafía DMSA en la fase aguda de una ITU? ¿Existe algún criterio clínico que permita precisar estas recomendaciones (edad, fiebre, sexo, lugar de asistencia, analítica o evolución)?
4.¿Debe realizarse gammagrafía DMSA diferida después de una primera ITU? ¿En qué momento debe realizarse? ¿Existe algún criterio clínico que permita precisar estas recomendaciones (edad, fiebre, sexo, lugar de asistencia, analítica o evolución)?
5.Ante la existencia de ITU recurrentes, ¿debe indicarse alguna prueba previamente no realizada o está justificada la repetición de otras ya disponibles?
6.En los niños mayores con clínica de cistitis ¿está indicada la realización de alguna prueba de imagen?
7.¿Debe hacerse alguna recomendación concreta en cuanto a otras pruebas de imagen?
Miembros del Grupo Investigador del Proyecto "Estudio de la Variabilidad e Idoneidad del Manejo Diagnóstico y Terapéutico de las Infecciones del Tracto Urinario en la Infancia"
C. Ochoa Sangrador (Hospital Virgen de la Concha, Zamora); C. Pérez Méndez y G. Solís Sánchez (Hospital de Cabueñes, Gijón, Asturias); J.C. Molina Cabañero y J. Lara Herguedas (Hospital del Niño Jesús, Madrid); F. Conde Redondo, R. Bachiller Luque, J.M.ª Eiros Bouza, V. Matías del Pozo y B. Nogueira González (Hospital Clínico Universitario, Valladolid); M.ªC. Urueña Leal, J.M. Andrés de Llano, P. Rostami y J.F. Sáenz Martín (Complejo Asistencial de Palencia); E. Formigo Rodríguez, M. Cueto Baelo y M.ªC. González Novoa (Hospital Xeral-Cies, Vigo, Pontevedra); N. Silva Higuero y H. González García (Hospital de Medina del Campo, Valladolid); J. González de Dios (Hospital de Torrevieja, Alicante); M. Brezmes Raposo (Hospital La Fe, Valencia); M.ªM. Urán Moreno y J.M. Gea Ros (Hospital Universitario San Juan, Alicante); M.ªV. Barajas Sánchez, M.ªF. Brezmes Valdivieso y M.ªA. Fernández Testa (Hospital Virgen de la Concha, Zamora).
Financiado parcialmente por una beca de la Gerencia Regional de Salud de la Junta de Castilla y León (año 2006).
Correspondencia: Dr. C. Ochoa Sangrador.
Unidad de Investigación. Hospital Virgen de la Concha.
Avda. Requejo, 35. 49029 Zamora. España.
Correo electrónico: cochoas@meditex.es
Recibido en mayo de 2007.
Aceptado para su publicación en junio de 2007.