Introducción
Los tumores del sistema nervioso central (SNC) representan la segunda neoplasia en frecuencia en la edad infantil tras las leucemias (la primera si nos referimos exclusivamente a tumores sólidos)1. Su manejo incluye en la mayoría de los casos la extirpación quirúrgica del tumor, ya sea de manera total si esto es posible, o parcial de cara a reducir la masa tumoral y aumentar la eficacia de otros tratamientos coadyuvantes. El postoperatorio inmediato de los niños sometidos a este tipo de cirugía transcurre habitualmente en la unidad de cuidados intensivos pediátricos (UCIP). Entre las complicaciones descritas destacan trastornos hidroelectrolíticos tales como la diabetes insípida (DI), el síndrome pierde sal (SPS) y el síndrome de secreción inadecuada de hormona antidiurética (SIADH). Las alteraciones que estos desórdenes neuroendocrinos producen sobre el equilibrio hídrico y la natremia pueden tener consecuencias potencialmente graves sobre el propio SNC. Por ello es importante la monitorización estrecha de estos pacientes durante su estancia en UCIP de cara a realizar un diagnóstico y tratamiento precoces.
Existen dos objetivos principales en este estudio. En primer lugar, establecer la frecuencia de aparición de trastornos hidroelectrolíticos (DI, SPS y SIADH) en el postoperatorio inmediato de los niños afectados de tumores cerebrales intervenidos en nuestro centro. En segundo lugar, valorar las características clínicas y analíticas de presentación y la evolución de dichos trastornos.
Material y métodos
Se realiza una revisión retrospectiva de todos los pacientes intervenidos de tumores cerebrales en nuestro centro entre enero de 1998 y junio de 2005 que en el postoperatorio presentaron un cuadro clínico-analítico compatible con DI, SPS o SIADH, en función de los criterios reflejados en la tabla 1.
Se valoran diferentes parámetros con relación al tumor y al trastorno hidroelectrolítico identificado. Sobre el tumor se ha tenido en cuenta su localización anatómica, su histología, si se practicó una resección total o parcial del mismo y si se trataba de la primera cirugía o de una reintervención por recidiva. Sobre el trastorno hidroelectrolítico se han valorado parámetros clínicos (la diuresis, el equilibrio hídrico, la estabilidad hemodinámica y la aparición de clínica neurológica), parámetros bioquímicos (la natremia y natriuria, la osmolaridad en plasma y orina y la densidad urinaria), el momento de aparición del trastorno así como su duración, y el tratamiento aplicado en cada caso.
Resultados
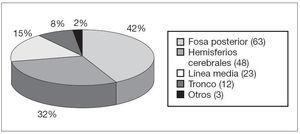
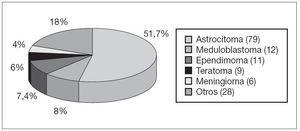
Durante un período de 7 años y medio se realizaron 149 resecciones de tumores del SNC en 120 pacientes, con edades comprendidas entre los 15 días y los 18 años (mediana de edad de 7,4 años). El 58,4 % fueron varones. La localización tumoral más frecuente fue la fosa posterior (42,3 %), seguida de los hemisferios cerebrales (32,2 %) y de la línea media (15,4 %) (fig. 1). El estudio anatomopatológico reveló que en más de la mitad de los casos el tumor resecado era un astrocitoma (fig. 2). En el 55,0 % de los casos se realizó una resección completa del tumor. La tasa de reintervención por recidiva tumoral fue del 22,1 %. Como tratamiento antiinflamatorio se utilizó dexametasona en todos los casos.
Figura 1. Localización de los 149 tumores del SNC intervenidos.
Figura 2. Anatomía patológica de los 149 tumores del SNC intervenidos.
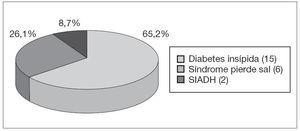
Se identificaron 23 trastornos hidroelectrolíticos en 149 intervenciones realizadas, lo que representa una incidencia del 15,4 %. El trastorno más frecuente fue la DI con 15 casos (incidencia del 10,1 % sobre el total de intervenciones realizadas), lo que supone casi las dos terceras partes de todos los trastornos hidroelectrolíticos diagnosticados (fig. 3). El segundo en frecuencia fue el SPS con 6 casos (incidencia del 4,0 %), y por último el SIADH con tan sólo 2 casos (incidencia del 1,3 %). Las alteraciones electrolíticas han sido más frecuentes en niñas (19 % frente al 12 % en niños).
Figura 3. Distribución de los diferentes trastornos hidroelectrolíticos identificados.
Se valoró la distribución de los diferentes trastornos hidroelectrolíticos en función de la localización anatómica del tumor. Así, se produjo alguna alteración electrolítica en el 17,5 % de las intervenciones de fosa posterior, el 10,4 % de las de hemisferios cerebrales, el 21,7 % de las de línea media y el 8,3 % de las de tronco. Por otro lado, en función de la anatomía patológica del tumor resecado se halló alguna alteración hidroelectrolítica en el 15,6 % de los astrocitomas, el 33,3 % de los meduloblastomas, el 27,3 % de los ependimomas, el 16,7 % de los meningiomas y el 11,1 % de los teratomas. Así mismo, en función del tipo de cirugía realizada se detectaron un 17,1 % de alteraciones electrolíticas en las resecciones totales frente a un 13,4 % en las parciales, y un 17,2 % de trastornos en caso de ser la primera cirugía frente a un 9,1 % en las reintervenciones por recidiva tumoral. Ninguna de las diferencias comentadas anteriormente ha alcanzado la significación estadística.
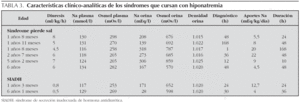
En las tablas 2 y 3 se resumen las características clínicas y bioquímicas de los 23 trastornos hidroelectrolíticos recogidos en nuestra serie.
Los 15 pacientes con DI cursaron con poliuria importante (diuresis media de 11,7 ml/kg/h) y equilibrio hídrico negativo (hasta 1.650 ml en el momento del diagnóstico), a pesar de lo cual todos ellos se mantuvieron hemodinámicamente estables. Sólo se detectó un caso de hipernatremia de 156 mmol/l con hiperosmolaridad sanguínea de 310 mOsmol/l. Precisamente éste fue el único paciente diagnosticado de DI que presentó una convulsión durante el postoperatorio. Destaca en todos los pacientes una densidad urinaria inferior o igual a 1.005. El trastorno apareció en una media de 19 h tras la intervención quirúrgica. Todos los pacientes recibieron tratamiento con desmopresina, en su mayoría intranasal. La diabetes se autolimitó en una media de 73 h tras el diagnóstico, excepto un caso de DI permanente tras la resección de un astrocitoma supraselar.
Los 6 casos de SPS también se presentaron con poliuria (diuresis media de 6,0 ml/kg/h) y equilibrios hídricos negativos (hasta 300 ml en el momento del diagnóstico). Al igual que en el caso anterior, todos los pacientes mantuvieron la estabilidad hemodinámica. La presencia de hiponatremia fue la norma, con sodio en plasma inferior a 125 mmol/l en 3 casos (uno de ellos presentó una convulsión). Destacan las elevadas pérdidas urinarias de sodio (natriuria en ocasiones > 300 mEq/l) y la osmolaridad y densidad urinarias elevadas. La media de aparición del trastorno tras la cirugía fue de 50,4 h. Se adecuó el aporte hídrico en todos los casos y precisaron corrección de sodio 5 de los 6 pacientes (aporte máximo de hasta 22 mEq/kg/día por hiponatremia de 118 mmol/l). El trastorno se resolvió en una media de 57,6 h tras su aparición.
Sólo se detectaron 2 casos de SIADH en sendas intervenciones de tumores de fosa posterior, que cursaron con oliguria (diuresis media de 0,65 ml/kg/h) y equilibrios hídricos positivos. Ambos presentaron hiponatremia (uno de ellos de hasta 117 mmol/l, presentando una convulsión) y osmolaridad y densidad urinarias elevadas. El trastorno se diagnosticó a las 24 y 30 h del postoperatorio, respectivamente, tratándose en ambos casos con restricción hídrica. Sólo uno de ellos requirió corrección de sodio. La resolución espontánea se produjo en las primeras 36 h tras el diagnóstico.
Discusión
La DI se debe a un déficit de hormona antidiurética (ADH), mientras que el SIADH se produce por un exceso de la misma. La DI puede ser causada de manera directa por lesión o degeneración de las neuronas de los núcleos supraópticos y paraventricular del hipotálamo (la causa más frecuente en niños son los tumores como el craneofaringioma y el germinoma, seguida de la histiocitosis de células de Langerhans u otros procesos infiltrativos como leucemias, linfomas o sarcoidosis)2. También se postula que, de manera indirecta tras una neurocirugía (u otro proceso traumático craneal), puede producirse una reprogramación de los osmorreceptores que controlan la secreción de ADH y el mecanismo de sed, situados en el hipotálamo anterior: según si producen secreción de ADH con osmolaridades sanguíneas más bajas o más elevadas de lo normal (umbral osmótico para la secreción de ADH ≥ 280 mOsmol/kg H2O) se producirá un trastorno hidroelectrolítico del tipo SIADH o DI, respectivamente2-4.
La fisiopatología del SPS es menos conocida. El proceso más probable incluye una alteración tanto en los impulsos neurales hacia el riñón como en la elaboración central de sustancias natriuréticas. Una disminución del tono simpático del riñón produce una disminución de la reabsorción de sodio a nivel de la nefrona proximal y una disminución de la secreción de renina (y por lo tanto de aldosterona). Por otra parte, la liberación de uno o más factores natriuréticos (factor natriurético atrial, factor natriurético cerebral) inhiben la reabsorción de sodio a nivel del túbulo colector, al mismo tiempo que disminuyen el tono simpático5.
En nuestra serie, el 15,4 % de los pacientes intervenidos de tumores cerebrales desarrollaron un trastorno hidroelectrolítico, siendo el trastorno más frecuente la DI, con una incidencia del 10,1 %. Existen pocas series de casos publicadas que describan el porcentaje de aparición de alteraciones hidroelectrolíticas en estos pacientes (la mayoría de publicaciones recogen sólo el postoperatorio de los pacientes intervenidos de tumores selares y supraselares). Murillo et al6 registraron una incidencia del 20 % en un total de 158 postoperados (con una incidencia de DI del 8,2 %). En cambio en una serie de 79 pacientes, Hiranrat et al7 observaron una frecuencia de aparición de trastorno electrolítico más elevada, del 45,57 %, con un porcentaje de DI del 29,3 % (23 casos). Pero 8 de estos pacientes presentaban ya la DI previamente a la cirugía, por lo que la incidencia real de trastorno hidroelectrolítico tras la cirugía fue del 40,0 %, con un 21,1 % de DI. El hecho de que 9 individuos presentaran alteraciones hidroelectrolíticas previamente a la cirugía (8 DI y 1 SIADH) (frente a ninguno en nuestra serie) hace presuponer un diagnóstico en una fase más avanzada de la enfermedad, o bien una mayor incidencia en su serie de tumores de línea media, ya que el desarrollo de DI y SIADH está estrechamente relacionado con la localización del tumor7, en especial la DI, que se relaciona con la localización selar y supraselar. Así, en nuestros pacientes, el mayor porcentaje de trastornos en función del número de tumores intervenidos en cada localización tuvo lugar en los postoperados de tumores de la línea media (21,7 %), seguido de los postoperados de fosa posterior (17,5 %). Estas diferencias no han sido estadísticamente significativas, probablemente por el pequeño tamaño de la muestra (23 casos). Si tenemos en cuenta la anatomía patológica del tumor, el mayor porcentaje de complicaciones electrolíticas aparece en las resecciones de meduloblastomas (33,3 %), seguida de los ependimomas (27,3 %). Estas diferencias tampoco han alcanzado la significación estadística. De todas formas, si tenemos en cuenta que no se trata de tumores neurosecretores, pensamos firmemente que estas diferencias se deben a la localización característica de cada histología tumoral. Así, todos los meduloblastomas y ependimomas que produjeron algún trastorno hidroelectrolítico se localizaban en la fosa posterior, mientras que el 60 % de los astrocitomas se encontraban en fosa posterior y línea media (que como hemos comentado con anterioridad eran las localizaciones más frecuentemente relacionadas con la aparición de trastorno electrolítico). Por último, en función del tipo de cirugía realizada hemos observado una mayor incidencia de trastorno electrolítico en el caso de las resecciones totales, y si se trataba de la primera intervención sobre el tumor, aunque estas diferencias tampoco han sido estadísticamente significativas.
El diagnóstico de estos trastornos hidroelectrolíticos puede ser difícil, sobre todo su diferenciación de poliurias fisiológicas tras un aporte excesivo de líquidos intravenosos durante el acto quirúrgico. También el diagnóstico del SIADH puede verse dificultado por el amplio rango de antidiuresis existente según variaciones individuales en el tipo de defecto de osmorregulación (siendo el tipo C el que presenta una diuresis más parecida a la fisiológica)8. La tabla 1 recoge las características clínico-analíticas que orientan al diagnóstico de DI, SPS o SIADH2,3,6.
La DI cursa con poliuria y equilibrios hídricos muy negativos (si no se reponen las elevadas pérdidas urinarias). Esta orina está típicamente muy diluida (densidad ≤ 1.005), siendo el cociente osmolaridad urinaria/osmolaridad plasmática < 13. Sin embargo, la presencia de hipernatremia no es un criterio necesario para el diagnóstico de DI, dado que ésta suele presentarse en fases avanzadas de dicho trastorno. Por el contrario, no podemos establecer el diagnóstico de SPS o SIADH sin la presencia de hiponatremia. Ambos trastornos presentan además una osmolaridad urinaria/osmolaridad plasmática > 13 (por las pérdidas elevadas de sodio por orina en el primer caso, y por la dilución plasmática por retención hídrica en el segundo), por lo que el diagnóstico diferencial se establece en base a la presencia de poliuria u oliguria, respectivamente (y por ende en el volumen extracelular)6,9,10.
Los 15 niños diagnosticados de DI en nuestra serie presentaron poliurias importantes con equilibrios hídricos negativos (a pesar de lo cual mantuvieron la estabilidad hemodinámica) y densidades urinarias bajas. Sólo hubo un caso de hipernatremia (Nap 156 mmol/l) con osmolaridad de 310 mOsmol/l. Precisamente este fue el único paciente que manifestó clínica neurológica (en forma de convulsión), que creemos más relacionada con la localización del tumor (tercera cirugía por recidiva de teratoma en hemisferio cerebral) que con la disnatremia. La DI apareció en una media de 19 h tras la cirugía y se autolimitó en una media de 73 h tras el diagnóstico, excepto en un caso en que perduró un panhipopituitarismo tras la resección de un astrocitoma supraselar, por supuesta lesión del eje hipotálamo-hipofisario. Todos los pacientes afectados de SPS y SIADH presentaron hiponatremia en el momento del diagnóstico. Dada la mayor tendencia a la disnatremia que en la DI, es más frecuente que estas dos alteraciones se presenten con hiponatremias graves (natremia <120 mmol/l en un tercio de los casos de SPS y en la mitad de los SIADH descritos en nuestra serie), y por lo tanto aumenta la probabilidad de aparición de manifestaciones neurológicas. Ambos trastornos se han presentado también en las primeras 24-48 h del postoperatorio, excepto un caso de SPS que se presentó tras una semana de la cirugía en un paciente que había presentado una DI que había precisado tratamiento con vasopresina hasta 2 días antes.
En lo que se refiere al tratamiento, todos los pacientes diagnosticados de DI excepto uno recibieron tratamiento con desmopresina, la mayoría por vía intranasal. La dosis recomendada es de 5-20 µg/8-24 h. También puede administrarse de forma parenteral a dosis de 1-2 mg intramuscular o subcutánea, pero su uso queda generalmente restringido a situaciones agudas. Para ambas presentaciones (intranasal y parenteral), el aumento de la dosis administrada influye más en la duración del efecto que en la intensidad del mismo2. En el SPS, y debido a la natriuresis, los aportes diarios de sodio necesarios para mantener la natremia pueden ser muy elevados (hasta 22 mEq/ kg/día en nuestra serie), así como también la reposición hídrica necesaria para evitar la deshidratación. Hay descritos casos que se han beneficiado del tratamiento con fludrocortisona a altas dosis (0,2-0,4 mg/día)3,8, ya que su efecto mineralocorticoide es capaz de controlar la natriuresis excesiva debida a la secreción inadecuada de péptido natriurético auricular (PNA), aumentando así la reabsorción renal de sodio y evitando la diuresis osmótica. De la misma manera Moro et al9 utilizaron la hidrocortisona como tratamiento profiláctico del SPS. Ninguno de nuestros pacientes recibió tratamiento mineralocorticoide que pudiera hacernos pensar en un sesgo en la incidencia real de SPS en nuestra serie (todos los pacientes recibieron dexametasona como tratamiento antiedema, que carece de poder mineralocorticoide). Los 2 casos de SIADH se controlaron con restricción hídrica (y ajustando los aportes de sodio), sin precisar tratamiento diurético.
En conclusión, los tumores de línea media y fosa posterior son los que más trastornos hidroelectrolíticos han producido en nuestra serie. La DI es la alteración electrolítica más frecuente. Su tratamiento precoz evita la aparición de hipernatremia. La resolución espontánea suele producirse en una media de 3 días (si no existe lesión del eje hipotálamo-hipofisario), requiriéndose durante este tiempo tratamiento sustitutivo con vasopresina. El SPS y el SIADH precisan una estrecha monitorización del sodio por la gran tendencia a la hiponatremia, que exige un adecuado ajuste del aporte hídrico y de sodio.
Correspondencia: Dra. S. Segura Matute.
Servicio de UCIP. Hospital Sant Joan de Déu.
P.º Sant Joan de Déu, 2. 08950 Esplugues de Llobregat. Barcelona. España.
Correo electrónico: ssegura@hsjdbcn.org
Recibido en diciembre de 2006.
Aceptado para su publicación en junio de 2007.