Introducción
La utilización de fármacos en pacientes pediátricos, y muy especialmente en recién nacidos, sigue siendo en la actualidad un tema controvertido. Las condiciones de su uso en esta población no están siempre bien definidas y además, en ocasiones se utilizan fármacos en situaciones no aprobadas en la ficha técnica. Afortunadamente, este panorama ha mejorado en los últimos años, ya que cada vez son más las monografías de fármacos que incluyen datos sobre el uso en niños 1.
La administración de fármacos a niños y en especial a neonatos es mucho más compleja que en adultos. En ciertas ocasiones se realiza una extrapolación de las dosis del adulto, utilizándose un ajuste en relación con el peso corporal, o más raramente con la superficie corporal. No obstante, esta aproximación puede derivar en el uso de dosis tóxicas o ineficaces consecuencia de la variabilidad de los procesos farmacocinéticos y farmacodinámicos de los fármacos en niños.
En la primera etapa de la vida se producen cambios fisiológicos constantes hasta llegar a la vida adulta, no sólo en cuanto a crecimiento, sino también en la maduración de los órganos y sistemas. Las pautas de administración de fármacos en el período neonatal van a diferir de las del resto de niños consecuencia de las importantes diferencias fisiológicas (pH gástrico menos ácido, tránsito intestinal más lento, menor contenido de grasa corporal, mayor permeabilidad de la barrera hematoencefálica, menor unión a proteínas plasmáticas, inmadurez de los microsomas hepáticos, múltiples sistemas enzimáticos inmaduros, menor filtración glomerular, menor reabsorción tubular, etc.) 2.
Otro problema al que nos enfrentamos en la administración de fármacos a niños es la falta de preparaciones comerciales adaptadas a las dosis pediátricas 3. La disponibilidad en el mercado farmacéutico de productos adaptados a las necesidades de los niños, y en especial a las del neonato, es escasa, por lo que va a ser necesaria la elaboración de fórmulas magistrales.
En nuestro entorno, son pocos los estudios que han valorado la utilización de fármacos en las unidades neonatales. El objetivo principal del estudio es describir la prescripción de fármacos en neonatos, con respecto a lo aprobado en ficha técnica y a la necesidad de elaboración de fórmulas magistrales.
Pacientes y métodos
Se realizó un estudio prospectivo de septiembre a noviembre de 2005 en el que durante 46 días elegidos al azar, se recogieron las prescripciones de todos los niños ingresados en la unidad de cuidados intensivos neonatales (UCIN) y en el área de Cuidados Intermedios de la Unidad Neonatal de nuestro centro. Esta unidad cuenta con 38 camas, 12 de cuidados intensivos y 26 de intermedios. Durante el período del estudio, el número de pacientes ingresados fue de 164.
Este análisis de utilización de fármacos en neonatos se realizó dentro de un estudio más amplio cuyo objetivo principal era estimar la incidencia de errores en los procesos de prescripción, transcripción y dispensación, y que ha sido publicado ya de modo parcial 4.
Se excluyeron del estudio las prescripciones de nutrición parenteral, perfusiones de electrólitos, derivados hemáticos, fármacos usados en el marco de ensayos clínicos, gases medicinales y soluciones de heparina para mantenimiento de los accesos vasculares.
Se evaluaron las condiciones de uso de los fármacos utilizando el Catálogo de Especialidades Farmacéuticas del Consejo General del Colegio Oficial de Farmacéuticos del año 2005 5. Se eligió este catálogo por ser una fuente de rápido acceso para obtener información sobre el uso de fármacos, ya que contiene datos de todos los fármacos comercializados en España y coincide, salvo algunas excepciones, con lo recogido en las fichas técnicas de los medicamentos.
En función de la información contenida en el catálogo los fármacos se clasificaron en:
1. Fármacos de uso pediátrico aceptado en niños de cualquier edad sin contraindicaciones ni precauciones especiales de uso por tratarse de población infantil.
2. Fármacos de uso pediátrico restringido:
a)Sólo hay recomendaciones de uso para un determinado grupo de edad.
b)Hay advertencias sobre el uso en población infantil.
3. Fármacos de uso pediátrico no recomendado:
a)Contraindicados en niños.
b)Su uso no se recomienda por la ausencia de estudios en esta población y/o problemas de toxicidad.
Finalmente, siguiendo los criterios de la Food and Drug Administration (FDA) 6 clasificamos los fármacos usados en tres categorías, según el nivel de evidencia científica que los avala:
1. Categoría A. Fármacos cuyo uso está respaldado por ensayos clínicos controlados y con un elevado número de pacientes o por metaanálisis de ensayos cínicos controlados.
2. Categoría B. Fármacos avalados por metaanálisis de ensayos clínicos controlados con conclusiones conflictivas, ensayos con insuficiente número de pacientes o no aleatorizados (estudios de cohortes, casos-controles u observacionales).
3. Categoría C. Incluye fármacos cuyo uso únicamente está apoyado por la experiencia y la opinión de expertos.
Para el agrupamiento de los datos registrados, se emplearon indicadores estadísticos descriptivos de recuento.
Resultados
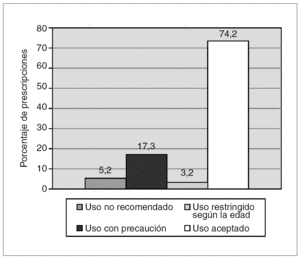
En el período de estudio se registraron un total de 2.558 prescripciones correspondientes a 62 fármacos distintos. El 74,2 % de las prescripciones correspondieron a fármacos con uso aceptado en pediatría, frente al 5,2 % de prescripciones de fármacos no recomendados. Sin embargo, si se valoraban las recomendaciones específicas para su uso en recién nacidos, el porcentaje de fármacos no recomendados ascendía al 8,4 % (fig. 1).
Figura 1. Clasificación de las prescripciones de fármacos en relación a las condiciones de uso en pediatría.
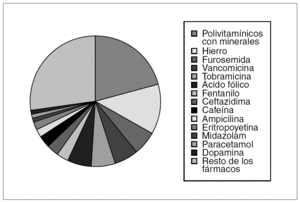
De los 62 fármacos prescritos, 14 (22,6 %) no tenían indicación autorizada en este grupo de edad (dopamina, milrinona, hidralazina, nifedipino, enalapril, omeprazol, sildenafilo, cotrimoxazol, cefaclor, cefazolina, metamizol, cloranfenicol, loperamida y ofloxacino). De estos 14 fármacos, los tres primeros están contraindicados en pediatría, los cuatro siguientes correspondieron a fármacos no recomendados en pediatría y los siete restantes, a fármacos de uso restringido en pediatría según la edad del paciente. Se utilizaron 14 (22,6 %) fármacos autorizados en pediatría, pero con advertencias de uso y otros 34 (54,8 %) con indicación aprobada en pediatría. El 75,5 % de las prescripciones correspondieron a sólo 15 fármacos, todos menos uno (dopamina) con indicación autorizada en pediatría y en tres su uso se recomendaba con precaución (furosemida, midazolam y fentanilo) (fig. 2).
Figura 2. Fármacos prescritos con mayor frecuencia.
En el 17,2 % de las prescripciones fue necesaria la elaboración de fórmulas magistrales orales, por no existir en el mercado una presentación comercial adecuada a la dosificación en pacientes neonatos (tabla 1).
De los 62 distintos fármacos prescritos, 27 (43,5 %) precisaron preparación por el Servicio de Farmacia del centro; en 17 casos se prepararon fórmulas magistrales de uso oral y en 10 de uso parenteral.
En función de la citada clasificación de la FDA, 13 de los 14 fármacos sin indicación autorizada en recién nacidos en nuestro estudio, se clasificaron en la categoría B. El metamizol fue el único fármaco clasificado por la FDA en la categoría C consecuencia de tratarse de un fármaco no comercializado en Estados Unidos.
Discusión
Los resultados del estudio ponen de manifiesto dos problemas relevantes a los que nos enfrentamos a la hora de prescribir, dispensar y administrar fármacos a pacientes neonatos. Por un lado, el 8,4 % de las prescripciones correspondieron a fármacos de uso no recomendado en neonatos, este porcentaje de prescripciones se relacionó con 14 fármacos. Por otro lado, la falta de preparados comerciales adaptados a las necesidades de los recién nacidos, supuso la necesidad de elaborar fórmulas magistrales para la administración vía oral en el 17,2 % de las prescripciones.
Tampoco hay que olvidar la necesidad de dilución de la mayoría de los fármacos previa a la administración parenteral. Esta maniobra, obligada en pacientes neonatos, puede ser una fuente de errores en la preparación y posterior administración de fármacos, bien por utilización de solventes incorrectos, concentraciones finales no recomendadas o bien por problemas de estabilidad de las disoluciones finales.
No son muchos los estudios publicados en relación con las condiciones de utilización de fármacos en pediatría 7. El estudio de Danés Carreras et al 8 evaluó la utilización de fármacos en niños utilizando datos de consumo y no de prescripciones. Las condiciones de uso de los fármacos consideradas fueron las que figuraban en el Catálogo de Especialidades Farmacéuticas del Consejo General del Colegio Oficial de Farmacéuticos de los años 1997 y 2001. El 47 % de los fármacos consumidos fueron de uso pediátrico aceptado, el 28 % de uso restringido, el 9 % de uso no recomendado y en el 16 % de los fármacos no figuraba información referente a población pediátrica. La comparación de estos datos con los obtenidos en un nuestro estudio, revela que la información sobre utilización de fármacos en pediatría ha mejorado en los últimos años. Todos los fármacos registrados en nuestro estudio presentaban información pediátrica específica en el mencionado catálogo de 2005.
El grupo español de Farmacia Pediátrica 9 realizó un estudio de prevalencia en seis Unidades de Neonatos, registrando un total de 816 prescripciones y observaron que en el 12,7 % de los casos se requirió la elaboración de fórmulas magistrales.
T'Jong et al 10,11 realizaron un estudio prospectivo en pacientes pediátricos en el que registraron el 34 % de prescripciones de fármacos de uso aprobado para pediatría y adaptados a las necesidades de dosificación de esta población y el 48 % de prescripciones de fármacos no autorizados para su uso o fármacos que requirieron modificación de sus formas farmacéuticas previo a la administración. El análisis por servicios médicos reveló que en las UCIN la elaboración de fórmulas magistrales fue más frecuente que en otros servicios, consecuencia de la falta de preparados comerciales para esta población.
Estudios similares al realizado en Holanda por T'Jong et al, se han llevado a cabo en Inglaterra y Australia. En el estudio de Turner et al 12,13 en un hospital pediátrico británico se analizaron 2.013 prescripciones, siendo el 25 % de fármacos no autorizados o formas farmacéuticas no adaptadas a los niños. O'Donnell et al 14 analizaron el uso de fármacos en una UCIN australiana durante 10 semanas, recogiendo 1.442 prescripciones correspondientes a 69 fármacos distintos. El 42 % de las prescripciones fueron de fármacos aprobados para su uso en neonatos, el 11 % fueron de fármacos no autorizados para su uso o que requirieron modificaciones de sus formas farmacéuticas antes de su administración. Las diferencias de fármacos no autorizados o que requirieron la elaboración de fórmulas magistrales en los estudios de T'Jong et al y Turner et al y O'Donnell et al son debidas a la crucial función de los Servicios de Farmacia en los hospitales holandeses, al dispensar fármacos adaptados a las necesidades de los niños.
La autorización de uso de fármacos en pediatría requiere la realización previa de ensayos clínicos. Sin embargo, son pocos los ensayos que reclutan a pacientes pediátricos, únicamente aquellos que ensayan con fármacos de uso exclusivo en esta población. Como consecuencia de la escasa investigación, la población pediátrica se suele considerar "huérfana", desde una perspectiva farmacológica. Por ello, los niños no acceden a los fármacos en las mismas condiciones de eficacia y seguridad que los adultos. Los ensayos clínicos en pediatría son complejos debido a no tratarse de una población homogénea, es necesario estratificarla en cinco grupos: recién nacidos pretérmino (< 36 semanas de gestación), recién nacidos a término (0-27 días), lactantes (28 días a 23 meses), escolares (2-11 años) y adolescentes (12-17 años). Por otro lado, el seguimiento de reacciones adversas a largo plazo es lógicamente superior al tratarse de sujetos jóvenes. Esta complejidad técnica junto a la escasa rentabilidad económica ha hecho que la industria no promueva el registro de fármacos en pediatría y la fabricación de especialidades farmacéuticas adaptadas a las dosificaciones pediátricas.
La información disponible en las fichas técnicas de los medicamentos es en muchos casos insuficiente. En ciertas monografías de fármacos autorizados en pediatría no se contemplan aspectos tan fundamentales como la dosificación en los distintos rangos de edad. Los fármacos no aprobados en pediatría son en muchas ocasiones fármacos con los que se cuenta de amplia experiencia en las UCIN. Sería interesante que se fomentara la investigación y trabajo en el campo pediátrico y a la vez se modificaran o completaran las fichas técnicas de los fármacos sobre la base de la evidencia científica disponible en cada momento, con el fin de cubrir las necesidades terapéuticas de una población que se encuentra, todavía, en inferioridad respecto al uso de fármacos 15-17.
Curley et al 18 revisaron el tratamiento de 80 neonatos de muy bajo peso. De las 943 intervenciones terapéuticas registradas, el 91,3 % estuvieron basadas en evidencias científicas, y solamente en el 8,7 % de los casos no hubo evidencia alguna que apoyara su uso.
La necesidad de cubrir las lagunas terapéuticas existentes en la población infantil, ha hecho surgir varias iniciativas con objeto de mejorar la prescripción y administración de fármacos a niños. En el ámbito europeo se ha creado un registro de ensayos clínicos en niños, cuya información es útil para planear nuevos estudios y evitar su duplicación, promover la comunicación y colaboración entre investigadores e identificar las necesidades terapéuticas que siguen desatendidas en niños 19, a la que puede accederse en http://www.dec-net.org. En 2001 el Committee for Medicinal Products for Human Use de la European Agency for the Evaluation of Medicinal Products (EMEA), formó un grupo de trabajo que le proporcionara información y recomendaciones con relación a los problemas existentes con los fármacos en niños. Este grupo de trabajo, llamado Paediatric Working Party desde 2004, realiza reuniones periódicas (Developing a Europea Framework for Research on Children's Medicines, http: //www.efgcp.org/index.php?div = records_mgt&id = wp_children). En 2005 publicó un documento (Formulations of choice for the paediatric population [EMEA/CHMP/ PEG/194810/2005] 20), cuyo objetivo principal es estimular a la industria farmacéutica para que comercialice preparados adaptados a las necesidades pediátricas e informar sobre el uso de fármacos no específicamente formulados para su uso en niños.
La terapéutica en pacientes pediátricos y muy especialmente en recién nacidos se beneficiaría ampliamente de la participación de farmacéuticos especializados en las propias unidades. Los servicios de farmacia deben participar activamente en los procesos de prescripción, dispensación y administración de fármacos ya que, entre sus múltiples funciones se encuentran el asesoramiento al médico en el momento de la prescripción (dosis recomendadas, uso compasivo), la elaboración de fórmulas magistrales orales y mezclas intravenosas adaptadas a las dosis pediátricas y el consejo al personal de enfermería sobre administración de fármacos (estabilidad, volumen de administración, tiempo de infusión, compatibilidades, etc.). La escasa información sobre fármacos en neonatos y la falta de preparaciones comerciales diseñadas para esta población, convierten al farmacéutico en una pieza clave para fomentar el uso racional de los fármacos, participar en la mejora de la calidad asistencial y en la seguridad de estos pequeños y vulnerables pacientes neonatales.
Este trabajo ha sido realizado en parte gracias a una ayuda de investigación concedida por la Fundación Vasca de Innovación e Investigaciones Sanitarias (OIKER/BIOEF). Expediente n.º: BIO04/URM/12.
Correspondencia: Dr. Adolf Valls i Soler.
Unidad Neonatal. Servicio de Pediatría. Hospital de Cruces.
Pl. de Cruces, s/n. 48903 Baracaldo. Bilbao. España.
Recibido en enero de 2006.
Aceptado para su publicación en febrero de 2006.