La enfermedad inflamatoria intestinal pediátrica continúa siendo poco prevalente en nuestro medio. El comienzo de los síntomas puede ser insidioso y el diagnóstico precoz permite disminuir las complicaciones y las secuelas de la enfermedad, así como mejorar el pronóstico. Conviene definir los diferentes intervalos que componen el tiempo hasta el diagnóstico, así como sus peculiaridades y condicionantes para poder actuar sobre ellos y evitar, en la medida de lo posible, que se demore el diagnóstico, lo que repercutirá directamente sobre la salud de nuestros pacientes. Esta revisión pretende proporcionar herramientas para que cada vez sea más precoz el diagnóstico de la enfermedad.
Paediatric inflammatory bowel disease is not very common in Spain. Its onset can be silent and an early diagnosis reduces complications and sequelae related to the disease, and can improve the prognosis. It is advisable to define the different intervals into which the time until the diagnosis is divided, as well as the peculiarities and conditions in order to be able to act on them and, to avoid, as far as possible, the diagnostic delay. The aim of this review is to provide tools to reduce the time to diagnosis.
Pese a que su incidencia y prevalencia se han visto incrementadas en los últimos años1-3, la enfermedad inflamatoria intestinal (EII) no deja de ser una enfermedad poco frecuente en las consultas de Atención Primaria (AP). Además, los pediatras de Atención Primaria (PAP) deben hacer frente diariamente a enfermedades mucho más prevalentes y con sintomatología similar a la EII, como los trastornos de dolor abdominal funcional entre los que se incluyen la dispepsia funcional, el síndrome de intestino irritable, la migraña abdominal y el dolor abdominal funcional no especificado de otra forma, que alcanzan una prevalencia en población pediátrica del 10-20%4. Otro aspecto de suma importancia es la presión asistencial a la que se ven sometidos los PAP, con una media de 1.002 tarjetas sanitarias individuales (TSI)/PAP (fuente: Portal Estadístico del Ministerio de Sanidad Servicios Sociales e Igualdad). Estos 3factores son algunos de los más importantes que condicionan la falta de sospecha diagnóstica y, por ende, de retraso en el diagnóstico de estas enfermedades. Cabe destacar que también se debe trabajar en el ámbito de atención hospitalaria, tanto en urgencias como en planta de hospitalización y en consultas externas, para disminuir el tiempo hasta el diagnóstico (TD) de la EII. Dado que el retraso en su diagnóstico tiene consecuencias deletéreas a corto, medio y largo plazo, es conveniente conocer e identificar las causas de dicho retraso en aras de establecer las estrategias adecuadas para disminuir el intervalo desde el comienzo de los síntomas hasta la confirmación diagnóstica por parte del pediatra especialista en gastroenterología infantil.
Consecuencias del retraso en el diagnóstico de la enfermedad inflamatoria intestinal pediátricaEl TD de la EII es especialmente relevante en niños. La pérdida de días de colegio debido a la enfermedad o a la prolongación indebida del proceso diagnóstico y el aislamiento social son algunas consecuencias potenciales. Los síntomas no tratados, como el dolor o la diarrea, pueden tener un impacto directo en el desarrollo físico y psicosocial de los niños y adolescentes con EII. El retraso en el diagnóstico se asocia a un incremento en el riesgo de complicaciones5,6, a retraso de crecimiento y puberal7, a enfermedad más extensa8-10, a peor respuesta al tratamiento médico8, a mayor necesidad de cirugía5 y a menor calidad de vida11 (Health-related quality of life [HRQOL]). No obstante, no parece influir en el riesgo de colectomía en pacientes con colitis ulcerosa (CU)12. La EII pediátrica (EII-P) se inicia habitualmente en un periodo muy crítico de la vida en el que se están produciendo cambios físicos, como una rápida velocidad de crecimiento, en un estadio fundamental del desarrollo psicosocial de la persona, la fase de desarrollo de la identidad, con el consiguiente riesgo de confusión de roles. El fracaso de crecimiento, las alteraciones del metabolismo óseo, el retraso puberal, la malnutrición y las deficiencias en micronutrientes y vitaminas se asocian con frecuencia a la EII-P. El retraso del crecimiento, menos común en la CU en comparación con la EC, puede aparecer tanto en el momento del diagnóstico como durante el seguimiento. Acontece en el 40-50% de los niños con EC, puede persistir en la edad adulta en el 15-30% de los pacientes y en un 20% hace que no se alcance el potencial de talla adulta. El TD de la EC es uno de los condicionantes de este retraso del crecimiento13,14. De esta forma, en una serie amplia de pacientes se pudo comprobar cómo la prevalencia de retraso de crecimiento era del 9,4, del 15,7 y del 22,3% para aquellos pacientes diagnosticados antes de los 3 meses, entre los 3-6 meses y más allá de los 6 meses, respectivamente, desde el comienzo de los síntomas15. El retraso puberal genera sentimientos de aislamiento o de abandono, más frecuentes que el «bullying», debilitando las relaciones con sus iguales. Los pacientes tienen una pobre imagen corporal, pérdida de autoestima, mayor riesgo de depresión y de ansiedad acerca del futuro y, a largo plazo, pérdida de oportunidades sociales y de desarrollo personal.
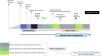
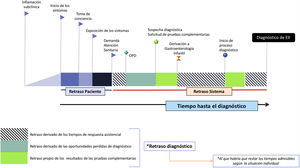
Tiempo hasta el diagnóstico retraso en el diagnóstico y oportunidades perdidas de diagnóstico: conceptos e intervalosEl retraso diagnóstico (RD) se define como el tiempo desde el inicio de los síntomas hasta el diagnóstico. En nuestra opinión, este término es impreciso, por ejemplo, en el hipotético caso de diagnosticar a un paciente con CU en el plazo de 2semanas se consideraría, en nuestra opinión de forma incorrecta, RD. Para evitar confusión, quizás sería mejor hablar del TD como aquel periodo desde el inicio de los síntomas hasta el diagnóstico (fig. 1) y del RD como el tiempo injustificadamente perdido en el diagnóstico cuando no se han aprovechado los episodios de atención médica. Esto incluye el retraso debido al paciente y el retraso debido al sistema de salud. Las oportunidades perdidas de diagnóstico se definen como aquellos episodios de atención médica donde no se inició el procedimiento diagnóstico pese a que la presencia de uno o más signos/síntomas indicativos de EII fueron relatados durante la entrevista. Los episodios de atención médica pueden definirse como aquellas situaciones de interacción médico-paciente bien en Atención Primaria, Urgencias o Atención Hospitalaria. Es difícil determinar cuál es el TD admisible porque dependerá de cada paciente y situación clínica. En este TD se incluyen los tiempos de respuesta asistencial, definidos como aquellos periodos que el paciente espera para la realización de pruebas complementarias o para que sea atendido por un especialista.
El TD comprende diferentes intervalos que merecen ser analizados de forma pormenorizada (tabla 1).
Tiempo hasta el diagnóstico e intervalos del retraso diagnóstico en la EII-P
| Autor | Retraso debido al paciente | Retraso con responsabilidad del sistema de salud | Tiempo hasta diagnóstico | |
|---|---|---|---|---|
| Intervalo 1 | Intervalo 2 | Intervalo 3 | ||
| Schoepfer et al. (2019)16 | 1 m (RIC 1-4) | 1 m (RIC 1-7) | 3 m (RIC 1-9) | |
| El Mouzan et al., 201917 | 6 m (rango 1-24)a | 0,6 m (RIC 0,4-3,4)a,c | 8 m (rango 4-24)a | |
| 2,4 m (rango 0,3-7)b | 0,8 m (0,5-3,9)b,c | 5 m (rango 2,1-8.8)b | ||
| Ricciuto et al., 201810 | 2,96 m (RIC 1,6-8,3) | 15 d (RIC 7-45) | 4,5 m (RIC 2,1-8,8)6,9 m (RIC 2,9-12,6)a2,4 m (RIC 1,3-5,3)b | |
| Jimenez et al., 201718 | 15 d (RIC 12-30)21 d (RIC 12-57)a12 d (RIC 12-27)b | 2,5 m (RIC 0,7-6,8)4,2 m (RIC 1,2-11)a1,1 m (RIC 0,5-2,6)b | 12 d (RIC 7,7-44)14 d (RIC 6,5-43,7)a17 d (RIC 12,5-36,9)b | 4,2 m (RIC 2,3-11,7)9,4 m (RIC 3-14)a3,2 m (RIC 1,4-5,0)b |
| Schoepfer et al., 20179 | 1 m (RIC 0-3) | 3 m (RIC 1-9)c | 4 m (RIC 2-8)a | |
| 0 m (RIC 0-3)b | 2 m (RIC 1-4)b,c | 2 m (RIC 1-7)b | ||
| Arcos-Machancoses et al., 201419 | 2 s (RIC 1-3)a1 s (RIC 1-2,5)b | 0,5 s (RIC 0-1,25)a2 s (RIC 0-4)b | 2 s (RIC 1-4)a5 s (RIC 1,5-34)b | 12 s (RIC 3-51)a12 s (RIC 4-38)b |
| Timmer et al., 201115 | 4 m (RIC 2-8)5 m (RIC 2-10)a3 m (RIC 1-6)b | |||
| Sawczenko et al., 200320 | 5 m (RIC 1-108)6 m (RIC 3,6-12)a4,8 m (RIC 2,4-8,4)b | |||
| Spray et al., 200121 | 11,7 m (rango 1-84)a5 m (rango 0,5-36)b | |||
| Heikenen et al., 199922 | 7,1 m (rango 0,25-36)a6,7 m (rango 0,1-36)b | |||
d: días; m: meses; RIC: rango intercuartílico; s: semanas.
Este intervalo sería responsabilidad del paciente y se refiere al tiempo transcurrido, generalmente desconocido, desde que comienza la enfermedad hasta que el paciente es visto por el primer médico. Se divide en 2subintervalos: el que va desde el momento en que se instaura la enfermedad hasta que el paciente identifica los síntomas y lo pone en conocimiento de sus padres o estos se percatan de la presencia de algún problema, y posteriormente aquel que transcurre hasta que deciden solicitar atención médica. Estos intervalos generalmente se miden en días o semanas y el retraso se debe fundamentalmente a la falta de reconocimiento de signos/síntomas por parte de los padres/pacientes (p. ej., retraso de crecimiento, astenia, dolor abdominal leve, etc.); vergüenza por tratarse de síntomas digestivos (diarrea, molestias perianales, etc.), o a ansiedad causada por el miedo a recibir malas noticias (tabla 2). También pueden influir en este intervalo el medio social del paciente, la extensión geográfica y la accesibilidad a los centro de atención sanitaria, la automedicación, la consideración de que se trata de algo transitorio, el pensamiento místico y el uso de la medicina alternativa para mitigar/aliviar los síntomas. Resulta curioso que no se constatan diferencias en este intervalo en aquellos pacientes con otros familiares afectados frente a los que no tienen antecedentes familiares de EII9,18.
Factores condicionantes de los distintos intervalos
| Factores condicionantes | |
|---|---|
| Intervalo 1 | Falta de reconocimiento de signos/síntomas por parte de los padres/pacientesSíntomas inespecíficos: retraso de crecimiento, astenia, dolor abdominal leve, etc.Vergüenza por tratarse de síntomas digestivos (diarrea, molestias perianales, etc.)Ansiedad causada por el miedo a recibir malas noticiasMedio social del pacienteExtensión geográficaAccesibilidad a los centros de atención sanitariaError diagnóstico y automedicaciónConsideración de que se trata de algo transitorioPensamiento místicoUso de la medicina alternativa para mitigar/aliviar los síntomas |
| Intervalo 2 | Edad del pacienteTipo de EIIExtensión y localización de la enfermedadGravedad del broteSíntomas de presentaciónFalta de reconocimiento de los síntomas por parte del médicoAtribución de los síntomas a procesos más frecuentes |
| Intervalo 3 | Problemas organizativosPriorización de casos más graves o difícilesRealización de excesivas pruebas complementarias no definitivas |
Este intervalo se cuantifica generalmente en meses y es de especial relevancia, ya que se ha objetivado9,10,18 como el que influye más en el TD. Es muy dependiente de la edad del paciente, del tipo de EII, de su extensión, de la actividad y de los síntomas de presentación. Se debe fundamentalmente a la falta de reconocimiento de los síntomas por parte del médico y a la atribución de estos a procesos más frecuentes como los infecciosos.
El registro nacional SPIDER, que incluyó a 149 pacientes con diagnóstico reciente de EII-P en España, puso de manifiesto que el 73,5% acudió a más de un médico, un 29,5% acudió a 3 o más médicos y hasta un 32,7% fue evaluado más de 4 veces por el mismo médico antes de ser derivado al pediatra especialista en gastroenterología infantil. El 52% de los pacientes fue diagnosticado de gastroenteritis aguda; otros diagnósticos fueron intolerancia a la lactosa, síndrome de intestino irritable, intolerancia al gluten, hemorroides, fisura anal, absceso perianal, dolor abdominal recurrente, alergia alimentaria, talla baja y gastritis18.
Los 3factores determinantes de este intervalo son el índice de sospecha de EII, las vías de comunicación con la unidad de referencia a la que se debe derivar al paciente y las experiencias previas. Es muy importante que el PAP tenga presente la posibilidad de una EII, ya que se trata de una enfermedad de baja incidencia y prevalencia. Según el Instituto Nacional de Estadística, la población infantil menor de 14 años en España a 31 de diciembre del 2018 era de 6.438.614 habitantes y la ratio TSI/PAP en 2018 de 1002 niños (fuente: Portal Estadístico del Ministerio de Sanidad Servicios Sociales e Igualdad), conociendo que la incidencia de EII-P en España es de 2,8/105 hab.1, la incidencia de casos de EII-P/Pediatra sería de 0,18 pacientes/año. Si un PAP trabajase durante 35 años podría atender 6,3 pacientes con EII durante toda su vida profesional. Dichos datos hacen patente la necesidad de una alta sospecha diagnóstica en los PAP, puesto que, comparado, por ejemplo, con el dolor abdominal, que constituye el 8-18% del total de las consultas en AP, serán muy pocos los pacientes que finalmente presenten una EII.
Por otra parte, hay que tener en consideración los tiempos de espera y las vías de comunicación desde AP hasta la unidad de referencia a la que se debe derivar al paciente, que varían según las comunidades autónomas. En ocasiones, y según el estado clínico del paciente, dicha espera puede ser excesiva, por lo que se hace prioritario establecer otras vías de derivación a la Unidad de Gastroenterología Infantil que acorten este intervalo.
Este intervalo es significativamente menor en aquellos pacientes con CU o EII no clasificada (EIInC), en mayores de 11 años, en enfermedad de Crohn colónica (B2)23 o ileocolónica (B3) frente a enfermedad de Crohn de localización exclusivamente ileal (L1), y en aquellos con alguno de los signos/síntomas siguientes: diarrea, rectorragia, diarrea sanguinolenta, fiebre o pérdida de peso10,15. El dolor abdominal no es un síntoma discriminativo en el RD pero sí lo es la velocidad de crecimiento10. Este punto es de especial relevancia, ya que el retraso del crecimiento no es reconocido per se como signo de EII y por ello no queda recogido en algunos algoritmos publicados sobre la evaluación de la talla baja24, pese a que la prevalencia de retraso de crecimiento es del 10-56% en la EC y del 0-10% en la CU, y que hasta el 46% tendrán una velocidad de crecimiento reducida antes del comienzo de cualquier otro síntoma relacionado con la EII. Además, solo el 12% tiene una velocidad de crecimiento normal en el momento del diagnóstico13-15.
Intervalo 3: desde la derivación a Gastroenterología Infantil hasta el diagnósticoLa duración de este intervalo suele ser de días y el retraso viene fundamentalmente condicionado por problemas organizativos y debido a la priorización de casos más graves o difíciles10,18,19. En estos casos, la rectorragia contribuyó a agilizar el diagnóstico10.
En este intervalo, hay que tener en cuenta que determinados patógenos pueden producir lesiones endoscópicas similares a las de la EII (tabla 3), de ahí la importancia de ser rigurosos y sistemáticos en el diagnóstico de estos pacientes, recomendándose el estudio en centros con suficiente experiencia31 siguiendo los Criterios de Oporto32, catalogando de forma correcta al paciente, disminuyendo así los casos de EIInC33.
Principales agentes infecciosos responsables de lesiones endoscópicas similares a la EII
| Microorganismo | Posible afectación ileal | Aspecto similar a EC | Aspecto similar a CU |
|---|---|---|---|
| Plesiomonas shigelloides | No | + | +++ |
| Entamoeba histolytica | No | + | +++ |
| Aeromona spp. | No | + | ++ |
| Clostridium difficile | No | + | + |
| Escherichia coli | No | + | + |
| Klebsiella oxytoca | No | + | + |
| Vibrio parahaemolyticus | No | + | + |
| Mycobacterium tuberculosisb | Sí | +++ | + |
| Yersinia enterocoliticaa | Sí | +++ | + |
| Campylobacter spp.a | Sí | ++ | + |
| Salmonella enteritidisa | Sí | + | ++ |
| Shigella dysenteriae | Sí | + | +++ |
| Citomegalovirus | Sí | + | +++ |
Neisseria gonorrhoeae, Chlamydia trachomatis, virus herpes simple, citomegalovirus, Treponema pallidum, Giardia lamblia, Haemophilus ducreyi y Entamoeba histolítica pueden ser causa de proctitis en adolescentes sexualmente activos, considerar ETS.
ETS: enfermedad de transmisión sexual.
Analizando de forma global los factores que influyen en el RD, la afectación colónica en la EC supone un factor protector que aceleraría el diagnóstico, al igual que la sintomatología consistente en diarrea o rectorragia. La edad de inicio inferior a 5 años supondría un factor de riesgo para el RD, así como la enfermedad ileal en la EC. Los resultados de los factores implicados en el TD quedan recogidos en la tabla 4.
Factores implicados en el diagnóstico de la EII
| Factor | OR (IC del 95%) | Tipo de análisis | p | Ref. |
|---|---|---|---|---|
| Enfermedad de Crohn | 0,62 (0,56-0,68)b | MV | ND | 15 |
| EIInC | 0,80 (0,66-0,96)b | MV | ND | 15 |
| Historia familiar | 1,45 (1,07-1,96)b | UV | ND | 15 |
| 8,84 (0,98-76)EC | MV | 0,051 | 17 | |
| Edad (incremento anual) | 1,07 (1,06-1,08)a,b | MV | ND | 15 |
| Edad < 5 años | 0,11 (0,018-0,66) | UV | 0,015 | 19 |
| Edad > 10 años | 15,625 (1,23-200)CU | MV | 0,034 | 17 |
| L2 o L2 + L4 | 1,52 (1,25-1,85)b | MV | ND | 15 |
| L1 | 0,35 (0,13-0,95) | MV | 0,040 | 17 |
| B3 | 0,83 (0,73-0,97)b | UV | ND | 15 |
| G1 | 0,66 (0,53-0,72)b | UV | ND | 15 |
| MEI | 0,89 (0,77-1,01)b | UV | ND | 15 |
| Gravedad del brote | 1,53 (1,00-2,38) | UV | 0,051 | 10 |
| Diarrea | 3,44 (1,35-9,0) | UV | 0,010 | 10 |
| Rectorragia | 3,03 (1,17-7,69) | UV | 0,021 | 10 |
| Diarrea sanguinolenta | 3,57 (1,19-10) | MV | 0,024 | 10 |
| Fiebre | 4,34 (0,93-20) | UV | 0,061 | 10 |
| Pérdida de peso | 2,63 (1,01-6,6) | UV | 0,047 | 10 |
| Retraso de crecimiento | 0,48 (0,31-0,75) | MV | 0,001 | 10 |
| Dolor abdominal | 2,94 (1,06-8,33) | UV | 0,037 | 10 |
| Hipoalbuminemia | 1,26 (1,11-1,42) | MV | 0,001 | 10 |
| Anemia | 1,05 (1,02-1,09) | UV | 0,001 | 10 |
| Elevación PCR | 1,02 (1,0-1,03) | UV | 0,065 | 10 |
| Elevación VSG | 1,03 (1,01-1,05) | UV | 0,015 | 10 |
Variable dependiente: diagnóstico precoz.
CU: colitis ulcerosa; EC: enfermedad de Crohn; EIInC: enfermedad inflamatoria intestinal no clasificada; L: localización de la enfermedad de Crohn (L1: afectación ileal; L2: afectación colónica; L3: afectación ileocolónica; L4: afectación de tramos digestivos altos); B3: enfermedad de Crohn con patrón fistulizante; G1: afectación del crecimiento; MEI: manifestaciones extraintestinales; MV: multivariante; ND: no disponible; PCR: proteína C reactiva; Ref: referencia; UV: univariante; VSG: velocidad de sedimentación globular.
No es infrecuente que durante el intervalo 2 los pacientes reciban uno o varios diagnósticos en un intento de buscar una explicación plausible de lo que está aconteciendo entre una lista de enfermedades de mayor prevalencia que la EII. Es importante acotar en el tiempo la duración de los síntomas e iniciar el estudio diagnóstico de EII cuando estos se prolongan, esto es, cuando se convierten en un signo/síntoma de alarma. En otras ocasiones, son las anomalías en los resultados de las pruebas de laboratorio las que constituyen datos de alarma (tabla 5).
Signos, síntomas y resultados de laboratorio que pueden indicar una enfermedad inflamatoria intestinal
| Síntomas | Astenia o anorexiaDeposiciones nocturnas. Urgencia defecatoriaDiarrea ≥ 2-4a semanas (tipo 5-7 de Bristol) o ≥ 2 episodios en los últimos 6 meses sin otra causa aparenteDiarrea sanguinolenta > 1 semanaaDolor abdominal recurrenteb > 14 días o ≥ 2 episodios de dolor abdominal en los últimos 6 meses (sin cumplir criterios ROMA IV de trastorno funcional)Familiar de primer grado afecto de EIIb,cPérdida involuntaria de más de 1 kg de pesob,cRectorragia sin estreñimiento (según criterios ROMA IV)c |
| Signos | Aftas orales recurrentesEnfermedad perianalc recurrente (abscesoa, fístulasa, fisuras o colgajos cutáneos)Fiebre prolongadabManifestaciones extraintestinales (epiescleritis, escleritis, uveítis, eritema nudoso, pioderma gangrenoso, psoriasis, artritis o acropaquías)cRetraso de crecimientob,c (> –1 DE con respecto a talla diana)Retraso puberal |
| Laboratorio | ASCA o ANCA positivosbElevación de calprotectina fecalbCoprocultivos/estudio de parásitos en heces negativosHemoglobina inferior al rango normal para edad y sexocHipertransaminasemiaElevación de PCR > 10 mg/lb,cPlaquetas > 450 × 109/mm3cElevación de VSG > 20 mm/hb,c |
DE: desviación estándar; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Ninguno de los signos/síntomas ni las determinaciones de laboratorio expuestos con anterioridad son patognomónicos de EII, es por ello que se está trabajando en el desarrollo y la validación de algoritmos que incrementen el índice de sospecha de los médicos y los PAP, y de otros especialistas para la derivación precoz del paciente. Danese et al.38 desarrollaron el Red Flag Index, que está compuesto de 8 ítems puntuados de 2 a 5 puntos. Un Red Flag Index > 8 puntos es capaz de discriminar a pacientes adultos con EC de aquellos con síntomas indicativos, con una sensibilidad, una especificidad, una razón de verosimilitud positiva y una razón de verosimilitud negativa del 94, el 94, 5,1 y 0,066, respectivamente. Holtman et al.35 incluyeron de forma prospectiva a 90 pacientes con síntomas gastrointestinales (diarrea prolongada o dolor abdominal crónico/recurrente) derivados desde Atención Primaria para ser valorados en una Unidad de Gastroenterología infantil. Los autores describen que añadir la calprotectina fecal a los síntomas de alarma (tabla 4) incrementaba de forma significativa el área bajo la curva de 0,80 (0,67-0,92) a 0,97 (0,93-1,00), algo que no ocurría al incluir la proteína C reactiva. En este sentido, los árboles de decisión confirmaron que la combinación de síntomas y calprotectina fecal constituían una estrategia diagnóstica con el beneficio neto más alto con un umbral de probabilidades razonable.
Recientemente, Turner et al. han desarrollado y validado el IBD-REFER, herramienta diseñada para guiar la selección de pacientes que requieren ser derivados a las unidades de Gastroenterología infantil y de adultos ante la sospecha de EII, que está compuesta de 3 criterios mayores y 8 criterios menores incluidos, junto a otros publicados, en la tabla 5. Comparado con el Red Flags Index de la IOIBD, el IBD-REFER presentó sensibilidad y especificidad superiores tanto en adultos como en niños37.
Propuestas de mejoraPor todo lo expuesto, consideramos clave la colaboración entre un equipo interdisciplinar, para así conseguir los objetivos propuestos. Algunas líneas necesarias de trabajo son las siguientes:
- a)
Desarrollo y divulgación de recomendaciones y algoritmos, creados conjuntamente con Atención Primaria, que ayuden a la identificación precoz de estos pacientes (fig. 2)39.
- b)
Establecer canales de comunicación rápidos y efectivos entre centros de Atención Primaria, de Atención Hospitalaria y Centros de Referencia para la derivación precoz de estos pacientes40.
- c)
Creación de rutas de derivación alternativas a las convencionales para reducir el tiempo de diagnóstico (consultas de demanda aguda no demorable, consultas virtuales, consultas telefónicas, etc.).
Los autores declaran no tener ningún conflicto de intereses.