El síndrome de encefalopatía posterior reversible, previamente conocido como leucoencefalopatía posterior reversible, es una entidad manifestada clínicamente por cefalea, disminución del nivel de conciencia, convulsiones y alteraciones visuales, y radiológicamente como edema cerebral, predominantemente de la sustancia blanca de regiones parietooccipitales en la resonancia magnética.
Son múltiples las situaciones que pueden desencadenar el cuadro. Exponemos 5 casos de pacientes oncológicos, 4 de ellos con leucemia linfoblástica aguda, que desarrollaron el síndrome cuando se encontraban bajo tratamiento quimioterápico. Un diagnóstico precoz y un adecuado tratamiento de la hipertensión y las convulsiones son la base para evitar la aparición de secuelas en estos pacientes.
Posterior reversible encephalopathy syndrome, previously known as Reversible posterior leukoencephalopathy syndrome, is a clinical-radiological condition characterized by headache, altered mental functioning, seizures and visual alterations, with the magnetic resonance imaging showing cerebral edema, predominantly in the white matter with posterior distribution.
Multiple clinical conditions can act as triggers. We present five oncology patients, four of them with acute lymphoblastic leukemia, receiving chemotherapy when they presented with this pathology. A prompt diagnosis, an appropriate therapy for hypertension, and a rapid control of the seizures are the keys to avoiding sequelae.
El síndrome de encefalopatía posterior reversible (PRES), descrito en 1996 como leucoencefalopatía posterior reversible, define una entidad clínico-radiológica caracterizada por cefalea, confusión, convulsiones y pérdida de visión, con imágenes en la resonancia magnética (RM) cerebral de edema predominantemente en la sustancia blanca parietooccipital1. Posteriormente, el término fue sustituido por PRES, al apreciar que no había afectación exclusiva de la sustancia blanca2,3.
Múltiples situaciones clínicas y numerosos medicamentos se relacionan con esta enfermedad3–12. Exponemos aquí 5 casos de pacientes oncológicos con PRES, como ampliación de un trabajo publicado en 200813; añadimos los nuevos casos acontecidos, así como nuevos avances publicados.
Casos clínicosCaso 1Niña de 7 años diagnosticada de leucemia linfoblástica aguda (LLA) de alto riesgo que inicia tratamiento de inducción (vincristina, metotrexato, daunorrubicina, ciclofosfamida, corticoide y triple terapia intratecal [TIT]). A los 14 días presenta grave aplasia medular, toxicidad de mucosas, íleo paralítico y enterocolitis mucosanguinolenta; deterioro neurológico progresivo, somnolencia, convulsiones y pérdida de visión. Se objetiva hipertensión arterial (HTA), con cifras de 140/95mmHg. La RM cerebral muestra áreas hiperintensas bilaterales, con afectación de cerebelo, y el electroencefalograma objetiva ondas lentas difusas. Inicialmente se sospecha infiltración tumoral del sistema nervioso central, se suspende la quimioterapia y se inicia radioterapia de globos oculares y creaneoespinal.
A los 7 días mejora progresivamente la clínica hasta normalización neurológica, sospechando el diagnóstico de PRES y reiniciando la quimioterapia, y a las 8 semanas se normaliza la RM.
Actualmente está asintomática, a los 8 años de finalizar el tratamiento.
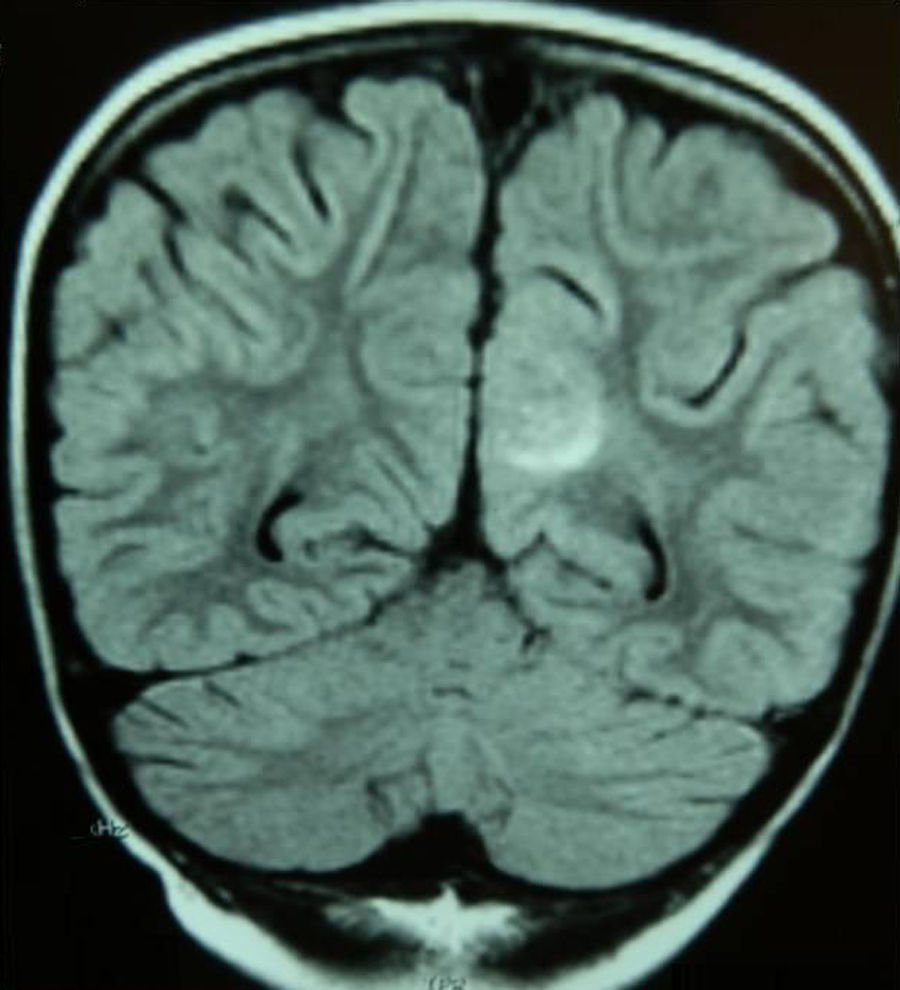
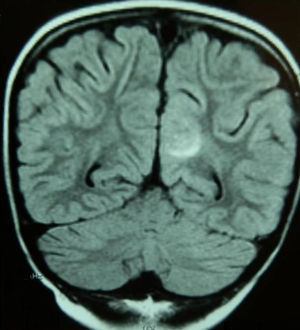
Caso 2Niña de 6 años con LLA de riesgo normal en mantenimiento. Tras la primera reinducción (vincristina, metotrexato, mercaptopurina y TIT) presenta empeoramiento clínico, grave aplasia, íleo paralítico, HTA (150/100mmHg) y 2 crisis focales. Se realiza tomografía computarizada (TC) craneal, que resulta normal, e ingresa en la unidad de cuidados intensivos (UCI), suspendiéndose la quimioterapia e instaurándose tratamiento antiepiléptico y antihipertensivo. A los 3 días la RM muestra hiperintensidad subcortical en la región medial occipital izquierda (fig. 1) y el electroencefalograma objetiva foco lento continuo posterior.
Presenta normalización clínica a los 7 días y RM normal al mes del episodio.
Actualmente está asintomática en la primera remisión, tras 3 años sin tratamiento.
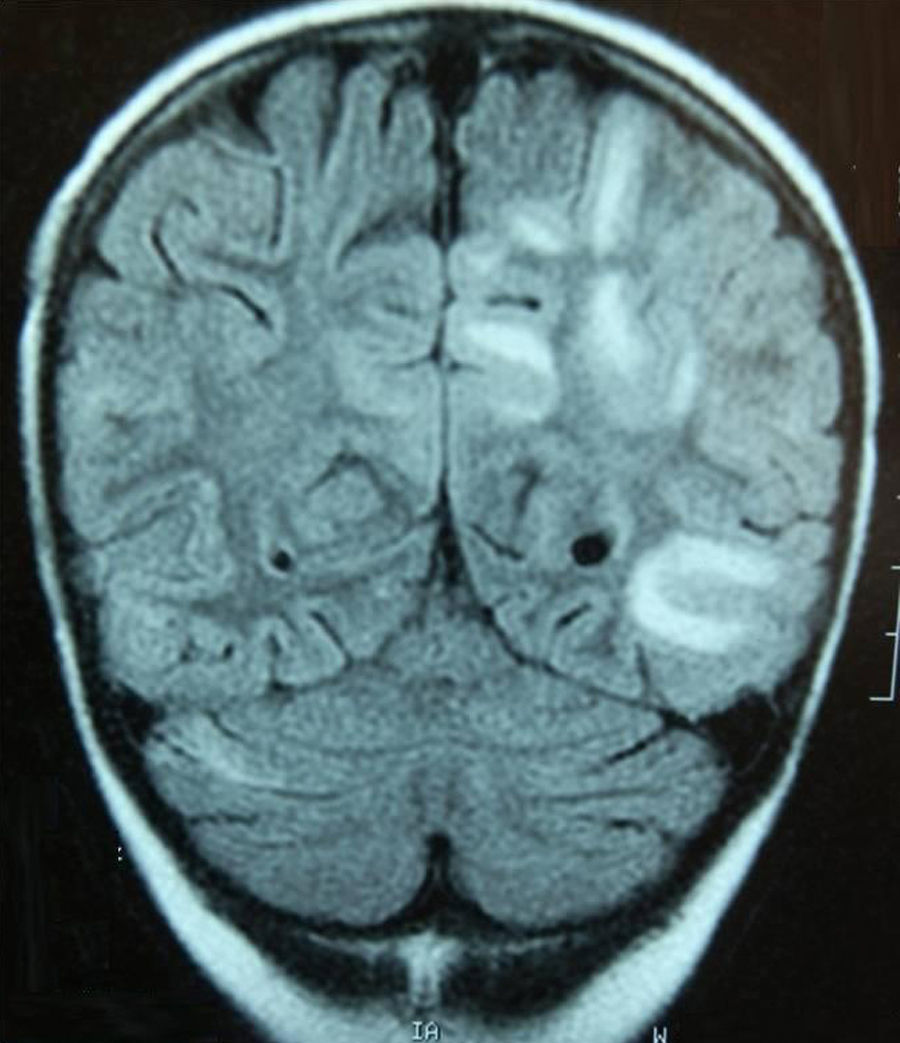
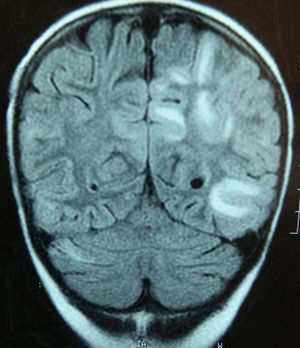
Caso 3Niña de 7 años con LLA de riesgo normal en consolidación (metotrexato, mercaptopurina, citarabina y TIT). Tras presentar inadecuada eliminación de metotrexato presenta retención hídrica, HTA (144/105mmHg), cuadro confusional y convulsiones generalizadas. Ingresa en la UCI, precisando ventilación mecánica, tratamiento antiepiléptico y antihipertensivo. La RM cerebral muestra leucoencefalopatía subcortical predominantemente parieto-occipital (fig. 2), y el electroencefalograma importante lentificación basal y actividad epileptiforme posterior.
La exploración física se normaliza a los 3 días, con resolución de la RM a los 2 meses, persistiendo discreta lentificación temporal derecha en el electroencefalograma.
Actualmente se encuentra en remisión, 2 años tras finalizar la quimioterapia, con tratamiento antiepiléptico por persistencia de crisis.
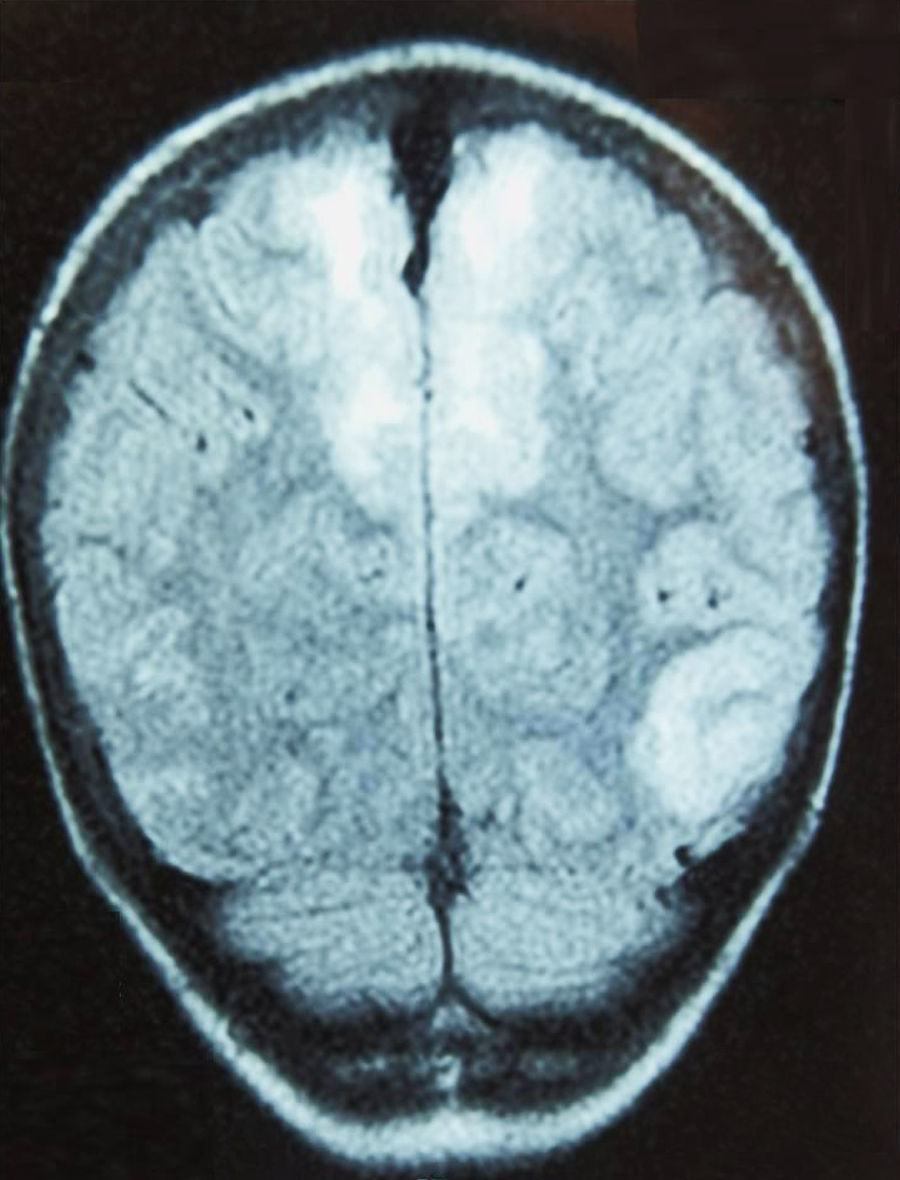
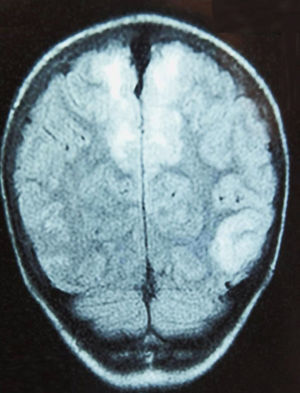
Caso 4Paciente de 12 años con rabdomiosarcoma alveolar metastásico que ingresa por cefalea y dolor abdominal, objetivando HTA (142/103mmHg); es dado de alta 48h antes, tras completar el segundo ciclo de quimioterapia (vincristina, doxorrubicina y ciclofosfamida). En planta presenta 2 crisis generalizadas, e ingresa en la UCI con tratamiento antiepiléptico y antihipertensivo. La TC craneal muestra hipodensidad occipital derecha, objetivando la RM afectación parcheada de la corteza cerebral y sustancia blanca subcortical (fig. 3); el electroencefalograma muestra ondas lentas en regiones occipitales.
Permanece estable, siendo el electroencefalograma de control a los 5 días normal, así como la TC craneal a los 2 meses del episodio.
Actualmente se encuentra en tratamiento quimioterápico por una segunda recidiva tumoral.
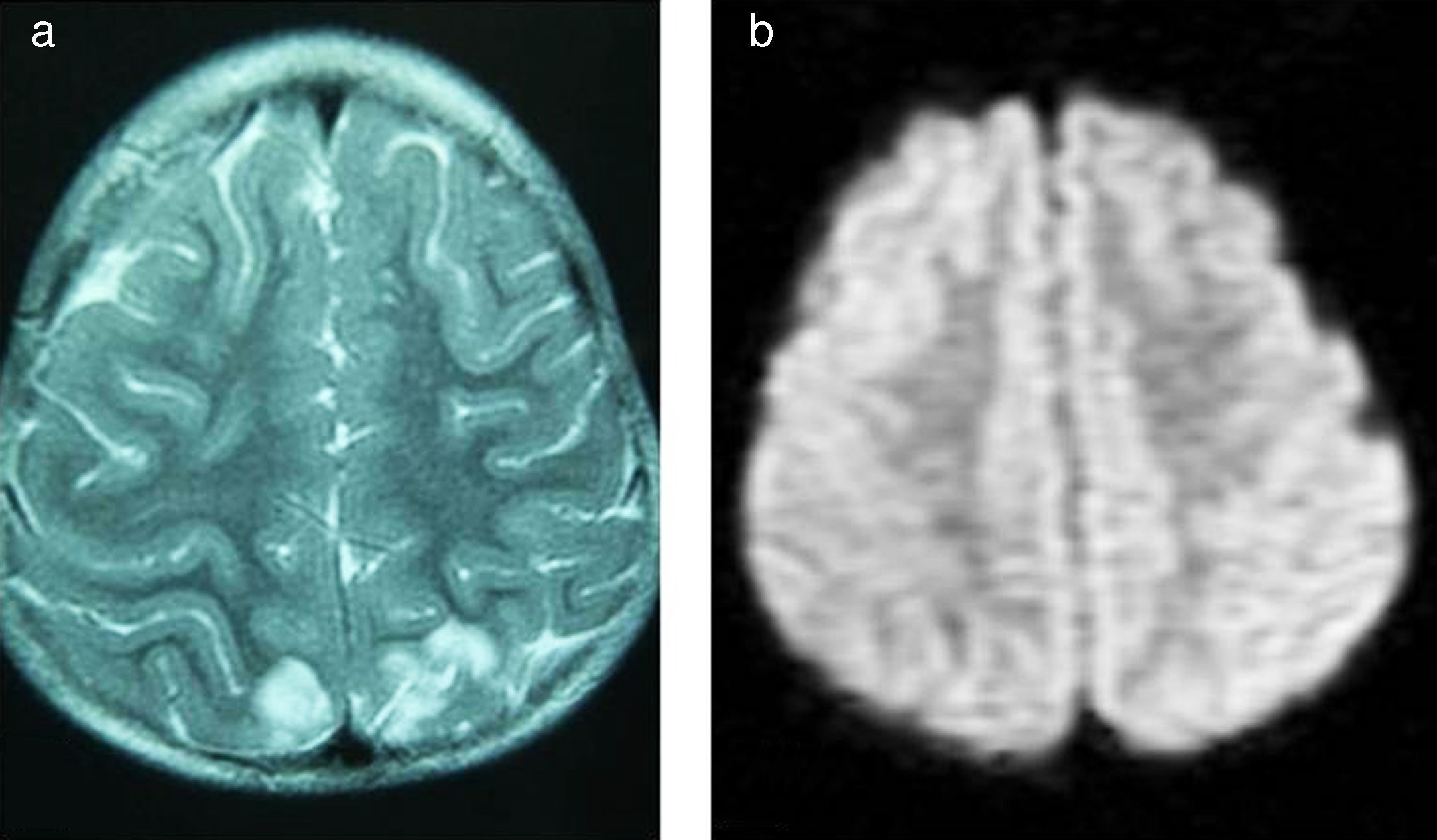
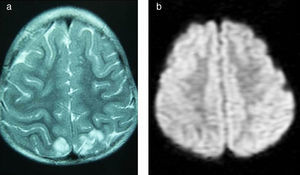
Caso 5Niña de 4 años con síndrome de Down y LLA de alto riesgo, que comienza tratamiento de inducción (vincristina, daunorrubicina, corticoide y TIT). A las 24h presenta decaimiento y retención hídrica, objetivando HTA (150/110mmHg), y se inicia tratamiento antihipertensivo. Se realiza RM cerebral programada como imagen al diagnóstico, observando edema vasogénico en las regiones occipitales (fig. 4). En las horas siguientes presenta tendencia al sueño y una crisis que cede con tratamiento antiepiléptico. Se realiza electroencefalograma, mostrando lentificación generalizada y foco lento parietooccipital bilateral, de predominio izquierdo.
Progresivamente mejora el estado general, con normalización clínica a los 3 días. El electroencefalograma a los 10 días muestra mejoría respecto al previo, así como la RM realizada al mes, persistiendo áreas de leucomalacia subcortical posterior bilateral.
Actualmente está asintomática y continúa tratamiento de consolidación.
DiscusiónEl PRES es una encefalopatía aguda/subaguda, caracterizada por cefalea, disminución del nivel de conciencia, náuseas y/o vómitos, alteraciones visuales y convulsiones12,14, siendo estas últimas generalmente focales secundariamente generalizadas9,12,14. Es una complicación infrecuente de la quimioterapia, pero gracias al aumento de la supervivencia las complicaciones por la toxicidad del tratamiento son cada vez más importantes12,15.
Múltiples enfermedades pueden desencadenar el cuadro, tanto en adultos como en niños11: eclampsia3,7, HTA maligna5, enfermedad renal4,16 o fármacos son las situaciones principalmente descritas; inmunosupresores8 y quimioterápicos6,9,10,12 son los principales tratamientos implicados, aumentando progresivamente la lista. Nuestros pacientes recibieron varios fármacos simultáneamente, siendo difícil identificar el agente causal, pero existen coincidencias entre ellos: la vincristina se administró en 4 pacientes (casos 1, 2, 4 y 5), el metotrexato en 3 (casos 1, 2 y 3) y las 4 pacientes con LLA (1, 2, 3 y 5) recibieron TIT; estos fármacos han sido descritos como desencadenantes habituales del cuadro6,8,9,10,12,13,14.
Respecto a la fisiopatología todavía queda mucho por descubrir. La HTA es un factor importante para el desarrollo del cuadro, y todos nuestros pacientes la presentaban. La hipótesis más aceptada postula que la presencia de HTA que exceda la capacidad de autorregulación vascular cerebral conlleva una vasodilatación arteriolar y la consecuente hiperperfusión, lesionándose la barrera hematoencefálica y extravasándose líquido, originando el edema vasogénico9,14–16. Se acepta que variaciones bruscas de presión arterial actúan como desencadenantes, pero se han descrito casos con HTA desde una semana antes del comienzo del cuadro6. Otra teoría aceptada en casos relacionados con fármacos se basa en su citotoxicidad sobre el endotelio vascular, que alteraría directamente la barrera hematoencefálica con el consecuente daño9,11,14,15. En pacientes pediátricos con LLA varios artículos coinciden en la mayor frecuencia de PRES durante la inducción: bien por la administración repetida de quimioterapia sistémica e intratecal6, o por la administración de prednisona que favorezca la HTA12; un reciente artículo detecta mayor frecuencia de PRES en 2 periodos: durante la inducción, relacionado principalmente con la citotoxicidad de la quimioterapia, y tras el trasplante de progenitores hematopoyéticos, influenciado por HTA e inmunosupresores15.
Respecto a la localización, tradicionalmente se ha descrito predilección por los lóbulos parieto-occipitales, probablemente por mayor susceptibilidad de la circulación posterior al presentar menor inervación simpática8,10,12,14,16, aunque se ha visto que múltiples áreas cerebrales pueden estar implicadas. De hecho, diferentes patrones de distribución han sido descritos16,17.
En cuanto al diagnóstico la TC puede ser útil, apreciando en el 50% de los pacientes hipodensidad de sustancia blanca occipital12. Sin embargo, la técnica de elección es la secuencia de difusión de RM, capaz de diferenciar entre edema vasogénico (sin restricción a la difusión de moléculas de agua) y edema ciototóxico (sí existe restricción, implicando un peor pronóstico)3,6,7,10,12,14,16. Varios artículos citan la hipomagnesemia como un posible dato facilitador del diagnóstico10–12.
La reversibilidad no siempre se cumple, ya que son numerosos los pacientes que desarrollan secuelas, pudiendo darse incluso una evolución fatal6,18,19. En nuestros casos la paciente 3 continuó presentando convulsiones una vez resuelto el cuadro, lo que obligó a mantener tratamiento antiepiléptico. Para evitar la aparición de isquemia y posibles secuelas el tratamiento debe realizarse precozmente11. Debe retirarse el posible desencadenante, así como controlar la presión arterial y las convulsiones11,12. No existe consenso respecto al tratamiento antihipertensivo de elección, pero los fármacos parenterales, como nicardipino, labetalol o nitroprusiato son más eficaces, asociando furosemida en caso de sobrecarga de volemia9. Sin embargo, múltiples fármacos han sido empleados en la literatura para realizar un descenso controlado de la tensión arterial3,4,6,7. Respecto al tratamiento anticonvulsivo se recomienda mantenerlo durante 3-6 meses y retirarlo si no existen anomalías clínicas en la RM o el electroencefalograma10,15. Una vez resuelto el episodio agudo, y alcanzado un estado general que lo permita, es posible reiniciar la quimioterapia10, realizándola siempre cautelosamente debido al riesgo de recurrencia6.
Como conclusión cabe insistir en la importancia de realizar un diagnóstico precoz para iniciar un tratamiento eficaz lo antes posible, con el objetivo de intentar evitar el desarrollo de secuelas. Como ya hemos comentado el PRES es una complicación relativamente infrecuente del tratamiento quimioterápico en niños, pero el aumento de la prevalencia del cáncer infantil, así como una mayor supervivencia, probablemente hagan que la incidencia del cuadro aumente en los próximos años.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.