Esta revisión tiene como objetivo discutir los recientes avances en el conocimiento, diagnóstico y manejo del síndrome linfoproliferativo autoinmune (ALPS).
El ALPS consiste en una alteración en la homeostasis de los linfocitos debida a un fallo en la apoptosis. Las manifestaciones clínicas en la infancia son las citopenias recurrentes, la linfoproliferación crónica no maligna y complicaciones autoinmunes. Los recientes descubrimientos en la biología y genética de esta afección permiten un mejor conocimiento de la misma, que se traduce en cambios en los algoritmos diagnósticos y de tratamiento, con la aparición de nuevos inmunosupresores que han demostrado una mejoría en la calidad de vida de muchos pacientes.
Autoimmune lymphoproliferative syndrome (ALPS) represents a failure of apoptotic mechanisms to maintain lymphocyte homeostasis. ALPS often manifest in childhood with cytopenias, chronic non-malignant lymphoproliferation and autoimmune complications. A number of new insights have improved the understanding of the genetics and biology of ALPS. The treatment of the disease has changed and mycophenolate mofetil and sirolimus have been demonstrated to have marked activity against the disease, improving quality of life for many patients. These will be discussed in this review.
El síndrome linfoproliferativo autoinmune (ALPS) es una alteración de la apoptosis que afecta la supervivencia global de los linfocitos. Se describió por primera vez en los años noventa1 y desde su descubrimiento muchos avances en el diagnóstico, el conocimiento de su fisiopatología y tratamiento han cambiado el conocimiento sobre esta entidad y mejorado la calidad de vida de los pacientes afectados. Este trabajo resume los principales avances científicos en esta afección.
Fisiopatología y genéticaEl ALPS se define como un defecto en la vía de la apoptosis linfocitaria. En condiciones normales, los linfocitos T y B activados aumentan la expresión de Fas (CD95) y los linfocitos T activados incrementan la expresión de Fas ligando. Fas y Fas ligando interactúan activando el dominio asociado a Fas que pone en marcha la cascada de la caspasa que culmina en la degradación de ADN, proteólisis y apoptosis o muerte celular2,3. La apoptosis mediada por Fas es conocida como vía extrínseca de la apoptosis, existiendo una vía intrínseca que se activa por etiologías que producen estrés celular, disminuyendo la permeabilidad de la membrana mitocondrial y activando la apoptosis. Una apoptosis defectuosa conlleva linfoproliferación, alteraciones autoinmunes y cáncer4. En aproximadamente el 70% de los pacientes con ALPS se encuentra una mutación genética responsable. La mayoría (60-70%) son mutaciones del gen FAS en la línea germinal con herencia autosómica dominante, mientras que en un 10% de los casos se trata de mutaciones somáticas del mismo gen. Es menos frecuente que la mutación esté en el Fas ligando (FAS-L) (< 1% de los pacientes) y en la caspasa 10 (2-3% de los casos). Hasta en un 20-30% no se identifica ninguna mutación genética2,5,6. En otoño del 2009, tras una reunión de expertos en ALPS y otros trastornos relacionados procedentes de Estados Unidos, Europa y Australia, el Nacional Institute of Health (NIH) estableció una revisión de los criterios diagnósticos y la clasificación del ALPS con varias modificaciones que se resumen en la tabla 15. Se suprime el uso de números cuando se clasifica el ALPS en función de los defectos genéticos encontrados. Los pacientes con mutaciones de FAS en la línea germinal en estado homocigoto y heterocigoto, que previamente se clasificaban como tipo 0 y ia, respectivamente, se clasifican ahora conjuntamente como ALPS-FAS. Aquellos pacientes con mutación somática del FAS se clasificarán como ALPS-sFAS; cuando la mutación se encuentra en el FAS-L deben clasificarse como ALPS-FASLG y los pacientes con mutación de caspasa 10 se definen como ALPS-CASP10.
Cambios en la nomenclatura del ALPS y afecciones relacionadas
| Nomenclatura actual | Gen | Definición | |
| Nomenclatura previa | |||
| ALPS tipo 0ALPS tipo iaALPS tipo imALPS tipo ibALPS tipo iiaALPS tipo iii | ALPS-FASALPS-FASALPS-sFASALPS-FASLGALPS-CASP10ALPS-U | FASFASFASFASLGCASP10Desconocido | Criterios diagnósticos de ALPS+mutacióngerminal homocigota en el gen FASCriterios diagnósticos de ALPS+ mutacióngerminal heterocigota en FASCriterios diagnósticos de ALPS + mutaciónsomática en FASCriterios diagnósticos de ALPS+mutacióngerminal en el Fas ligandoCriterios diagnósticos de ALPS + mutaciónen caspasa 10Criterios diagnósticos de ALPS, pero no seencuentra alteración genética |
| Patologías relacionadas | |||
| ALPS tipo iiBALPS tipo ivDALDXLP1 | CEDSRALDDALDXLP1 | CASP8NRASKRASDesconocidoSH2D1A | Pacientes con linfadenitis y/o esplenomegalia, infecciones recurrentes, aumento DNT y mutación germinal en caspasa 8Pacientes con autoinmunidad, esplenomegalia y/o linfadenopatías, DNT normal o elevada y mutación somática en NRAS.Pacientes con autoinmunidad, esplenomegalia, linfadenopatías, DNT normal y mutación somática en KRASPacientes con autoinmunidad, linfadenopatía y/o esplenomegalia y defecto en la apoptosisPacientes con infección fulminante por virus de Epstein-Bar, hipogammaglobulinemia o linfoma |
ALPS: síndrome linfoproliferativo autoinmune; CEDS: déficit de caspasa 8; DALD: enfermedad linfoproliferativa autoinmune de Dianzani; DNT: células T dobles negativas; FAS-LG: Fas-ligando; RALD, enfermedad autoinmune leucoproliferativa asociada a RAS; XLP1: síndrome linfoproliferativo ligado al X.
Aquellos casos en que no se encuentra ninguna mutación, conocidos previamente como tipo iii se clasifican en la actualidad como ALPS-U (undetermined). Este grupo tiene manifestaciones clínicas similares a otros pacientes con ALPS, pero no se ha demostrado mayor incidencia de linfomas5.
La mayoría de las mutaciones del gen FAS asociadas a ALPS son mutaciones heterocigotas que afectan al dominio intracelular del receptor FAS y que dan lugar a una proteína defectuosa con efecto dominante negativo en la vía de señalización. Sin embargo, en una proporción significativa de pacientes (hasta un 30%) se detectan mutaciones que afectan a la región extracelular y que afectan a la maquinaria de la apoptosis por un fenómeno de haploinsuficiencia6.
Las mutaciones del ALPS tienen una expresión variable y el tipo de mutación no predice las manifestaciones clínicas y/o de laboratorio. La única asociación encontrada es una mayor incidencia de linfomas secundarios en pacientes con mutación dominante negativa intracelular del gen FAS7.
Aunque la edad de presentación es inferior en los pacientes portadores de mutación en la línea germinal del gen FAS respecto a los portadores de mutaciones somáticas, el fenotipo en ambos casos es similar en cuanto a sus manifestaciones clínicas y hallazgos de laboratorio6.
La penetrancia de la mutación del FAS puede ser diferente en miembros de una misma familia; recientemente, Magerus-Chatinet et al.8 observan que esto puede explicarse como consecuencia de la combinación de múltiples mutaciones (adquiridas y hereditarias) en los genes responsables de esta afección.
En la actualidad, se describe una serie de afecciones que previamente se clasificaban como ALPS y actualmente se reconocen como enfermedades relacionadas (tabla 1). Los pacientes con mutación en el gen que codifica la caspasa 8, previamente clasificados como ALPS tipo iib pasan a clasificarse como déficit de caspasa 8 (CEDS); estos pacientes, a diferencia del ALPS, presentan defectos de linfocitos B, T y natural killer (NK), con infecciones recurrentes por virus y bacterias9,10.
El síndrome con mutación somática del NRAS, previamente conocido como ALPS tipo iv, se reclasifica como RALD; este cambio es consecuencia de la descripción de algunos pacientes con esta entidad que no presentan aumento de células DNT5,11.
El síndrome conocido como enfermedad linfoproliferativa autoinmune de Dianzani sin elevación de DNT, pero con linfoproliferación, alteraciones autoinmunes y defecto en la apoptosis mediada por FAS, conocido como DALD, sigue con igual nomenclatura12,13. Por último, la enfermedad linfoproliferativa ligada al X o enfermedad de Duncan, causada por mutación o deleción en el gen SH2D1A, mantiene igual nomenclatura. Estos pacientes presentan alteraciones de inmunidad asociadas a infecciones por virus de Epstein-Barr (VEB), con mononucleosis grave, hipogammaglobulinemia y linfomas.
Manifestaciones clínicasLa difusión de los avances en el conocimiento del ALPS entre los clínicos en general y los pediatras en particular ha permitido que esta rara entidad se diagnostique con cada vez mayor frecuencia14. Actualmente, se sabe que algunos casos por la variabilidad de las manifestaciones clínicas y el solapamiento con otras enfermedades más conocidas, como la inmunodeficiencia variable común, tenían un diagnóstico erróneo14.
La edad media de presentación está entorno a los 2 años.
La linfadenopatía, la hepatomegalia y/o la esplenomegalia, como manifestaciones de proliferación linfoide, son los hallazgos clínicos más frecuentes y obligan a plantear un diagnóstico diferencial con neoplasia e infecciones15,16. Esta linfoproliferación aparece a edades tempranas (media 11,5 meses), afectando sobre todo a cadenas cervicales, axilares e inguinales. El mediastino y el retroperitoneo también suelen estar afectados cuando se realizan estudios de imagen. En ocasiones, la linfoproliferación es masiva y compromete órganos vitales17. El bazo suele estar aumentado en más del 85% de los pacientes con tamaño fluctuante a lo largo de los años y el hígado en un 45%15. En general, la linfoproliferación mejora con la edad16.
Las alteraciones autoinmunes constituyen la segunda manifestación en frecuencia, presentando estos pacientes citopenias autoinmunes que, por orden de frecuencia, afectan a la serie roja, con anemia hemolítica autoinmune (test de Coombs directo positivo), a la serie megacariocítica (trombocitopenia inmune con anticuerpos antiplaquetarios positivos en la mayoría de los casos) y a la serie granulocítica, con neutropenia autoinmune (anticuerpos antipolimorfonucleares positivos)15.
Otros autoanticuerpos, como anticardiolipinas, antinucleares, etc., suelen ser positivos.
Otras manifestaciones autoinmunes menos frecuentes descritas son: nefritis, hepatitis, cirrosis, pancreatitis, colitis y úlceras en mucosas digestivas, artritis, uveítis, Guillen-Barre, síndromes cerebelosos autoinmunes, convulsiones, fibrosis pulmonar y bronquiolitis obliterante.
Muchos pacientes presentan episodios repetidos de rash cutáneo, urticaria y vasculitis inespecífica14,18.
Los pacientes con ALPS tienen un riesgo aumentado de desarrollar procesos malignos. El riesgo exacto se desconoce, pero se describe entre un 10 y un 20%19, siendo el linfoma no Hodgkin el más frecuente y los pacientes con mutación dominante negativa del gen FAS, los de mayor riesgo7.
DiagnósticoEn 1999 los investigadores del NIH indicaron los criterios diagnósticos del ALPS (tabla 2)19,20. Dichos criterios fueron revisados de forma exhaustiva en el 2009 con el objetivo de simplificar el diagnóstico y la clasificación de esta enfermedad (tabla 2)5.
Criterios diagnóstico de ALPS
| Antiguos criterios | Actuales |
| Necesarios | Necesarios |
| 1. Linfoproliferación crónica no maligna | 1. Linfoproliferación crónica>6 meses |
| 2. Aumento de dobles negativas T | 2. Aumento de dobles negativas T |
| 3. Defecto in vitro de la apoptosis | |
| Accesorios | |
| Primarios | |
| 1. Déficit de apoptosis in vitro (2 determinaciones) | |
| 2. Mutaciones somáticas o germinales en los genes (FAS, FASL, CASP 10) | |
| Secundarios | |
| 1. Alguno de los siguientes marcadores elevados | |
| a. sFAS-LG en plasma>200pg/ml | |
| b. IL-10>20pg/ml | |
| c. Vitamina B12>1.500ng/l | |
| d. IL-18>500pg/ml | |
| 2. Biopsia con hallazgos histológicos compatibles con ALPS | |
| 3. Hipergammaglobulinemia y citopenias inmunes | |
| 4. Historia familiar de ALPS o linfoproliferación no maligna |
Diagnóstico definitivo: cumple criterios necesarios+un criterio accesorio primario.
Diagnóstico probable: cumple criterios necesarios+un criterio accesorio secundario.
Las principales modificaciones en los criterios diagnósticos se resumen a continuación:
- 1.
El defecto en la apoptosis de los linfocitos, considerado previamente un criterio diagnóstico absoluto, pasa a ser un criterio accesorio debido a que su demostración implica la aplicación de técnicas complejas no disponibles en muchos centros, cuya metodología no se encuentra estandarizada y que, además, son incapaces de identificar a los pacientes con mutaciones somáticas de FAS o mutaciones de FASL en línea germinal.
- 2.
Los criterios antiguos no incluían la información genética u otros marcadores que en la actualidad se ha demostrado pueden ser de utilidad en el diagnóstico.
- 3.
Una revisión realizada en diferentes centros, incluyendo controles pediátricos, mostró que un nivel de células TCR alfa β+ DNT del 1%, no siempre predice ALPS. (Niveles entre 1-1,5% pueden observarse en población sana o en otras afecciones8,21,22).
- 4.
Una historia familiar de linfoproliferación no maligna ni secundaria a infección pasa a considerarse un criterio diagnóstico accesorio.
El diagnóstico definitivo de ALPS requiere la presencia de los 2 criterios necesarios linfadenopatía y/o esplenomegalia de causa no infecciosa ni maligna de al menos 6 meses de evolución y elevación de la población DNT, además de un criterio accesorio primario (véase la tabla 2). Cuando el paciente cumple los 2 criterios necesarios y cualquiera de los criterios accesorios clasificados actualmente como secundarios, se considera como diagnóstico probable de ALPS. Desde el punto de vista clínico, el manejo en cuanto a monitorización y tratamiento de los pacientes es similar.
Diagnóstico diferencialLos pacientes con ALPS presentan fenotipos heterogéneos y manifestaciones clínicas que se solapan con múltiples afecciones: malignas, infecciosas, autoinmunes y reumatológicas.
Procesos linfoproliferativos como la enfermedad de Castleman, Rosai-Dorfman, enfermedad linfoproliferativa ligada al X, enfermedad de Dianzani, Kikuchi-Fujimoto, déficit de caspasa 8 y desorden leucoproliferativo asociado a Ras, pueden tener presentaciones clínicas similares al ALPS. La mayoría de estas afecciones pueden diferenciarse histológicamente en la biopsia de algún tejido6.
La enfermedad de Rosai-Dorfman es una histiocitosis con presencia de linfofagocitosis, hallazgo que también pueden presentar algunos ganglios linfáticos en el ALPS, por lo que debe realizarse diagnóstico diferencial20.
El síndrome linfoproliferativo ligado al X es un trastorno en la respuesta inmunitaria mediada por linfocitos T y células NK frente al VEB debido a una mutación en SH2D1A. Los pacientes afectados pueden presentar mononucleosis fulminante, síndrome hemofagocítico, anemia aplásica o linfoproliferación. Estos pacientes pueden considerarse como una forma similar al ALPS, con defecto en la vía de la apoptosis23.
Pacientes con mutaciones de la caspasa 8, anteriormente clasificados como ALPS, como se comenta anteriormente en el texto (véase el apartado «Fisiopatología y genética»), presentan un trastorno de apoptosis no solo en linfocitos T, sino también en B y NK. Estos pacientes tienen predisposición a infecciones mucocutáneas por herpes virus9.
RALD es un nuevo síndrome también descrito en el texto previamente, debido a una mutación somática de genes de la familia Ras (KRAS y NRAS), que puede presentar linfoproliferación, citopenias e hipergammaglobulinemia con DNT moderadamente elevadas o normales y, por tanto, debe incluirse en el diagnóstico diferencial del ALPS11,24,25.
Pacientes con síndrome de Evans con afectación autoinmune de al menos 2 series hematológicas también deben incluirse en el diagnóstico diferencial de ALPS. Recientemente, Seif et al.22, en un estudio multicéntrico, encuentran un porcentaje significativo de niños diagnosticados como Evans que realmente son ALPS. Esta alta incidencia no la encuentran otros trabajos26.
Por último, debemos destacar que, al igual que en la afección previa, pacientes clasificados previamente como inmunodeficiencia variable común han resultado ser ALPS, debido a la dificultad diagnóstica entre ambas afecciones por el solapamiento entre manifestaciones clínicas e inmunológicas27. En todos los pacientes con inmunodeficiencia variable común y citopenias autoinmunes, se recomienda en la actualidad realizar estudio de ALPS17.
En general, los pacientes pediátricos con alteraciones autoinmunes y linfoproliferación deben incluir en su diagnóstico diferencial el ALPS. Igualmente en el caso de niños con citopenias autoinmunes no bien explicadas.
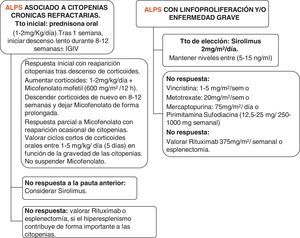
Manejo de pacientes con síndrome linfoproliferativo autoinmune (fig. 1)El consejo genético es una parte integral de la evaluación de pacientes con ALPS y sus familias.
Las adenopatías crónicas pueden fluctuar en su tamaño a lo largo del tiempo, hasta un 20-30% pueden evolucionar hacia un linfoma, por tanto, la vigilancia en estos pacientes es fundamental. Debe realizarse seguimiento clínico estrecho y pruebas de imagen TC, resonancia magnética o PET-TC de forma seriada cada 1-2 años. La PET-TC en la actualidad es una técnica estándar en el diagnóstico y el seguimiento de linfomas, que puede ser de ayuda en centros con experiencia para diferenciar entre adenopatías benignas y adenopatías asociadas a linfoma, en pacientes con ALPS, teniendo en cuenta que la biodistribución de la fluoro-2-deoxi-D glucosa es anormal, incluso en las adenopatías benignas29. En este grupo de pacientes debe considerarse la biopsia cuando existe sospecha clínica de linfoma (manifestaciones sistémicas) o exacerbación de la linfoproliferación.
Actualmente, Rapamicina (también conocido como Sirolimus), un potente inmunosupresor inhibidor del mTOR, que frena la proliferación de linfocitos T y citoquinas, se ha utilizado con éxito en pacientes con ALPS. Sus indicaciones actuales son las citopenias refractarias a otros tratamientos, esplenomegalia importante que plantea la esplenectomía y la linfoproliferación significativa. La ventaja de este fármaco frente al resto es la capacidad de frenar la linfoproliferación y normalizar la población DNT, todo ello debido a que provoca la apoptosis de los linfocitos y aumenta Tregs. Otros fármacos frenan la linfoproliferación de linfocitos, pero no provocan la muerte celular ni aumento de Tregs16,30,31. El fármaco necesita monitorización de la función hepática, renal, produce inmunosupresión de células T, hipercolesterolemia y estomatitis.
La pauta de tratamiento es la siguiente: dosis de carga de 3mg/m2 y, posteriormente, 2,5mg/m2 día (dosis máxima 4mg). Los niveles deben mantenerse entre 5-15ng/ml.
Los niveles deben monitorizarse 2 veces por semana, hasta niveles estables y, posteriormente, espaciar, realizando niveles mensuales.
Pacientes con síndrome linfoproliferativo autoinmune y citopenias refractariasEl manejo inicial de pacientes con citopenias autoinmunes (anemia hemolítica, trombocitopenia, neutropenia) es semejante al de otros enfermos con estas alteraciones. En el caso de las trombocitopenias aisladas, puede seguirse la guía de la Sociedad Española de Hematología y Oncología Pédiatricas (SEHOP) o la guía de la Sociedad Americana de Hematología32.
En general, se aconseja como tratamiento inicial el uso de corticoides a dosis de 1-2mg/kg/día durante una semana, con posterior descenso lento entre 8-12 semanas. El uso concomitante de inmunoglobulinas puede ser eficaz en caso de anemia hemolítica, sin muy buena respuesta en el caso de la trombocitopenia.
En enfermos con neutropenia aislada e infecciones, la asociación de corticoide con factor estimulante de colonias factor estimulante de colonias de granulocitos a dosis bajas (1-2 μg/kg) 2-3 veces a la semana puede ser útil.
Rituximab, un anticuerpo monoclonal anti-CD20, ha sido usado en un pequeño número de pacientes con resultados diversos33. Sin embargo, su uso debe evitarse o reservarse para aquellos pacientes en los que fallan el resto de las terapias, debido a que un porcentaje de pacientes con ALPS puede desarrollar inmunodeficiencia variable común y se ha descrito que el uso de anti-CD20 puede incrementar el riesgo33,34.
Asimismo entre los avances en esta enfermedad se recomienda evitar la esplenectomía debido al alto riesgo de sepsis en esta población, a pesar de una vacunación y una profilaxis con antibiótico correctas16.
Tras los corticoides, el inmunosupresor más estudiado en estos pacientes es el micofenolato mofetilo (MMF), el cual inactiva una enzima necesaria para la síntesis de las purinas, clave para la linfoproliferación de linfocitos, más de 30 casos tratados con este fármaco se han publicado con respuesta de las citopenias en más del 80%28,35. La medicación requiere controles analíticos frecuentes. La tolerancia en general es buena, produciendo como efectos secundarios más comunes diarrea y neutropenia.
La tercera opción de tratamiento en casos refractarios a corticoides, MMF o la combinación de ambos, es el uso de sirolimús.
La cuarta línea de tratamiento, tras fallo de las previas, sería otros inmunosupresores, como hidroxicloroquina, metotrexato, azatioprina, vincristina y mercaptopurina.
En caso de fallo, contemplar la opción de rituximab y la esplenectomía.
Trasplante hematopoyético en pacientes con síndrome linfoproliferativo autoinmuneEn general, la mayoría de los casos no requieren trasplante hematopoyético (TPH). Se han descrito casos de curación tras TPH en pacientes con linfoma, poliarteritis nodosa o fenotipo grave (homocigotos para la mutación del FAS) con citopenias refractarias36,37. Hay que asegurar que el donante ideal (hermano HLA idéntico) no presente la misma alteración de la apoptosis, aunque se encuentre asintomático. La mortalidad resultante de realizar trasplante de donante no emparentado (aproximadamente un 35%)16,38 es muy alta para justificar este tipo de TPH en la mayoría de los pacientes con una afección crónica, que mejora en la mayoría de los casos con los años y debe reservarse para los casos más graves. En la actualidad, diferentes acondicionamientos de intensidad reducida disminuyen la toxicidad a corto y largo plazo, mientras establecen una hematopoyesis procedente del donante suficiente para curar la afección de base, siendo adecuados en niños con inmunodeficiencias39.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.