El grupo de niños menores de 3 años presenta una elevada incidencia y prevalencia de episodios de sibilancias recurrentes, con distintos subgrupos que expresan diferentes respuestas inflamatorias ante agentes desencadenantes diversos, subgrupos que difieren en etiopatogenia e inmunopatología. Los métodos diagnósticos de los que se dispone en la actualidad (óxido nítrico exhalado a respiraciones múltiples, óxido nítrico en el condensado de aire exhalado, esputo inducido, lavado broncoalveolar y biopsia endobronquial) permiten identificar el patrón inflamatorio y realizar un tratamiento que resulte más eficaz y más seguro.
Se revisan las distintas opciones terapéuticas, entre las que se incluyen los glucocorticoides inhalados cuando el fenotipo inflamatorio es eosinofílico y los antagonistas de los receptores de los leucotrienos cuando el fenotipo inflamatorio es de predominio neutrofílico.
De acuerdo con las recomendaciones actuales, tanto el diagnóstico como la terapia iniciada en los niños de esta edad deben revisarse regularmente, de tal modo que si el beneficio no está claro, el tratamiento debe suspenderse y considerar un diagnóstico o tratamiento alternativo. El inicio del tratamiento deberá ser determinado en función de la intensidad y de la frecuencia de los síntomas, con el objetivo de disminuir la morbilidad y aumentar la calidad de vida del paciente.
The 3 year-old group of children has an increased incidence and prevalence of recurrent wheezing episodes. There are different subgroups, who give different inflammatory responses to different triggering agents, and subgroups that differ in aetiopathology and immunopathology. Current diagnostic methods (exhaled nitric oxide in multiple breaths, nitric oxide in exhaled air condensate, induced sputum, broncho-alveolar lavage and endobronchial biopsy), enable the inflammatory pattern to be identified and to give the most effective and safe treatment.
The various therapeutic options for treatment are reviewed, such as inhaled glucocorticoids when the inflammatory phenotype is eosinophilic, and leukotriene receptor antagonists, when the inflammatory phenotype is predominantly neutrophilic.
In accordance with the current recommendations, for the diagnosis as well as for the therapy initiated in children of this age, they must be regularly reviewed, so that if the benefit is not clear, the treatment must be stopped and an alternative diagnosis and treatment considered. The start of treatment should be determined depending on the intensity and frequency of the symptoms, with the aim of decreasing morbidity and increasing the quality of life of the patient.
El III Consenso Pediátrico Internacional1 definió en 1998 el “asma del lactante” como aquella situación en la que se producen tres o más episodios de sibilancias y/o tos, en un marco clínico en el que el diagnóstico de asma es el más probable, tras haber excluido otros procesos menos frecuentes. Esta definición, conceptualmente estratégica, mantiene su actualidad (consenso PRACTALL, 2008)2, ya que incluye la expresión de la enfermedad (sibilancias, tos), la recurrencia de los episodios (tres o más) y la ausencia de otras afecciones (sibilancias y tos no suponen asma)3.
En relación con estas últimas, la radiografía simple de tórax, el test del sudor, las pruebas alérgicas, las inmunoglobulinas (Ig), en especial la IgE, la tomografía computarizada (TC) pulmonar, la pH-metría esofágica, la fibrobroncoscopia, etc., permitirán descartar otras enfermedades que presentan los síntomas del asma en menores de 3 años de edad, como son las malformaciones pulmonares, vasculares, cardiopatías congénitas, fibrosis quística, discinesia ciliar primaria, displasia broncopulmonar y otras neumopatías intersticiales, bronquiolitis obliterante, aspiraciones por reflujo gastroesofágico, cuerpos extraños, tuberculosis pulmonar y otras infecciones, etc. (tabla 1).
Exploraciones relacionadas con el diagnóstico diferencial
| Prick test/IgE total y específicas (aeroalérgenos y alérgenos alimentarios) | Atopia |
| Radiografía de tórax | Malformaciones congénitas, bronquiectasias, enfermedad pulmonar crónica, adenopatías |
| Esofagograma | Compresiones extrínsecas (anomalías vasculares) |
| TC pulmonar | Bronquiectasias, malformaciones congénitas o adquiridas |
| pH-metría | Reflujo gastroesofágico |
| Fibrobroncoscopia | Malformaciones de VAS, cuerpo extraño, signos inflamatorios macroscópicos, patrón inflamatorio (LBA, biopsia) y remodelado (biopsia) |
| Test del sudor | Fibrosis quística |
| Inmunoglobulinas | Inmunodeficiencias |
| Cepillado nasal | Discinesia ciliar primaria |
IgE: inmunoglobulina E; LBA: lavado broncoalveolar; VAS: vía aérea superior.
La mayoría de los estudios epidemiológicos longitudinales consideran el asma como una enfermedad inflamatoria heterogénea con diferentes fenotipos y expresión clínica, y esta disparidad se relaciona con la edad, el sexo, la genética y la exposición ambiental. El conocimiento de la existencia de diversos fenotipos en el asma, con independencia de la edad4,5, amplía el concepto de la enfermedad como síndrome y abre el debate a las modificaciones en las intervenciones terapéuticas.
En general se distinguen tres fenotipos epidemiológicos en lactantes según los datos obtenidos a partir de la cohorte de Tucson6–8 (tabla 2). Además, un nuevo fenotipo se ha relacionado con el sexo femenino y la adolescencia, ajeno al contexto de esta revisión9.
Fenotipos epidemiológicos de lactantes con sibilancias recurrentes según datos de la Cohorte de Tucson
| Fenotipo sibilancias (%) | Edad (años) | |||
| < 3 | 6 | 11–13 | 16 | |
| Sibilancias precoces transitorias (60 %) | ||||
| Sibilancias | + | ¿ | ¿ | ¿ |
| Función pulmonar anormal | + | + | + | + |
| HRB/variabilidad PEF | ? | ? | ¿ | ¿ |
| Sibilancias persistentes no atópicas (20 %) | ||||
| Sibilancias | + | + | ¿ | ¿ |
| Función pulmonar anormal | ¿ | + | + | + |
| HRB/variabilidad PEF | + | ? | ¿ | ¿ |
| Sibilancias persistentes atópicas (20 %) | ||||
| Sibilancias | ¿ | + | + | + |
| Función pulmonar anormal | ¿ | + | + | + |
| HRB/variabilidad PEF | ¿ | + | + | + |
HRB: hiperrespuesta bronquial; PEF: pico de flujo espiratorio.
Presentan, en el primer año de edad, episodios de sibilancias recurrentes que se normalizan antes de los 3–5 años10, con independencia de las intervenciones terapéuticas realizadas. Por lo general no tienen antecedentes familiares de asma ni sensibilización alérgica. Se ha descrito la existencia de una función pulmonar anormal al nacimiento (medidas mediante espirometría parcial forzada, VmáxFRC), análisis del asa flujo-volumen a respiración corriente (tPTEF/tE) o pletismografía corporal antes de los 3 años de edad, con software adecuado para medir las resistencias específicas de la vía aérea (sRaw) sin interrumpir el flujo aéreo11. Esta función pulmonar anormal persiste durante años12.
Los niños con sibilancias precoces transitorias también presentan asociadas otras variables, como son la prematuridad, el sexo masculino, el contacto con hermanos y otros niños en la guardería, el tabaquismo durante el embarazo y la exposición posnatal al humo del tabaco13.
Niños con sibilancias no atópicasEl cuadro se inicia antes del año de edad y los episodios se prolongan más allá de los 3–5 años. El comienzo de la clínica se relaciona con infecciones virales, y destacan el rinovirus (RV)14 y el virus respiratorio sincitial (VRS)15, además de metaneumovirus humano (hMP)16. A diferencia del grupo anterior, la función pulmonar es normal en el momento del nacimiento y se deteriora posteriormente17. Se ha descrito la existencia de hiperrespuesta bronquial a la metacolina y se asume que en este grupo podría existir una respuesta exagerada del sistema immunitario, junto con alteraciones histológicas o funcionales de las vías aéreas18.
Este fenotipo expresa menos gravedad, persistencia y prevalencia que el asma atópica clásica, sobre todo en países desarrollados, en relación con los cuales García-Marcos et al19 han comunicado que al menos el 40 % de los escolares asmáticos no son atópicos.
Niños con sibilancias persistentes atópicasSe manifiestan a partir del primer año de edad y tienen antecedentes personales de atopia (IgE elevada, eosinofilia en sangre periférica, dermatitis atópica, alergia alimentaria) y/o antecedentes familiares en primer grado (asma, alergia alimentaria, dermatitis atópica, rinitis alérgica, alergia medicamentosa, etc.). La función pulmonar es normal en el momento del nacimiento pero, en general, se deteriora de forma significativa antes de los primeros 6 años de vida, se prolonga a lo largo de los 18 años y puede no recuperarse en la vida adulta20. Se ha descrito la existencia de hiperrespuesta bronquial en este grupo, y se ha considerado que la sensibilización alérgica precoz incrementa el riesgo de la morbilidad obstructiva e inflamación de la vía aérea e implica un mayor riesgo de deterioro de la función pulmonar21.
Recientemente, Spycher et al22 han estudiado una cohorte de 1.650 casos de menores de 5 años y los han observado hasta los 18 años. Mediante el análisis de clases latentes, han descrito tres fenotipos de lactantes con sibilancias (niños con sibilancias atópicas persistentes, niños con sibilancias persistentes no atópicas y niños con sibilancias virales transitorias) y dos fenotipos en relación con la tos (tos persistente y tos transitoria). La principal diferencia con los fenotipos descritos en la cohorte de Tucson se encuentra en el grupo de los niños con sibilancias precoces transitorias. Han comunicado que en este grupo, de acuerdo con lo publicado por Lau et al, no existía una función pulmonar anormal en el momento del nacimiento. Las sibilancias se asociaban únicamente a las infecciones virales, el FEV0,5 era igual al grupo control y la hiperrespuesta bronquial era algo superior a la obtenida en niños sanos. Además, han sugerido la posibilidad de que los niños con sibilancias virales transitorias y los que presentan sibilancias persistentes no atópicas formen parte de un mismo grupo en la edad adulta, equivalente al asma intrínseca clásica del adulto.
Actualmente no se dispone de marcadores biológicos sensibles y específicos que permitan distinguir a los lactantes con sibilancias recurrentes que van a ser futuros asmáticos atópicos y que son, además, los que habiendo nacido con una función pulmonar normal presentarán un deterioro irreversible de ésta en los primeros 5 años de la vida. Asimismo, son los que presentarán una mayor persistencia y gravedad de la enfermedad, así como un número superior de recaídas.
Para identificar a este grupo de lactantes, Castro-Rodríguez et al23 propusieron el índice predictivo de asma (IPA) (tabla 3). Los lactantes con más de tres episodios de sibilancias o bronquitis obstructivas al año, durante los primeros 3 años de vida, que además cumplieran con un criterio mayor o dos criterios menores, fueron denominados IPA positivos. Dichos lactantes tienen una sensibilidad del 16 %, una especificidad del 97 %, un valor predictivo positivo del 77 % y un valor predictivo negativo del 68 %, para desarrollar asma. Además, los lactantes con un IPA positivo tuvieron siete veces más riesgo de ser asmáticos en la edad escolar que aquellos con un índice negativo (odds ratio [OR] = 7,1; intervalo de confianza [IC] del 95 %, 3,5-14,1).
Índice predictivo de asma (IPA) para lactantes con sibilancias recurrentes
| IPA original (Castro Rodríguez et al23) | IPA modificado (Guilber et al24) | IPA modificado (Piippo-Savolainen et al26) | |
| Criterios mayores | Diagnóstico médico de asma en alguno de los padres | Diagnóstico médico de asma en alguno de los padres | Diagnóstico médico de asma en alguno de los padres |
| Diagnóstico médico de dermatitis atópica en los primeros 3 años de vida | Diagnóstico médico de dermatitis atópica en los primeros 3 años de vida | Diagnóstico médico de dermatitis atópica en los primeros 3 años de vida y/o alergia alimentaria | |
| Sensibilización alérgica a más de un neumoalérgeno | Tabaquismo familiar* | ||
| Criterios menores | Diagnóstico médico de rinitis alérgica en los primeros 3 años de vida | Alergia alimentaria a leche, huevo o cacahuete | Sensibilización alérgica a neumoalérgenos** |
| Sibilancias no asociadas a resfriados en los primeros 3 años de vida | Sibilancias no asociadas a resfriados en los primeros 3 años de vida | Sibilancias asociadas a virus distintos del VRS en los primeros 3 años de vida | |
| Eosinofilia periférica igual o superior al 4 % en los primeros años de vida | Eosinofilia periférica igual o superior al 4 % en los primeros años de vida | Eosinofilia periférica igual o superior al 4 % en los primeros años de vida |
VRS: virus respiratorio sincitial.
Dada la dificultad para diagnosticar la rinitis alérgica en niños pequeños, Guilbert et al24 han modificado el IPA, añadiendo la sensibilización a uno o más neumoalérgenos como criterio mayor, y la alergia alimentaria al huevo, a la leche o a los frutos secos como criterio menor (tabla 3). Del mismo modo, Goksor et al25 han estudiado 101 casos menores de 2 años de edad, hospitalizados por sibilancias, y han comunicado que la exposición al humo del tabaco, tanto prenatal como posnatal, aumenta el riesgo de desarrollar asma entre los 17 y 20 años de edad, con una OR de 3,5 (IC del 95 %, 1,1-11,3) y de 3,4 (IC del 95 %, 1,2-10,1), respectivamente. También Piippo-Savalainen et al26 han observado que el tabaquismo familiar, y en especial el tabaquismo materno, son un criterio mayor en el índice predictivo de asma de lactantes con sibilancias recurrentes (tabla 3).
Tradicionalmente el asma se considera en niños mayores como una enfermedad inflamatoria de las vías aéreas, inducida por eosinófilos y mediada por Th2, por interleucina 4 (IL-4) e IL-527. Sin embargo, al estudiar la respuesta inflamatoria de las vías aéreas en menores de 3 años, mediante lavado broncoalveolar (LBA)28 y esputo inducido, se han observado patrones inflamatorios no eosiofílicos que representan el 50 % del asma en niños, independientemente de la edad29; predomina el patrón neutrofílico, después los patrones mixtos (neutrófilo y eosinófilo) y, finalmente, el paucigranulocítico. Diversos estudios sugieren que dichos subgrupos inflamatorios pudieran diferir en su etiopatogenia, inmunopatología y, por tanto, en la respuesta al tratamiento clásico con glucocorticoides inhalados (GCI)30. Bourgeois et al31 han estudiado el patrón inflamatorio mediante LBA en 83 lactantes con edades comprendidas entre 4 y 32 meses, encontrando un aumento de la celularidad en los lactantes con sibilancias a expensas de neutrófilos en comparación con los controles, tanto en porcentaje (9 ± 12,1 frente al 2,1 ± 2,2 %; p < 0,05), como en valores absolutos (43,2 ± 81,6 frente a 7,9 ± 11,8 × 103/ml; p < 0,05). La tasa de neutrófilos fue mayor en los lactantes que presentaban episodios graves de sibilancias. Asimismo, no se encontraron diferencias significativas en el patrón eosinofílico en comparación con controles sanos (0,09 ± 0,27 frente a 0,08 ± 0,25 %).
En la fase inicial de las infecciones virales y bacterianas en lactantes con sibilancias, se ha descrito un incremento de neutrófilos, IL-8, IL-1β y leucotrieno B432,33 en las vías aéreas. En ausencia de infección respiratoria, también se ha comunicado34, aunque en menor medida, un aumento significativo en el número de macrófagos, mastocitos, neutrófilos, leucotrieno B4, leucotrieno E4, prostaglandina E2 (PGE2) y 15-hidroxieicosatetraenoico (15-HETE). Además, en lactantes con sibilancias asociadas con infecciones virales, se ha descrito un incremento de la L-selectina con disminución subsiguiente de la CD61 y activación posterior de la inflamación neutrofílica35. Por tanto, el patrón inflamatorio predominante en menores de 3 años de edad sería intermitente, agudo y neutrofílico, a diferencia del patrón eosinofílico crónico de los niños mayores atópicos.
Otro hallazgo de gran interés es que los fenotipos inflamatorios pueden mantenerse independientes en el tiempo, coexistir en un mismo individuo o cambiar a lo largo de la evolución de la enfermedad, dependiendo de las interacciones entre genes y medio ambiente. La identificación del fenotipo predominante en cada fase de la enfermedad, entendida como síndrome, facilitaría la elección del tratamiento idóneo para cada individuo y, por tanto, una mejor respuesta a éste36. Sin embargo, continuamos sin saber cuándo y por qué se produce el cambio de fenotipo en un mismo individuo, desde el patrón inflamatorio intermitente y neutrofílico de la edad preescolar, al crónico y eosinofílico con cambios estructurales de la pared bronquial, característicos de la adolescencia y la edad adulta.
Saglani et al37 han estudiado mediante LBA y biopsia la respuesta inflamatoria en preescolares con episodios graves de sibilancias recurrentes y encontraron un incremento significativo en el grosor de la lámina reticular de la membrana basal del epitelio respiratorio (media = 4,6μm; rango, 2,9-8) en comparación con controles sanos (media = 3,8μm; rango, 2,5-7), en casos con una edad media de 29 meses. Sin embargo, no encontraron correlación significativa con la atopia, la edad, la inflamación eosinofílica y las infecciones por virus. Otros autores38 han comunicado, también en preescolares, la existencia de una pérdida en la estabilidad del epitelio respiratorio con aumento de su fragilidad y de la angiogénesis, así como un incremento máximo de la membrana basal a la edad de 5 años39.
Por tanto, sería razonable pensar que durante los primeros 3 años de vida existiría la oportunidad de intervenir de forma estratégica sobre este síndrome, con el objetivo de minimizar las lesiones sobre la función pulmonar, que ya existen a la edad de 6 años y persisten después, y a nivel inmunopatológico, disminuyendo la inflamación y, por tanto, el remodelado subsiguiente de la vías respiratorias. Sin embargo, el remodelado parece ser la consecuencia de una inflamación crónica de las vías respiratorias y de un funcionamiento inadecuado del sistema inmunitario del propio individuo, que ocurre en diferentes grados y en distintos períodos de la evolución de estos procesos, probablemente en relación, de nuevo, con la interacción de factores genéticos y medioambientales (exacerbaciones respiratorias, infecciones virales, tabaquismo, etc.)40.
APROXIMACIÓN DIAGNÓSTICA AL PATRÓN INFLAMATORIOÓxido nítrico exhaladoEl óxido nítrico (NO) exhalado es un marcador subrogado de inflamación eosinofílica de las vías aéreas. Se sintetiza a partir de dos isoformas de la enzima NO sintetasa: una constitucional (c-NOS) (neuronal y endotelial) y una inducible (i-NOS). Los valores de esta última se correlacionan con los valores de NO exhalado. En numerosos estudios se describe un incremento de la fracción exhalada del NO (FENO) en adultos y en niños asmáticos, y una asociación estrecha con la inflamación eosinofílica, medida en la mucosa de las vías aéreas de dichos pacientes41. Dada su alta capacidad distintiva, se utiliza como complemento de la función pulmonar en el diagnóstico de la enfermedad42. Asimismo, se ha utilizado en la monitorización del tratamiento con GCI en niños asmáticos43,44, por su alta sensibilidad para detectar cambios en respuesta a las dosis recibidas y para detectar el deterioro de la función pulmonar, aun en ausencia de síntomas respiratorios45,46.
En niños menores de 3 años, la medida de la FENO puede realizarse mediante sistemas on-line y off-line, de acuerdo con las recomendaciones publicadas por la European Respiratory Society (ERS) y la American Thoracic Society (ATS) en el año 200547. La medición de la FENOon-line en niños preescolares, con respiraciones múltiples (a respiración corriente) y sin sedación, es posible gracias a las técnicas de imagen y animación para la motivación de los niños pequeños; si ello no es posible, se precisa sedación (con hidrato de cloral) o sueño posprandial, para mantener flujos espiratorios próximos a 50ml/s. Buchvald et al48 han documentado la posibilidad de realizar mediciones on-line válidas de la FENO con respiraciones múltiples y a flujo constante (40–60ml/s), mediante ajuste continuo de las resistencias espiratorias durante la exhalación, a través de restrictores automáticos del flujo. El tiempo de exhalación requerido para un flujo de 50ml/s fue de aproximadamente 1s. Otros investigadores han comunicado la posibilidad de realizar la restricción del flujo de forma manual49. Recientemente, Daniel et al50 han comunicado la posibilidad de determinar la FENO a respiraciones múltiples mediante mascarilla facial, tanto on-line como off-line, en niños de 2 a 7 años, con muy buenos resultados.
Los datos obtenidos con el sistema on-line en niños preescolares a respiraciones múltiples concuerdan con los obtenidos mediante el método on-line a respiración única en pacientes escolares. De este modo, se propone utilizar la FENO como parámetro no invasivo en el seguimiento de la gravedad y la actividad de la enfermedad en niños preescolares con sibilancias recurrentes51.
Óxido nítrico en el condensado del aire exhaladoSe trata de una técnica novedosa y no invasiva en desarrollo. Los principales objetivos de analizar el condensado del aire exhalado son, por una parte, obtener información fiable y segura del revestimiento líquido de las vías respiratorias y, por otra, obtener evidencias sobre el tipo de patrón inflamatorio, alteraciones en el equilibrio ácido-base y del patrón de estrés oxidativo de las distintas enfermedades de las vías respiratorias52. En este contexto se han estudiado numerosos marcadores inflamatorios como son citocinas, leucotrienos, isoprostanos y prostaglandinas.
Ratnawati et al53 han estudiado a 92 niños de edades comprendidas entre 6 y 18 años y determinaron la FENO y el NO en el condensado de aire exhalado. Sus resultados demuestran que tanto la FENO como el NO en el condensado del aire exhalado son significativamente superiores en los pacientes afectados de asma que en los atópicos y que en los sujetos sanos. Asimismo han comunicado una correlación significativa entre ambas técnicas, sin ser intercambiables ni sustituibles, pero se requiere un mayor número de estudios en lactantes54,55. La determinación del NO en el condensado del aire exhalado ha sido estandarizada recientemente por la ATS y la ERS56,57, y es posible su determinación en lactantes con sibilancias recurrentes58.
Esputo inducidoCon esta técnica se pretende obtener una muestra significativa de mucosidad bronquial para analizar parámetros inflamatorios, alérgicos en niños asmáticos, y microbiológicos en enfermedades infecciosas. El estudio del recuento celular en las secreciones bronquiales a través del esputo inducido puede ser de gran utilidad en el diagnóstico y tratamiento de sujetos con tos crónica, sibilancias recurrentes y/o asma. En estos procesos, la presencia de eosinofilia en el esputo (asma con fenotipo eosinofílico) suele permitir que se prediga una buena respuesta clínica al tratamiento con GCI, mientras que su ausencia indicaría una respuesta menos adecuada a dicho tratamiento (asma con fenotipo no eosinofílico). En pacientes con asma de control difícil y patrón eosinofílico ayuda a determinar si la dosis de GCI es suficiente y a determinar la correcta cumplimentación del tratamiento59. Así, la persistencia de una inflamación eosinofílica mantenida en el tiempo pasa a ser un marcador de asma no controlada60,61. Además, algunos estudios han podido establecer una cierta correlación entre eosinofilia o neutrofilia y la gravedad de la enfermedad, lo cual resulta muy interesante para el tratamiento62.
La técnica del esputo inducido ha demostrado tener una rentabilidad diagnóstica similar a la del LBA, pero con una menor agresividad y mayor facilidad de realización. Se trata de una técnica fiable y segura que en general se recomienda en niños mayores de 6 años, aunque existen estudios realizados en lactantes y preescolares con sibilancias recurrentes en los que se ha obtenido la muestra mediante la expectoración inducida en los pacientes que eran capaces de colaborar63,64, o mediante la aspiración a través de la orofaringe o la nasofaringe65. Lex et al66 estudiaron a 27 niños de edades comprendidas entre 5 y 15 años diagnosticados de asma grave y determinaron la FENO, realizaron esputo inducido y fibrobroncoscopia con LBA y biopsia endobronquial posterior. Encontraron una discreta asociación entre el recuento de eosinófilos en el esputo inducido y el LBA (r = 0,45; p = 0,045) y la FENO (r = 0,42; p = 0,049). Además, han comunicado la existencia de una asociación entre la FENO y el recuento de eosinófilos en el LBA (r = 0,54). Sin embargo, no hubo correlación entre la eosinofilia obtenida por LBA y la obtenida mediante biopsia endobronquial, probablemente debido a que estudian el patrón inflamatorio en distintos niveles. El valor predictivo positivo (VPP) para detectar un elevado número de eosinófilos en el LBA al obtener un recuento de eosinófilos superior al 2,5 % en el esputo inducido fue del 75 % y el valor predictivo negativo (VPN) fue del 63 %. Además, el VPP para detectar eosinofilia en el LBA era del 100 % si la FENO era superior a 23ppb y el recuento de eosinófilos en el esputo era superior al 2,5 %. Por tanto, se ha propuesto al esputo inducido como una técnica no invasiva, fiable y segura de monitorización de inflamación eosinofílica en las distintas enfermedades respiratorias.
Lavado broncoalveolarEl LBA es una técnica estandarizada que permite la recuperación de componentes celulares y no celulares de la superficie epitelial del tracto respiratorio inferior. En general se realiza a través de fibrobroncoscopia (LBA broncoscópico)67. En niños, esta técnica se ha visto limitada durante años por el inadecuado tamaño de los fibrobroncoscopios disponibles en relación con el calibre de las vías aéreas de los niños de menor edad y por su mayor grado de agresividad, cuando se utilizaba bajo anestesia general68. Sin embargo, los nuevos fibrobroncoscopios flexibles y rígidos, así como los nuevos procedimientos de sedación-analgesia, han favorecido su utilización en cualquier niño, sea cual sea su edad o condición69,70.
FUNCIÓN PULMONAREspirometría parcial forzadaLos lactantes son incapaces de realizar una maniobra de espiración forzada necesaria para la espirometría clásica y, por tanto, se recurre a la aplicación de una presión negativa en la boca (aspiración torácica forzada) o a realizar una compresión torácica externa (espiración parcial forzada). En general, la maniobra de espiración forzada se inicia al final de una inspiración normal mediante la compresión externa del tórax a través de una chaquetilla inflable y bajo sedación (tidal rapid thoraco-abdominal compression, RTC)71,72. Posteriormente, se ha descrito una modalidad que consiste en realizar una insuflación rápida previa, con el objetivo de alcanzar un volumen cercano a la capacidad pulmonar total (TLC) y posteriormente se realiza la compresión toracoabdominal para alcanzar el volumen residual (VR), de forma similar a lo que ocurre en la espirometría forzada clásica (raised volume rapid thoraco-abdominal compression technique, RVRTC)73. De esta forma, pueden evaluarse variables similares a las obtenidas con la espirometría forzada en niños mayores como la capacidad vital forzada (FVC) y los volúmenes espiratorios forzados (FEV0,4, FEV0,5, FEV0,75 y FEV1), además de la morfología e índices de la curva flujo-volumen obtenida.
En lactantes pequeños, la espiración puede ser inferior a 1s; por tanto, no podrían calcularse la FVC ni el FEV1, y en ese caso se recomienda74 la determinación del FEV0,4, FEV0,5 y del FEV0,75. Asimismo, están adquiriendo mayor relevancia los flujos espiratorios al 50, al 75 y al 85 % de la FVC (FEF50, FEF75 y FEF85), así como el flujo espiratorio forzado entre el 25 y el 75 % de la FVC (FEF25-75), y se ha considerado que el FEF50 es el parámetro más relevante para establecer la normalidad de la función pulmonar75.
Distintos autores han comparado ambas técnicas en lactantes con sibilancias y afectados de fibrosis quística, y han encontrado una mayor sensibilidad distintiva de la RVRTC respecto de la RTC para determinar la disminución en los parámetros obtenidos por función pulmonar (FEV0,5, FEF75, FEF25-75)76,77. Así, esta técnica se utiliza con buenos resultados para analizar la función pulmonar en lactantes sanos, en lactantes con bronquiolitis, bronquitis con sibilancias, fibrosis quística y displasia broncopulmonar, en las que son capaces de detectar alteraciones más leves y sutiles que pueden pasar inadvertidas con las técnicas habituales78–80.
Pletismografía corporal totalEn los lactantes las vías aéreas son pequeñas, las resistencias son elevadas y la conductancia específica es baja. Estas características se modifican con el crecimiento y con el aumento del diámetro relativo de las vías respiratorias81.
La pletismografía corporal total mide el volumen de gas intratorácico y determina la capacidad residual funcional (FRC), las resistencias de la vía respiratoria (Raw), la resistencia específica (sRaw), la conductancia (Gaw) y la conductancia específica (sGaw). La resistencia pulmonar total engloba las resistencias de la pared torácica (Rw), del tejido pulmonar (Rint) y de las vías aéreas (Raw). La Raw es un parámetro reproducible de obstrucción de las vías aéreas y también la morfología de la curva obtenida proporciona información sobre la localización de la obstrucción. La técnica ha sido adaptada para el lactante y preescolar no colaborador, que no es capaz de realizar la inspiración ni la espiración máximas necesarias para determinar la TLC ni el VR. La ERS y la ATS82 han publicado la estandarización y las recomendaciones de la pletismografía en lactantes, que permiten la determinación de la FRC, sRaw y sGaw.
Asimismo, se han comunicado valores de normalidad de VR, FRC y TLC, que son especialmente útiles cuando se repiten en un mismo individuo a lo largo del tiempo, aunque pueden ser específicos de la población y del equipo utilizado, por lo que se recomienda obtener parámetros de normalidad en cada laboratorio83. En lactantes pequeños no colaboradores continúa siendo necesaria la sedación, aunque se ha descrito la posibilidad de la determinación de la sRaw, incluso en niños a partir de los 2 años84–86, mediante fórmulas matemáticas obtenidas a través de la relación entre los cambios de presión en la cabina pletismográfica y el flujo respiratorio sin interrupción del flujo87. La determinación de la sRaw se ha utilizado con buenos resultados para el estudio del crecimiento y desarrollo normal de las vías aéreas durante el primer año de vida, para la distinción entre lactantes sanos y los que presentan sibilancias recurrentes, en quienes se ha descrito un incremento significativo de aquélla respecto a la que presentan los controles sanos88,89.
Pruebas de provocación bronquialLa hiperrespuesta bronquial (HRB), estrechamiento excesivo de los bronquios ante una gran variedad de estímulos, es una de las características del asma en niños mayores y adultos, y forma parte de la tríada diagnóstica de la enfermedad. Sin embargo, no es patognomónica ni exclusiva del asma, incluso pueden presentarla niños asmáticos asintomáticos y también sanos90.
La relación entre la HRB en lactantes y preescolares y las sibilancias recurrentes no está totalmente aclarada y no es equivalente a la de los niños mayores y adultos. En este grupo de edad, la HRB se mide mediante pruebas de provocación bronquial con estímulos directos (metacolina, histamina) o con estímulos indirectos (adenosina). La metacolina y la histamina son las más utilizadas y ambas poseen una potencia similar. La metacolina estimula los receptores vagales muscarínicos de las vías respiratorias y provoca un reflejo broncoconstrictor.
Recientemente se han publicado las recomendaciones para realizar las pruebas de HRB en lactantes y preescolares91. En general, el aerosol de la sustancia broncoconstrictora se administra, mediante nebulizador tipo jet, respirando a volumen corriente a través de una mascarilla. La exploración física y la función pulmonar deben ser normales antes de comenzar, y la SaO2 debe ser superior al 95 %. Tras finalizar la prueba se administra un broncodilatador. Valorar la HRB en lactantes resulta difícil por la necesidad de utilizar técnicas complejas de función pulmonar como la compresión torácica rápida con hiperinsuflación, la medición de resistencias por pletismografía, la oscilometría de impulsos y las resistencias por oclusión que habitualmente requieren sedación92,93. En este sentido, se han propuesto nuevas técnicas que no requieren sedación, como son la determinación de la presión transcutánea de oxígeno y la auscultación de sibilancias en la tráquea y en los campos pulmonares (PCwheeze)94.
Se denomina PCwheeze a la concentración de la sustancia broncoconstrictora en la que se auscultan sibilancias en la tráquea; además, también se considera como prueba positiva si desciende la SaO2 más de un 5 % o si aumenta la frecuencia respiratoria un 50 % respecto al valor basal. Se trata de una técnica validada en niños mayores, y se ha obtenido una buena correlación entre la PCwheeze y la concentración de sustancia que disminuye un 20% el volumen espiratorio forzado en el primer segundo (FEV1) obtenido por espirometría forzada (PC20)95. Es una técnica segura, eficaz y fiable para detectar HRB en lactantes y preescolares96, que alcanza una sensibilidad del 100 % y una especificidad del 91 % para las sibilancias auscultadas por el propio pediatra97. Saga et al98 han referido una mayor HRB en lactantes y preescolares con bronquiolitis y con sibilancias recurrentes que en los sujetos sanos y, además, han descrito un incremento significativo de la probabilidad de desarrollar asma en los sujetos que presentan una mayor HRB. Asimismo, Palmer et al99 han estudiado la HRB en lactantes de 1 mes de edad y han comunicado que la determinación de HRB a dicha edad, antes incluso de que se presenten problemas respiratorios, se asocia con función pulmonar anormal y con el desarrollo posterior de asma a los 6 años de edad. Por tanto, se ha propuesto que la PCwheeze es una técnica fiable y segura para la determinación de la HRB en lactantes y niños preescolares no colaboradores.
TRATAMIENTO DE LAS SIBILANCIAS RECURRENTES EN MENORES DE 3 AÑOSLas dificultades e incertidumbres expuestas en la introducción de este artículo hacen que la mayor parte de las guías y consensos dediquen una sección aparte para los niños menores de 3–5 años (Guía de Práctica Clínica del País Vasco100, GINA101, Guía Británica102, NAEPP103, PRACTALL2). Aunque en un lactante con sibilancias recurrentes es difícil predecir con certeza a cuál de los grupos fenotípicos descritos pertenece, hasta el momento sólo dos documentos de consenso, en Suiza104 y en España105, han dedicado una atención específica al tratamiento del preescolar con sibilancias recurrentes, de acuerdo a su clasificación por fenotipos y/o al índice predictivo de asma.
En general, las recomendaciones actuales sugieren que tanto el diagnóstico como la terapia iniciada en los niños de esta edad deben revisarse regularmente, de tal modo que si el beneficio no está claro, el tratamiento debe suspenderse y considerar un diagnóstico o tratamiento alternativo. Muchos niños con síntomas leves pueden ser controlados de forma conservadora con una simple información de la naturaleza del proceso. La introducción escalonada de fármacos de rescate y preventivos sigue las mismas líneas que para los niños mayores.
¿Quiénes deberían recibir tratamiento de mantenimiento?El NAEPP Expert Panel Report 3103 considera que el tratamiento de control debe iniciarse “en los lactantes y niños pequeños que requieran tratamiento sintomático, al menos 2 días a la semana durante más de 1 mes; que hayan tenido dos exacerbaciones que hayan requerido tratamiento sistémico con corticoides en los 6 meses anteriores, o en los sujetos, que teniendo un IPA (+), hayan presentado, en el año anterior, más de cuatro episodios de sibilancias, de más de 1 día de duración, que afecten al sueño”. Otra posibilidad es considerar esta terapia sólo durante los períodos o estaciones de riesgo, datos previamente documentados (p. ej., infecciones virales). Por tanto, el inicio del tratamiento deberá determinarse en función de la intensidad y de la frecuencia de los síntomas, con el objetivo de disminuir la morbilidad y aumentar la calidad de vida del paciente.
Intervenciones farmacológicas en niños con sibilancias recurrentesDurante bastante tiempo se ha postulado la introducción precoz de los GCI con el objetivo de modificar la historia natural de las sibilancias recurrentes al asma e impedir el remodelado de las vías aéreas. Sin embargo, en los ensayos clínicos PEAK106, PAC107 e IFWING108 se ha podido constatar que los GCI administrados muy precozmente no modifican la historia natural del asma, aunque sí son capaces de controlar los síntomas de la enfermedad mientras se mantiene su administración.
En algunos estudios realizados en niños con edades comprendidas entre 12 y 47 meses tratados con fluticasona se observó una clara mejoría en cuanto a frecuencia de síntomas y exacerbaciones109–112. Otros estudios han referido la eficacia de los GCI en esta franja de edad cuando se mide la función pulmonar113, aunque otros investigadores no han observado dicho beneficio114. Cuando se ha valorado la FENO como medida de eficacia de los GCI en lactantes con sibilancias recurrentes y riesgo de atopia115, se ha observado su reducción significativa en el grupo tratado con fluticasona. Por el contrario, otros estudios en lactantes afectados de sibilancias posbronquiolitis o con episodios de sibilancias relacionados con infecciones virales, han cuestionado la utilidad de los GCI116–119. Por tanto, la evidencia que apoya el uso de los GCI como fármacos preferentes para el tratamiento en los episodios de sibilancias recurrentes en lactantes pequeños es bastante limitada.
Algunos estudios han tratado de identificar factores que pudieran predecir la respuesta positiva del lactante a los GCI. Roorda et al120 identificaron dos factores: la presencia de síntomas frecuentes (igual o más de 3 días/semana) e historia familiar de asma, pero no encontraron correlación con otros factores de riesgo de asma, como son rinitis o eccema. Sin embargo, puesto que no hay forma de conocer prospectivamente el fenotipo al que pertenece cada paciente, parece razonable instaurar un tratamiento a modo de prueba (ensayo-error) durante 4–8 semanas, interrumpiéndolo en caso de fracaso terapéutico121.
La eficacia de los antagonistas de los receptores de los leucotrienos (ARLT) se ha demostrado en distintos estudios y se ha comunicado su beneficio en el control de los síntomas122–125. Sin embargo, otros investigadores no han observado mejoras en la función pulmonar y en los parámetros inflamatorios126–128.
En relación con el papel que puedan desempeñar otro tipo de fármacos, si tenemos en cuenta que la inflamación de tipo neutrofílico es la que predomina en este tipo de pacientes, es posible que fármacos como los macrólidos, por su efecto antiinflamatorio, puedan contribuir al tratamiento eficaz de determinados pacientes. Si bien es cierto que no se dispone de pruebas que justifiquen el uso universal de macrólidos en pacientes con sibilancias recurrentes129, su efecto inmunomodulador se ha descrito en diferentes estudios resumidos y publicados en interesantes revisiones130,131. Los efectos no ribosomales que producen en las distintas bacterias (disminución de la adherencia, de la formación del biofilm y de la virulencia), la disminución de la hipersecreción mucosa, la inhibición de la expresión de las moléculas de adhesión como las ICAM-1, junto con la supresión de citocinas proinflamatorias (IL-1β, IL-8, TNF-α, IFN-γ), quimocinas y otros mediadores, constituyen las características principales de los efectos relacionados con la inmunomodulación de los macrólidos. En lactantes con sibilancias recurrentes, la administración de claritromicina ha demostrado conseguir una reducción de la concentración de IL-1β, IL-10 y TNF-α en la mucosa nasofaríngea132.
Finalmente, ni las cromonas ni la teofilina son fármacos recomendados en este grupo de edad. Tampoco los agonistas beta-2-adrenérgicos de acción prolongada están indicados, salvo en los casos en los que la necesidad de administrar broncodilatadores sea muy frecuente y haya buena respuesta, en particular si los pacientes son atópicos.
La decisión sobre qué tipo de fármaco utilizar debe ser individualizada en función de los medios de los que se disponga para determinar la expresión inflamatoria de las sibilancias recurrentes o, en ausencia de aquéllos, que se presuponga, teniendo en cuenta la historia clínica y los exámenes complementarios (IPA), intentando evitar tanto el infratratamiento como el sobretratamiento, cuestión esta última de gran actualidad. Hay que clasificar los episodios de sibilancias recurrentes en función de la gravedad, para realizar una aproximación farmacológica, además de otras, adecuada.
Si no se dispone de medios complementarios oportunos, como los reseñados previamente para medir y establecer la inflamación subyacente, y se sospecha un patrón neutrofílico, por relacionarse las exacerbaciones con infecciones víricas, recomendamos realizar un tratamiento de entrada con ALTR (prueba ensayo-error). Sin embargo, cuando el diagnóstico médico de asma es de alta probabilidad de corresponder a un patrón eosinofílico, los GCI son el tratamiento de elección (evidencia A)102 y hay que iniciarlo lo antes posible.
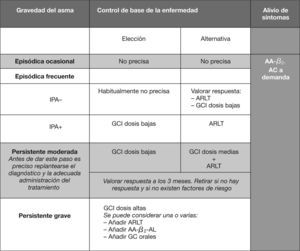
Tratamiento de mantenimientoLos niños menores de 3 años con IPA negativo, con cuadro de sibilancias recurrentes de baja frecuencia y/o intensidad, no precisan tratamiento de base. Cuando la intensidad y/o la frecuencia es algo mayor, se debe valorar la respuesta (opción de elección) a los ARLT o a GCI (opción alternativa). En los casos que presentan un IPA positivo, los GCI a dosis bajas son los fármacos de elección y la alternativa son los ARLT.
En los casos de sibilancias recurrentes de grado moderado, con fenotipo no eosinofílico, la propuesta terapéutica sería (ensayo-error), terapia combinada con ALTR y macrólidos, valorando en este tiempo la respuesta clínica. Si el fenotipo fuera eosinofílico, el esquema sería monoterapia con GCI a dosis medias o terapia combinada de GCI a dosis bajas asociados con ARLT (fig. 1).
Tratamiento inicial de mantenimiento en el niño menor de 3 años.
IPA: índice predictivo de asma; ARLT: antagonistas de los receptores de los leucotrienos; GCI: glucocorticoides inhalados; AA β2-AL: agonistas beta-2-adrenérgicos de larga duración; AA β2 AC.: agonistas beta-2-adrenérgicos de corta duración.
Modificado de Castillo JA et al. Consenso sobre tratamiento del asma en pediatría. An Pediatr (Barc). 2007;67:253–73. (Autorizada su reproducción.)
Por último, cualquier caso de grado grave o moderado que fracase en la prueba ensayo-error debe ser estudiado en ámbito hospitalario por los especialistas pertinentes.
Tratamiento de los episodios agudosLos lactantes y los menores de 3 años poseen receptores agonistas beta-2-adrenérgicos funcionantes133,134 y tanto la eficacia como la seguridad de dichos fármacos ha sido documentada a esta edad135,136, sobre todo en aquellos niños con factores de riesgo de desarrollar asma atópica137. Se recomienda el uso de estos fármacos en lactantes con sibilancias si el niño tiene una historia de episodios de sibilancias frecuentes/moderadas y/o episodios agudos graves. En todo caso, si la administración de los inhaladores ha sido correcta y no se observa respuesta, es necesario considerar otros diagnósticos y/o otras opciones de tratamiento.
Como primera elección, la vía de administración ha de ser la inhalada y no se recomienda la vía oral. En los episodios leves o moderados, la administración inhalada con cartucho presurizado y cámara espaciadora con mascarilla facial es tan efectiva como los nebulizadores138–141.
Asimismo, diversos estudios han demostrado un efecto beneficioso de los agonistas beta-2-adrenérgicos cuando se estudian la función pulmonar y los parámetros clínicos142–144; sin embargo, otros autores no han observado efecto alguno145–148, e incluso algunos investigadores han señalado, paradójicamente, un cierto efecto perjudicial149–151. En el metaanálisis publicado por Cavasse et al152 se llega a la conclusión de que no existía evidencia clara que apoye el uso de agonistas beta-2-adrenérgicos de acción corta en lactantes con sibilancias recurrentes menores de 2 años de edad, expresión que en la mayoría de los casos no se corresponden al fenotipo eosinofílico.
La utilización de anticolinérgicos, como el bromuro de ipratropio, asociado al salbutamol, ha demostrado tener un efecto broncodilatador aditivo, tanto en niños mayores153 como en menores de 5 años154. Una revisión de la Cochrane Library llega a la conclusión de que no existen evidencias para su uso en lactantes con episodios agudos de sibilancias155.
La administración de glucocorticoides por vía oral ha demostrado ser eficaz, tanto en el ámbito de los servicios de urgencia156, disminuyendo el número de ingresos157 y de recaídas158, como en los pacientes ingresados, reduciendo la estancia hospitalaria159, aunque algunos trabajos no han observado beneficios en los episodios de sibilancias asociadas con virus160, expresión de un fenotipo no eosinofílico.
Con el objetivo de prevenir una reagudización, se ha valorado la eficacia de la administración precoz de glucocorticoides orales por parte de los padres ante los primeros síntomas de infección respiratoria viral. El resultado de un metaanálisis realizado al respecto no ofrece pruebas claras, por lo que no se recomienda el empleo de esta estrategia, al menos de forma universal161. Por tanto, la administración de glucocorticoides orales habrá de considerarse en los episodios agudos moderados-graves de sibilancias, exclusivamente, con el objetivo de disminuir la gravedad de los síntomas.
En resumen, en la actualidad se dispone de datos para observar a los niños menores de 3 años con sibilancias recurrentes como un amplio síndrome, en el cual el patrón inflamatorio subyacente seguramente condiciona los resultados terapéuticos. También se dispone de evidencias suficientes para limitar el uso indiscriminado de los GCI en este grupo. Otros fármacos, como los antagonistas de los leucotrienos, poseen efectos beneficiosos con una evidencia limitada por el número de estudios y los macrólidos tienen un perfil de interés en este campo, pendiente de confirmación en un futuro próximo. De cualquier modo, ante la dificultad de objetivar el tipo de inflamación, es correcto intentar una prueba terapéutica, con cualquiera de las modalidades reseñadas, y observar estrechamente su efecto, suspendiéndola si tal efecto positivo no se produce, con el objetivo de evitar el sobretratamiento. Además, un amplio número de niños menores de 3 años con síntomas leves y/o episódicos pueden ser controlados sin tratamiento continuo.