El objetivo del trabajo ha sido evaluar la seguridad del PEG 3350 con electrolitos (PEG+E) a nivel renal y digestivo. Objetivo secundario: valorar su eficacia y dosis de efectividad.
Pacientes y métodosQuince pacientes con estreñimiento funcional (criterios de Roma III) y función renal normal fueron evaluados. La mediana de edad fue de 6,2 años (r=2-9). Sobres pediátricos de PEG+E fueron administrados durante 4 semanas (4ST) La dosis media administrada fue de 0,44g/kg/día. La natruria y osmolaridad urinaria se midieron al inicio y a las 4ST. La determinación de principios inmediatos en heces mediante FENIR (análisis de reflexión de infrarrojos) y una prueba de hidrógeno espirado fueron efectuadas a las 4ST. La eficacia del tratamiento fue evaluada mediante el cambio en el número de deposiciones por semana y la consistencia de las heces (escala de Bristol)
ResultadosA las 4ST el número de deposiciones por semana fue de 5,29±1,68 vs 2,46±0,71 al inicio (p<0,001). La puntuación de la escala de Bristol fue de 4,5±0,91 tras 4TS vs 2,47±1,24 al inicio (p<0,001). No se encontraron diferencias estadísticas entre los valores de sodio y osmolalidad en orina al inicio vs 4ST. Los valores de FENIR fueron normales en todos los pacientes. La prueba del aliento de hidrógeno fue normal con una mediana de 7ppm.
ConclusionesNo se observaron efectos adversos renales ni alteraciones digestivas. El PEG+E puede ser recomendado para el tratamiento del estreñimiento funcional en los niños.
Polyethylene glycol 3350 plus electrolytes (PEG+E) efficacy has been validated in some studies, but not many have evaluated its safety in children. The aim of our study was to evaluate the safety; renal, malabsorption or excessive production of gas and efficacy of PEG+E treatment in our paediatric population.
Patients and methodsFifteen patients who suffered functional constipation (Rome III criteria) were evaluated. Median age was 6.2years (r 2-9). All patients had normal renal function. PEG+E were administered for 4weeks (4WP). The mean dose was 0.44g/kg/day, titrated according to age, weight and response. Urine screens (sodium and osmolality) were performed at the beginning and 4WP. Stool sample NIRA (near-infrared reflectance analysis) and hydrogen breath test analysis samples were performed at 4WP. To analyse the efficacy of the treatment, the number of stools per week and stool form type (Bristol stool scale) were recorded.
ResultsThe number of stools per week was higher after 4weeks (2.46±0.71 vs 5.29±1.68, P<.001), as well as the stool form score (2.47±1.24 vs 4.5±0.91, P<.001). No statistical differences were obtained between urine sodium and urine osmolality values at the beginning and 4WP. After 4WP the NIRA median values were normal in all patients [fat 4.45% (range (r) 3.6-7.09); nitrogen 0.78% (r 0.4-1); sugars 1.4% (r 0.47-2.35) and water 68% (r 59-74)]. Median breath hydrogen test was 7ppm (r 2-18).
ConclusionsNo adverse effects on biochemistry values or gastrointestinal disturbances were observed. PEG+E can be recommended for the treatment of functional constipation in children.
El estreñimiento es un trastorno frecuente en la infancia responsable de hasta el 5% de las consultas pediátricas ambulatorias y un 18% de las consultas en las unidades de gastroenterología pediátrica. Después del periodo neonatal, etapa en la que se suele diagnosticar el estreñimiento secundario a organicidad, la causa más frecuente y prácticamente única es el estreñimiento funcional. Si bien no es un trastorno grave, sí representa una gran disconfortabilidad para el paciente y la familia, sobre todo si se asocia a disquecia, incontinencia fecal o dolores abdominales1-3. La definición del estreñimiento funcional en niños menores y mayores de 4 años fueron dados en 2006 en los criterios de Roma III4,5.
En el año 2006 la North American Society for Pediatric Gastroenterology, Hepatology and Nutrition (NASPGHAN) elaboró una guía práctica para el tratamiento del estreñimiento infantil. Consiste en la aplicación de medidas dietéticas y educacionales, así como el inicio de tratamiento laxante para garantizar una adecuada evacuación intestinal6.
Numerosos estudios avalan la eficacia del PEG 3350 con y sin electrolitos y del PEG 4000 en el tratamiento del estreñimiento crónico e impactación fecal en niños7-13. Sin embargo, pocos trabajos han evaluado su seguridad en pediatría13,14 y se ha especulado sobre un potencial riesgo, solicitándose estudios de seguridad que lo refrenden en su más amplio contexto15,16.
El objetivo de este trabajo ha sido evaluar la seguridad de PEG 3350 con electrolitos (PEG+E) en el tratamiento del estreñimiento funcional infantil desde un punto de vista renal y digestivo. El objetivo secundario ha sido valorar su eficacia clínica.
Pacientes y métodosPacientesQuince pacientes sin enfermedad orgánica, con una edad media de 7 años y medio (rango 2-9 años), 7 varones y 8 mujeres afectados de estreñimiento crónico funcional fueron evaluados en un estudio prospectivo y observacional en la consulta externa de nuestra unidad de gastroenterología. El diagnóstico de estreñimiento crónico funcional se realizó según los criterios Roma III4,5 y los pacientes no habían solucionado su problema tras la aplicación de medidas educacionales y dietéticas aplicadas durante un periodo mínimo de 1 mes. Ninguno presentaba impactación fecal en el momento de la evaluación y no habían recibido tratamiento con algún otro laxante las 2 semanas previas.
El período de seguimiento fue de 4 semanas (4ST) durante las que se administró PEG+E en forma de polvo para suspensión oral (Movicol Pediátrico®, Norgine, España) en sobres de 6,9g que contenían 6, 56g de PEG 3350, 175,4mg cloruro sódico, 89,3mg bicarbonato sódico y 25,1mg cloruro potásico. La dosis de inicio se estableció según la edad con un sobre al día para los pacientes entre 2 y 6 años y 2 sobres al día para los pacientes entre 7 y 9 años, repartido en 2 dosis. Dicha dosis se ajustó a los 7 días en función de la respuesta clínica, consistente en efectuar la evacuación más blanda y sin molestias, sin superar la dosis máxima recomendada de 27,6g al día. Los sobres debían ser disueltos en 150ml de agua, leche o zumos de frutas. Se aconsejo la ingesta de abundantes líquidos a lo largo del día y la dieta no se modificó acorde con los hábitos individuales. El peso de los pacientes referenció una media de 21,5kg (rango 12,7-40,4).
A todos los responsables legales de los niños se les invitó a participar en el estudio, con consentimiento informado.
Valoración de eficacia y tolerancia clínicaSe realizó una entrevista clínica en la primera visita, a la semana para ajustar dosis y a las 4ST, obteniéndose información sobre la frecuencia de deposiciones por semana, forma, consistencia. Para la valoración de la forma y consistencia se empleó la escala Bristol, que evalúa la consistencia de las heces en una puntación de 1-717.
Se recogieron los posibles efectos adversos: dolor abdominal, diarrea, flatulencia, náuseas y aceptación de la palatabilidad del producto.
Estudio de la función renalCon el fin de asegurar normalidad renal de los pacientes, se determinaron urea, creatinina, potasio y sodio plasmáticos.
Para evaluar la repercusión de la ingesta de sodio se determinó en orina osmolaridad expresada en mOsm/kg y sodio en orina expresado en mEq/l antes de iniciar el tratamiento y a las 4ST. Una osmolaridad y una natruria sin modificaciones estadísticas demostrarían una sobrecarga de sodio mínima o una compensación renal adecuada.
Prueba de hidrógeno espiradoLa determinación del hidrógeno en aire espirado se efectuó a las 4ST con el fin de estudiar el efecto osmótico del PEG+E. Se recogieron dos muestras con una hora de intervalo en condiciones de hábito dietético normal, sin preparación y sin ayuno. El resultado valorado fue la media de ambas determinaciones. La muestra de aire espirado fue inyectada dentro del modelo de gas cromatografía SC MicroLyzr, para detección simultanea de H2, CO218,19. El gas es introducido dentro de un cartucho de SvRite-10 antes de ser analizado. Los resultados son expresados en partes por millón (ppm). La equilibración se efectúa antes de con un gas estándar con 102ppm de H2 y 5% de CO2. Se considera la prueba patológica, cuando el hidrógeno en aire espirado con corrección para CO2 es superior a 15ppm.
Paparámetros bioquímicos de malabsorción en hecesLa determinación a las 4ST de la grasa, nitrógeno, agua, almidón y azúcar en las heces se efectuó mediante el análisis de la reflexión de infrarrojos(FENIR)20-23 para valorar si el PEG+E conducía a una posible malabsorción de principios inmediatos. Esta técnica se basa en la medición de las radiaciones en el espectro cercano de infrarrojos (FENIR 8820-infrared Analyzer, Perten, Hamburg, Alemania), difundido por la superficie de la muestra, es decir, en la relación entre matriz y el sustrato y la reflexión de infrarrojos difundida por la superficie fecal a una determinada longitud de onda. Los componentes medidos poseen unos determinados grupos funcionales (CH, NH, OH); en el infrarrojo posee bandas específicas de absorción cercanas (700-2.500nm). Por ello la respuesta espectroscópica (reflexión) a partir de una muestra fecal está relacionada con la concentración de los componentes (grupos funcionales). La correlación de la reflexión tomada a 12 longitudes de onda está determinada por un algoritmo computarizado.
Los resultados de los parámetros mencionados han sido previamente validados con referencia a los procedimientos clásicos22,23. Los valores normales expresados en g/100g de heces (con una cantidad de agua del 75%-80%) son: de<5% para la grasa, < 1,8%, para el nitrógeno y < 2,5% para el almidón y los azúcares.
Estudio estadísticoLos resultados se expresan como media aritmética±desviación estándar cuando las variables siguieron una distribución normal y como mediana y rango en el resto de los casos. Se utilizó una prueba no paramétrica (U de Mann-Whitney) para las variables numéricas y las pruebas de la chi al cuadrado y de Fisher para las variables categóricas, cuando se compararon ambos grupos. Los valores de p menores a 0,05 se consideraron significativos. El análisis estadístico se realizó mediante el programa SPSS 18.0 (SPSS Inc, Chicago, IL).
ResultadosEficacia y tolerancia clínicaLa dosis eficaz PEG+E arrojó una mediana de 1,5 sobres/día (rango 1-3), que equivale a 0,39g/kg/día (rango 0,27-0,95). Ningún paciente interrumpió el tratamiento durante las 4 semanas de seguimiento ni ningún efecto adverso relevante fue comunicado por el paciente o sus padres. El producto fue bien aceptado y no se refirieron quejas sobre la palatabilidad.
Tomando el número de deposiciones por semana como parámetro de eficacia, se observó un aumento significativo tras la administración de PEG+E (2,46±0,71 antes del tratamiento vs 5,29±1,68, a las 4ST, p<0,001). El tratamiento con PEG+E también conllevó un incremento significativo y favorable en la puntuación en la escala Bristol (2,47±1,24 vs 4,5±0,91, p<0,001) (véase tabla 1).
Valoración de la eficacia del PEG+E
| Visita inicial | 4ST | ||
| N.° heces por semana | 2,46±0,71 | 5,29±1,68 | p<0,001 |
| Forma y consistencia fecal* | 2,47±1,24 | 4,5±0,91 | p<0,001 |
Los parámetros bioquímicos de urea, creatinina, potasio y sodio plasmáticos fueron normales en todos los pacientes e el momento de la inclusión. Teniendo en cuenta que un sobre contiene 4 mEq de Na, lo que equivale a 92mg de Na, el aporte de Na fue de 0,24 mEq Na+/kg/día (rango 0,17-0,58), que equivale a una media 6mg Na/kg/día (r=4-12). Dentro de la población estudiada, el mayor aporte absoluto de Na+ fue de 8,00 mE.
Los datos correspondientes al estudio renal en orina se exponen en la tabla 2. No se registraron diferencias estadísticamente significativas entre la cifra de sodio en orina basal y tras el tratamiento de 4ST (p=0,36) ni entre la osmolalidad urinaria basal y a las 4ST (p=0,12).
Estudio de la función renal
| Visita inicial | 4ST | p | |
| Natriuria (mEq/l) | 132,87±59 | 134,77±70 | NS |
| Osmolaridad urinaria (mOsm/kg) | 684,80±307 | 784,07±256 | NS |
FG (ml/min/1,73m2)* 105,2 (rango 98,0-140,2).
*Tasa de filtrado glomerular estimada según fórmula de Schwartz: talla (cm) x K/Crp (mg/dl)=ml/min/1,73 m2 (K=0,55 para la población pediátrica entre 1 y 12 años).
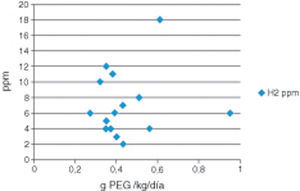
En la figura 1 se muestran los valores (media de 2 determinaciones) del H2 espirado tras 4ST referidos a la dosis de PEG+E ingerida y eficaz. Todos los valores, a excepción de un paciente que reflejó un leve aumento, se encontraban dentro de la normalidad. Se obtuvo una mediana de 7ppm (rango 2-18), dentro de la normalidad.
El resultado del análisis del FENIR de las heces a las 4ST, expresado en medianas, mostró unos valores dentro de la normalidad (tabla 3) que demuestra que el PEG+E no conlleva malabsorción de nutrientes. Unas heces con una proporción de agua del 65% suelen equivaler a un índice de 4-5 de la escala de Bristol.
DiscusiónEl 40% de los niños con estreñimiento funcional presentan síntomas durante el segundo año de vida. Suele empezar con el adiestramiento del uso del orinal y la supresión de pañales (toilet training). Los intentos para consumar el adiestramiento del retrete a una edad inadecuadamente temprana (menos de 2,5 años) y la presión excesiva para lograr una defecación diaria perfecta desencadenan una lucha de poder entre los padres y el niño, haciendo que el niño retenga sus heces en el recto. El recto se adapta a la masa fecal y el impulso para defecar se desvanece. Con el paso del tiempo, este comportamiento llega a ser una respuesta automática aprendida. La evacuación de una deposición de volumen muy abundante, que dilata dolorosamente el esfínter anal, refuerza la idea de que la defecación debe ser evitada. A medida que la pared rectal se dilata, el esfínter anal se relaja inapropiadamente y puede aparecer «ensuciamiento» fecal, lo que enoja a los padres y aterra al niño.
Hace unas décadas, la suplementación con altas dosis de fibra fue la primera línea de tratamiento para el estreñimiento funcional. Los laxantes formadores de masa fecal, como la esterculina, el salvado, la ispágula, los polisacáridos naturales o semisintéticos o los derivados de celulosa, absorben agua y se expanden hasta llenar el colon con residuos no absorbibles. Presentan efectos secundarios, sobre todo meteorismo y flatulencia, y es esencial garantizar la ingesta adecuada de líquidos. Estos inconvenientes junto al rechazo a su ingesta por su mala palatabilidad los hacen inviables en la edad pediátrica.
Los laxantes salinos magnesio y sales de fosfato sódico actúan a través de la liberación de colecistoquinina, hormona que contrae la vesícula biliar, aumenta la motilidad del intestino grueso y delgado, reduce la absorción de sodio en la mucosa del intestino delgado y aumenta la secreción de enzimas pancreáticas24. Su uso aparece asociado con una absorción sustancial de los iones que los componen, lo cual puede provocar una toxicidad sistémica que incluye diarrea crónica, deshidratación y desequilibrio electrolítico por absorción excesiva de magnesio, y eliminación de potasio y calcio25,26. Deben usarse con precaución, dado que su eficacia está unida a altas dosis.
Los laxantes estimulantes, como las antraquinonas, el sen o cáscara sagrada, o el bisacodilo, viajan sin ser absorbidos hasta el intestino grueso, donde son metabolizados y transformados en agliconas. Estas agliconas ejercen su efecto laxante dañando las células epiteliales, efecto que ocasiona directa e indirectamente cambios en la absorción, secreción, promoviendo la acumulación de agua y electrolitos en la luz del colon, y estímulo de la motilidad. Los laxantes estimulantes causan a menudo calambres abdominales y lesiones irreversibles en las neuronas mioentéricas27-30. Su uso está contraindicado en niños. Los lubricantes orales oleosos como el aceite mineral o la parafina líquida pueden causar incontinencia y malabsorción de vitaminas liposolubles31,32 y en lactantes han sido comunicadas aspiraciones lipoideas33.
Los agentes orgánicos hiperosmolares/osmóticos comprende solutos orgánicos no absorbibles (sorbitol, lactulosa y lactitol), que actúan ablandando y aumentando el contenido hídrico de las heces. La lactulosa es un disacárido sintético y, dada la ausencia de disacaridasa específica en la membrana de las microvellosidades de los enterocitos humanos, no puede ser hidrolizada y absorbida en el intestino delgado. El principal lugar de acción se localiza en el colon, donde es fermentada por la microbiota colónica reteniendo agua y produciendo importante cantidad de gases, CO2, metano e hidrógeno. Puede provocar síntomas, como dolor abdominal, meteorismo y flatulencia, y sus posibles efectos adversos han sido descritos34,35. El lactitol, un disacárido compuesto de galactosa y sorbitol, comparte básicamente el mismo mecanismo de acción que la lactulosa36,37.
El PEG 3350 es un macrogol con un peso molecular medio de 3350 (±10% del peso molecular nominal), no absorbible y no metabolizado por bacterias colónicas. Se dispone del PEG 3350 sin electrolitos o en combinación con electrolitos (Movicol pediátrico®). Los preparados farmacéuticos de macrogol se designan partiendo de su peso molecular medio nominal, que determina la presión osmótica de una solución acuosa y, por tanto, su capacidad de retener agua y su velocidad de difusión a través de las mucosas, actuando básicamente reteniendo en la luz intestinal el líquido y los electrolitos ingeridos. La absorción o eliminación neta de agua, sodio o potasio es mínima o nula. La pequeña proporción absorbida se elimina inalterada por filtración glomerular.
Desde la década de los ochenta las soluciones de PEG se han utilizado como soluciones de lavado gastrointestinal para la limpieza del intestino en preparación de fibroendoscopias y en desimpactación fecal en adultos y niños38-41. Dados los grandes volúmenes administrados (de 3 a 5 l), era particularmente importante no alterar el equilibro hidroelectrolítico del paciente. A fin de evitar las pérdidas netas, aunque fueran mínimas, se añadieron electrolitos (sodio, potasio, cloruro y bicarbonato) a la solución oral (PEG+E) y la concentración de macrogol se redujo. Como se ha podido confirmar posteriormente, incluso después de la administración de grandes volúmenes, la diarrea provocada por PEG+E está asociada con pérdidas o ganancias mínimas de electrolitos42,43.
Recientemente, las soluciones con pequeñas cantidades de PEG 4000 y PEG 3350 se han erigido en un tratamiento eficaz y seguro del estreñimiento crónico en la edad pediátrica7-13. Ha sido demostrada su seguridad a nivel renal tras la administración de PEG+E44. También ha sido estudiada su seguridad absortiva en cuanto a datos bioquímicos de normalidad de niveles de vitaminas hidrosolubles y liposolubles con PEG sin electrolitos45. Otros trabajos han demostrado la eficacia y seguridad tras la administración en edades inferiores a 2 años46,47. Un mayor grado de eficacia ha sido demostrada en estudios comparativos con respecto a otros laxantes salinos e hiperosmolares osmóticos44,45,48-51.
No existe una dosis establecida para el PEG 3350 y las dosis efectivas de mantenimiento empleadas por los diferentes autores oscilan entre 0,4-0,8g/kg/día, si bien las dosis de ataque, hasta el inicio de respuesta, sobre todo cuando se ha empleado para la desimpactación fecal, son más elevadas (alrededor de 1g/kg/día), descendiendo por lo general a la semana a la dosis de mantenimiento6,48,52,53. Diferentes factores, como el grado de estreñimiento, el tipo de dieta y la ingesta de líquidos, se implican en la dosis terapéutica de efectividad. La dosis eficaz PEG+E en nuestro trabajo arrojo una mediana de 1,5 sobres/día (rango 1-3), que equivale a 0,39g PEG 3350/kg/día (rango 0,27-0,95). El peso de nuestros pacientes referenció una media de 21,5kg (rango 12,7-40,4), variando lógicamente la dosis si el cálculo se efectúa referenciado a peso, aunque con similar eficacia. Creemos que la dosis se tendría que pautar por sobres/día más que por peso, buscando la dosis terapéutica eficaz. Ningún paciente interrumpió el tratamiento durante las 4 semanas de seguimiento ni ningún efecto adverso relevante fue comunicado por el paciente o sus padres.
La administración de PEG+E supuso un aporte de Na+ de 0,24 mEqNa+/kg/día (rango 0,17-0,58), lo que equivale a una media de 6mg Na/kg/día (r 4-12). Dentro de la población estudiada, el mayor aporte absoluto de Na+ fue de 8,00 mEq, que equivale a 0,47g de cloruro sódico. Esta cifra representa un incremento escaso en relación con el contenido de sal ingerido en una dieta regular. Recordemos que 1g de sal aporta 333mg de sodio equivalente a 14,5 mEq. Se asume que en un niño con función renal normal, el aumento de la ingesta oral de sodio dentro del rango normal de la variación dietética no comportará variaciones de la natremia. No se obtuvieron diferencias significativas en los valores de osmolalidad urinaria ni sodio en orina que sugieran una pobre absorción luminal de las sales presentes en la composición de PEG+E. Nuestro estudio prospectivo y observacional demuestra que la administración de PEG+E durante un periodo de un mes resultó segura al igual que otros trabajos44,45.
A diferencia de otros laxantes osmóticos, el PEG+E no sufre degradación enzimática ni se metaboliza por la flora intestinal. Los laxantes osmóticos fermentables conllevan la producción de importantes cantidad de gases, CO2, metano e hidrógeno, que pueden ser determinados mediante cromatografía en el aliento espirado. En nuestro trabajo solo hemos determinado el hidrógeno como gas de referencia, evidenciándose que los valores se encontraban dentro de la normalidad, mediana de 7ppm (rango 2-18), lo cual demuestra y confirma que el PEG+E no tiene efectos osmóticos y no es degradado por la flora intestinal. Solamente un paciente mostró un valor levemente elevado,18ppm, con una dosis de PEG+E de 0,6g/kg/día, cantidad dentro de la media, por lo cual dicha elevación estaría ligado más bien a algún componente de la dieta. Estos datos, según nuestra revisión, son los primeros que evidencian dicha particularidad. En nuestra experiencia (datos no publicados), el uso de lactitol y lactulosa presenta niveles de H2 patológicos, en ocasiones con cifras de 50ppm.
Se ha descrito que determinados laxantes pueden conllevar una malabsorción de nutrientes, siendo una de las contraindicaciones para su prescripción. El estudio del FENIR en nuestros pacientes demostró unas valores de grasa, nitrógeno y azúcares dentro de la normalidad, demostrando que la administración de PEG+E no produce malabsorción de ningún tipo de nutrientes. Tampoco este tipo de estudio se había realizado con anterioridad en pacientes pediátricos.
Nuestro estudio se ha centrado fundamentalmente en demostrar la seguridad del PEG+E y solo de una manera secundaria aportar datos de eficacia. Distintos estudios han avalado la eficacia del PEG 3350 con y sin electrolitos, y del PEG 4000 en el tratamiento del estreñimiento crónico e impactación fecal en niños5-12. Los datos de eficacia de nuestro estudio han sido corroborados posteriormente en nuestra unidad, una vez efectuados los estudios de seguridad, en más de 100 pacientes; las dosis de eficacia fueron similares a las referenciadas en este trabajo. La duración del tratamiento dependerá de la edad del niño, de los hábitos dietéticos y del aprendizaje de la defecación. En ningún momento debe retirarse bruscamente, o hasta que la rutina de defecación se haya instaurado correctamente y en el sitio adecuado54.
En conclusion, el uso de PEG+E pediátrico demuestra ser eficaz a una dosis de mantenimiento de 1-2 sobres al día. La tolerancia es excelente sin consecuencias clínicas indeseables. No hemos evidenciado efectos adversos a nivel renal ni digestivo. Creemos que puede ser recomendado con seguridad para el tratamiento del estreñimiento funcional en la infancia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.