La introducción del tratamiento con hipotermia para la encefalopatía hipóxico-isquémica neonatal ha conseguido reducir el número de niños con esta enfermedad que fallecen o que sobreviven con secuelas neurológicas. A pesar de la generalización de esta terapia, la encefalopatía hipóxico-isquémica continúa siendo una causa importante de mortalidad y de discapacidad neurológica. Las consecuencias de esta enfermedad sobre el neurodesarrollo y la calidad de vida del recién nacido justifican que estos pacientes sean incluidos en programas de seguimiento específicos con el fin de identificar y tratar precozmente los problemas que puedan surgir, así como de ofrecer orientación y apoyo a las familias.
En este artículo se describen las complicaciones más importantes que presentan los niños con encefalopatía hipóxico-isquémica después del alta hospitalaria y se propone un programa de seguimiento basado en el pronóstico neurológico, establecido este a partir del estado clínico del recién nacido y de otros indicadores pronósticos, principalmente los estudios de neuroimagen. Se exponen también brevemente algunos aspectos sociales de importancia durante el seguimiento.
Hypothermia treatment for newborn infants with hypoxic-ischemic encephalopathy reduces the number of neonates who die or have permanent neurological deficits. Although this therapy is now standard of care, neonatal hypoxic-ischaemic encephalopathy still has a significant impact on the child's neurodevelopment and quality of life. Infants with hypoxic-ischaemic encephalopathy should be enrolled in multidisciplinary follow-up programs in order to detect impairments, to initiate early intervention, and to provide counselling and support for families.
This article describes the main neurodevelopmental outcomes after term neonatal hypoxic-ischaemic encephalopathy. We offer recommendations for follow-up based on the infant's clinical condition and other prognostic indicators, mainly neonatal neuroimaging. Other aspects, such as palliative care and medico-legal issues, are also briefly discussed.
Las consecuencias de la encefalopatía hipóxico-isquémica (EHI) neonatal son permanentes y se expresan intensamente durante la infancia y la niñez. La introducción del tratamiento con hipotermia ha supuesto una disminución del número de niños con esta enfermedad que fallecen o que presentan discapacidad grave en el seguimiento1, y actualmente se considera que esta terapia debe ser ofrecida en nuestro país a todos los niños con EHI moderada o grave2. Sin embargo, y a pesar de este importante avance terapéutico, actualmente la EHI continúa siendo una causa importante de mortalidad y de discapacidad neurológica, y no es esperable que esta situación cambie sustancialmente en los próximos años. Es por ello que todos los niños con EHI, hayan recibido o no tratamiento con hipotermia en el periodo neonatal, deben ser incluidos en un programa de seguimiento hasta como mínimo los 2 años de edad.
Los niños con EHI necesitan la atención de un equipo multidisciplinar, pero siempre es conveniente que un miembro de este equipo sea el encargado de coordinar el seguimiento y sea quien establezca una relación más frecuente y estrecha con la familia. Este profesional puede ser un pediatra general, un neonatólogo o un neuropediatra, dependiendo de cómo esté organizada en cada hospital la unidad de seguimiento neonatal y de la experiencia de los diferentes miembros del grupo en esta enfermedad. En cualquier caso, no se debe olvidar que los problemas a los que se enfrentan estos niños no son exclusivamente neurológicos y que estas familias se benefician de un enfoque integral y holístico. Si en un hospital no existe un programa de seguimiento apropiado para niños con EHI, la familia debe ser remitida a otro centro que sí lo tenga, de la misma forma que actualmente ya es obligado que todos los recién nacidos con EHI subsidiaria de tratamiento con hipotermia sean trasladados a un centro de referencia que ofrezca esta terapia, independientemente de su lugar de nacimiento. Todos los niños con EHI y sus familias tienen derecho a continuar recibiendo una atención apropiada tras el alta hospitalaria.
El seguimiento de los niños con EHI debe ser individualizado y adaptarse a las necesidades cambiantes del niño y de su familia. El primer paso para ofrecer un plan de seguimiento eficiente y que responda a las necesidades reales del paciente es establecer un pronóstico lo más preciso posible en el momento del alta.
Evolución de los niños con encefalopatía hipóxico-isquémica después del periodo neonatalEvolución según el grado de encefalopatía clínicaEl grado de encefalopatía clínica en el periodo neonatal se ha utilizado para predecir la evolución de los niños con EHI prácticamente desde que se describió esta enfermedad. Estudios en los años setenta y ochenta del siglo pasado mostraron de forma consistente que la inmensa mayoría de los niños con EHI leve tenían un riesgo muy bajo de presentar alteraciones graves del neurodesarrollo, mientras que los niños con EHI grave casi invariablemente fallecían en el periodo neonatal o tras el alta, o presentaban alteraciones significativas como parálisis cerebral grave, déficit cognitivo y epilepsia. El pronóstico de los niños con EHI moderada ha sido siempre mucho más variable y difícil de predecir3–6.
Esta aproximación pronóstica tiene algunas limitaciones: en primer lugar, las clasificaciones de gravedad de la encefalopatía utilizadas en los diferentes estudios no son uniformes, lo que da lugar a solapamientos entre las categorías de leve-moderado e incluso entre las categorías de moderado y grave; en segundo lugar, deja a los niños con EHI moderada, quizá el grupo que más podría beneficiarse de estrategias rehabilitadoras tempranas, sin un pronóstico concreto, y en tercer lugar, estudios a largo plazo muestran que los niños con EHI leve, tradicionalmente considerados «sin riesgo» y, por tanto, muchas veces no incluidos en programas de seguimiento, tienen una tasa de alteraciones en el desarrollo más alta de lo que se había considerado hasta ahora7. Estas alteraciones incluyen problemas motores finos en ausencia de parálisis cerebral8, trastornos neuropsicológicos y de memoria9,10, problemas del comportamiento con repercusión en la vida diaria (especialmente problemas de atención y de integración social)11,12, así como necesidades educativas especiales13,14. Estos niños no necesitan un seguimiento tan estrecho en los primeros 2 años de vida, pero se beneficiarían de una evaluación neuropsicológica completa en la edad escolar dirigida a detectar este tipo de problemas y a establecer medidas educativas y/o de rehabilitación neuropsicológica. Es cada vez mayor la evidencia que apunta a que la EHI neonatal no es un fenómeno de «todo o nada», sino que existe un amplio rango de secuelas, desde la normalidad total hasta grados de afectación muy extremos.
La introducción de la terapia con hipotermia ofrece una dificultad añadida, y es que hasta ahora no se ha evaluado el papel predictivo de la gravedad clínica en este nuevo contexto. La monitorización continua de la función cerebral mediante el electroencefalograma integrado por amplitud se utiliza rutinariamente como método de apoyo para definir la gravedad clínica de la encefalopatía; estudios recientes han mostrado que el valor predictivo precoz de esta prueba se modifica durante el tratamiento con hipotermia15.
Evolución según la distribución y la gravedad del daño cerebralEl tipo y la duración de la asfixia intrauterina parecen dar lugar a diferentes patrones de lesión cerebral, según han mostrado repetidamente diversos estudios con resonancia magnética (RM) en recién nacidos con EHI16-18. La agresión hipóxico-isquémica perinatal aguda lesiona preferentemente los ganglios basales y tálamos. Estas estructuras son muy vulnerables a la hipoxia-isquemia por su alta tasa metabólica y por su activa mielinización a la edad del término. En casos graves, el daño se extiende al tronco del encéfalo19. En niños expuestos a episodios subagudos, menos graves, pero más mantenidos en el tiempo, la lesión ocurre preferentemente en la corteza y la sustancia blanca, especialmente en la región parasagital, que es la que se corresponde con zonas de vascularización limítrofe. En muchos niños, ambos patrones coexisten en proporción variable. Estos diferentes patrones de lesión cerebral en la EHI neonatal se han relacionado con diferentes factores perinatales y presentaciones clínicas, pero más importante, tienen diferentes consecuencias sobre el desarrollo posterior del recién nacido. El reconocimiento de estas lesiones en el periodo neonatal, junto con el resto de los datos clínicos y otras pruebas complementarias del paciente, permite establecer el pronóstico con mucha más precisión.
En general, cuando hay daño gangliotalámico, este determina el pronóstico. En estos niños, la secuela más importante es la parálisis cerebral (PC), y hasta un 50-75% de los supervivientes con lesión gangliotalámica la presentan17,20. El tipo de PC más frecuente en estos pacientes es la PC discinética, que se acompaña en un porcentaje significativo de casos de alteraciones oromotoras que producen dificultades en la alimentación y en el lenguaje hablado. El daño gangliotalámico se ha asociado también con déficits motores menores en ausencia de PC en la edad escolar7.
Los niños con lesión aislada en la corteza y sustancia blanca tienen un pronóstico mucho más favorable desde el punto de vista motor. El riesgo de PC en estos niños es inferior al 10% y además en la mayoría de los casos el trastorno motor es leve y permite una deambulación independiente17,21. Estos niños, sin embargo, tienen una alta frecuencia de problemas cognitivos y conductuales, que se manifiestan preferentemente después de los 2 años de edad7,17,21,22. Estos pacientes también tienen un riesgo incrementado de problemas visuales y de desarrollar epilepsia.
El valor predictivo de la RM en la EHI no parece alterarse con el uso de hipotermia terapéutica23-25.
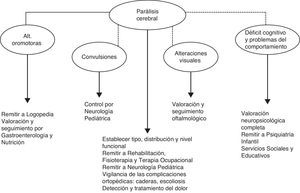
Principales problemas durante el seguimientoTrastorno motor secundario a la encefalopatía hipóxico-isquémica neonatal: parálisis cerebralEl término PC es un término inespecífico que únicamente hace referencia a la existencia de un trastorno permanente y no progresivo que afecta al tono, la postura y los movimientos, y que es debido a una lesión sobre el cerebro en desarrollo26. Sin embargo, el grado de capacidad funcional, establecido mediante la Clasificación de la Función Motora Grosera (Gross Motor Function Classification System [GMFCS])27, puede ser muy variable (tabla 1). Esta clasificación se diseñó y estandarizó originalmente en niños con PC y con edades comprendidas entre 1 y 12 años, con el propósito de describir las habilidades en la función motora observadas en la vida diaria de los niños, haciendo énfasis en la sedestación y la deambulación27,28. El nivel de capacidad funcional afecta no solo a las habilidades motoras propiamente dichas, sino que se relaciona con la frecuencia y gravedad de otros problemas asociados con la PC, como los trastornos de la alimentación y el lenguaje, las alteraciones visuales y la epilepsia (fig. 1)29,30. Por este motivo, en todo niño en el que se diagnostique PC es necesario no solo determinar el tipo y la distribución del trastorno motor, sino también el nivel funcional. El diagnóstico de PC en un niño que tuvo EHI, sin aportar otros datos, dice muy poco acerca de sus habilidades y limitaciones, y de la repercusión de la enfermedad en su estado de salud, en su calidad de vida y en sus posibilidades de participación social30,31.
Clasificación de la Función Motora Grosera para niños con parálisis cerebral
| Nivel | Descripción |
| A. Clasificación antes de los 2 años | |
| I | El niño es capaz de sentarse y mantenerse sentado en el suelo con las 2 manos libres para manipular objetos. El niño gatea sobre manos y rodillas, se pone de pie y da pasos agarrándose a los muebles |
| II | Se mantiene sentado en el suelo, pero puede necesitar las manos para apoyarse y mantener el equilibrio. El niño repta o gatea con manos y rodillas. Puede ponerse de pie y dar algunos pasos, agarrándose a los muebles |
| III | El niño se mantiene sentado en el suelo con apoyo lumbar. Puede reptar y darse la vuelta |
| IV | Necesita apoyo en el tronco para mantenerse sentado. El control cefálico es suficiente. Puede darse la vuelta a supino, y a veces, a prono |
| V | No existe control cefálico ni del tronco contra gravedad, ni en prono ni en sedestación. El niño necesita la ayuda de un adulto para darse la vuelta |
| B. Clasificación para niños de 2 a 4 años | |
| I | El niño se mantiene sentado en el suelo con las 2 manos libres para manipular objetos. Se puede sentar, mover del lugar de asiento y ponerse de pie sin ayuda del adulto. Para desplazarse prefiere caminar y no necesita ayudas técnicas |
| II | El niño se mantiene sentado en el suelo pero puede desequilibrarse cuando manipula objetos con las 2 manos. Se sienta y se pone de pie sobre una superficie estable agarrándose a algo sin la ayuda de un adulto. Gatea con manos y rodillas con un patrón recíproco, pasa de un mueble a otro agarrándose y para desplazarse prefiere caminar utilizando una ayuda técnica |
| III | El niño se mantiene sentado adoptando frecuentemente una posición en «W» (rotación interna de las caderas y las rodillas flexionadas) y puede necesitar ayuda de un adulto para sentarse. Para desplazarse de forma autónoma, preferentemente repta o gatea sobre manos y rodillas (con frecuencia, sin movimientos recíprocos de las piernas). El niño puede agarrarse a algo para ponerse de pie sobre una superficie estable y recorrer distancias cortas. Puede caminar pequeñas distancias en espacios cerrados con una ayuda técnica manual (andadores) y la asistencia de un adulto para dirigir y girar |
| IV | El niño no puede alcanzar la posición de sentado sin ayuda y no es capaz de mantener la alineación ni el equilibrio sin usar las manos para apoyarse. Suele necesitar adaptaciones para estar sentado y mantenerse de pie. Para desplazarse en pequeñas distancias y en espacios cerrados de forma autónoma, el niño se voltea, repta y gatea con manos y rodillas, sin movimiento recíproco de las piernas |
| V | Las deficiencias físicas limitan el control voluntario del movimiento y la capacidad de mantener cabeza y tronco contra la gravedad. Todas las áreas de la función motora están limitadas. Las limitaciones funcionales para sentarse y ponerse de pie no se compensan totalmente con el uso de adaptaciones y ayudas técnicas. En el nivel v el niño no es independiente para desplazarse y tiene que ser transportado. Algunos niños logran ser autónomos para desplazarse usando una silla de ruedas eléctrica con numerosas adaptaciones |
En general, los niños con lesiones aisladas en núcleos de la base y tálamos suelen tener formas discinéticas (distónicas y/o atetoides) de PC. Esta forma de PC, aunque es muy discapacitante (en la mayoría el grado de afectación funcional está entre los niveles ii y iv del GMFCS) debido a la presencia de movimientos anormales, a la distonía y a la afectación oromotora; puede y suele acompañarse de un nivel intelectual dentro del rango normal. La desgracia para muchos de estos niños es que las dificultades motoras y de comunicación les impiden mostrar sus verdaderas capacidades cognitivas. La evaluación del nivel de desarrollo o del nivel intelectual en estos pacientes debe llevarse a cabo por profesionales familiarizados con este tipo de problemas y los test que se utilicen deben estar especialmente diseñados para niños con discapacidades motoras y comunicativas (a partir de los 4-5 años) o deben adaptarse apropiadamente (antes de esta edad no existen tests de desarrollo específicos para este tipo de pacientes).
Lesiones muy extensas en ganglios basales-tálamos, especialmente si se acompañan de daño en la sustancia blanca, se asocian con más frecuencia a PC espástica y a afectación funcional grave (niveles iv-v del GMFCS)20,32. En estos casos, el nivel de inteligencia es más variable, aunque de nuevo, suele estar subestimado en niños con grandes limitaciones motoras.
En los pocos niños con daño aislado en sustancia blanca y/o corteza que desarrollan PC, esta suele ser espástica y con un patrón de afectación preferente en miembros inferiores. La mayoría de estos niños tienen un grado de afectación leve o leve moderado (niveles i-iii del GMFCS) y son capaces de alcanzar la marcha independiente, aunque puedan tardar en hacerlo21.
Los niños con espasticidad significativa tienen un riesgo elevado de desarrollar subluxación o incluso dislocación completa de caderas. Este riesgo es máximo en los niños no ambulantes, donde la prevalencia de esta complicación dolorosa y grave ronda el 50%. La subluxación de caderas se puede detectar a tiempo mediante programas de vigilancia radiológica, que han mostrado reducir la incidencia de luxación y la necesidad de cirugía de rescate. Todo niño con PC y afectación funcional significativa (niveles ii-v del GMFCS) debería tener una radiografía de caderas anualmente desde los 2 años de edad y antes o con más frecuencia si hay sospecha clínica de subluxación33. Ante cualquier duda, la opinión de un traumatólogo pediátrico siempre será útil. Otras complicaciones músculo-esqueléticas incluyen escoliosis, osteoporosis y contracturas, y suelen aparecer en niños más mayores.
En resumen, en todos aquellos niños en los que durante el seguimiento se diagnostica PC, es necesario establecer el tipo, la distribución y el nivel funcional mediante el GMFCS. Además, si no se había hecho antes, estos niños deben remitirse a Neurología Pediátrica para el manejo específico de la espasticidad, de la distonía y de las complicaciones médicas asociadas con el trastorno motor.
Trastornos de la alimentación y del lenguajeLos niños con PC secundaria a lesión en los núcleos de la base-tálamos pueden presentar problemas en la alimentación oral y en el lenguaje hablado debido a la afectación de la musculatura oro-facial. La prevalencia de estos problemas no es bien conocida, pero parecen afectar a un número significativo de estos niños y están en relación con la gravedad del trastorno motor34; de hecho, estos trastornos no son exclusivos de los niños con EHI, sino que ocurren también en niños con PC de otros orígenes35,36.
Los problemas en la alimentación oral tienen graves consecuencias para la vida de los niños con EHI y es un factor que, junto con el reflujo gastroesofágico y las neumonías por aspiración, contribuye a su malnutrición, con todos los efectos deletéreos que esta acarrea37. Otras consecuencias de los trastornos de la alimentación oral son la prolongación de las horas de las comidas y el consecuente agotamiento tanto del niño como de los cuidadores38, y que la administración de fármacos puede no ser fiable, lo que tiene importantes repercusiones en los niños que necesitan tomar medicamentos como los antiepilépticos35,39. Los trastornos de la alimentación oral se suelen complicar porque a los padres les cuesta admitir su existencia y, a menos que se les pregunte directa y repetidamente, y de que exista un alto índice de sospecha por parte de los profesionales que los atienden, ellos tienden a no mencionarlo o a minimizarlo en la consulta; lo que conduce a un agravamiento de la situación40 (tabla 2). Los problemas de alimentación causan vergüenza a muchas familias y además la alimentación oral tiene un fuerte componente simbólico y muchos padres se resisten a admitir que no pueden seguir «alimentando» a sus hijos. Se necesita una actitud empática y compasiva por parte de los profesionales que tratan con estas familias para poder sacar a la luz la existencia de estos trastornos y manejarlos de forma apropiada38,41,42.
Problemas de alimentación
| Niños en riesgo de presentar trastornos de la alimentación oral durante el seguimiento |
| Niños con EHI grave |
| Niños con afectación gangliotalámica extensa, especialmente si hay además participación del tronco encefálico |
| Niños que no han logrado establecer una alimentación oral normal en el momento del alta |
| Signos de alerta |
| Comidas que duran excesivamente, lactantes y niños que muestran estrés ante la toma (intentar observar una toma en la consulta) |
| Necesidad de espesar los líquidos |
| Niños que después del año de edad no son capaces de tomar alimentos sólidos |
| Atragantamiento (con líquidos y/o sólidos) |
| Tos persistente |
| Infecciones respiratorias frecuentes |
| Reflujo gastroesofágico, vómitos repetidos |
| Crecimiento lento, estado nutricional subóptimo |
| Dificultades en el desarrollo del lenguaje hablado |
| Salivación excesiva para la edad |
Los niños con trastornos de la alimentación oral deben recibir intervención en 2 niveles. Por una parte, se pueden beneficiar si reciben rehabilitación por parte de un logopeda especialista en praxias oro-faciales42,43 y, por otra, deben ser valorados y seguidos rutinariamente en un servicio de Gastroenterología y Nutrición Pediátrica con el fin de optimizar su nutrición y valorar si es necesaria la alimentación a través de una sonda de gastrostomía37. La necesidad de esta es relativamente frecuente en los casos más graves por la incapacidad total de estos niños para la alimentación oral y/o por los peligros que conlleva esta para la seguridad de la vía aérea. Aunque la inserción de una sonda de gastrostomía es una técnica segura que mejora el estado nutricional y la calidad de vida del niño y de la familia35,44, muy a menudo los padres se resisten a la cirugía porque la consideran antinatural, porque temen el rechazo social y/o porque sienten privar a sus hijos de uno de los pocos placeres que estos pueden disfrutar38,41.
Las alteraciones en el lenguaje pueden ser tan frecuentes o más que los problemas de alimentación y su origen es el mismo que en el caso anterior36. La alteración oromotora produce disartria y además los niños con PC discinética pueden tener alterada la expresividad facial; todo esto afecta a su capacidad de comunicación y hace que aparenten tener un nivel intelectual menor que el que realmente tienen. Los niños con problemas en la comunicación oral deben ser evaluados por profesionales expertos en este tipo de alteraciones, ya que muchos de ellos mejoran sus habilidades con una rehabilitación adecuada y otros se pueden beneficiar de sistemas de comunicación alternativa / aumentativa45.
Trastornos visualesLas alteraciones de la función visual en distinto grado son frecuentes tras la EHI neonatal5,46. Los niños con lesiones graves en núcleos de la base-tálamos y/o con lesiones extensas en la sustancia blanca, son los que tienen mayor riesgo de presentar discapacidad visual21,46. En niños con EHI, las lesiones gangliotalámicas (y específicamente en la región posterolateral del putamen) muestran mayor asociación con las alteraciones visuales que el daño en la corteza occipital47. Por tanto, es conveniente que estos niños sean evaluados durante el primer año de vida y, posteriormente y de forma regular, por oftalmólogos pediátricos familiarizados con estas alteraciones.
Pérdida auditivaLa frecuencia de este problema se estima en alrededor de un 5%3,48-50. Aunque la prevalencia de esta secuela es baja, las cifras son considerablemente más altas que en la población general (5/1.000 recién nacidos), lo que hace pensar que la agresión hipóxico-isquémica perinatal puede tener en algunos casos efectos permanentes sobre la función auditiva. Aunque es un tema controvertido, la presencia de hipoacusia neurosensorial significativa como única secuela de la hipoxia-isquemia perinatal es un hecho excepcional. La mayoría de los niños con pérdida auditiva tienen también alteraciones significativas en otras áreas de su desarrollo. A pesar de todo, parece prudente examinar la función auditiva de todos los niños con antecedente de EHI en el primer año de vida (independientemente de la prueba de cribado neonatal) y posteriormente, si existen sospechas clínicas.
EpilepsiaEl riesgo de desarrollar crisis epilépticas tras EHI no es bien conocido, pero se calcula que entre un 10-20% del total de niños con EHI la presentarán a lo largo de la infancia5,7,48,49,51,52. Suele aparecer durante el primer año de vida (50% de los casos), aunque a veces la aparición se retrasa hasta los 5-10 años. Los factores de riesgo más importantes son la gravedad de la encefalopatía, la presencia, la gravedad y la duración de las convulsiones en el periodo neonatal, y las lesiones extensas en ganglios basales y/o en sustancia blanca y corteza21,53. En niños con gran afectación motora en los que las manifestaciones clínicas pueden no ser evidentes, la realización de un electroencefalograma periódicamente puede ser de utilidad.
Déficit cognitivo y problemas conductualesNo es fácil conocer el alcance de estas secuelas, especialmente en los primeros 2 años de vida. Los estudios sobre evolución de los niños tras EHI, principalmente los ensayos clínicos que han evaluado el efecto terapéutico de la hipotermia, refieren cifras de retraso psicomotor (considerado como puntuaciones en test de desarrollo inferiores a las 2 desviaciones estándar por debajo de la media de la población normal) en el 25-35% de los niños con EHI moderada y grave48-50,52,54. Estas cifras son muy similares a la prevalencia global de PC en esta población y probablemente en muchos casos reflejen la discapacidad motora de estos niños, más que un déficit intelectual propiamente dicho.
A pesar de lo anterior, el retraso cognitivo y las dificultades en el aprendizaje tras la EHI neonatal son más frecuentes de lo que se pensaba hasta ahora y se presentan incluso en ausencia de PC55. Al contrario que la discapacidad motora, las alteraciones cognitivas parecen ser marcadamente dependientes del entorno familiar y social. El grado de educación materna y el nivel de ingresos familiar se han asociado a diferencias significativas en la incidencia de deficiencias neuropsicológicas durante la infancia en los niños con EHI neonatal4,5,56.
Aunque pueden resultar útiles en el subgrupo de niños con EHI que no desarrollan PC grave, así como para comparar resultados en estudios de investigación, los test de desarrollo convencionales no se deben utilizar en la práctica clínica para valorar la inteligencia o el grado de desarrollo cognitivo de un niño con EHI y lesión gangliotalámica significativa. Estos niños pueden tener una importante discapacidad motora que afecte además a su capacidad de comunicación, por lo que los resultados obtenidos mediante estos test no reflejan su nivel intelectual o de desarrollo general. En particular, el test de Bayley no está diseñado para ser empleado en niños con discapacidad física y/o neurosensorial y no debería ser aplicado rutinariamente a estos niños; y si se hace, los resultados deberían ser interpretados con mucha prudencia57. Desafortunadamente, no hay test de desarrollo para niños pequeños que tengan en cuenta el impacto de la discapacidad motora sobre el resto del neurodesarrollo. Más importante que obtener un cociente intelectual o de desarrollo es evaluar qué áreas del desarrollo del niño necesitan una mayor atención y también cuáles son sus puntos fuertes. Esto es especialmente importante a la hora de que el niño se incorpore al sistema educativo, para determinar si tiene necesidades educativas especiales o si necesita adaptaciones al currículo escolar.
En niños con EHI evaluados en la edad escolar se han referido alteraciones conductuales y sociales, en especial ansiedad, inatención-hiperactividad y agresividad12. Un estudio poblacional incluso ha señalado una frecuencia mayor de autismo respecto a la población general, pero en ese trabajo los pacientes evaluados habían tenido no solo EHI sino otros tipos de encefalopatía neonatal no debida a asfixia perinatal y el porcentaje de niños con trastornos genéticos era importante58. La frecuencia y el rango de los problemas de comportamiento en los niños con EHI no son bien conocidos, pero es un tema que suscita un creciente interés y preocupación.
Programa de seguimiento para recién nacidos con encefalopatía hipóxico-isquémica tras el alta de NeonatologíaEn las tablas 3 y 4 se muestra cómo se puede organizar el seguimiento de los niños con EHI de acuerdo con su pronóstico. Este esquema es orientativo y no sustituye en ningún caso a la valoración individual de las necesidades de cada paciente y de su familia. Diferentes familias pueden tener distintas necesidades incluso con grados de afectación de sus hijos aparentemente similares. El pronóstico, como se ha explicado anteriormente, se basa en la combinación de los datos clínicos y de los resultados de las pruebas complementarias, principalmente las pruebas de imagen. Cualquier niño con EHI significativa (moderada o grave) debe tener una RM cerebral, idealmente entre los 7 y 21 días de edad, pero si esto no es posible, en cualquier otro momento del periodo neonatal. En los niños con EHI leve que muestran una rápida recuperación, que tienen una exploración neurológica normal en el momento del alta y en los que las ecografías cerebrales han sido repetidamente normales, la RM no es imprescindible.
Calendario de seguimiento para los niños con EHI
| Grupo | 1 | 2 | 3 | 4 | 5 |
| Estimación del pronóstico en el momento del alta | |||||
| Grado de encefalopatía | Leve | Leve/moderada | Moderada/grave | Moderada/grave | Grave |
| Neuroimagen | |||||
| Afectación GT | No | Leve | No | Moderada-grave | Moderada-grave |
| Afectación SB | No/leve-moderada | No/leve-moderada | Extensa | No/leve-moderada | Extensa |
| Pronóstico general | Muy buenoDiscreto aumento del riesgo de problemas de aprendizaje y conductuales en edad escolar | BuenoPC leve en 10-15%Discreto aumento riesgo de alteraciones motoras finas, problemas de aprendizaje y conductuales en edad escolar | IntermedioPC leve en 15-25%Riesgo significativo de retraso cognitivo, alteraciones visuales y conductuales; microcefalia y epilepsia | AdversoPC moderada-grave en 50-75%Frecuentes trastornos de alimentación y comunicación; alteraciones visuales y epilepsia | Muy adversoPC moderada-grave en > 90%Muy frecuentes trastornos alimentación-comunicación; alteraciones visuales, microcefalia y epilepsia. Mortalidad elevada, especialmente si lesión tronco-encefálica |
| Edad posnatal | |||||
| Planificación del seguimiento | |||||
| 3 meses | – | – | – | Evaluación general y neurológicaValoración alimentación-nutriciónRemitir a NRL y equipo multidisciplinar | Evaluación general y neurológicaValoración alimentación-nutriciónRemitir a NRL y equipo multidisciplinarValoración riesgo vital |
| 6 meses | – | Evaluación general y neurológicaRemitir a NRL y rehabilitación si signos motores | Evaluación general y neurológica. (¡P. cefálico!)Valoración función visualRemitir a NRL y rehabilitación si signos motores | Evaluación general y neurológicaValoración alimentación-nutriciónValoración función visual | Evaluación general y neurológicaValoración alimentación-nutriciónValoración función visualValoración riesgo vital |
| 9 meses-1 año | Evaluación general y neurológicaConsiderar valoración auditiva | Repetir evaluación si exploración no enteramente normal a los 6 meses. Remitir a NRL y rehabilitación si signos motoresValoración auditiva | Evaluación general y neurológicaValoración auditiva | Evaluación general y neurológicaValoración alimentación-nutriciónValoración auditiva | Evaluación general y neurológicaValoración alimentación-nutriciónValoración auditivaValoración riesgo vital |
| 18 meses | – | – | Evaluación general y neurológicaValoración formal del neurodesarrolloValoración psicológica/psiquiátrica si alteraciones conductuales | Continuar visitas cada 6-9 meses con el mismo esquema, según necesidades familiaresEvaluación trastornos comunicación y lenguajeEvaluación nivel cognitivo y necesidades educativas (no utilizar tests de desarrollo o inteligencia sin adaptar)Evaluación recursos sociales | |
| 24 meses | Evaluación general y neurológicaValoración formal del neurodesarrollo | Evaluación general y neurológicaValoración formal del neurodesarrollo | |||
| > 24 meses | Evaluación neuropsicológica en edad escolar | Evaluación neuropsicológica en edad escolar | Evaluación neuropsicológica en edad escolar | ||
Incluye niños con EHI leve y ecografías cerebrales normales (al menos 2), en los que no necesariamente se hizo resonancia magnética.
GT: ganglio-talámica; NRL: neurología; PC: parálisis cerebral; SB: sustancia blanca.
Evaluaciones durante el seguimiento
| Evaluación | En qué consiste | Cuándo |
| Evaluación general | Estado de salud general, problemas de salud desde la última visita, medicaciones habituales | En todas las visitas |
| Evaluación neurológica | Exploración neurológica, incluyendo medición del perímetro cefálicoEntrevista orientada: aparición de convulsiones desde la visita anterior; tolerancia/efectos adversos de los anticonvulsivos y de otros fármacos, como los utilizados para tratar la espasticidad y la distonía (asegurar seguimiento regular por parte de Neurología Pediátrica)En niños con PC: repercusión funcional según la Clasificación de la Función Motora Grosera, detección precoz de la subluxación de cadera, otras complicaciones músculo-esqueléticasdolor | En todas las visitas |
| Valoración de los trastornos de alimentación | Valoración del estado nutricionalEntrevista orientada: ¿qué come?, ¿cuánto duran las comidas?, ¿tiene buen apetito?, ¿se alegra cuando es la hora de la comida?, ¿le gusta probar diferentes texturas y sabores?, ¿se atraganta con frecuencia?, ¿le cuesta beber?, ¿tose continuamente?, ¿cuántas veces en los últimos 6 meses ha tenido alguna infección respiratoria?, ¿ha necesitado ingreso por este motivo?, ¿ha sido alguna vez diagnosticado de neumonía por aspiración?, ¿tiene signos de reflujo gastroesofágico?, ¿toma alguna medicación para el reflujo?, ¿tiene estreñimiento?Observar una toma/comida directamente en la consulta siempre que sea posible | En todas las visitas en niños con trastorno motor de cualquier grado |
| Valoración de los trastornos de comunicación | Entrevista orientada: ¿habla, cuántas palabras usa?, ¿le entienden bien, incluidas las personas que no le conocen bien, o solo le entiende su familia?, ¿utiliza algún otro medio para comunicarse —señalar con los ojos o el dedo, distintas entonaciones de voz o gritos, gestos—?, ¿es capaz de transmitir sus gustos, necesidades y estados de ánimo?, ¿es capaz de expresar cuando tiene dolor?Observar directamente cómo se comunica el niño con nosotros y con sus familiares | En todas las visitas en niños con trastorno motor de cualquier grado |
| Evaluación función visual | Defectos de refracción, movimientos oculares, presencia de estrabismo, agudeza visual, campos visuales, atención visual, integración visuomotora | A partir de los 6 meses en los niños con lesión GT significativa y/o extensa en la SB |
| Evaluación función auditiva | Una vez antes del año de edad en todos los niños con EHI moderada o grave (considerar en los niños con EHI leve si presentan otros factores de riesgo o si hay sospecha clínica) | 9-12 meses |
| Evaluación del neurodesarrollo | Evaluación del desarrollo mediante observación en la consulta e información proporcionada por los padresEvaluación formal (test de desarrollo) alrededor de los 2 años. Cualquier test de desarrollo (Bayley, Brunet-Lezine, Batelle, otros) con el que el examinador esté familiarizado. No administrar sin adaptar a niños con discapacidad motora y/o neurosensorial | En todas las visitasTest de desarrollo: 2 años |
| Evaluación neuropsicológica | Cualquier test de inteligencia o batería neuropsicológica (Wechsler, NEPSY, K-ABC). Evaluación conductualUtilizar pruebas específicamente adaptadas en aquellos niños con discapacidad motora y/o neurosensorial | Entre los 5-7 años |
Nunca se debe establecer un pronóstico que esté basado exclusivamente en los resultados de la RM o de otra prueba complementaria. Si existe discrepancia entre los antecedentes, el estado clínico y la neuroimagen, será necesario revisar el diagnóstico y asegurar la fiabilidad de las imágenes (incluyendo el momento en que fueron realizadas) antes de dar un pronóstico a la familia. Ante la duda, siempre es mejor esperar y repetir la prueba para ver cómo han evolucionado las lesiones.
Niños con encefalopatía hipóxico-isquémica leve y pruebas de neuroimagen normales, o daño aislado leve-moderado en la sustancia blancaEn estos niños, el pronóstico motor es muy bueno y es excepcional el niño que desarrolla PC. El desarrollo de estos niños durante los primeros 2 años de vida es normal en la mayoría de los casos y no necesitan intervenciones terapéuticas o rehabilitadoras; o atención especializada. Estos niños pueden ser vistos entre los 9 y los 12 meses de edad y, si todo está bien, de nuevo a los 2 años. A partir de los 2 años, este grupo de niños puede presentar problemas conductuales con mayor frecuencia que la población general. Si no existe un programa de seguimiento específico más allá de esta edad, la familia debería ser informada de la posibilidad de que se presenten estos problemas y deberían conocer qué recursos socio-educativos pueden utilizar. Idealmente, estos niños deberían ser evaluados en la edad escolar para detectar dificultades de memoria y aprendizaje, y necesidad de apoyo escolar, además de para detectar alteraciones del comportamiento y socio-emocionales. En cualquier caso, es conveniente que el pediatra de atención primaria conozca la historia perinatal de estos niños y pueda remitirlos a centros especializados si fuera necesario.
Niños con encefalopatía hipóxico-isquémica leve o moderada y lesiones leves en núcleos de la base-tálamosEste grupo de niños es muy similar al anterior, pero puede presentar trastornos motores leves en un 10-20% de los casos, por lo que precisan una vigilancia un poco más estrecha durante el primer año de vida. En la mayoría de los casos, pueden ser evaluados a los 6 meses y, si todo está bien, de nuevo a los 2 años. Si la exploración a los 6 meses no es completamente normal o si existe otro motivo de preocupación, una nueva visita a los 12 meses puede ser útil. La práctica totalidad de los casos de PC secundarios a EHI neonatal habrán aparecido antes de esta fecha.
El seguimiento posterior puede hacerse como en los niños del primer grupo.
Niños con encefalopatía hipóxico-isquémica moderada o grave y lesiones extensas en la sustancia blancaEste grupo tiene un riesgo leve pero significativo de desarrollar PC; en la mayoría de los casos, en forma de diplejía o de tetraparesia espástica leves que suelen permitir una marcha independiente. Los mayores retos a los que se enfrentan estos niños, sin embargo, son el retraso cognitivo y del lenguaje, los trastornos conductuales, los problemas visuales y el desarrollo de epilepsia21,22. La alta frecuencia de problemas visuales en este grupo de niños justifica que sean evaluados a partir de 6 meses por un oftalmólogo con experiencia en las secuelas visuales de esta enfermedad. De acuerdo con este primer examen, se programará el seguimiento oftalmológico específico posterior. Es conveniente ser muy receptivos ante los posibles problemas conductuales que nos puedan referir los padres ya desde el segundo año de vida, y en caso de que los sospechemos, una evaluación por parte de Psiquiatría Infantil y/o de un psicólogo especializado puede ser de gran ayuda.
En estos niños, el crecimiento del perímetro cefálico durante los primeros meses tras el alta es un indicador de la pérdida de volumen y, por tanto, de la extensión del daño en la sustancia blanca y puede ser utilizado para identificar a los niños con mayor riesgo de presentar trastornos del neurodesarrollo en el medio y largo plazo21,59.
Niños con encefalopatía hipóxico-isquémica moderada o grave y lesiones moderadas-graves gangliotalámicas, con o sin daño leve-moderado en la sustancia blancaEn este grupo de niños, la prevalencia de PC es muy alta, superior al 50%, y está en relación directa con la extensión del daño ganglio-talámico20. Como consecuencia de las alteraciones en la función oromotora, son frecuentes los trastornos de la alimentación y de la comunicación34. Los signos de afectación motora y las dificultades en la alimentación oral aparecen muy pronto y casi sin excepción antes del fin del primer año de vida, lo que justifica un seguimiento más frecuente y estrecho durante los primeros meses tras el alta que en los grupos anteriores.
En este grupo, una primera visita a los 3 meses de edad nos permitirá saber cómo se ha llevado a cabo la adaptación del niño al hogar familiar y qué problemas han surgido desde el alta hospitalaria. Los niños más graves ya manifestarán en este momento signos de afectación motora y es conveniente que inicien terapia rehabilitadora lo antes posible, así que es un buen momento para que sean remitidos a Rehabilitación y Fisioterapia, si esto no se hizo antes del alta. Es necesario empezar desde este mismo momento a valorar la posibilidad de que aparezcan trastornos de la alimentación oral y, si hay sospechas, empezar a explorar los sentimientos y actitudes de los padres en cuanto a estos problemas. A lo largo del segundo semestre, es conveniente realizar una evaluación de la función visual y de la audición. Durante el segundo año de vida, generalmente tras haber abordado los problemas en la alimentación oral, es cuando se hacen más evidentes los trastornos de comunicación y del lenguaje en estos niños.
A partir de los 18 meses de edad, se pueden programar el resto de las visitas de acuerdo con las necesidades de la familia y los problemas que vayan surgiendo. Probablemente, si los padres están satisfechos con la atención que el niño está recibiendo por parte del equipo multidisciplinar, la labor del coordinador sea ya menos necesaria.
Niños con encefalopatía hipóxico-isquémica grave, lesiones moderadas-graves gangliotalámicas y daño extenso en la sustancia blancaEn este grupo, la presencia de PC grave, alteración oromotora, discapacidad visual y epilepsia es la norma, pero además la tasa de mortalidad durante la infancia es considerable. Estos niños deberían ser vistos por primera vez a los 3 meses de edad o antes, dependiendo del estado del niño y del nivel de preocupación de la familia. Algunos niños de este grupo se van a casa con sonda nasogástrica por imposibilidad de recibir alimentación oral y por dificultad en el manejo de secreciones. Es muy improbable que estos problemas mejoren, por lo que es obligado el monitorizar el crecimiento y el estado nutricional; así como la derivación precoz a Gastroenterología y Nutrición. La mayor parte de las consideraciones que se han hecho para el grupo anterior son aplicables a estos niños con la consideración adicional del riesgo de fallecimiento; esto se comenta con más detalle en el apartado siguiente.
Mortalidad en el seguimiento. Cuidados paliativosLa EHI grave se asocia con una alta mortalidad en el periodo neonatal, que puede llegar al 25-30%48,54. Entre los supervivientes con EHI grave, un número significativo de niños fallecerán durante la infancia, con frecuencia durante el primer año de vida20,49,60. Los niños que mueren no solo han tenido antes una discapacidad motora grave, sino que con una elevada frecuencia han tenido también problemas de alimentación, discapacidad visual y epilepsia. La causa más frecuente de fallecimiento son los problemas respiratorios, incluyendo neumonía y neumonitis por aspiración, y en segundo lugar, las crisis epilépticas refractarias a tratamiento61.
En la mayoría de los casos, el mejor lugar donde el niño puede morir es en su casa con su familia62; y siempre que los padres lo deseen también, esta opción se debe facilitar al máximo. En algunas comunidades autónomas se han desarrollado unidades de cuidados paliativos pediátricos; estas unidades ofrecen el marco idóneo para la atención a estos niños. La finalidad es favorecer los cuidados del niño en su propio hogar y evitar consultas en Urgencias o ingresos hospitalarios siempre que sea posible. Idealmente, en los días o semanas previos al fallecimiento se debería acordar con la familia qué potenciales tratamientos estarían dispuestos a aceptar para su hijo y en qué circunstancias. Si se considera necesario, esto se puede recoger por escrito para facilitar que otros profesionales sanitarios que no han conocido al niño previamente puedan prestarle la atención más apropiada cuando llegue el momento.
La muerte del niño que tuvo EHI es devastadora para la familia, independientemente de cuál fuera su grado de discapacidad. Para muchos padres la muerte es la prolongación del duelo que se inició con el nacimiento y la consiguiente pérdida del hijo sano que esperaban. La atención al duelo, no solo en los padres, sino también en los hermanos y otros miembros de la familia, debe formar parte de los cuidados médicos que se ofrecen a estos pacientes.
Otros aspectos de la atención al seguimiento de los niños con encefalopatía hipóxico-isquémicaLa relación que se establece con las familias durante el seguimiento tras el alta de Neonatología nos coloca a los pediatras en una situación privilegiada no solo para conocer de cerca las dificultades por las que atraviesan estas familias en la vida diaria, sino para ser partícipes de otras preocupaciones más íntimas. No es infrecuente que una vez pasado el periodo agudo de la enfermedad, muchas familias empiecen a revivir los momentos que rodearon al nacimiento del niño y se replanteen las causas que condujeron a la enfermedad de su hijo. Algunas veces, los padres pueden incluso sentirse culpables pensando que alguna actitud o decisión suya tomada durante el embarazo o el parto pudo haber llevado a ese desenlace. Es necesario ser sensible a estas preocupaciones y estar alerta ante los signos que indican que los padres tienen todavía dudas no resueltas. Nunca es tarde para volver a hablar de lo ocurrido, incluso aunque el niño haya muerto, y en ocasiones puede ser muy beneficioso que en estas conversaciones participe alguno de los obstetras que intervino en la atención al parto. Los padres que desean tener más hijos necesitan saber los riesgos de que algo similar vuelva a ocurrir y necesitan discutir las posibles opciones que existen para minimizarlos. Un nuevo embarazo puede suponer una fuente de estrés para ambos padres, especialmente a medida que se acerca el momento del parto. Aunque el nuevo embarazo no sea estrictamente de alto riesgo por razones médicas, las circunstancias emocionales de los padres lo convierten en un embarazo de alto riesgo y como tal se debería manejar.
Si la evolución de un niño con EHI no es la esperada y se sospecha que algún factor diferente del episodio hipóxico-isquémico perinatal pudo haber causado o contribuido a las lesiones cerebrales, es obligado replantear el diagnóstico inicial y hacer un estudio completo de acuerdo a las nuevas circunstancias. La colaboración con los neuropediatras, los genetistas y otros especialistas puede ser muy valiosa.
Las demandas legales por supuesta negligencia obstétrica o perinatal son muy frecuentes tras el nacimiento de un niño con EHI que presenta posteriormente secuelas. En el año 2001, las indemnizaciones por casos de mala praxis obstétrica constituyeron el 60% del total de indemnizaciones que el sistema de salud británico tuvo que afrontar63; y aunque no hay datos comparables en nuestro país, es muy probable que las cifras sean similares. Esto significa que es muy posible que durante el seguimiento de estos pacientes nos enteremos de que la familia ha presentado una demanda y esto puede dar lugar a una situación incómoda en nuestra relación con los padres. En estos casos, lo mejor es hablar directamente del tema con ellos. Tenemos que tener en cuenta que la mayoría de los padres no desean causar un perjuicio al equipo médico que los atendió, pero necesitan entender qué ocurrió, si el daño se habría podido evitar y si se han tomado medidas para que un episodio similar no vuelva a producirse. En ciertas circunstancias, cuando el conflicto amenaza la relación profesional, puede ser mejor tanto para la familia como para los profesionales derivar al paciente a otro centro para la continuación de los cuidados y del seguimiento, pero en ningún caso la existencia de una demanda legal debe poner en peligro la calidad de la atención que reciba el paciente ni puede constituir una barrera en nuestra comunicación con los padres.
La carga económica y de trabajo que supone el cuidado de un niño con discapacidad es un tema al que habitualmente los profesionales sanitarios prestamos escasa atención. Las necesidades de estos niños son incomparablemente mayores que las de los niños con un desarrollo normal y generalmente se incrementan con el paso de los años. Muchos niños se beneficiarían de equipamientos y dispositivos especiales que habitualmente no están cubiertos por el Estado o que solo lo están parcialmente y que, por su precio, son inaccesibles para un gran número de familias. Entre estos se incluyen sillas de ruedas, artículos ortopédicos, dispositivos de apoyo a la comunicación y adaptaciones arquitectónicas en el hogar64. Es importante que los trabajadores sociales formen parte del equipo multidisciplinar que cuida de estos niños en el seguimiento. Los pediatras podemos ayudar transmitiendo estas necesidades a los organismos correspondientes y, en general, contribuyendo a hacer más visibles estos problemas en la sociedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Dorotea Blanco, Eva Valverde, Alfredo Garcia-Alix, Violeta Tenorio, Isabel Izquierdo, Juan Arnáez, Simón Lubian, Hector Boix, Gemma Arca y Fernando Cabañas.
Los miembros del Grupo de Trabajo de Hipotermia de la Sociedad Española de Neonatología se presentan en el anexo 1.