La restricción al crecimiento en recién nacidos prematuros se ha relacionado con un peor neurodesarrollo a largo plazo.
ObjetivosDefinir la incidencia de la restricción del crecimiento posnatal en prematuros ≤1.500gramos y detectar qué marcadores clínicos o bioquímicos se relacionan con la misma.
MétodosEstudio observacional longitudinal retrospectivo. Se utilizaron modelos de regresión lineal multivariante para determinar qué variables permiten predecir el cambio en el z-score de peso durante el ingreso.
ResultadosSe incluyeron 130 pacientes, con un peso medio al nacer de 1.161±251g y una edad gestacional de 29,9±2,5 semanas. Al alta hospitalaria el 59,2% tenía un peso<P10. Durante el ingreso los z-score de peso y longitud descendieron una media de –0,85±0,79 y –1,09±0,65, respectivamente. El mayor descenso del z-score se produjo en UCIN, con una velocidad de ganancia ponderal de 6,6±8,8g/kg/día, tras lo cual tuvo lugar una aceleración del crecimiento (16,7±3,8g/kg/día) insuficiente para realizar catch-up. Niveles más altos de urea se correlacionaron negativamente con el cambio en el z-score de peso (p<0,001) y el peso<P10 al nacer lo hizo de forma positiva (p=0,013).
ConclusionesMás de la mitad de los recién nacidos ≤1.500g presentan un peso al alta<P10. Esta restricción del crecimiento tiene lugar durante el ingreso en UCIN y afecta con menos frecuencia a los neonatos de bajo peso al nacer. Los niveles de urea se correlacionan negativamente con la ganancia ponderal, lo cual obliga a continuar estudiando la relación entre el crecimiento y el compartimento proteico.
Growth restriction in preterm infants has been related to a poor neurodevelopment outcome.
ObjectivesTo define the incidence of postnatal growth restriction in premature babies ≤1,500 grams and to detect related clinical or biochemical markers.
MethodsRetrospective longitudinal observational study. Multivariate linear regression models were used to determine variables that can predict the change in weight z-score during admission.
ResultsThe study included 130 patients with a mean birthweight of 1,161±251grams and a gestational age of 29.9±2.5 weeks. At hospital discharge, 59.2% had a weight below P10.During admission, the z-scores of weight and length decreased by -0.85±0.79 and –1.09±0.65, respectively.The largest decrease in z-score occurred during NICU admission, with a weight gain rate of 6.6±8.8g/Kg/day, after which growth acceleration took place (16.7±3.8g/Kg/day), but was insufficient to catch-up.Higher levels of urea were negatively correlated with the change in the z-score of weight (P<.001), and a weight <P10 at birth positively correlated (P=.013).
ConclusionsMore than half of newborns ≤1,500 grams have a weight at discharge of <P10. This growth restriction occurs during NICU admission, and affects low birth weight infants less frequently.Urea levels correlate negatively with weight gain, which requires further study of the relationship between growth and the protein compartment.
El nacimiento del gran prematuro conlleva que los procesos fisiológicos que en condiciones normales tendrían lugar intraútero a lo largo del tercer trimestre de la gestación tengan lugar en las unidades de cuidados intensivos neonatales (UCIN). La restricción posnatal del crecimiento (RPC) no es más que un ejemplo de las dificultades de la neonatología actual a la hora de remedar las condiciones ideales intrauterinas. A pesar de que las recomendaciones a nivel nutricional en el prematuro tienen como referencia las tasas de crecimiento fetal1,2, con frecuencia es un objetivo que no se alcanza antes del alta hospitalaria o de la edad a término. De hecho, el retraso del crecimiento extrauterino ha sido considerado como un «problema universal»3, una «consecuencia inevitable»4 o un «serio problema»5, y aunque algunos estudios han demostrado una mejoría en el crecimiento posnatal en los últimos años con una estrategia nutricional más agresiva6,7, todavía es un hallazgo común en las unidades neonatales5,8,9 y sigue siendo un punto de controversia3,5,10–13.
El RPC no es solo un concepto estadístico de alejamiento de unos estándares de referencia, sino que es muy probable que sea un factor pronóstico relevante a otros niveles, principalmente en la esfera neurológica14–16. Por lo tanto, mejorar el crecimiento posnatal, prevenir su restricción y conocer los grupos de riesgo que requieran estrategias individualizadas es una forma de mejorar los resultados a largo plazo17.
Diseñamos un estudio con el objetivo de definir la incidencia de RPC en recién nacidos≤1.500g de peso al nacer, tomando como referencia curvas de crecimiento fetal. Como objetivo secundario buscamos detectar si algunas características basales (peso al nacer, edad gestacional, sexo), algunos marcadores bioquímicos (urea, albúmina y proteínas totales) o algunas complicaciones hospitalarias (enterocolitis, ductus arterioso persistente, y displasia broncopulmonar) pudiesen estar relacionadas con una mayor RPC.
Material y métodosSe trata de un estudio observacional longitudinal retrospectivo de los recién nacidos ≤1.500g que ingresaron en una unidad neonatal nivel III-C en un período de 4 años (enero de 2013-diciembre de 2016). Se excluyeron los recién nacidos con síndromes polimalformativos, aquellos que no requirieron ingreso en UCIN, los nacidos en otros centros y aquellos que no tuvieron seguimiento tras el alta de UCIN por traslado a otros centros o exitus precoz (≤28 días).
La unidad en la que se realizó el estudio dispone de un protocolo de manejo nutricional en el recién nacido prematuro que cumple en líneas generales con las recomendaciones actuales1,2: nutrición parenteral del día 0 con aporte proteico inicial de 2-2,5g/kg/día y calórico de ≈40kcal/kg/d, con un objetivo de 3,5-4g/kg/d de proteínas y 110-120kcal/kg al final de la primera semana, inicio de enteral trófica precoz, suspensión de parenteral una vez se toleren 100ml/kg/d vía enteral, fortificación de lactancia materna, etc. En el período de estudio no se disponía de leche materna de banco, por lo que en ausencia de leche materna propia se usaron fórmulas para prematuros. No hubo cambios relevantes en este protocolo durante el período de estudio, salvo el cambio a emulsión lipídica con aceite de pescado (SMOF Lipid®) en la nutrición parenteral al final del primer año.
Las variables de somatometría (peso, longitud y perímetro craneal) se recogieron en valor absoluto y se convirtieron en z-scores y/o en percentiles con respecto a las tablas de Fenton 201318. Se consideró bajo peso para la edad gestacional (BPEG) al nacer el peso por debajo del percentil 10 (<P10). La longitud y el perímetro craneal (PC) se midieron al ingreso y al alta hospitalaria. El peso se midió al ingreso, al alta de UCIN, a las 36 semanas y al alta hospitalaria. Las variables bioquímicas (urea, proteínas totales y albúmina) se determinaron a los 15 días de vida. Como marcadores de displasia broncopulmonar se recogieron la dependencia de oxígeno a los 28 días y a las 36 semanas de edad corregida. Se recogió además la presencia de enterocolitis necrosante de estadio≥ii de Bell y el diagnóstico de ductus arterioso persistente.
Para calcular la velocidad de ganancia ponderal (VGP) entre 2 periodos se utilizó el método exponencial, como en estudios previos9,19, con la siguiente fórmula: VGP= (1000×ln[pesofinal/pesoinicial])/n.°de días
Un tamaño muestral de 130 pacientes permite estimar la incidencia de desnutrición en función del peso<P10 para su edad gestacional (EG) al alta hospitalaria con un nivel de confianza de 95% y una precisión de ±7% para una proporción esperada del 75%.
Se realizó un análisis descriptivo de todas las variables incluidas en el estudio, expresando las variables cuantitativas como media±desviación típica, mediana y rango intercuartílico y las variables cualitativas como valor absoluto y porcentaje. Se estudió la asociación de variables cualitativas con el test Chi-cuadrado o test exacto de Fisher según procediese. Se realizó la comparación de medias entre 2 grupos con el test «t» de Student o U de Mann-Whitney, según procediese. La comparación de medias entre más de 2 grupos se llevó a cabo mediante la prueba ANOVA o test de Kruskal-Wallis. Se estudió la asociación de variables cuantitativas con el coeficiente de correlación de Spearman. Se utilizaron modelos de regresión lineal multivariante para determinar qué variables permiten predecir el cambio en el z-score durante el ingreso, ajustando por aquellas variables que resultaron significativas en el modelo univariado o eran clínicamente relevantes. Todos los análisis se realizaron con el programa estadístico SPSS v.24.0 para Windows.
El protocolo de estudio fue evaluado y aprobado por el comité de ética de la investigación clínica de referencia.
ResultadosDurante el período de estudio ingresaron en la UCIN 163 neonatos≤1.500g, de los que se excluyeron los nacidos en otros centros hospitalarios (n=16) y aquellos sin seguimiento por traslado a otros centros (n=3) o por exitus precoz (n=14). La muestra final fue de 130 pacientes, cuyas características basales, evolución y antropometría se pueden ver en la tabla 1.
Características de la muestra: basales, de evolución intrahospitalaria, de somatometría y de la bioquímica a los 15 días de vida
| Variables | N=130 |
|---|---|
| Basales | |
| Sexo. Varón, n.° (%) | 62 (47,7) |
| EG (semanas) | |
| Media±DE | 29,9±2,5 |
| Mediana (IQ) | 29,8 (28-32) |
| EG (grupos) | |
| <28 sem n.° (%) | 34 (26,2) |
| 28-32 sem n.° (%) | 62 (47,7) |
| >32 sem n.° (%) | 34 (26,2) |
| Gemelar, n°. (%) | 55 (42,3) |
| Evolución | |
| Días UCIN | |
| Media±DE | 23,0±18,2 |
| Mediana (IQ) | 18 (9-36) |
| Días ingreso | |
| Media±DE | 55,0±21,6 |
| Mediana (IQ) | 51,5 (37,7-68,2) |
| EC corregida al alta (semanas) | |
| Media±DE | 37,45±1,9 |
| Mediana (IQ) | 37 (36-38) |
| Surfactante, n.° (%) | 65 (50) |
| VM, n.° (%) | 45 (34,6) |
| O2 28 días, n.° (%) | 28 (21,5) |
| O2 36sem, n.° (%) | 11 (8,5) |
| Duración VM horas (n=45) | |
| Media±DE | 305,3±887,7 |
| Mediana (IQ) | 96 (17,5-180) |
| Duración O2horas (n=91) | |
| Media±DE | 623,6±748,4 |
| Mediana (IQ) | 192 (48-1.080) |
| Enterocolitis, n.° (%) | 8 (6,2) |
| Cirugía para enterocolitis, n.° (%) | 4 (3,1) |
| DAP, n.° (%) | 30 (23,1) |
| DAP tratado médicamente, n.° (%) | 20 (15,4) |
| DAP tratado quirúrgicamente, n.° (%) | 7 (5,4) |
| Somatometría | |
| Peso al nacer (gramos) | |
| Media±DE | 1161±251,2 |
| Mediana (IQ) | 1170 (957-1.410) |
| Longitud al nacer (cm) n=64 | |
| Media±DE | 38±3,1 |
| Mediana (IQ) | 38,7 (35-40) |
| PC al nacer (cm) n=91 | |
| Media±DE | 26,3±2,0 |
| Mediana (IQ) | 26,5 (24,5-28) |
| Peso al alta de UCIN (gramos) | |
| Media±DE | 1.459,3±332,5 |
| Mediana (IQ) | 1.390 (1.240-1.626,2) |
| Peso a las 36 sem (gramos) | |
| Media±DE | 1.953,5±365,0 |
| Mediana (IQ) | 1.927,5 (1.712,5-2.200) |
| Peso al alta (gramos) | |
| Media±DE | 2.424,7±330,5 |
| Mediana (IQ) | 2.307,5 (2.180-2.580) |
| Longitud al alta (cm) | |
| Media±DE | 45,4±2,0 |
| Mediana (IQ) | 45 (44-46,5) |
| PC al alta (cm) | |
| Media±DE | 33±1,3 |
| Mediana (IQ) | 33 (32-33,8) |
| Peso<P10 al ingreso, n.° (%) | 36 (27,7) |
| Peso<P10 al alta, n.° (%) | 77 (59,2) |
| Bioquímica 15 días | |
| Urea (mg/dl) | |
| Media±DE | 20,1±21,2 |
| Mediana (IQ) | 14 (10-21) |
| Albúmina (g/dl) | |
| Media±DE | 3,2±0,3 |
| Mediana (IQ) | 3,2 (3-3,5) |
| Proteínas totales (g/dl) | |
| Media±DE | 4,5±0,6 |
| Mediana (IQ) | 4,6 (4,3-5) |
DAP: ductus arterioso persistente; DE: desviación estándar; EG: edad gestacional; IQ: primer y tercer cuartiles; O2: oxígeno; P10: percentil 10 según tablas de Fenton 2013; PC: perímetro craneal. UCIN: unidad de cuidados intensivos neonatales; VM: ventilación mecánica en algún momento durante el ingreso.
Al ingreso la prevalencia de peso <P10 fue del 27,7% (n=36), del 66,9% (n=87) a las 36 semanas de edad corregida, del 66,2% (n=86) al alta de UCIN y del 59,2% (n=77) al alta hospitalaria.
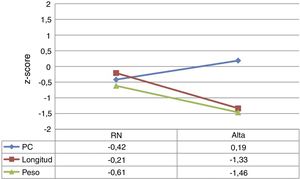
Al ingreso los valores de z-score de peso, longitud y PC fueron cercanos a 0. Sin embargo, al alta hospitalaria los z-score de peso y longitud descendieron una media de –0,85±0,79 y –1,09±0,65, respectivamente. El z-score de PC se mantuvo cercano a 0 e incluso mejoró ligeramente. Los valores de z-score en cada punto y la representación gráfica de estos cambios se pueden observar en la figura 1.
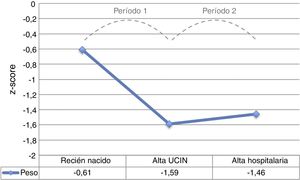
El período de mayor descenso del z-score de peso fue el comprendido entre el ingreso y el alta de UCIN (período 1), tras el cual tuvo lugar una leve recuperación hasta el alta hospitalaria (período 2), pero sin alcanzar los valores del nacimiento (fig. 2).
La ganancia media de peso durante el ingreso fue de 1.263,6±467,7g, con una media de 23,7±5,6g/día. La VGP media fue de 13,9±3,8g/kg/día. Durante el período 1 la VGP media fue significativamente más baja que durante el período 2 (6,6±8,8 vs 16,7±3,8g/kg/día p-valor<0,001).
Los niveles de las determinaciones bioquímicas figuran en la tabla 1. Tan solo los niveles de urea se correlacionaron significativamente, y de forma negativa, con el cambio en el z-score de peso durante el ingreso (rs=–0,289, p=0,001).
La EG al nacer se correlacionó de forma positiva con el cambio en el z-score de peso durante el ingreso, es decir, con mayores valores de z-score al alta (rs=0,324, p<0,001). En cambio, los días de ingreso hospitalario (rs=–0,353, p<0,001) y los días de ingreso en UCIN (rs=–0,178, p=0,043) se correlacionaron negativamente. No se encontró correlación con la duración de la oxigenoterapia ni con la duración de la ventilación mecánica.
En la tabla 2 se puede observar el análisis univariado de la asociación de las variables cualitativas al cambio en el z-score de peso durante el ingreso.
Asociación de variables cualitativas con la variación del z-score durante el ingreso. Análisis univariado
| Variación del z-score del ingreso al alta Media±DE | p-valor | |
|---|---|---|
| EG (semanas) por grupos | <0,001 | |
| <28 (n=34) | –1,3±1,0 | |
| 28-32 (n=62) | –0,7±0,6 | |
| >32 (n=34) | –0,4±0,6 | |
| <P10 al nacer | 0,001 | |
| Sí (n=36) | –0,47±0,6 | |
| No (n=94) | –1,0±0,7 | |
| Sexo | 0,841 | |
| Varón (n=68) | –0,8 ± 0,6 | |
| Mujer (n=62) | –0,8 ± 0,9 | |
| Surfactante | 0,002 | |
| Sí (n=65) | –1,0±0,8 | |
| No (n=65) | –0,6±0,6 | |
| VM | 0,045 | |
| Sí (n=45) | –1,1±0,9 | |
| No (n=85) | –0,7±0,6 | |
| O228 días | 0,542 | |
| Sí (n=33) | –1,0±1,0 | |
| No (n=97) | –0,7±0,6 | |
| O236sem | 0,931 | |
| Sí (n=14) | –1,1±1,1 | |
| No (n=116) | –0,8±0,7 | |
| Enterocolitis | 0,149 | |
| Sí (n=8) | –1,5±1,3 | |
| No (n=122) | –0,8±0,7 | |
| Cirugía para enterocolitis | 0,010 | |
| Sí (n=4) | –2,5±1,4 | |
| No (n=126) | –0,8±0,7 | |
| DAP | 0,003 | |
| Sí (n=30) | –1,4±1,0 | |
| No (n=100) | –0,6±0,6 | |
| DAP tratado médicamente | 0,038 | |
| Sí (n=20) | –1,4±1,1 | |
| No (n=110) | –0,7±0,6 | |
| Cirugía DAP | 0,008 | |
| Sí (n=7) | –1,7±0,8 | |
| No (n=123) | –0,8±0,7 | |
DAP: ductus arterioso persistente; DE: desviación estándar. EG: edad gestacional; P10: percentil 10 según tablas de Fenton 2013; VM: ventilación mecánica en algún momento durante el ingreso.
En negrita los p-valores <0.05.
En el modelo final de regresión lineal multivariado para predecir el descenso en el z-score se ajustó por la EG, los niveles de urea y el peso<P10 al nacer. La única variable con efecto independiente para predecir los valores de descenso en el z-score fue la urea (p<0,001), encontrándose en el límite de la significación el peso<P10 al nacer (p=0,098). Eliminando del modelo la EG por no resultar significativa, se objetiva que tanto la urea como el peso<P10 son variables con efecto independiente para predecir el descenso de z-score. Es decir, niveles más altos (más positivos) de urea se asocian a valores más negativos de la variable «cambio de z-score», lo que significa mayores descensos en z-score (p<0,001) y el peso<P10 al nacer se asocia a menores descensos de z-score y por tanto menor RPC (p=0,013).
DiscusiónEn un sentido estricto, cualquier caída de puntuación z o percentil desde el nacimiento supone alguna restricción al crecimiento extrauterino, aunque en la literatura lo más frecuente es encontrar definiciones de la RPC con puntos de corte más o menos arbitrarios, de los cuales el más común es el peso<P10 con respecto al crecimiento fetal a la edad a término. En el presente estudio, con una muestra contemporánea de 130 neonatos procedentes de una sola unidad neonatal, observamos una caída en torno a una puntuación z del peso y la longitud durante el ingreso hospitalario, lo que condicionó que al alta hospitalaria más de la mitad de los neonatos tuviesen un peso <P10 para su EG. Encontramos que esta RPC tiene su origen en una desaceleración de la velocidad de crecimiento durante el ingreso en UCIN. Además, usando metodología de regresión lineal intentamos identificar factores bioquímicos y clínicos que pudiesen estar relacionados con la caída en el z-score de peso.
A nivel internacional varios estudios obtuvieron resultados similares al nuestro10,20. En un extenso estudio publicado en 2003 el 34% de los 12.323 neonatos<32 semanas de la muestra fueron dados de alta con un peso<P105. En otros estudios se comunican tasas mucho más altas, de hasta el 97% de los neonatos de muy bajo peso y hasta el 99% en los menores de 1.000g21.
En el ámbito nacional también disponemos de datos fiables de las tasas de RPC, destacando los estudios de Krauel et al. y de García-Muñoz et al. usando como base la red SEN15008,9, y el de Sáenz de Pipaón et al. en una muestra de una sola unidad neonatal22. En el año 2008 Krauel et al. estudiaron una muestra de 2.317 neonatos y encontraron una incidencia de peso al alta<P10 del 77%. Más recientemente, en un excelente e ímprobo trabajo liderado por García-Muñoz Rodrigo se estudió la evolución posnatal del peso en una cohorte de 4.520 neonatos ≤28 semanas y observaron un descenso del z-score de peso en torno a –1,7 hasta el alta hospitalaria9. Ambos trabajos son multicéntricos y con un alto número de pacientes, lo cual les otorga unas indudables ventajas, pero también es probable que las prácticas nutricionales fuesen muy heterogéneas entre las distintas unidades23. Los estudios de un solo centro, si bien tienen sus propias limitaciones, suelen tener muestras más homogéneas. En este sentido, Sáenz de Pipaón et al. comunicaron en el año 2014 los resultados de un estudio prospectivo en una muestra de 111 neonatos<1.500g y<34 semanas del Hospital La Paz de Madrid, y observaron un descenso de z-score de peso de –0,97 en las primeras 5 semanas, muy similar al nuestro de –0,85 durante el ingreso, a pesar de un aporte proteico y energético muy cercano a los objetivos nutricionales actuales22.
En un intento de definir el origen de esta RPC analizamos la VGP durante el período de UCIN y durante el período posterior a UCIN hasta el alta, observando que era durante el primer período cuando se producía un enlentecimiento más significativo de la VGP. Otros estudios previos ya habían definido este progreso ponderal dual, con un período inicial de pérdida de percentiles seguido de un período de crecimiento paralelo al intrauterino, pero sin realizar catch-up9,13,19,24,25. Cole et al., en un estudio de 5.009 neonatos <32 semanas en el Reino Unido, describen una caída del peso al nacer de 258g de media hasta el 8.° día de vida, tras la cual se produce una ganancia de peso hasta un máximo de 16g/kg/día19. Este valor es muy similar al del período 2 de nuestro estudio que fue de 16,7g/kg/día. También Rochow et al. demostraron recientemente en una cohorte de 981 neonatos <34 semanas, con un curso clínico sin complicaciones relevantes que estos neonatos cambian su trayectoria postnatal a –0,8 z-scores y después crecen de forma paralela al crecimiento intrauterino esperado13.
Esa pérdida de peso inicial parece ser independiente del aporte calórico y proteico y probablemente refleje tan solo una pérdida de agua7, por lo que se ha sugerido asignar como objetivo la curva del percentil de peso tras la pérdida ponderal inicial, no al nacer7,9,19. Otros estudios consideran como «obligatoria» una pérdida de –0,7 z-scores desde el nacimiento hasta el día 326.
Teniendo en cuenta estas limitaciones en los patrones de referencia antropométricos, consideramos que sería de mucha utilidad encontrar algún dato de laboratorio que nos permitiese mejorar la valoración nutricional27,28. Ya que el progreso ponderal depende al menos en parte de la ingesta de proteínas4,22,29, resulta especialmente atractivo el estudio del compartimento proteico. Por esta razón, en neonatos de muy bajo peso se ha recomendado la determinación de las proteínas séricas y la albúmina de forma rutinaria para la evaluación nutricional27, aunque en nuestra muestra no encontramos asociación de estas variables con el RPC. La urea, un producto de la degradación de las proteínas, se ha usado tradicionalmente para monitorizar la ingesta proteica, aunque esta práctica también ha sido puesta en duda30,31. Existen muy pocos estudios que específicamente estudien la relación entre los niveles de urea y los parámetros nutricionales28. En nuestra muestra, en ausencia de datos retrospectivos fiables de la ingesta diaria de proteínas, la hipótesis inicial fue que un mayor nivel de urea sería indicativo de un mayor aporte proteico, y por tanto se asociaría a una menor RPC. Sin embargo, los niveles más altos de urea se asociaron a un mayor descenso en el z-score de peso (valores más negativos de la variable «cambio en el z-score»). Este hallazgo probablemente refleje el hecho de que la urea se ve modificada por el estado de hidratación, la función renal y la presencia de catabolismo27. De esta forma, tanto el aumento del catabolismo relacionado con la gravedad como la pérdida de líquido extracelular característica de los primeros días de vida podrían justificar una mayor elevación de la urea en los pacientes con mayor RPC. De hecho, la asociación de la gravedad inicial con el descenso en el z-score ha sido previamente comunicada3,22.
El significado clínico de esta asociación entre los niveles de urea a los 15 días de vida, con una mayor RPC es controvertido, ya que aunque la asociación estadística entre ambas variables numéricas es cierta, la gran mayoría de los valores de urea en la muestra se encontraban dentro de los límites que podemos considerar normales para recién nacidos (el rango intercuartílico en la muestra total fue de 10-21mg/dl), y esto ocurrió incluso en el grupo de neonatos que al alta estaban<P10. Sin embargo, creemos que nuestro hallazgo corrobora la necesidad de profundizar en el estudio de la relación del compartimento proteico y el crecimiento posnatal.
En nuestra muestra observamos que los recién nacidos de BPEG exhibían una menor RPC, de forma similar a lo observado por otros autores5,8,10,24. Obviamente, muchos de estos neonatos pequeños para la edad gestacional continúan siéndolo al alta hospitalaria, pero lo que aquí analizamos es su relación con el descenso de z-score durante el ingreso, no solo el porcentaje de <P10 al alta. Senterre y Rigo comunicaron que con un protocolo agresivo de nutrición en neonatos de peso adecuado para EG el cambio en el z-score durante el ingreso fue de –0,37±0,57 y en cambio en pequeños para EG se mantuvo (0,18±0,52)26. Si este comportamiento es un proceso adaptativo del feto con retraso del crecimiento intrauterino, o si responde a un manejo neonatal distinto, a cambios en la composición corporal u a otros factores, permanece sin aclarar24.
Este estudio tiene algunas limitaciones. Las principales están en relación con la naturaleza retrospectiva del mismo, lo que impidió recoger datos fiables referentes al manejo hídrico y nutricional, especialmente el aporte proteico. Del mismo modo, la baja incidencia de algunas de las morbilidades más graves (enterocolitis, ductus quirúrgico) limita la posibilidad de encontrar asociaciones significativas con la RPC. Por último, las mediciones de peso, PC y longitud, aunque todas fueron realizadas en la misma unidad, no se estandarizaron previamente. Con más de 1.000 mediciones en el estudio creemos que los potenciales errores de medida se deberían haber atenuado.
En conclusión, la RPC continúa siendo un hallazgo frecuente al alta hospitalaria, estando presente en más de la mitad de los neonatos con un peso al nacer ≤1.500g. El origen de esta RPC se sitúa en el periodo entre el nacimiento y el alta de UCIN.
Los neonatos con BPEG al nacer con frecuencia son dados de alta también con un peso <P10, pero parecen sufrir una menor RPC. Los niveles de urea a los 15 días de vida se correlacionan negativamente con la ganancia ponderal. Si bien es difícil sacar conclusiones aplicables a la práctica clínica de esta asociación, es un hallazgo que hace necesaria su confirmación en estudios prospectivos orientados a estudiar la relación del compartimento proteico y la ganancia ponderal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de los resultados de este trabajo han sido presentados en el xxvi Congreso de Neonatología y Medicina Perinatal (Zaragoza, septiembre de 2017) y en el lxviiiCongreso de la Sociedad de Pediatría de Galicia (Ourense, noviembre de 2017).