Investigar la etiología, curso clínico y respuesta al tratamiento del quilotórax neonatal.
Pacientes y métodoEstudio prospectivo en la unidad de cuidados intensivos neonatales de un hospital terciario durante un período de 2 años. Se aplicó un protocolo terapéutico predefinido consistente en la administración secuencial de nutrición parenteral total (NPT), octreótide y cirugía. Se investigó la influencia de la etiología sobre la evolución y respuesta al tratamiento.
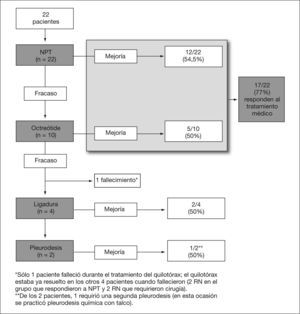
ResultadosSe incluyeron 22 recién nacidos. Las causas más frecuente fueron la cirugía cardíaca (n=14) y la hernia diafragmática (n=4), en las que la incidencia de quilotórax fue del 11,2 % (intervalo de confianza del 95 % [IC 95 %]: 5,7-16,8 %) y del 26,6 % (IC 95%: 4,3-40%), respectivamente. Un total de 17 pacientes respondieron al tratamiento médico. El octreótide fue eficaz en 5 de los 10 pacientes en que fracasó la NPT; ninguno de los pacientes en que fracasó el octreótide mejoraron tras 3 semanas de NPT. No se observaron complicaciones atribuibles al octreótide. No observamos una asociación significativa entre la etiología y la respuesta al tratamiento, aunque los 4 pacientes que requirieron cirugía pertenecieron al grupo de recién nacidos postoperados de cardiopatía congénita. Todos presentaron complicaciones atribuibles al quilotórax. Fallecieron 5 pacientes durante los 6 meses de seguimiento pero en ningún caso la muerte fue directamente atribuible al quilotórax.
ConclusionesDebe considerarse una cirugía precoz en la minoría de pacientes que no responden al tratamiento médico. La etiología es el principal determinante de la mortalidad. Son necesarios estudios aleatorizados controlados que establezcan la eficacia y momento de aplicación de las diferentes opciones terapéuticas.
To investigate the aetiology, clinical course and response to treatment of neonatal chylothorax.
Patients and methodProspective study over a 2-year period in a neonatal intensive care unit of a tertiary university hospital. All newborns followed a predefined therapeutic protocol that included the sequential administration of total parenteral nutrition (TPN), octreotide and surgery. The influence of aetiology on outcome and response to treatment was investigated.
ResultsThe study included 22 newborns. Surgery for congenital heart disease (CHD) (n=14) and congenital diaphragmatic hernia (n=4) were the most common aetiologies. The incidence of chylothorax in these aetiological groups was 11.2 % (95% CI 5.7-16.8 %) and 26.6 % (95% CI 4.3-40 %), respectively. Medical treatment was successful in 17 patients. Five of the 10 patients who did not respond to TPN were successfully treated with octreotide; none of the patients in whom octreotide failed responded to the subsequent 3 weeks of TPN. No side-effects were observed during octreotide administration. No significant association between aetiology and response to treatment was found, although all 4 patients who ultimately required surgery were in the CHD group. All patients had complications attributable to chylothorax. Five patients died during the 6 months of follow-up although mortality was never directly attributed to chylothorax.
ConclusionsMost patients can be successfully managed with medical treatment but early surgery should be considered in patients who do not respond to medical treatment. Aetiology is the main determinant of mortality. Randomized controlled studies are needed to demonstrate the efficacy and adequate timing of application of each therapeutic intervention.
El quilotórax, definido como la acumulación anormal de linfa en el espacio pleural, es la causa más frecuente de derrame pleural en el recién nacido1. Suelen distinguirse dos grupos etiológicos2,3. El quilotórax primario es el asociado a malformaciones del sistema linfático4. El quilotórax secundario, especialmente el observado tras cirugía cardiotorácica, es el más frecuente y se debe a una lesión directa del conducto torácico y/o a la existencia de hipertensión venosa en el territorio de la vena cava superior (VCS)5–7
Son frecuentes el curso tórpido y las complicaciones debidas a la pérdida de quilo (hipovolemia, diselectrolitemias, hipoalbuminemia, hipogammaglobulinemia, hipofibrinogenemia) y a la necesidad de tratamientos invasivos (drenaje torácico, ventilación mecánica, vías, nutrición parenteral)4. Son fundamentales un soporte respiratorio apropiado, una ingesta calórico-proteica adecuada y el tratamiento de las complicaciones derivadas de la pérdida de quilo8.
Los tratamientos propuestos incluyen la modificación dietética (nutrición parenteral total y/o dieta con triglicéridos de cadena media), la administración de octreótide o somatostatina y la cirugía1,3,5,7,9,10. La eficacia de estas intervenciones ha sido sólo sugerida a partir de estudios descriptivos retrospectivos que incluyen niños de diferentes edades. Además, el reducido número de pacientes estudiados no permite comparar diferentes grupos etiológicos, aunque la etiología parece ser un determinante fundamental de la respuesta al tratamiento y del pronóstico. Concretamente, la existencia de hipertensión venosa se ha asociado a una peor respuesta al tratamiento y a una mayor morbimortalidad1,11,12
En el presente estudio describimos la etiología, el curso clínico y la respuesta a un protocolo terapéutico de una cohorte de recién nacidos con quilotórax recogida a lo largo de 2 años y seguida hasta los 6 meses de vida. Se describe también la incidencia de quilotórax en el recién nacido tras la cirugía de la cardiopatía congénita y de la hernia diafragmática observada durante el mismo período.
Pacientes y métodoEstudio prospectivo que incluyó todos los recién nacidos con quilotórax diagnosticados en el Servicio de Neonatología del Hospital Materno-Infantil Vall d'Hebron de Barcelona entre julio de 2004 y julio de 2006. Se excluyeron aquellos pacientes con quilotórax diagnosticado tras los 28 días de vida.
El diagnóstico se basó en los siguientes criterios3: líquido pleural estéril, más de 1.000 céls./μl con más de 80 % de linfocitos y triacilglicéridos por encima de 110mg/dl. Este último criterio se consideró necesario sólo si el recién nacido recibía nutrición enteral. El líquido pleural se obtuvo mediante toracocentesis o drenaje quirúrgico (en caso de quilotórax posquirúrgico precoz).
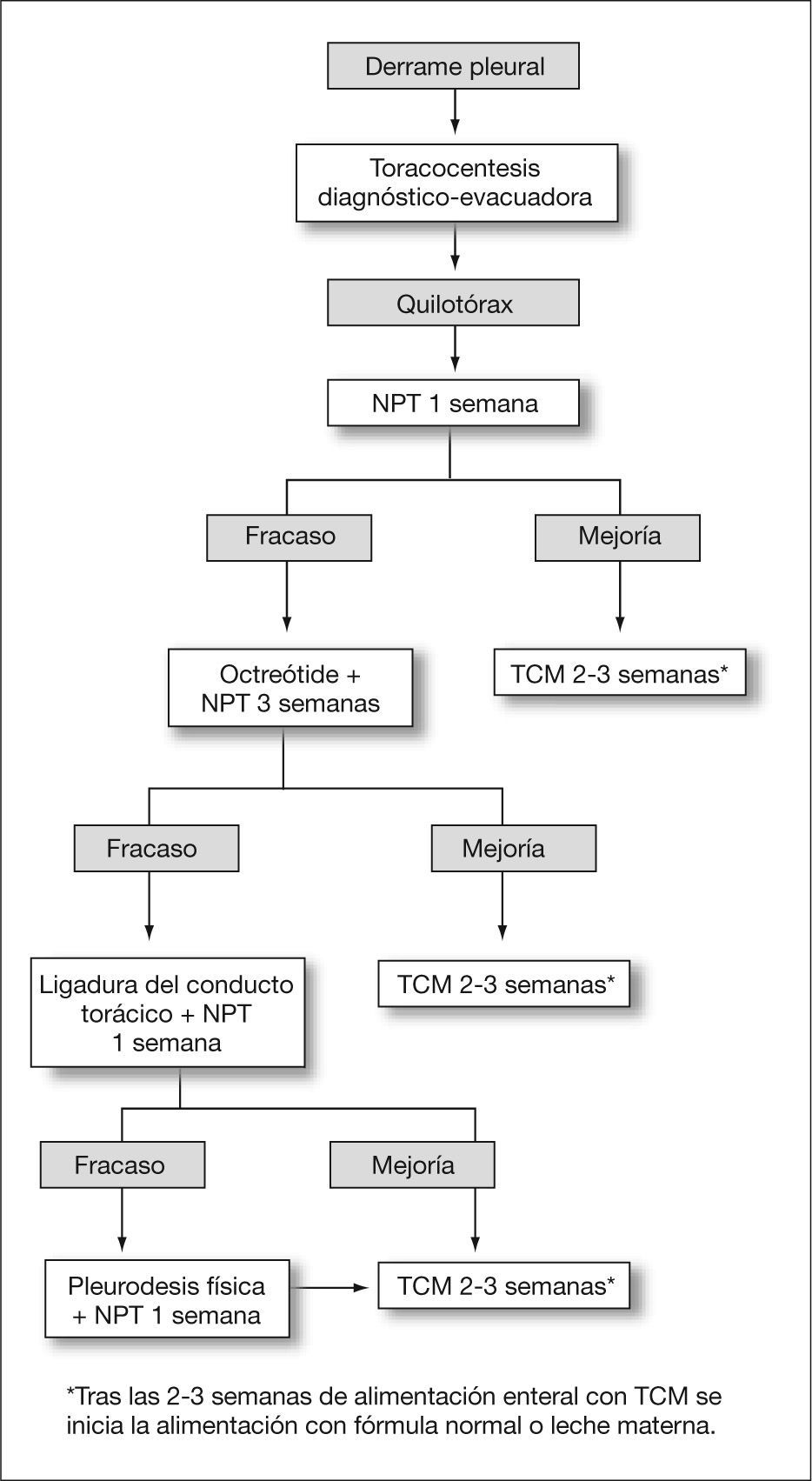
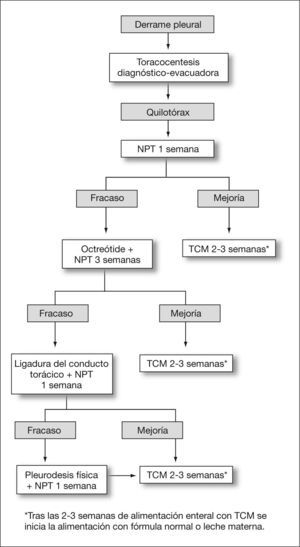
Diseñamos y aplicamos a todos los pacientes el protocolo terapéutico que se indica en la figura 1. Éste incluye la práctica de una única toracocentesis evacuadora, que es a la vez diagnóstica y terapéutica. En todos los pacientes se instaura nutrición parenteral total (NPT) durante al menos 1 semana. En caso de evidencia radiológica de reacumulación de líquido pleural, se coloca un drenaje torácico en el lado del derrame. La respuesta a cada intervención subsiguiente es valorada por el débito del drenaje: se define mejoría como la disminución del débito a menos de 10ml/kg/día y resolución radiológica del derrame; todo débito superior a 10ml/kg/día es definido como fracaso terapéutico. En caso de fracaso de NPT se administra octreótide acetato intravenoso (Sandostatin®, Novartis) en infusión continua en una dosis inicial de 0,5μg/kg/h por vía central o periférica. Se aumenta diariamente el ritmo de infusión en 0,5μg/kg/h hasta una dosis máxima de 1,5μg/kg/h que, en ausencia de mejoría, se suspende a las 72h. En caso de mejoría, el tratamiento se mantiene durante 8–12 días con la dosis mínima eficaz. El tratamiento quirúrgico se indica a partir de las 4 semanas del diagnóstico y consiste en la ligadura del conducto torácico mediante toracotomía lateral derecha. En caso de requerir reintervención quirúrgica, se practica religadura del conducto torácico y pleurodesis física.
Se realizaron controles seriados de hemograma, ionograma, glucemia, proteínas totales, albúmina, inmunoglobulinas, función hepática, función renal, proteína C reactiva y estudio de coagulación. Se definió hiponatremia por natremia inferior a 135mEq/l, hipoalbuminemia por albúmina sérica inferior a 3g/dl, hipogamaglobulinemia por una cifra de IgG total inferior a 500mg/dl, linfopenia por una cifra de linfocitos en sangre inferior a 2.300/μl y colostasis por hiperbilirrubinemia de predominio directo superior a 2mg/dl. Los criterios de transfusión de albúmina y gammaglobulina fueron albuminemia inferior a 2g/dl e IgG inferior a 250mg/dl, respectivamente. En estos casos se administraron seroalbúmina intravenosa al 20 % (albúmina humana Grífols® 20 %) 1g/kg y gammaglobulina intravenosa inespecífica (Endobulin® S/D, Baxter) 400mg/kg, ambas en una infusión de 4-6h. Se determinó la función tiroidea en los pacientes que recibieron tratamiento con octreótide. Se practicó eco-Doppler del territorio de la VCS en los pacientes en quienes fracasó el tratamiento médico.
La duración del quilotórax se definió por los días que se mantuvo la NPT tras el diagnóstico. Los resultados de mortalidad se presentan a los 6 meses de edad.
Se exploró la relación de la duración del quilotórax con la etiología e incidencia de colostasis mediante test no paramétricos (Mann-Whitney y Kruskal-Wallis). La asociación entre la eficacia de las intervenciones y la etiología subyacente se investigó mediante el test exacto de Fisher. La correlación entre las cifras de albúmina, linfocitos e IgG se estudió mediante la Rho de Spearman. Todos los análisis se realizaron con el SPSS (versión 12 para Windows).
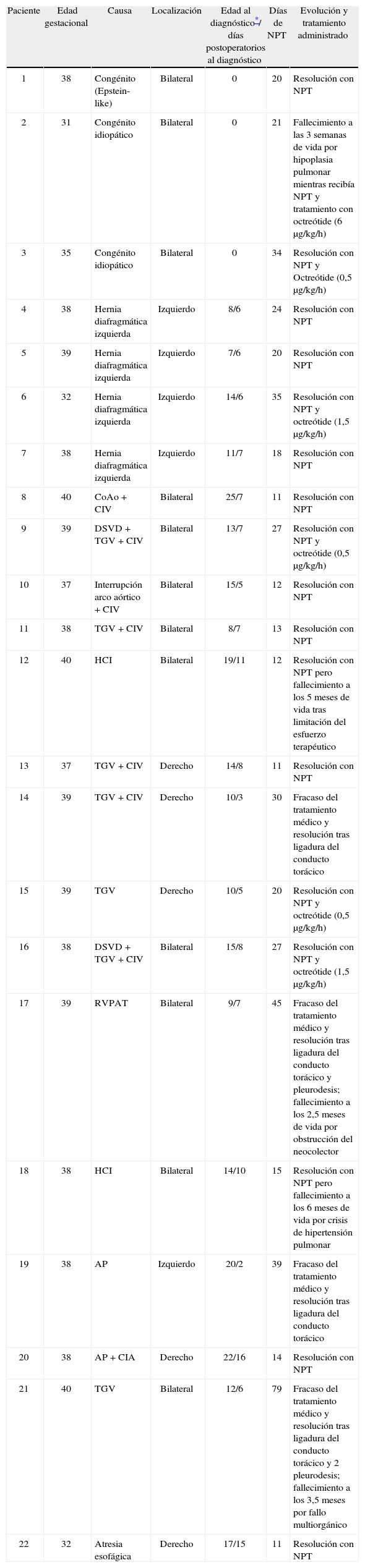
ResultadosSe incluyeron 22 recién nacidos (16 varones) cuyas características estan recogidas en la tabla 1. El 82 % de los recién nacidos fueron a término (18/22) y la causa más frecuente de quilotórax fue la cirugía cardiotorácica, observada en el 86 % de los pacientes (19/22; 14 pacientes con cardiopatía congénita, 4 con hernia diafragmática y 1 con atresia esofágica). En los 19 pacientes con quilotórax posquirúrgico, éste se diagnosticó entre 2 y 16 días tras la cirugía (mediana 7, rango intercuartílico 6–8 días). Los 3 pacientes con quilotórax congénito fueron diagnosticados prenatalmente y sólo el paciente 1 presentó hydrops fetalis; la paciente 2 recibió tratamiento prenatal con shunts pleuroamnióticos en la semana 27 de gestación.
Resumen de los pacientes incluidos en el estudio
| Paciente | Edad gestacional | Causa | Localización | Edad al diagnóstico*/ días postoperatorios al diagnóstico | Días de NPT | Evolución y tratamiento administrado |
| 1 | 38 | Congénito (Epstein-like) | Bilateral | 0 | 20 | Resolución con NPT |
| 2 | 31 | Congénito idiopático | Bilateral | 0 | 21 | Fallecimiento a las 3 semanas de vida por hipoplasia pulmonar mientras recibía NPT y tratamiento con octreótide (6μg/kg/h) |
| 3 | 35 | Congénito idiopático | Bilateral | 0 | 34 | Resolución con NPT y Octreótide (0,5μg/kg/h) |
| 4 | 38 | Hernia diafragmática izquierda | Izquierdo | 8/6 | 24 | Resolución con NPT |
| 5 | 39 | Hernia diafragmática izquierda | Izquierdo | 7/6 | 20 | Resolución con NPT |
| 6 | 32 | Hernia diafragmática izquierda | Izquierdo | 14/6 | 35 | Resolución con NPT y octreótide (1,5μg/kg/h) |
| 7 | 38 | Hernia diafragmática izquierda | Izquierdo | 11/7 | 18 | Resolución con NPT |
| 8 | 40 | CoAo + CIV | Bilateral | 25/7 | 11 | Resolución con NPT |
| 9 | 39 | DSVD + TGV + CIV | Bilateral | 13/7 | 27 | Resolución con NPT y octreótide (0,5μg/kg/h) |
| 10 | 37 | Interrupción arco aórtico + CIV | Bilateral | 15/5 | 12 | Resolución con NPT |
| 11 | 38 | TGV + CIV | Bilateral | 8/7 | 13 | Resolución con NPT |
| 12 | 40 | HCI | Bilateral | 19/11 | 12 | Resolución con NPT pero fallecimiento a los 5 meses de vida tras limitación del esfuerzo terapéutico |
| 13 | 37 | TGV + CIV | Derecho | 14/8 | 11 | Resolución con NPT |
| 14 | 39 | TGV + CIV | Derecho | 10/3 | 30 | Fracaso del tratamiento médico y resolución tras ligadura del conducto torácico |
| 15 | 39 | TGV | Derecho | 10/5 | 20 | Resolución con NPT y octreótide (0,5μg/kg/h) |
| 16 | 38 | DSVD + TGV + CIV | Bilateral | 15/8 | 27 | Resolución con NPT y octreótide (1,5μg/kg/h) |
| 17 | 39 | RVPAT | Bilateral | 9/7 | 45 | Fracaso del tratamiento médico y resolución tras ligadura del conducto torácico y pleurodesis; fallecimiento a los 2,5 meses de vida por obstrucción del neocolector |
| 18 | 38 | HCI | Bilateral | 14/10 | 15 | Resolución con NPT pero fallecimiento a los 6 meses de vida por crisis de hipertensión pulmonar |
| 19 | 38 | AP | Izquierdo | 20/2 | 39 | Fracaso del tratamiento médico y resolución tras ligadura del conducto torácico |
| 20 | 38 | AP + CIA | Derecho | 22/16 | 14 | Resolución con NPT |
| 21 | 40 | TGV | Bilateral | 12/6 | 79 | Fracaso del tratamiento médico y resolución tras ligadura del conducto torácico y 2 pleurodesis; fallecimiento a los 3,5 meses por fallo multiorgánico |
| 22 | 32 | Atresia esofágica | Derecho | 17/15 | 11 | Resolución con NPT |
AP: atresia pulmonar; CIA:comunicación interauricular; CIV: comunicación interventricular; CoAo: coartación aórtica; DSVD: doble salida de ventrículo derecho; HCI: hipoplasia de cavidades izquierdas; NPT: nutrición parenteral total; RVPAT: retorno venoso pulmonar anómalo total; TGV: transposición de los grandes vasos.
Durante los 2 años del estudio se operaron 125 recién nacidos por cardiopatía congénita y 15 por hernia diafragmática, lo que supone una incidencia de quilotórax posquirúrgico del 11,2 % (IC 95 %: 5,7-16,8) y 26,6 % (IC 95 %: 4,3-40), respectivamente.
El quilotórax fue unilateral en 10 pacientes (derecho en 5 pacientes e izquierdo en otros 5 pacientes) y bilateral en 12 pacientes. El derrame fue ipsolateral al lado de la hernia en los 4 pacientes con hernia diafragmática (izquierdo).
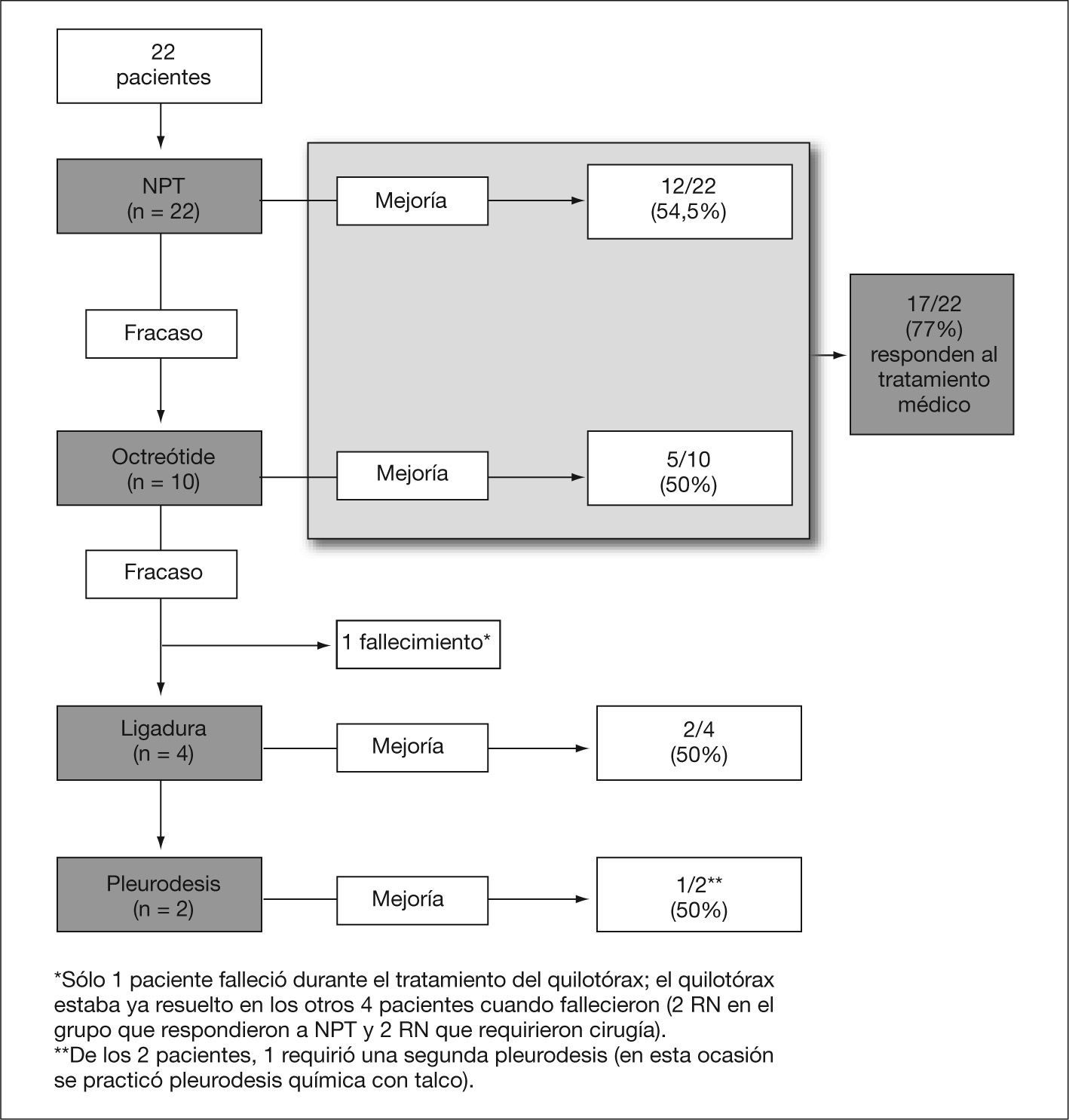
El tratamiento inicial con NPT fue eficaz en el 54,5 % de los pacientes (12/22) y sólo 3 no precisaron de drenaje torácico (fig. 2). El tratamiento con octreótide fue eficaz en 5 de los 10 pacientes (50 %) que no respondieron al tratamiento inicial: 3 pacientes respondieron a la dosis inicial (0,5μg/kg/min) y sólo 2 de los 7 pacientes restantes respondieron a las dosis máximas establecidas en el protocolo. No se evidenciaron disglucemia, trastornos gastrointestinales, trastornos de la función hepática, disfunción tiroidea o empeoramiento hemodinámico atribuibles al octreótide.
Un total de 17 pacientes (77 %) respondieron al tratamiento médico. La paciente 2 falleció antes de la cirugía. Los 4 pacientes sometidos a ligadura del conducto torácico (18 %) pertenecieron al grupo de postoperados de cardiopatía congénita; sin embargo, no observamos una asociación significativa entre la etiología del quilotórax y la necesidad de cirugía (p = 0,25). Sólo en 1 paciente se demostró la existencia de trombosis de la VCS; 2 pacientes requirieron de pleurodesis.
La duración del quilotórax varió entre 11 y 79 días (mediana de 20 días, rango intercuartílico entre 12,7 y 31 días). No observamos diferencias en la duración mediana del quilotórax entre los pacientes con quilotórax congénito (21 días), secundario a hernia diafragmática (22 días), o aparecido tras cirugía cardíaca (17,5 días) (p = 0,41). Tampoco observamos diferencias al comparar la duración del quilotórax entre el grupo de recién nacidos con cardiopatía congénita con el resto (p = 0,73). No se observó recidiva del quilotórax en ningún paciente al suspender el tratamiento con octreótide o iniciar la alimentación enteral.
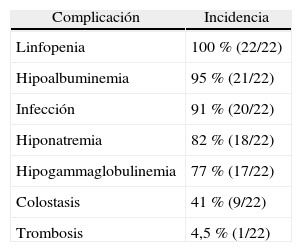
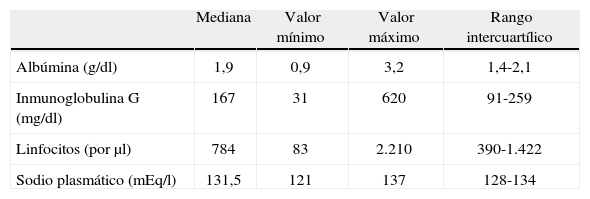
Todos presentaron alguna complicación atribuible al quilotórax (tabla 2). La infección se observó en 20 pacientes (91 %). Los gérmenes responsables fueron: Staphylococcus plasmocoagulasa negativo (n = 12), Candida (n = 6), Enterobacter (n = 3), Serratia (n = 2), Enterococcus (n = 2) y Escherichia coli (n = 1). Un total de 3 pacientes presentaron sepsis por sospecha clínica. Los valores de albúmina, IgG, linfocitos y sodio en sangre se muestran en la tabla 3. Se observó una elevada correlación entre las cifras de IgG plasmáticas con la de albúmina (Rho: 0,73; p = 0,003) y con la de linfocitos (Rho: 0,68; p = 0,004); 13 y 12 recién nacidos recibieron transfusión de seroalbúmina y gammaglobulina endovenosas, respectivamente, evidenciándose una asociación significativa entre la necesidad de transfusión de seroalbúmina y gammaglobulina endovenosas (p = 0,027). Los aportes de sodio parenteral variaron entre 3 y 25mEq/kg/día (mediana 5, rango intercuartílico 4–9mEq/kg/día). La duración total de la NPT fue mayor en los 9 pacientes que presentaron colostasis (p = 0,081); en todos la colostasis se resolvió tras la introducción de la alimentación enteral.
Incidencia de complicaciones asociadas al quilotórax observadas en nuestros pacientes
| Complicación | Incidencia |
| Linfopenia | 100 % (22/22) |
| Hipoalbuminemia | 95 % (21/22) |
| Infección | 91 % (20/22) |
| Hiponatremia | 82 % (18/22) |
| Hipogammaglobulinemia | 77 % (17/22) |
| Colostasis | 41 % (9/22) |
| Trombosis | 4,5 % (1/22) |
Valores de albúmina, inmunoglobulina G, linfocitos y sodio en sangre
| Mediana | Valor mínimo | Valor máximo | Rango intercuartílico | |
| Albúmina (g/dl) | 1,9 | 0,9 | 3,2 | 1,4-2,1 |
| Inmunoglobulina G (mg/dl) | 167 | 31 | 620 | 91-259 |
| Linfocitos (por μl) | 784 | 83 | 2.210 | 390-1.422 |
| Sodio plasmático (mEq/l) | 131,5 | 121 | 137 | 128-134 |
Un total de 5 pacientes fallecieron durante los 6 meses de seguimiento, lo que supone una mortalidad del 23% (IC 95 %: 5,2-40,2). En todos los casos el fallecimiento se atribuyó a la patología subyacente y no directamente al quilotórax; sólo la paciente 2 falleció durante el período neonatal y fue la única en quien el quilotórax estaba presente en el momento del fallecimiento.
DiscusiónEl quilotórax es especialmente frecuente en las unidades de cuidados intensivos neonatales y se ha sugerido que hasta el 50 % de todos los quilotórax ocurren durante el período neonatal. No obstante, la mayoría de estudios incluyen un reducido número de recién nacidos, lo que limita el conocimiento de su epidemiología, sus características clínicas y la posibilidad de estudiar el efecto que el tratamiento pueda ejercer sobre la historia natural de la enfermedad. Nuestra serie constituye una de las más largas publicadas hasta la fecha, lo que nos permite describir su incidencia, etiología, curso clínico y respuesta al tratamiento.
El quilotórax secundario a cirugía cardiotorácica fue el grupo etiológico más frecuente, y representaba el 86 % de los casos. La incidencia del 26,6 % tras la reparación de hernia diafragmática es similar a la comunicada hasta la fecha13, pero el 11,2 % observado tras cirugía de cardiopatía congénita es muy superior al 2,3-6,6 % reportado en series pediátricas recientes1,5,7. El diseño prospectivo, la inclusión sólo de recién nacidos (otras series incluyeron también pacientes pediátricos) y la complejidad de nuestros pacientes son explicaciones posibles de esta mayor incidencia. Curiosamente, no observamos ningún caso de quilotórax tras reparación por toracotomía de coartación de aorta o persistencia del conducto arterioso, que son causas frecuentes de quilotórax en otras series1.
El diseño y la posterior aplicación de nuestro protocolo terapéutico fue precedida por una exhaustiva revisión bibliográfica. Ésta puso de manifiesto la ausencia de estudios aleatorizados controlados que evalúen la eficacia de alguna intervención terapéutica9. La mayoría de estudios se limitan a la descripción de casos clínicos, son retrospectivos y difíciles de comparar por la heterogeneidad de los tratamientos aplicados. El presente estudio no es un ensayo clínico aleatorizado controlado, y la ausencia de controles no permite tampoco confirmar la eficacia del tratamiento. Sin embargo, todos los pacientes siguieron el mismo protocolo terapéutico y fueron seguidos de forma prospectiva, lo que nos ha permitido comparar el curso entre diferentes grupos etiológicos.
Más de la mitad de los pacientes respondieron al tratamiento inicial con NPT. La decisión de iniciar el protocolo con NPT se basó en nuestra percepción de su mayor eficacia sobre la utilización de fórmula de triglicéridos de cadena media (TCM). No existe ningún estudio aleatorizado controlado que apoye ninguna de las dos opciones y ambas tienen potenciales ventajas y desventajas. La mayoría de los protocolos terapéuticos descritos para el quilotórax congénito recomiendan NPT hasta la estabilidad clínica4,8,14,15, mientras que la actitud con el quilotórax posquirúrgico es más variable e incluye ambas opciones1,3,7,11,16. La NPT minimiza el estímulo de las secreciones gastrointestinales, pero su uso prolongado puede originar colostasis, complicaciones derivadas de la necesidad de mantener una vía intravenosa (infección, trombosis) y determinar la necesidad de controles analíticos más frecuentes14,15,17. Por ello, muchos autores sugieren mantener una dieta enteral exenta de grasas de cadena larga, que son sustituidas por TCM. Los TCM son incorporados directamente al sistema portal sin incrementar teóricamente la producción de quilo y el flujo a través del conducto torácico. Sin embargo, se ha sugerido que la simple ingestión de agua puede incrementar el flujo linfático15. Además, estudios experimentales sugieren un efecto neurotóxico de los TCM atribuido, en parte, al déficit de carnitina y que podría ser especialmente frecuente en el recién nacido pretérmino18.
El octreótide es un análogo sintético de la somatostatina que posee sus mismas propiedades terapéuticas, pero con una semivida más prolongada (1–2h frente a 2–3min)19–21. Puede administrarse por vía intravenosa (intermitente o en infusión continua), subcutánea o intramuscular. Existen marcadas variaciones en los protocolos terapéuticos que lo incluyen, tanto en el momento de iniciarlo (2–7 días tras el diagnóstico), la duración del tratamiento (3–34 días) y dosis utilizadas (0,3-10μg/kg/h)9,19. Estudios experimentales sugieren que el octreótide reduce la producción de quilo por: 1) reducción de las secreciones gástricas, pancreáticas e intestinales; 2) inhibición de la absorción intestinal de grasas e incremento de su excreción fecal, 3) vasoconstricción arteriolar esplácnica y 4) vasoconstricción de los vasos linfáticos20. Su efecto inhibidor sobre otras hormonas (hormona del crecimiento, tirotropina, insulina, glucagón, etc.) puede explicar algunos de los efectos adversos observados con su utilización19.
El octreótide fue eficaz en la mitad de los pacientes que no respondieron a NPT. Sin embargo, ninguno de los pacientes que no respondieron al tratamiento con octreótide mejoró tras las 3 semanas de NPT establecidas en el protocolo, lo que creemos que apoya una indicación más precoz de la cirugía en estos casos.
El octreótide resultó bien tolerado y no se detectó ninguno de los efectos adversos previamente descritos. Aunque la mayoría de nuestros pacientes presentaban compromiso hemodinámico, no observamos un empeoramiento del mismo durante el tratamiento con octreótide9,22. Esta buena tolerancia puede deberse a haber utilizado dosis inferiores a otros autores9.
En el 18 % de los pacientes que requirieron cirugía, ésta se indicó a partir de las 4 semanas del diagnóstico. Todos los pacientes en quienes se sospechó lesión traumática como única causa del quilotórax (hernia diafragmática y atresia esofágica) respondieron adecuadamente al tratamiento médico (4/5 con NPT y 1/5 con octreótide), mientras que todos los pacientes que requirieron cirugía pertenecieron al grupo de cardiopatías congénitas (grupo en el que el 28 % de los recién nacidos acabaron requiriendo cirugía). A pesar de la peor respuesta al tratamiento médico observada en este grupo etiológico, el tamaño de la muestra puede haber resultado insuficiente para demostrar una asociación estadísticamente significativa entre la etiología, el pronóstico y la respuesta al tratamiento. Es probable que en el grupo de recién nacidos con cardiopatía congénita se produzca una lesión directa del conducto torácico durante la cirugía y que la hipertensión venosa secundaria a la disfunción ventricular derecha u obstrucción en el territorio de la VCS contribuya a la refractariedad al tratamiento. Sólo pudimos documentar trombosis de la VCS en uno de los pacientes. La resistencia al tratamiento médico en pacientes con aumento de presion venosa ha sido descrita previamente y ha llevado a recomendar una cirugía precoz en pacientes con trombosis de la VCS1,11,12.
Las recomendaciones sobre el tipo de cirugía y el momento de indicarla son variables. Los criterios utilizados incluyen la duración prolongada (variable entre 1 y 5 semanas)10,23–25, la pérdida de quilo (> 100cc/año de edad del niño/día o > 10cc/kg/día durante 5 días)10,24,26, y la presencia de complicaciones nutricionales27. Nosotros optamos por la ligadura del conducto torácico como primera opción por la experiencia de nuestro equipo quirúrgico10. Otras opciones incluyen la pleurodesis física o química (talco, povidona yodada, etc.) y la derivación pleuroperitoneal26,28,29.
Observamos una mortalidad del 23 % tras 6 meses de seguimiento. Aunque todos los pacientes presentaron complicaciones atribuibles al quilotórax (tabla 2), en ningún caso fueron éstas las responsables directas del fallecimiento. Las complicaciones observadas fueron similares a las reportadas en otras series (tabla 2). La pérdida de linfa, la dieta absoluta y la necesidad de tratamiento invasivo (drenaje torácico, NPT, ventilación mecánica, vías) contribuyen a la elevada incidencia de complicaciones observadas en estos niños15,30. No es sorprendente que observáramos una mayor incidencia de colostasis en aquellos pacientes que recibieron NPT durante un período más prolongado. La elevada incidencia de sepsis observada en nuestra serie es superior a la comunicada previamente. Su origen es tal vez multifactorial y explicado, entre otras, por la gravedad de las enfermedades subyacentes, necesidad de tratamiento invasivo, hipogammaglobulinemia y linfopenia14. No podemos establecer la frecuencia de complicaciones trombóticas ya que sólo realizamos eco-Doppler en los pacientes refractarios al tratamiento médico; sin embargo, creemos improbable que una complicación trombótica mayor haya pasado inadvertido en los recién nacidos que evolucionaron favorablemente.
Nuestra serie incluye sólo 3 pacientes con quilotórax congénito primario, lo que no permite sacar conclusiones firmes acerca de este grupo etiológico. El quilotórax desarrollado intraútero puede causar hipoplasia pulmonar, que es la causa más frecuente de muerte perinatal, como fue el caso de la paciente 2, que falleció a pesar de la colocación intraútero de drenajes pleuroamnióticos4,14,15. Se ha sugerido un peor pronóstico en pacientes con edad gestacional inferior a 32 semanas en el momento del diagnóstico, parto antes de las 35 semanas, hydrops fetalis, cariotipo anormal o existencia de otras anomalías congénitas. La mortalidad oscila entre el 15 y el 57 %, llegando al 98 % si se asocia con hydrops fetalis1,4,14.
Nuestro estudio evidencia que el quilotórax neonatal es especialmente frecuente tras la cirugía cardiotorácica y que el tratamiento médico es eficaz en la mayoría de los casos. Aunque el tratamiento con octreótide es seguro, nuestro estudio no permite establecer con certeza ni la eficacia ni las dosis adecuadas del mismo. Es probable que deba considerarse una cirugía más precoz en aquellos pacientes que no responden a la NPT y octreótide, lo que disminuiría las complicaciones asociadas al tratamiento y a la hospitalización prolongada. Se necesitan estudios aleatorizados controlados que establezcan la eficacia de todas estas intervenciones y el momento en qué deberían aplicarse.
Queremos expresar nuestro agradecimiento al Dr. Miquel Raspall Chaure por la lectura del manuscrito.