Introducción
La púrpura de Schönlein-Henoch (PSH) es una vasculitis leucocitoclástica mediada por inmunocomplejos IgA que afecta a vasos de pequeño tamaño1. Se caracteriza por la aparición de púrpura palpable no trombocitopénica de distribución característica en miembros inferiores y nalgas, con frecuencia acompañada de artralgias, dolor abdominal y afectación renal2,3.
En 1990, el American College of Rheumatologists (ACR) estableció cuatro criterios diagnósticos para diferenciar la PSH del resto de vasculitis: edad de comienzo menor o igual a 20 años, púrpura palpable, dolor abdominal e infiltrado de neutrófilos en las paredes de arteriolas y vénulas. La presencia de dos o más criterios diferencia la PSH de otras vasculitis con una sensibilidad del 87,1 % y una especificidad del 87,7 %4. Es preciso señalar que estos criterios fueron elaborados para adultos y que en niños, la presencia de las lesiones cutáneas típicas con su distribución habitual puede ser suficiente para establecer el diagnóstico de esta enfermedad5. Recientemente la Sociedad Europea de Reumatología Pediátrica ha revisado dichos criterios y ha aprobado una modificación de los mismos según la cual para clasificar a un niño de tener una PSH se precisa uno de los cuatro siguientes: dolor abdominal difuso, depósito de IgA en una biopsia, artritis o artralgias y afectación renal, en presencia de púrpura palpable6.
La etiología de esta entidad es desconocida. La teoría más aceptada implica la interacción de un factor ambiental en un sujeto genéticamente predispuesto que desencadenaría una respuesta inmunitaria inadecuada2. Diversos agentes se han considerado posibles desencadenantes de dicha respuesta anómala, fundamentalmente infecciones y fármacos7.
En general es una enfermedad autolimitada, con una duración que varía entre 1 y 4 semanas, aunque en algunos casos se prolonga más tiempo. Ocasionalmente pueden aparecer recidivas tras meses o años del primer episodio. Las manifestaciones digestivas condicionan el pronóstico en el momento de la púrpura y las renales a largo plazo. Existen algunos estudios epidemiológicos de la PSH8-10, dos de ellos controlados11,12. El objetivo de este trabajo es investigar posibles factores asociados con el desarrollo y evolución de la enfermedad.
Pacientes y métodos
Diseño
El estudio se hizo en dos fases, en la primera se realizó un estudio caso-control. Posteriormente se llevó a cabo un estudio prospectivo de los pacientes.
Pacientes
Se incluyeron todos los niños de 2 a 16 años con PSH estudiados en las Unidades de Reumatología y Nefrología Pediátrica de un hospital terciario, desde el 1 de marzo de 2002 al 29 de febrero de 2004. Los pacientes habían sido remitidos por su pediatra o por el servicio de urgencias del hospital. Los criterios de inclusión, teniendo en cuenta los de la ACR, fueron: púrpura palpable, no trombocitopénica, de distribución característica en miembros inferiores y nalgas. Se excluyeron aquéllos cuya enfermedad llevaba más de 3 meses de evolución, en cuyo caso no podrían estudiarse adecuadamente los posibles factores infecciosos asociados, y los que tenían otra enfermedad crónica asociada.
Controles
Niños que acudieron a la consulta de Reumatología por problemas mecánicos o funcionales, durante el mismo período de tiempo.
Estudios realizados
En todos los niños, casos y controles, se realizó una exploración física completa y los siguientes estudios de laboratorio: hemograma, velocidad de sedimentación globular (VSG), proteína C reactiva (PCR), orina elemental, bioquímica básica, estudio de coagulación y determinación de inmunoglobulinas (IgG, IgA, IgM).
Para identificar posibles factores asociados con el desarrollo de PSH se elaboró una encuesta en la que se documentó la fecha de comienzo de los síntomas, los antecedentes de infección respiratoria, gastrointestinal, varicela o herpes, así como la ingesta de fármacos, durante los 3 meses precedentes. Se recogieron igualmente los antecedentes de PSH o de enfermedades reumáticas en familiares de primer grado. Así mismo se preguntó por infección por Helicobacter pylori en el paciente o familiares. Se realizó frotis faríngeo y se determinó la prevalencia, mediante serología, de virus de Epstein-Barr (VEB), citomegalovirus (CMV), parvovirus B19, Mycoplasma pneumoniae, Legionella, adenovirus y virus de la hepatitis B (VHB) y C (VHC). Se cuantificó la cifra de antiestreptolisina O (ASLO).
Para investigar factores pronósticos se recogieron de forma prospectiva en los pacientes los datos que podían indicar peor evolución: manifestaciones articulares (artralgias, tumefacción periarticular o derrame articular), digestivas (dolor abdominal, vómitos, diarrea o hemorragia digestiva) y renales (hematuria macroscópica y microscópica, proteinuria, síndrome nefrótico, insuficiencia renal e hipertensión arterial), así como la duración de los mismos. Se valoró el tratamiento instaurado, la presencia de recidivas y la necesidad de ingreso hospitalario. Se analizó la posible asociación entre estos datos y los factores epidemiológicos descritos previamente.
El tiempo mínimo de seguimiento en los enfermos fue de 3 meses si la púrpura se había resuelto y no existían alteraciones analíticas. En los casos de hematuria o proteinuria el seguimiento continuó hasta 3 meses después de su desaparición o de forma indefinida en caso contrario.
Todos los padres concedieron autorización para el estudio.
Análisis estadístico
La comparación entre los datos cualitativos se realizó mediante el test exacto de Fisher y la de los cuantitativos con la U de Mann-Whitney. La relación entre los datos cuantitativos se estudió mediante el coeficiente de correlación de Pearson. Para determinar los factores asociados de forma independiente con la enfermedad se realizó un estudio multivariante mediante análisis de regresión logística.
Resultados
Estudio caso-control: investigación de factores asociados con el desarrollo de PSH
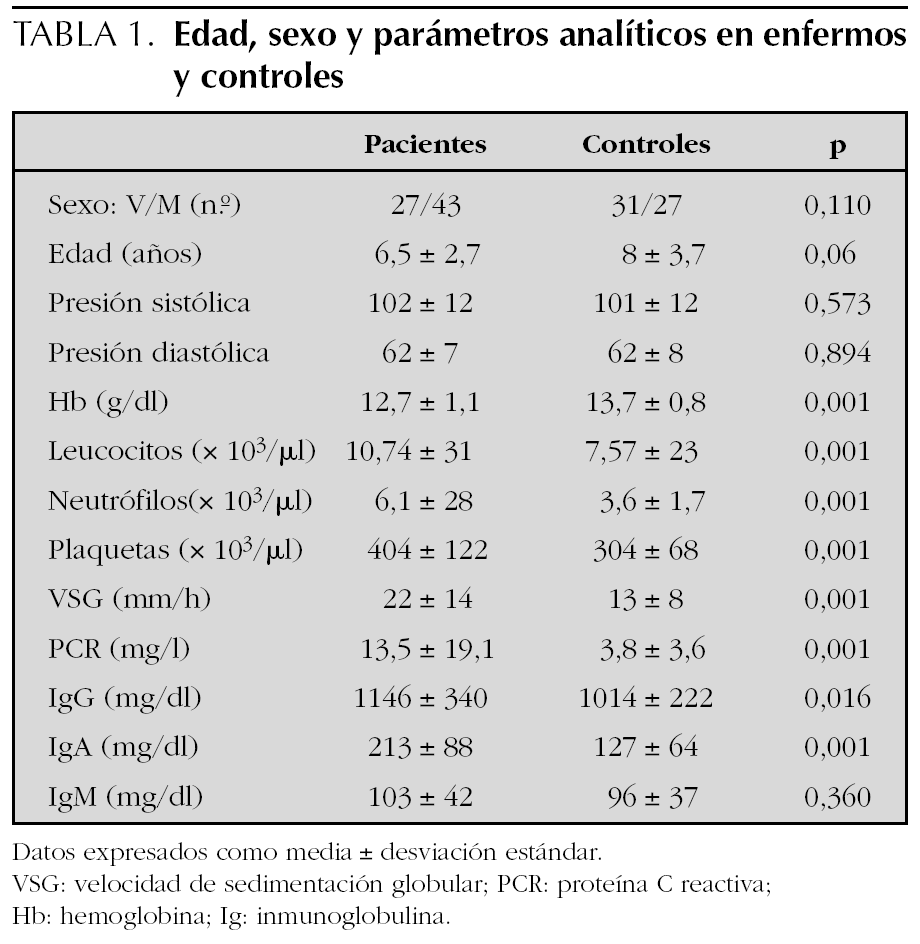
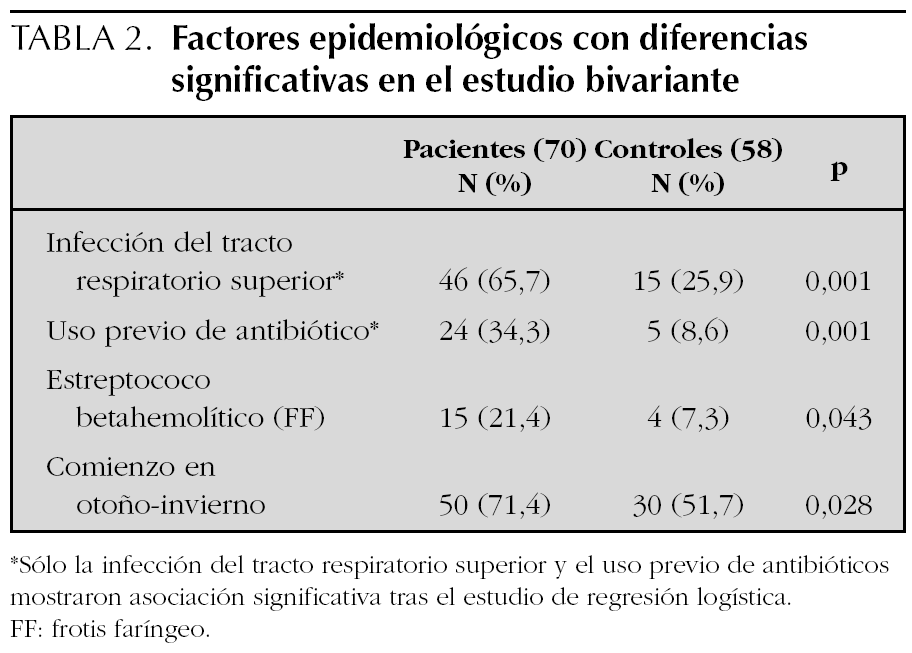
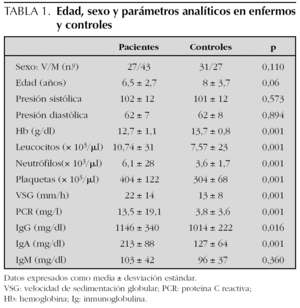
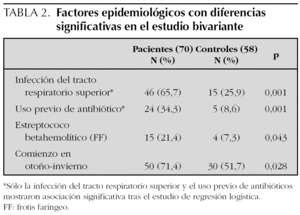
El número de pacientes fue 70 y el de los controles 58. La edad, el sexo y los parámetros analíticos principales se muestran en la tabla 1. Se encontró mayor número de varones entre los pacientes y la edad fue ligeramente menor en los mismos, pero estas diferencias no fueron estadísticamente significativas. La presión arterial fue normal en todos los niños. Los enfermos mostraron cifras algo más bajas de hemoglobina y más altas de leucocitos, neutrófilos, plaquetas, VSG y PCR, aunque estas diferencias no tenían relevancia clínica. Los niveles de inmunoglobulinas fueron más altos en los enfermos, pero dentro de parámetros normales. En el estudio bivariante, el antecedente de infección del tracto respiratorio superior (ITRS), la ingesta de antibióticos, la presencia de estreptococo betahemolítico del grupo A en el frotis faríngeo y el inicio en otoño-invierno fueron significativamente más altos en los pacientes (tabla 2). Tras el estudio multivariante de regresión logística incluyendo estas variables así como la edad y el sexo sólo la ITRS (p = 0,01; intervalo de confianza del 95 % [IC 95 %]: 1,7-9,2) y el uso previo de antibióticos (p = 0,034; IC 95 %: 1,1-12,2) se asociaban de forma independiente con el hecho de presentar una PSH. El intervalo entre la ITRS y el momento del estudio fue de 7 ± 6 días para los pacientes y de 25 ± 10 para los controles. Los antibióticos empleados habían sido amoxicilina en 14 casos, azitromicina en cinco y cefalosporinas de segunda generación en otros cinco. En todos los casos se habían indicado por una ITRS. El análisis individualizado según el tipo de antibiótico no mostró diferencias significativas.
El resto de los factores infecciosos investigados (antecedente de gastroenteritis, varicela, herpes, H. pylori, o serología positiva para virus) no mostraron diferencias significativas entre los pacientes y los controles. No existieron tampoco diferencias en los antecedentes familiares de enfermedad reumática o inflamatoria crónica. Así mismo no se encontró asociación con otras medicaciones utilizadas con anterioridad.
Estudio prospectivo de los casos: investigación de posibles factores pronósticos
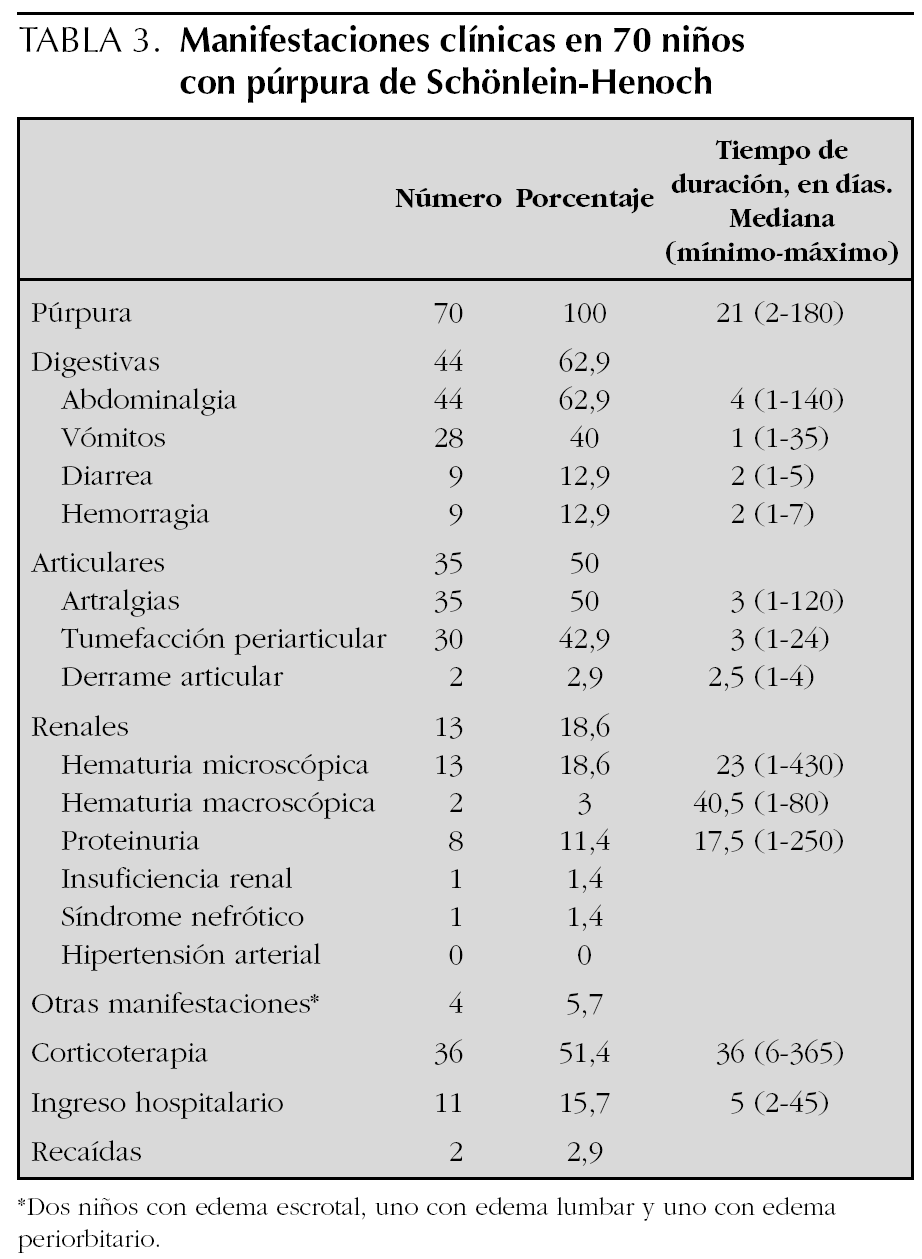
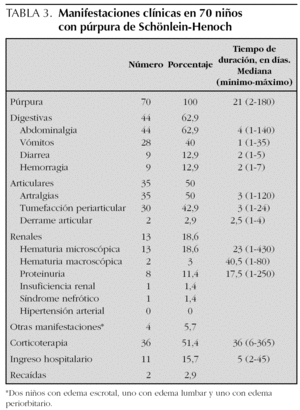
Las manifestaciones clínicas, el tiempo de duración de las mismas, así como la corticoterapia y los ingresos hospitalarios se muestran en la tabla 3. Las manifestaciones digestivas fueron las más frecuentes, presentando abdominalgia el 63 % de los pacientes, de los cuales nueve tuvieron hemorragia digestiva (rectorragia o melenas en todos y en dos además hematemesis), previo al tratamiento con corticoides en todos ellos y sólo en dos tras dosis analgésicas de ibuprofeno. Entre las manifestaciones articulares las artralgias y la tumefacción de partes blandas periarticular fueron las más comunes, objetivándose clínicamente derrame articular en sólo 2 pacientes. De los 13 niños que presentaron hematuria, en sólo cuatro persistía en la última revisión tras un período de seguimiento medio de 275 días (90-520). Los 8 pacientes que tuvieron proteinuria la negativizaron. Un niño tuvo insuficiencia renal durante 14 días que coincidió con un cuadro grave de hipovolemia por hemorragia digestiva. La biopsia renal mostró una glomerulonefritis segmentaria y focal con depósitos mesangiales de IgA y C3 y necrosis tubular aguda. Tras 2 años de evolución persiste con episodios de hematuria macroscópica asociados a ITRS. Otra niña desarrolló un síndrome nefrótico que se resolvió en 6 meses. Dos pacientes tuvieron recidivas a los 7 meses y al año del primer episodio. Se consideró recidiva la aparición de un nuevo episodio tras al menos 3 meses libre de síntomas. Un total de 36 pacientes recibieron corticoterapia en dosis medias de 1,3 mg/kg/día (0,4-2,5 mg/kg/día), en 29 casos por las manifestaciones digestivas, en cinco por la intensidad de las púrpura y en dos por nefropatía. Además, 4 niños recibieron bolos intravenosos de metilprednisolona y los pacientes con insuficiencia renal y síndrome nefrótico fueron tratados también con ciclofosfamida oral durante 2 meses, seguido en el primer caso de azatioprina que se mantiene tras 2 años de seguimiento. Un total de 13 niños ingresaron, todos con manifestaciones digestivas y seis además con alteraciones renales.
Se analizó la posible relación de variables independientes (sexo, edad, antecedente de infección respiratoria o digestiva, uso previo de antibióticos, época del año en que apareció la enfermedad, estreptococo betahemolítico en el frotis faríngeo, así como la serología positiva para los gérmenes estudiados) con parámetros de peor evolución: duración de la púrpura, existencia de manifestaciones articulares, digestivas o renales, necesidad de corticoterapia o de ingreso. Los resultados obtenidos mostraron mayor frecuencia de artralgias en las mujeres que en los varones (67 % frente a 40 %; p = 0,039). Los pacientes que presentaron la enfermedad durante primavera y verano tuvieron una duración más prolongada de la púrpura que aquellos que la presentaron durante los meses de otoño e invierno (52 días frente a 26 días; p = 0,001). El resto de los factores analizados no mostraron asociación significativa con los parámetros de peor evolución. Las cifras de plaquetas y de IgA tampoco se asociaron con ninguno de los parámetros descritos.
Discusión
La PSH es la vasculitis más frecuente en la edad pediátrica, con una incidencia que oscila según las series entre 13,5 y 20,4 casos nuevos por 100.000 niños y por año11,14. La edad media de presentación de los síntomas se encuentra entre 5 y 6 años8,9,15. La distribución según el sexo es similar con un ligero predominio de varones en algunas series9-15. Siguiendo esta tendencia, la edad media de presentación de la enfermedad en este estudio fue de 6,5 ± 2,7 años y un 61 % de los casos fueron varones, sin embargo, estos resultados no mostraron diferencias estadísticamente significativas cuando se compararon con el grupo control. Parece existir un predominio de casos en otoño e invierno8,9. En nuestra serie, aunque hubo más casos durante esas estaciones, los valores no resultaron estadísticamente diferentes tras el estudio de regresión logística.
Los datos analíticos en los pacientes revelaron cifras más altas de leucocitos, plaquetas, VSG y PCR, reflejando la naturaleza inflamatoria del proceso y probablemente la presencia de ITRS. La IgA parece desempeñar un papel fundamental en la patogenia de la enfermedad tal como revela el aumento de esta inmunoglobulina en el suero de los pacientes y los depósitos de inmunocomplejos IgA encontrados en la piel y en el glomérulo renal de estos pacientes16,17. La similitud de estos hallazgos con los encontrados en pacientes con nefropatía IgA apoyan la idea de que ambas enfermedades tengan un mecanismo patogénico común18. La PSH se ha asociado con glicosilación anómala del subtipo IgA1 a través de un mecanismo aún no aclarado19. En el presente trabajo las cifras de IgA estuvieron más elevadas en los enfermos. No se estudiaron los subtipos de IgA.
Es frecuente encontrar el antecedente de infección de vías respiratorias altas entre los pacientes con PSH11,20 El estreptococo betahemolítico es el agente infeccioso más implicado12,21,22. También se ha relacionado con M. pneumoniae, Legionella, Yersinia, H. pylori, Haemophilus parainfluenza, Bartonella henselae, así como con el virus de la varicela, VHB y VHC, rubéola, sarampión, CMV, parvovirus B19, adenovirus y VEB entre otros23-27. En el presente estudio los pacientes tuvieron ITRS en un porcentaje significativamente mayor que en los controles (65,7 % frente a 25,9 %). El estreptococo betahemolítico se encontró en mayor número de pacientes que de controles, pero estos resultados no alcanzaron significación estadística en el estudio multivariante.
Los fármacos descritos como posibles desencadenantes de la PSH son los antibióticos betalactámicos, los macrólidos y diversos analgésicos y antiinflamatorios no esteroideos7,28,29. También se han descrito asociaciones con otros fármacos de uso menos extendido como la carbamazepina, quinidina o quinina30. Además la enfermedad ha sido relacionada con diversas vacunas como fiebre tifoidea, paratifoidea A y B, sarampión, cólera, fiebre amarilla y meningococo31,32. En este estudio el uso de antibióticos se asoció de forma significativa con el desarrollo de PSH, aunque el hecho de que en todos los casos la indicación para los mismos fue una ITRS, limita el valor de estos resultados.
A diferencia de lo que describen otras series en las que la afectación articular es la alteración extracutánea más frecuente9,10,15, en este trabajo fue la digestiva (63 %). Las manifestaciones articulares aparecieron en el 50 % de los pacientes, consistentes la mayoría de las veces en artralgias y/o tumefacción periarticular. Sólo en 2 pacientes se evidenció clínicamente la existencia de derrame articular. La afectación renal ha sido analizada por Narchi33 en una revisión sistemática de la literatura especializada publicada después de realizado nuestro estudio. Este autor concluye que el 34,2 % de los pacientes tuvo hematuria o proteinuria, de los cuales sólo la quinta parte mostró otros signos de síndrome nefrítico o nefrótico. Cuando existía afectación renal ésta apareció en las primeras 4 semanas en el 85 % de los casos, en el 91 % en las primeras 6 semanas y en el 97 % en los primeros 6 meses. En nues-
tra serie el 18,6 % de los casos tuvo participación renal, sólo en dos grave, con insuficiencia renal transitoria en uno y síndrome nefrótico en otro. Ambos pacientes tuvieron hemorragia digestiva.
La disminución de la actividad del factor XIII parece relacionarse con mayor riesgo de afectación renal y síntomas digestivos34,35 y según Kamitsuji et al36, su administración disminuye las complicaciones gastrointestinales. Algunos estudios han descrito que la PSH es una enfermedad más grave en los adultos37. Sano et al35 refieren que la edad superior a 4 años al comienzo de la enfermedad, el dolor abdominal intenso con hemorragia digestiva y la púrpura persistente durante más de un mes se asociaron con afectación renal. Recientemente se ha publicado una serie española en la que la aparición de complicaciones renales se asoció al antecedente de ITRS20. En nuestro estudio la aparición de la enfermedad en primavera y verano se asoció con mayor duración de los síntomas. El resto de los estudios tratando de investigar factores pronósticos no mostró resultados positivos.
Las manifestaciones cutáneas y articulares de la PSH sólo precisan, en general, tratamiento con analgésicos o antiinflamatorios. El dolor abdominal mejora con los corticoides según la opinión de la mayoría de los expertos38,39. La hematuria o proteinuria aislada no requiere tratamiento pero sí vigilancia hasta su desaparición33. En la nefropatía grave se han publicado diversos trabajos que sugieren que la administración de corticoides e inmunosupresores pueden ser eficaces40-42. En nuestra serie, en algo más de la mitad de los casos se instauró corticoterapia, casi siempre por manifestaciones digestivas con o sin alteraciones renales y ocasionalmente por la gravedad de la púrpura. Los 2 pacientes con nefropatía grave (uno con síndrome nefrótico y otro con insuficiencia renal) recibieron pulsos intravenosos de metilprednisolona seguidos de corticoterapia oral. Así mismo en ambos se asoció terapia con ciclofosfamida oral durante 2 meses. El síndrome nefrótico se resolvió en 6 meses con normalización progresiva del sedimento en un año. El otro paciente sigue en tratamiento con azatioprina tras 2 años de evolución por episodios recidivantes de hematuria macroscópica, con función renal normal.
En resumen, este estudio pone de manifiesto la asociación de infección del tracto respiratorio superior y el uso previo de antibióticos con el desarrollo de PSH. Otros factores infecciosos no se encontraron asociados de forma significativa con el desarrollo de la enfermedad. El análisis de posibles factores relacionados con peor evolución, sólo mostró mayor duración de la púrpura cuando la enfermedad se presentó en primavera-verano. Todos los pacientes evolucionaron favorablemente, con resolución total de las alteraciones, salvo persistencia de microhematuria en 4 casos y episodios de repetición de hematuria macroscópica en uno de ellos.
Correspondencia: Dr. J. García-Consuegra Molina.
Sección de Reumatología Pediátrica. Hospital Universitario La Paz.
P.º de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: reumaped.hulp@salud.madrid.org
Recibido en agosto de 2006.
Aceptado para su publicación en diciembre de 2006.