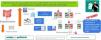
Ningún estudio ha analizado la efectividad del tratamiento del estreñimiento en niños críticamente enfermos. El objetivo de este estudio fue evaluar la implementación, la eficacia y la seguridad de un protocolo de tratamiento con polietilenglicol 3350 con electrolitos (PEG 3350+E) para el estreñimiento en niños en estado crítico.
MétodosEstudio prospectivo unicéntrico, incluyendo niños que ingresaron en cuidados intensivos pediátricos durante más de 72h y que desarrollaron estreñimiento. Se excluyeron los niños con trastornos o afecciones gastrointestinales previas. Los pacientes fueron tratados con enemas rectales o con PEG 3350+E oral a criterio del médico tratante. Se compararon variables clínicas, demográficas y efectos secundarios (diarrea, distensión abdominal y desequilibrio electrolítico).
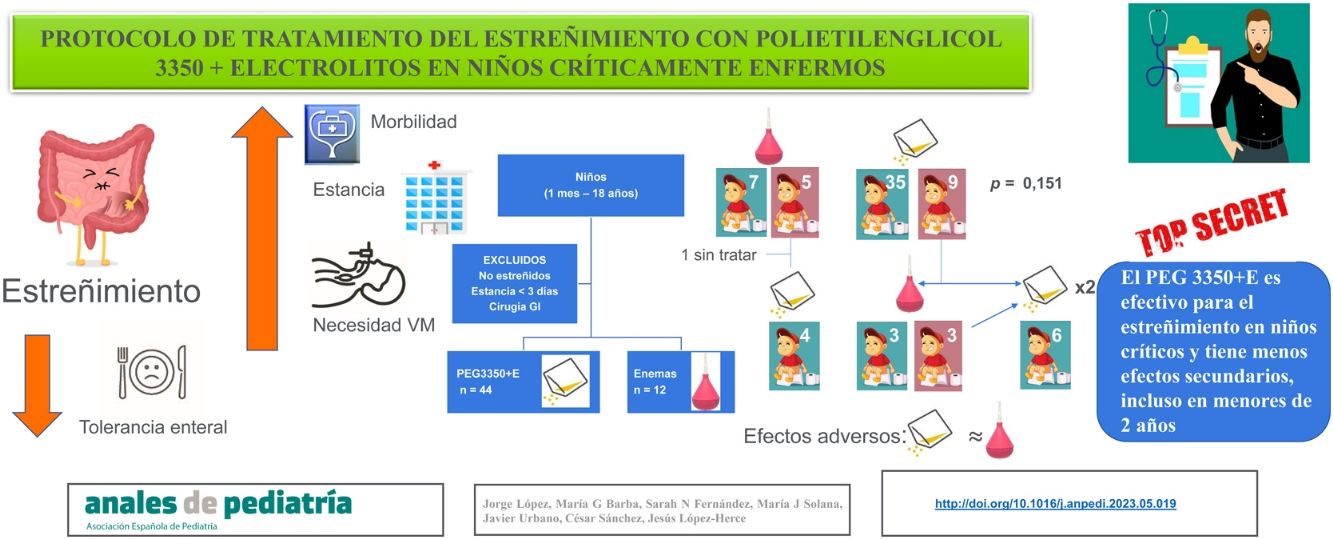
ResultadosSe estudiaron 56 pacientes de 48,2±11,9 meses de edad, siendo el 55,4% varones. Cuarenta y cuatro pacientes (78,6%) fueron tratados con PEG 3350+E y 12 pacientes (21,4%) con enemas rectales. El porcentaje de efectividad del PEG 3350+E (79,5%) fue mayor que el de los enemas (58,3%), pero la diferencia no fue estadísticamente significativa (p=0,151). No existieron diferencias significativas en ninguno de los efectos secundarios entre los 2 grupos. El PEG 3350+E fue más efectivo en los niños menores de 2 años (100%) que en los mayores de esa edad (65,4%), p<0,01, sin diferencias significativas en la aparición de efectos secundarios.
ConclusionesEl tratamiento del estreñimiento en los niños en estado crítico con PEG 3350+E es eficaz y tiene pocos efectos secundarios, incluso en niños menores de 2 años.
No studies have analysed the effectiveness of treatment for constipation in critically ill children. The aim of this study was to assess the implementation, efficacy and safety of a treatment protocol using polyethylene glycol 3350 with electrolytes (PEG 3350+E) for constipation in critically ill children.
MethodsWe conducted a single-centre prospective study in children admitted to the paediatric intensive care unit for a minimum of 72h and who developed constipation. Children with previous gastrointestinal disorders or diseases were excluded. The patients were treated with rectal enemas or with the oral PEG 3350+E protocol at the discretion of the treating physician. We compared clinical and demographic variables as well as adverse events (diarrhoea, abdominal distension and electrolyte imbalances).
ResultsThe sample included 56 patients with a mean age of 48.2±11.9 months, of who 55.4% were male. Forty-four patients (78.6%) were treated with PEG 3350+E and 12 (21.4%) with rectal enemas. The proportion of patients who responded well to treatment was greater in the PEG 3350+E group (79.5%) compared to the enema group (58.3%), but the difference was not statistically significant (P=.151). There were no significant differences between the groups in any of the adverse effects. Treatment with PEG 3350+E was more effective in children aged less than 2 years (100%) compared to older children (100% vs. 65.4%; P<.01), with no significant differences in the development of adverse events.
ConclusionsThe PEG 3350+E treatment protocol for constipation in critically ill children was effective and associated with few adverse events, even in children aged less than 2 years.
El estreñimiento es una complicación frecuente que no se ha investigado en profundidad en pacientes críticamente enfermos. Se ha relacionado con un aumento en la morbilidad, una disminución de la tolerancia enteral, y prolongación de la duración de la ventilación mecánica (VM) y de la estancia en las unidades de cuidados intensivos1–3. En los últimos años varios estudios en adultos han resaltado la importancia de establecer protocolos de profilaxis y tratamiento del estreñimiento4–7.
El estreñimiento es muy frecuente en la población pediátrica. Los criterios de Roma IV y las guías conjuntas de la European Society of Pediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) y la North American Society For Pediatric Gastroenterology, Hepatology & Nutrition (NASPGHAN) se han centrado en el estreñimiento funcional8–10, pero solo un número reducido de estudios han abordado el estreñimiento en niños críticamente enfermos, y ninguno ha analizado la utilidad de los protocolos diagnósticos y de tratamiento3,11. Además, uno de los principales obstáculos a la realización de estudios sobre el estreñimiento en pacientes críticamente enfermos, pediátricos o adultos, es que aún no se ha establecido una definición consensuada de estreñimiento agudo1,3.
En adultos críticos, el estreñimiento se maneja con los mismos tratamientos farmacológicos utilizados para el estreñimiento funcional. Los más frecuentes son el polietilenglicol (PEG), la lactulosa, los senósidos, los enemas y los aceites minerales6,7,12,13. En el caso del estreñimiento inducido por opiáceos, en los últimos años se han utilizado antagonistas periféricos de los receptores μ (metilnaltrexona y naloxegol), de los receptores μ y κ (axelopran) y de los receptores δ (bevenopran), así como agonistas serotoninérgicos como el prucalopride14–16. Estos tratamientos se han estudiado rigurosamente en adultos críticos6,7, pero no se han realizado estudios clínicos para analizar la eficacia y la seguridad de estos fármacos en el niño críticamente enfermo; solamente existen algunas publicaciones con un número escaso de pacientes17. La neostigmina, un antagonista de los bloqueantes musculares, también ha sido utilizada en algunos pacientes para revertir la ausencia de motilidad intestinal por el efecto de los bloqueantes neuromusculares18,19.
El PEG o macrogol es una molécula que no puede ser absorbida o metabolizada en el intestino, pero que puede atraer agua hacia la luz intestinal, ablandando así las heces y facilitando su eliminación20–22. El PEG, solo o combinado con electrolitos, es el fármaco más efectivo para la desimpactación y el tratamiento de mantenimiento en pacientes con estreñimiento14,23–26, y no se han observado diferencias entre las 2 moléculas disponibles para adultos13. Los resultados en niños han sido similares27, aunque los estudios comparadores en la población pediátrica son escasos y de baja calidad28,29.
El objetivo de este estudio fue evaluar la implementación, la eficacia y la seguridad de un protocolo de tratamiento con PEG 3350 con electrolitos (PEG 3350+E) para el estreñimiento en niños en estado crítico.
Pacientes y métodosTras diseñar un protocolo de tratamiento del estreñimiento en el niño crítico con PEG 3350+E, se llevó a cabo un estudio preliminar observacional prospectivo para evaluar su implementación y eficacia en un periodo de un año. El estudio se realizó en una unidad de cuidados intensivos pediátricos (UCIP) con 11 camas y 450 ingresos anuales, de los que aproximadamente el 65% son ingresos postoperatorios. El estudio fue aprobado por el Comité de Ética de nuestro hospital.
El estudio incluyó a pacientes de un mes a 18 años de edad con estreñimiento, ingresados en la UCIP durante más de 72h cuyos padres o tutores legales firmaron el consentimiento informado para su participación. Los criterios de exclusión fueron la estancia en la UCIP inferior a 72h y la presencia de alteraciones o afecciones gastrointestinales previas al ingreso que supusiesen una posible alteración del tránsito intestinal, como la cirugía abdominal o el íleo paralitico. El estreñimiento funcional no fue criterio de exclusión. El estreñimiento se definió como ausencia de deposición tras más de 3 días de ingreso en la UCIP tras haber recibido nutrición enteral (NE) completa al menos durante las 24h previas3. La NE completa se definió como el aporte por vía enteral de más del 80% de los requerimientos calóricos del paciente (en kcal/kg/día), calculados mediante la ecuación de Schofield.
Tratamiento del estreñimientoEl tratamiento del estreñimiento se realizó con enemas rectales o con PEG 3350+E por vía oral de acuerdo a las indicaciones del médico responsable del paciente. Este podía elegir el fármaco de primera elección según su criterio y, en caso de no respuesta, debía cambiar a la otra opción terapéutica (fig. 1). No se contempló la opción del PEG oral sin electrolitos para el estudio, ya que no está disponible en nuestro hospital.
El tratamiento con enemas consistió en la administración rectal de suero salino tibio (Salina Fisiológica Grifols® al 0,9%; Laboratorios Grifols SA, Barcelona, España), conforme al tratamiento habitual del estreñimiento en niños de cualquier edad. Otras opciones, como los enemas de docusato, no están indicadas para menores de 6 años en España, mientras que se recomienda evitar el uso de enemas de fosfato por el riesgo de hiperfosforemia, especialmente en niños pequeños. El volumen de los enemas fue de 5ml/kg (hasta un máximo de 250ml/enema). El número de enemas administrado cada día dependió de su eficacia, con un máximo de 2 enemas/cada 6h. Se consideró que el enema era eficaz si se producía defecación en las 2h siguientes a su aplicación. Esta opción terapéutica se consideró ineficaz cuando ninguno de los enemas consiguió la defecación en las 24h siguientes.
El PEG 3350+E se preparó diluyendo un sobre de Movicol Pediátrico® (Norgine Pharma, Rueil Malmaison Cedex, Francia) de 6,9g de PEG 3350 en 20ml de agua para niños con peso inferior a 25kg, y un sobre de Movicol® (Norgine Pharma, Rueil Malmaison Cedex, Francia) de 13,8g de PEG 3350 en 40ml de agua para los niños con peso superior a 25kg. Esta dilución (con una concentración de 0,345g/ml), realizada en un volumen de agua menor que el recomendado en la ficha técnica (un sobre en 62,5ml)30, se administró en dosis de 1ml/kg/cada 8h como tratamiento inicial (1.035g/kg/día). Se consideró que el tratamiento con PEG 3350+E era eficaz si se producía defecación en las 48h siguientes a su inicio. En caso de no ser eficaz, la dosis podía ser duplicada (2ml/kg/cada 8h) hasta un máximo de 100ml/8h en niños con un peso igual o superior a 25kg (7,5 sobres/día). Si el paciente defecaba en las primeras 48h, la dosis se reducía a 1ml/kg/día (0,345g/kg/día). Si continuaba habiendo al menos una deposición cada 48h, el tratamiento se espaciaba a 1ml/kg/48h. El tratamiento se retiraba una vez que había al menos una deposición cada 48h durante 4 días consecutivos.
Recogida de datosSe recogieron los siguientes datos: edad, sexo, peso, continencia fecal (definida como la evacuación voluntaria de heces del recto a través del ano sin episodios de fuga involuntaria de materia fecal), diagnóstico, escalas de gravedad (Pediatric Risk of Mortality III [PRISM III], Pediatric Index of Mortality 2 [PIM 2] y Pediatric Logistic Organ Dysfunction [PELOD])31–33, necesidad de técnicas de depuración extrarrenal continua (TDEC), oxigenación por membrana extracorpórea (ECMO), tratamiento con opiáceos o vasoconstrictores (adrenalina y/o noradrenalina), VM, duración de la estancia en la UCIP y mortalidad.
Durante la estancia en la UCIP, en los primeros 10 días de la aplicación del protocolo, se registró el número y las características de las deposiciones, la presencia de diarrea y distensión abdominal y los niveles de electrolitos (sodio, potasio, cloro, calcio, fósforo y magnesio) para evaluar los posibles efectos adversos del tratamiento. La diarrea se definió como más de 8 deposiciones líquidas en lactantes hasta los 3 meses, más de 4 deposiciones líquidas en lactantes de 3 a 12 meses, y más de 2 deposiciones líquidas en mayores de 12 meses.
Análisis estadísticoSe realizó un estudio específico de la eficacia y la aparición de efectos secundarios en el subgrupo de pacientes menores de 24 meses tratados con PEG 3350+E, puesto que este fármaco no estuvo aprobado en la ficha técnica para niños de 12 a 24 meses30 hasta abril de 2021.
El análisis de los datos se llevó a cabo con el paquete estadístico SPSS® versión 21,0 (IBM SPSS Statistics, Chicago, EE. UU.). Se utilizó el test de Kolmogorov-Smirnov para comprobar la normalidad de las variables. Las variables continuas se expresaron como media±2 desviaciones estándar (DS) o como mediana (rango intercuartílico [RIQ]), según su distribución fuese o no normal, y las variables categóricas como valor absoluto y porcentaje. Las variables cuantitativas se compararon con la prueba t de Student en caso de seguir una distribución normal y la prueba de medianas de Mood en caso contrario, y las categóricas mediante la prueba χ2 o la prueba exacta de Fisher según procediera. Al no tratarse de un estudio aleatorizado controlado, se desarrollaron modelos de regresión logística para controlar características basales en las que diferían los grupos de tratamiento. Los resultados se expresan como odds ratio (OR) con intervalos de confianza del 95% (IC 95%). La significación estadística se estableció en p<0,05.
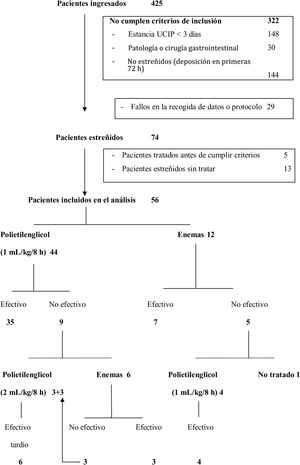
ResultadosDe los 425 pacientes ingresados durante el período de un año, 74 pacientes (17,4%) cumplían los criterios de inclusión, pero solo 56 pacientes (13,2%) fueron incluidos en el análisis. Cinco de los 74 pacientes potencialmente elegibles (6,7%) fueron excluidos porque requirieron tratamiento antes de cumplir los criterios diagnósticos de estreñimiento (3 con enemas y 2 con PEG 3350+E), que fue efectivo en todos ellos. Otros 13 pacientes (17,5%) no recibieron tratamiento a pesar de cumplir los criterios diagnósticos de estreñimiento. De estos 13 pacientes, 11 (84,6%) fueron dados de alta de la UCIP y 2 (15,4%) fallecieron sin tratamiento antes de realizar deposición, con una duración mediana de la estancia en la UCIP de 3 días (3-6) (fig. 1).
Los 56 pacientes incluidos en el análisis tenían una edad media de 48,2±11,9 meses, y 31 (55,4%) eran varones. Treinta (53,6%) tenían incontinencia fecal. Cuarenta y tres (76,8%) ingresaron en el postoperatorio de cirugía. Los motivos de ingreso fueron postoperatorio de cirugía cardiovascular en 40 pacientes (71,4%), fallo cardiaco en 7 (12,5%), enfermedad neurológica en 4 (7,1%), enfermedad respiratoria en 2 (3,6%), shock séptico en uno (1,8%), síndrome hemolítico urémico en uno (1,8%) y parada cardiorrespiratoria en uno (1,8%).
Las escalas de riesgo de mortalidad al ingreso fueron: PRISM III, 11,3% (5,4-32,2); PIM 2, 28,7% (2,5-20,1); PELOD, 1,7% (1-20,8). Cuarenta y tres pacientes (76,8%) recibieron MV durante un tiempo medio de 8 días (3-10), 52 (92,9%) requirieron tratamiento con opiáceos y 29 (51,8%) requirieron soporte vasoactivo con adrenalina o noradrenalina. Once pacientes (19,6%) precisaron TDEC y 9 (16,1%) ECMO. La duración mediana del ingreso en la UCIP fue de 16 días (10,2-30,2). La mortalidad en la muestra fue del 7,1% (4 pacientes). La nutrición enteral se inició en las primeras 48h del ingreso en UCIP en 54 pacientes (96,4%), y los 2 pacientes restantes (3,6%) recibieron nutrición parenteral esas 48h, iniciándose a continuación la NE.
El tratamiento con PEG 3350+E fue la primera elección en 44 pacientes (78,6%) y los enemas en los 12 restantes (21,4%) (fig. 1). No existieron diferencias en las características basales de ambos grupos salvo en la edad y el peso. Los pacientes tratados con PEG 3350+E eran de mayor edad y peso que los tratados con enemas (tabla 1). El PEG 3350+E tuvo un porcentaje de efectividad más alto (35/44, 79,5%) en comparación con los enemas (7/12, 58,3%), aunque la diferencia no fue estadísticamente significativa (p=0,151).
Comparación de las características de los pacientes según el grupo de tratamiento
| Variable | PEG 3350+E | Enemas | Valor de p |
|---|---|---|---|
| Características demográficas y clínicas al ingreso | |||
| Edad (meses) | 55,2±13,9 | 220,3±140,9 | 0,003 |
| Peso (kg) | 18,1±3,9 | 90,9±30,9 | 0,039 |
| Varón | 26/44 (59,1%) | 5/12 (410,7%) | 0,282 |
| Continencia | 26/44 (59,1%) | 4/12 (330,3%) | 0,113 |
| Hábito estreñido previo | 13/44 (29,5%) | 1/12 (80,3%) | 0,258 |
| Postoperatorio | 34/44 (77,3%) | 9/12 (75%) | 1 |
| Gravedad | |||
| PRISM III (%) | 10,8 (3,3-29) | 180,5 (60,1-380,6) | 0,499 |
| PIM2 (%) | 9,6 (3,1-19,2) | 4 (10,8-200,4) | 0,544 |
| PELOD (%) | 1,7 (1-20,8) | 10,7 (10,3-200,8) | 0,878 |
| TDEC | 9/44 (20,5%) | 2/12 (16,7%) | 1 |
| ECMO | 6/44 (13,6%) | 3/12 (25%) | 0,385 |
| Vasoconstrictores (adrenalina/noradrenalina) | 21/44 (47,7%) | 8/12 (66,7%) | 0,244 |
| Opiáceos | 41/44 (93,2%) | 11/12 (91,7%) | 1 |
| Ventilación mecánica | 33/44 (75%) | 10/12 (83,3%) | 0,711 |
| Duración de la VM (días) | 7,5 (2,2-10) | 9 (7,2-10) | 0,963 |
| Tiempo de estancia en la UCIP (días) | 16 (10,2-30,2) | 17,5 (8-29,5) | 0,963 |
| Mortalidad | 4/44 (9,1%) | 0/12 (0%) | 0,567 |
Las variables cuantitativas se expresan como media±2 desviaciones estándar (DE) o mediana (rango intercuartílico), dependiendo de si siguen una distribución normal o no, y las cualitativas como cociente (porcentaje).
Las diferencias significativas se presentan en negrita.
ECMO: oxigenación mediante membrana extracorpórea; PEG 3350+E: polietilenglicol 3350 con electrolitos; PELOD: Pediatric Logistic Organ Dysfunction; PIM2: Pediatric Index of Mortality 2; PRISM III: Paediatric Risk of Mortality III; TDEC: técnicas de depuración extrarrenal continua; UCIP: unidad de cuidados intensivos pediátricos; VM: ventilación mecánica.
De entre los 5 pacientes tratados con enemas y en los que estos no fueron efectivos, en 4 se inició tratamiento con PEG 3350+E, que fue efectivo en todos ellos. El paciente restante realizó deposición espontáneamente 24h más tarde (fig. 1). De los 9 pacientes tratados inicialmente con PEG 3350+E que no respondieron a este tratamiento, 6 recibieron enemas, que fueron efectivos en 3 (50%). Los 3 pacientes restantes en los que los enemas tampoco fueron efectivos y los 3 pacientes que no recibieron enemas tras el fracaso del tratamiento inicial con PEG 3350+E recibieron dosis crecientes de PEG 3350+E por indicación médica realizando deposición todos ellos entre el 7.o y el 13.o día de ingreso (fig. 1). Posteriormente todos los pacientes siguieron con un tránsito intestinal adecuado (al menos una deposición de características normales cada 48h) permitiendo el descenso de la dosis del tratamiento.
No se observaron diferencias significativas en la aparición de ningún efecto secundario entre los 2 grupos (tabla 2).
Comparación de trastornos gastrointestinales y electrolíticos en pacientes tratados con polietilenglicol y con enemas, con ajuste por edad
| Variable | PEG 3350+E | Enemas | Valor de p | ORa (IC 95%) |
|---|---|---|---|---|
| Diarrea | 18/43 (41,9%) | 2/12 (16,7%) | 0,176 | 4,14 (0,76-22,59) |
| Distensión abdominal | 7/44 (15,9%) | 4/12 (33,3%) | 0,224 | 0,36 (0,07-1,72) |
| Necesidad de suspender la NE temporalmente | 7/44 (15,9%) | 2/12 (16,7%) | 1 | 0,86 (0,14-5,3) |
| Hiponatremia (Na<130mEq/l) | 3/44 (6,8%) | 1/12 (8,3%) | 1 | 1,84 (0,15-21,99) |
| Hipocalemia (K<3mEq/l) | 14/44 (31,8%) | 3/12 (25%) | 0,738 | 1,18 (0,26-5,45) |
| Hipocloremia (Cl<96mEq/l) | 5/44 (11,4%) | 2/12 (16,7%) | 0,635 | 0,87 (0,14-5,56) |
| Hipofosforemiaa | 4/44 (9,1%) | 1/12 (8,3%) | 1 | 1,24 (0,11-13,44) |
| Hipomagnesemia (Mg<1,6mEq/l) | 8/42 (19%) | 0/12 (0%) | 0,176 | b |
| Hipernatremia (Na≥150mEq/l) | 5/44 (11,4%) | 2/12 (16,7%) | 0,635 | 1,03 (0,16-6,56) |
| Hipercalemia (K≥5,5mEq/l) | 3/44 (6,8%) | 1/12 (8,3%) | 1 | 1,66 (0,14-19,31) |
| Hipermagnesemia (Mg≥2,5mEq/l) | 7/42 (16,7%) | 2/12 (16,7%) | 1 | 1,48 (0,25-8,86) |
Variables expresadas como fracción (porcentaje).
IC: intervalo de confianza; NE: nutrición enteral; Ora: odds ratio ajustado por edad; PEG 3350+E: polietilenglicol 3350 con electrolitos.
El porcentaje de pacientes que desarrolló diarrea fue mayor en los tratados con PEG 3350+E (41,9 vs. 16,7%; p=0,176). En todos los casos la diarrea fue leve, y ninguno de los pacientes requirió tratamiento específico (salvo la reducción de la dosis de PEG 3350+E o el número de enemas) ni modificación o retirada de la NE. El porcentaje de pacientes con dolor o distensión abdominal fue mayor, aunque no de manera significativa, en el grupo tratado con enemas (33,3 vs. 15,9%; p=0,224). La distensión abdominal no fue importante y solo requirió la suspensión temporal de la NE en un paciente tratado con PEG 3350+E. En el resto de los pacientes que requirieron la interrupción temporal de la NE, el tratamiento del estreñimiento no fue la causa en ningún caso. La incidencia de alteraciones electrolíticas fue alta en ambos grupos, aunque las alteraciones no fueron graves y pudieron corregirse con ajustes mínimos del tratamiento diurético y optimizando la suplementación nutricional.
Los niños menores de 2 años presentaron una respuesta mayor al tratamiento con PEG 3350+E (100%) que los mayores de 2 años (65,4%; p<0,01). No hubo diferencias significativas en la aparición de efectos secundarios, aunque la incidencia de hipernatremia e hiperpotasemia fue mayor en los menores de 2 años (tabla 3).
Comparación de la efectividad y los efectos secundarios en pacientes tratados con PEG 3350+E por grupo de edad
| Variable | <2 años | ≥2 años | Valor de p |
|---|---|---|---|
| Efectividad | 18/18 (100%) | 17/26 (65,4%) | 0,006 |
| Diarrea | 8/17 (47,1%) | 10/26 (38,5%) | 0,576 |
| Distensión abdominal | 1/18 (5,6%) | 6/26 (23,1%) | 0,211 |
| Necesidad de suspender NE temporalmente | 2/18 (11,1%) | 5/26 (19,2%) | 0,682 |
| Hiponatremia (Na<130mEq/l) | 2/18 (11,1%) | 1/26 (3,8%) | 0,558 |
| Hipocalemia (K<3mEq/l) | 5/18 (27,8%) | 9/26 (34,6%) | 0,632 |
| Hipocloremia (Cl<96mEq/l) | 3/18 (16,7%) | 2/26 (7,7%) | 0,386 |
| Hipofosforemiaa | 2/18 (11,1%) | 2/26 (7,7%) | 1 |
| Hipomagnesemia (Mg<1,6mEq/l) | 3/17 (17,6%) | 5/25 (20%) | 1 |
| Hipernatremia (Na≥150mEq/l) | 4/18 (22,2%) | 1/26 (3,8%) | 0,142 |
| Hipercalemia (K≥5,5mEq/l) | 3/18 (16,7%) | 0/26 (0%) | 0,062 |
| Hipermagnesemia (Mg≥2,5mEq/l) | 4/17 (23,5%) | 3/25 (12%) | 0,413 |
Variables expresadas como fracción (porcentaje).
NE: nutrición enteral; PEG 3350+E: polietilenglicol 3350 con electrolitos.
Nuestro estudio es el primero que ha evaluado la implantación de un protocolo de tratamiento del estreñimiento en el niño críticamente enfermo y ha analizado la efectividad y la seguridad del PEG 3350+E.
El inicio precoz de la nutrición enteral y una vigilancia activa del tránsito intestinal que permita instaurar el tratamiento del estreñimiento, si se requiere, son aspectos esenciales para prevenir los efectos secundarios del estreñimiento3–7,11. A pesar de ello, de los 74 pacientes identificados como potencialmente estreñidos, 18 (24,3%) fueron incorrectamente tratados por exceso o por defecto (fig. 1), lo que subraya la dificultad de intentar cambiar la práctica clínica habitual y la necesidad de establecer un seguimiento continuo de la aplicación de los nuevos protocolos4,5. A nuestro parecer, la existencia de un protocolo de tratamiento del estreñimiento hace que el personal sanitario esté más atento a este problema. Esto puede permitir la iniciación precoz del tratamiento cuando sea necesario, lo que podría reducir las complicaciones del estreñimiento.
Nuestros datos muestran que tanto el PEG 3350+E como los enemas rectales consiguen que un porcentaje importante de los niños críticamente enfermos realicen deposición. El porcentaje de pacientes que respondieron al PEG 3350+E fue mayor que el conseguido con los enemas, aunque las diferencias no alcanzaron significación estadística. El número de pacientes tratado con enemas fue muy escaso y son necesarios estudios más amplios para poder comparar su eficacia.
En niños con estreñimiento funcional, el PEG con o sin electrolitos ha mostrado una eficacia mayor que otros laxantes orales28,29. En cambio, en otros estudios los enemas se mostraron relativamente superiores en comparación con el PEG, sin diferencias significativas20,22,34. Una ventaja adicional del PEG es su posible administración por vía oral o enteral, que es más fácil y cómoda para el paciente y el personal sanitario que la administración de enemas por vía rectal.
No se conoce cuál es la dosis de PEG más adecuada en niños. La dosis de PEG 3350+E utilizada en nuestro estudio (1g/kg/día) se encontraba en el límite inferior de la recomendada por algunos autores35 y era inferior a los 1,5g/kg/día utilizados por Bekkali et al.20.
Los enemas fueron utilizados en niños de menor edad, probablemente porque los médicos a su cargo se sentían más cómodos prescribiendo enemas en los más pequeños y/o porque el PEG350+E no estaba autorizado para el uso en lactantes. No obstante, en nuestro estudio se utilizó el PEG 3350+E en niños con edades de hasta 2 meses (fuera de ficha técnica)30, con una efectividad superior y sin aumento en la incidencia de eventos adversos. También se empleó un volumen de agua inferior al recomendado en la ficha técnica30 debido a la necesidad de restricción hídrica en muchos de nuestros pacientes, lo que no parece haber disminuido la efectividad del PEG 3350+E con respecto a otros estudios20,22,25–29.
Efectos secundariosEn nuestro estudio no se han encontrado efectos secundarios importantes relacionados con el tratamiento del estreñimiento. La diarrea es el efecto secundario más frecuente de los fármacos laxantes20–22. La incidencia de diarrea en los pacientes tratados con PEG 3350+E fue alta (41,9%), pero esta fue leve, autolimitada y no afectó a la tolerancia enteral, como se había descrito en adultos críticamente enfermos6. La distensión y el dolor abdominal también han sido descritos con ambos fármacos, aunque más asociados al uso de enemas20. En nuestro estudio el porcentaje de distensión abdominal también fue elevado en los pacientes tratados con enemas (33,3%), aunque no tuvo repercusión clínica.
En los niños menores de 2 años tratados con PEG 3350+E, el porcentaje de hipercaliemia e hipernatremia fue más elevado, aunque sin diferencias significativas. Aunque no se pudo establecer claramente una relación causal con el tratamiento, recomendamos realizar un seguimiento estricto de los niveles de electrolitos en los niños críticos más pequeños tratados con PEG 3350+E.
LimitacionesLa principal limitación del presente estudio es que no se trataba de un ensayo aleatorizado controlado y que carecía de un grupo de control sin tratamiento. En base a los resultados de estudios previos sobre las repercusiones del estreñimiento en niños críticamente enfermos3, no consideramos apropiado realizar un ensayo clínico con un grupo de control sin tratamiento. Por lo tanto, optamos por realizar un estudio preliminar observacional para analizar la eficacia del protocolo con laxantes orales.
En segundo lugar, el número de pacientes tratados inicialmente con enemas fue demasiado bajo para que la comparación estadística pudiera encontrar diferencias significativas, y la diferencia de edad y peso podría haber introducido un sesgo en la comparación de la eficacia. Aun así, la comparación realizada nos ha permitido obtener una idea general de la eficacia y los efectos secundarios de ambos tratamientos.
Además, no hay una definición ampliamente aceptada del estreñimiento en pacientes críticos3,36,37.
Por último, el estudio se llevó a cabo en un único centro, y la mayoría de la muestra consistía en pacientes postoperatorios de alta complejidad, por lo que son necesarios estudios adicionales para evaluar la validez externa de nuestro protocolo de tratamiento en otros tipos de niños críticamente enfermos.
ConclusionesNuestros resultados muestran que el protocolo de tratamiento del estreñimiento en los niños en estado críticos con PEG 3350+E es eficaz y tiene pocos efectos secundarios, incluso en niños menores de 2 años. Los resultados obtenidos con PEG 3350+E no fueron inferiores a los conseguidos con enemas rectales.
Este estudio preliminar podría servir de base a futuros ensayos clínicos aleatorizados y controlados para analizar la eficacia y seguridad en muestras más amplias, lo que permitiría desarrollar protocolos diagnósticos y terapéuticos para el manejo del estreñimiento en el niño críticamente enfermo. También se necesitan estudios sobre la eficacia y la seguridad del tratamiento precoz en niños críticos con riesgo alto de estreñimiento.
FinanciaciónEl estudio no recibió fondos específicos de agencias financiadoras públicas, privadas o sin ánimo de lucro.
Proyecto Primary Care Interventions to Prevent Maternal and Child Chronic Diseases of Perinatal and Development Origin Network (RICORS) (RD21/0012/0011), Instituto de Salud Carlos III, Madrid, España (sin asignación de fondos de ayuda).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a José María Bellón por su inestimable ayuda en el análisis estadístico. También a Rocío García, Andreina Ferreira y Tatiana Vilchez por su ayuda con la edición médica en inglés.