Informar acerca del proceso y de los resultados del primer consenso clínico neonatal de la región iberoamericana.
Diseño y métodosDos expertos reconocidos en el área (los Dres. Clyman y Van Overmeire) y 45 neonatólogos de 23 países fueron invitados a participar y a colaborar. Se desarrollaron 46 preguntas de importancia clínico-fisiológica sobre la totalidad de los aspectos del ductus arterioso permeable (DAP). Las pautas para el proceso del consenso, la búsqueda de la bibliografía y la futura preparación de material educativo y autoría fueron descritas, revisadas y acordadas por todos los participantes. Los expertos de diferentes países fueron distribuidos en grupos, y asignados para interactuar y trabajar conjuntamente para responder a las 3-5 preguntas, revisando la totalidad de la bibliografía globalmente y los factores locales. Las respuestas y los resúmenes fueron recibidos, cotejados y revisados por 2 coordinadores y los 2 expertos. Los participantes y los expertos se reunieron en Granada, España, durante 4,5 h (con conferencias de expertos, presentaciones por grupos y discusión de toda la bibliografía de la que se disponía).
ResultadosParticiparon 31 neonatólogos de 16 países. Las presentaciones de cada grupo y la discusión general se utilizaron para desarrollar un consenso en el que se consideraron: tratamiento general, disponibilidad de fármacos (indometacina frente a ibuprofeno), costes, indicaciones para eco/cirugía, etc. En este foro de cooperación, los participantes aprendieron numerosos aspectos del tratamiento de esta entidad.
ConclusionesEste primer grupo de consenso de neonatólogos iberoamericanos de SIBEN llevó a la participación activa y cooperativa de neonatolólogos de 16 países, mejoró la educación de todos los participantes y finalizó desarrollando un consenso sobre los enfoques clínicos del DAP. Además, indica recomendaciones para el cuidado clínico a las que se ha llegado mediante consenso. Asimismo, servirá como una base útil para futuros consensos de SIBEN en otros temas y podría llegar a ser un valioso modelo para disminuir la disparidad en el cuidado y mejorar los resultados en esta y en otras regiones.
To report the process and results of the first neonatal clinical consensus of the Ibero-American region.
Design and methodsTwo recognized experts in the field (Clyman and Van Overmeire) and 45 neonatologists from 23 countries were invited for active participation and collaboration. We developed 46 questions of clinical-physiological relevance in all aspects of patent ductus arteriosus (PDA). Guidelines for consensus process, literature search and future preparation of educational material and authorship were developed, reviewed and agreed by all. Participants from different countries were distributed in groups, and assigned to interact and work together to answer 3-5 questions, reviewing all global literature and local factors. Answers and summaries were received, collated and reviewed by 2 coordinators and the 2 experts. Participants and experts met in Granada, Spain for 4.5h (lectures by experts, presentations by groups, discussion, all literature available).
Results31 neonatologists from 16 countries agreed to participate. Presentations by each group and general discussion were used to develop a consensus regarding: general management, availability of drugs (indometacine vs. ibuprofen), costs, indications for echo/surgery, etc. Many steps were learnt by all present in a collaborative forum.
ConclusionsThis first consensus group of Ibero-American neonatologists SIBEN led to active and collaborative participation of neonatologists of 16 countries, improved education of all participants and ended with consensus development on clinical approaches to PDA. Furthermore, it provides recommendations for clinical care reached by consensus. Additionally, it will serve as a useful foundation for future SIBEN Consensus on other topics and it could become valuable as a model to decrease disparity in care and improve outcomes in this and other regions.
La enseñanza, la formación y los logros conseguidos en la neonatología en los países de habla hispana y portuguesa han sido muy dispares a lo largo de los últimos 15 años. En el año 2004 se creó la Sociedad Iberoamericana de Neonatología (SIBEN), con el objetivo principal de contribuir a mejorar la calidad de vida de los recién nacidos y de sus familias en la población iberoamericana. SIBEN es una sociedad nueva, con miembros de 25 países. La utilidad de una Sociedad basada en la neonatología, según se ha fundamentado en su visión y en su misión, es facilitar la educación, la comunicación y el avance de los profesionales que contribuyen al bienestar del recién nacido y de su familia, para mejorar los resultados neonatales en la región1.
En los últimos años se ha observado que los procesos de consenso médico pueden ser una vía para aumentar la colaboración profesional y también la uniformidad en los cuidados recibidos por los pacientes.
El ductus arterioso persistente (DAP) es un problema frecuente y complejo en los recién nacidos pretérmino. Es el más común de los defectos cardíacos en neonatos y se produce en el 60 % de los niños con menos de 28 semanas de edad gestacional2–4. El DAP está relacionado con la morbimortalidad de los recién nacidos prematuros y es improtante desde el punto de vista de la salud pública debido al desarrollo de unidades de cuidados intensivos neonatales en Iberoamérica y a las controversias en el tratamiento médico y quirúrgico.
Considerando estos tres puntos, se procedió a organizar el Primer Consenso Clínico SIBEN sobre DAP. El Grupo de Consenso, integrado por un grupo de neonatólogos de diferentes países de Iberoamérica (Consenso SIBEN), trabajó durante varios meses con una metodología intensa y colaboradora, y se reunió en Granada, España, durante el XII Congreso Nacional de Medicina Perinatal (SEN), IV Congreso Iberoamericano de Neonatología (SIBEN) y II Congreso de la Sociedad Española de Medicina Perinatal (SEMP), en octubre de 2007.
El objetivo de este trabajo es presentar los resultados de este primer consenso clínico neonatal de la región iberoamericana con respecto a múltiples aspectos del ductus arterioso, clínicos, diagnósticos y terapéuticos. Se espera que la presentación de datos y las recomendaciones del consenso SIBEN contribuyan a aunar criterios de los cuidados. La finalidad es disminuir la brecha entre el conocimiento y lo que recibe cada recién nacido en la región, disminuyendo así la disparidad en los cuidados recibidos y mejorando los resultados a largo plazo.
MÉTODOSA partir de comienzos del año 2007, el Dr. Augusto Sola inicia la idea de desarrollar “Consensos Clínicos de SIBEN”. A partir de marzo de 2007, los Dres. Sergio G. Golombek y Augusto Sola convocaron a los Dres. Ron Clyman (Universidad de California en San Francisco) y Bart van Overmeire (de Amberes, Bélgica), expertos mundiales en el tema, a ser “líderes de opinión” para el primer grupo de consenso clínico de SIBEN. También convocaron a 71 pediatras neonatólogos de 23 países del área iberoamericana. De los médicos convocados, 27 aceptaron participar; éstos, junto con los directores e investigadores principales y los 2 expertos, suman un total de 31 médicos de 16 países. La lista de integrantes del grupo de consenso, autores de este trabajo, se encuentra al final del manuscrito, junto con los países representados. Los métodos del consenso fueron los siguientes:
- 1.
Elaborar consensuadamente una guía y recomendaciones sobre todos los temas de relevancia clínica relacionados con el DAP en el recién nacido pretérmino.
- 2.
Durante un período de 4 meses se realizaron los siguientes pasos:
- a)
Formación de un grupo de neonatólogos de diversos países de la región iberoamericana.
- b)
Asignación de subgrupos y trabajo de colaboración de cada subgrupo.
- c)
Conferencias por parte de los 2 expertos.
- d)
Presentación de las conclusiones del estudio realizado por cada subgrupo.
- e)
Discusión de los integrantes del grupo de consenso clínico de SIBEN.
- f)
Planificación de la amplia difusión del documento final del consenso alcanzado por un método activo, de colaboración y de participación.
- a)
Todos los integrantes de este primer consenso clínico SIBEN firmaron, antes de participar, un acuerdo de confidencialidad, de derechos intelectuales, de autoría y de conflicto de intereses, el cual también se utilizará para los próximos grupos de consenso de SIBEN que se planean para el futuro.
Trabajo de subgruposLos directores del consenso elaboraron un listado de numerosas preguntas de relevancia clínica y las dividieron entre 10 subgrupos de 3–4 neonatólogos de diferentes países. Cada subgrupo trabajó durante 3 meses en las preguntas asignadas y no conocieron las cuestiones remitidas a los demás subgrupos. Los integrantes de cada uno de ellos trabajaron en colaboración en la búsqueda completa de la bibliografía correspondiente y en su análisis extenso. La problemática local o regional específica también fue investigada por cada subgrupo cuando se consideró necesario. Las respuestas con la bibliografía fueron enviadas en septiembre de 2007, 1 mes antes de la reunión del consenso clínico de SIBEN en Granada.
Reunión del grupo de consenso durante el Congreso de Granada, España (5-10-2007)Los Dres. Clyman y Van Overmeire dictaron tres conferencias y posteriormente un representante de cada subgrupo presentó sus respuestas y recomendaciones, a las que siguieron períodos de discusión con preguntas, respuestas y diálogos entre los participantes en búsqueda del consenso. Desde antes de realizar éste, estaba claro que iba a ser posible que en algunos temas el documento final pudiera contener conceptos como: “imposible recomendar a «ciencia cierta», pero a la luz de los conocimientos actuales la recomendación del grupo de consenso de SIBEN es…”, o bien que para algunos temas hubiera un “consenso principal” y una “segunda alternativa del consenso”.
Este manuscrito estuvo sujeto a cuatro revisiones realizadas por todos los integrantes del consenso. En el texto se enuncian las preguntas y las respuestas pertinentes acordadas por el grupo de consenso. Para completar el manuscrito se realiza a modo de conclusión una lista abreviada de las recomendaciones consensuadas.
RESULTADOSEn este apartado se describen con detalle las preguntas formuladas y las respuestas alcanzadas por consenso de todos los participantes según la metodología descrita, con el acuerdo de los 2 expertos y líderes de opinión.
Definición inicialEl tema fundamental de este grupo de consenso es el de la comunicación entre las arterias aorta y pulmonar con un cortocircuito de izquierda a derecha en recién nacidos pretérmino a través del conducto arterial, si bien el shunt puede ser muy escaso o bidireccional. Este consenso no analiza el cortocircuito de derecha a izquierda a través del ductus, ya que no es un DAP. Cuando el ductus se mantiene abierto y el cortocircuito es de derecha a izquierda (con hipoflujo pulmonar), la fisiopatología y la clínica son completamente diferentes y el tratamiento clínico también lo es.
En diferentes regiones de Iberoamérica se utiliza una terminología variable en la que se incluyen expresiones como “persistencia del conducto, ductus arteriosus, conducto permeable, ductus (o ducto) arterioso patente y ductus (o ducto) arterioso permeable”. En este consenso, para “unificar la terminología”, se usará la expresión DAP. No existe consenso uniforme sobre el período exacto de exposición al DAP para considerarlo como un DAP persistentemente prolongado (DAP-PP). Algunos expertos consideran que DAP-PP es el que se mantiene durante más de 14 días y otros lo consideran cuando está presente durante más de 21 días.
1Recién nacidos de alto riesgo para desarrollar un DAP y un DAP persistentemente prolongado (DAP-PP)El DAP es una alteración en la adaptación del recién nacido prematuro al medio extrauterino, el más común de los defectos cardiocirculatorios en neonatos retérmino. El recién nacido pretérmino, con un peso inferior a 1.500g, presenta una alta incidencia de DAP2,4–6. Los recién nacidos de más alto riesgo de desarrollar un DAP son los recién nacidos pretérmino con síndrome de distrés respiratorio (SDR)7.
La incidencia global en recién nacidos pretérmino es del 50–70%8, y es más frecuente cuanto menor es la edad gestacional. Se ha estimado que el DAP ocurre en el 53% de los recién nacidos de menos de 34 semanas de gestación, y en más de 65 % de recién nacidos de menos de 26 semanas9–11. El DAP afecta a aproximadamente el 80% de los recién nacidos pretérmino de extremado bajo peso (< 1.000g), a alrededor del 45 % de los niños con un peso al nacer inferior a 1.750g y sólo a uno de cada 5.000 recién nacidos a término3,12.
Algunos factores afectan a la incidencia. Por ejemplo, el tratamiento prenatal con esteroides disminuye la incidencia de DAP13. A la inversa, la exposición prenatal a sulfato de magnesio se asocia con un alto riesgo de DAP en el recién nacido pretérmino14, así como también la fototerapia15, la diabetes materna, la hemorragia preparto y el embarazo múltiple10.
No cabe duda de que numerosos recién nacidos pretérmino tienen un DAP no significativo que se cierra de forma espontánea, sin consecuencias. En los recién nacidos pretérmino sanos, cuando el DAP se cierra espontáneamente lo hace en un período de tiempo similar al de los recién nacidos a término16,17. En los demás recién nacidos pretérmino existe una amplia variabilidad de la frecuencia de cierre espontáneo y del momento en el que éste se produce, si es que se produce18. También hay muchos recién nacidos pretérmino enfermos en quienes el DAP sintomático no se cierra, ni siquiera con tratamiento médico. En recién nacidos de menos de 26 semanas sólo en el 36 % el DAP se cerró espontáneamente y esto ocurrió en los más maduros, con mayor prevalencia de administración de corticoides prenatales, retraso del crecimiento intrauterino e hipertensión materna, y con menos SDR19. El diámetro ductal precoz predice la persistencia del DAP y la falta de cierre espontáneo20,21. Se ha predicho la constricción ductal a las 5h de vida, si el diámetro es inferior a 1,6 mm18. Los recién nacidos con riesgo de desarrollar un DAP-PP son todos aquellos que tienen los riesgos mencionados para DAP y además presentan: a) DAP precoz, no tratado; b) DAP precoz tratado médicamente pero sin respuesta y sin cirugía o con cirugía tardía, y c) DAP más tardío, no tratado o tratado médicamente pero sin respuesta y sin cirugía o con cirugía tardía.
2Diagnóstico de ductus y de ductus hemodinámicamente significativoEl concepto de DAP hemodinámicamente significativo (HS) es algo “amplio”. Un DAP-HS es aquel que, en general, es sintomático (tabla 1), pero puede no serlo, y en el que se demuestra en el ecocardiograma Doppler que existe un cortocircuito de izquierda a derecha importante a través del DAP22,23. Los signos clínicos no son de gran valor para diagnosticar un DAP en forma precoz24. La sensibilidad y la especificidad del soplo cardíaco superan el 90 % sólo después de 6 días. Además, la presión diferencial o de pulso no es diferente estadísticamente en los recién nacidos con DAP-HS22,25. Estos datos demuestran que puede llevarse a cabo el diagnóstico de DAP dependiendo exclusivamente de los signos físicos, pero el diagnóstico será tardío. Por supuesto, si todos los signos clínicos que se resumen en tabla 1 están presentes, el diagnóstico clínico de DAP es sencillo. Sin embargo, cuando esto sucede, el DAP ya ha afectado más o menos seriamente al recién nacido. De ahí el valor de la ecocardiografía. Se ha estimado que cuando el diámetro del DAP es superior a 1,5mm, la relación flujo pulmonar/flujo sistémico es superior a 1,5 y cuando el diámetro es superior a 2,0mm, dicha relación es superior a 2 a 1. En la tabla 2 se exponen los hallazgos ecocardiográficos de un DAP hemodinámicamente significativo, cuya gravedad puede ser clasificada por expertos26.
Signos clínicos de DAP (la ausencia de muchos de ellos no lo descarta)
| Taquicardia |
| Precordio hiperdinámico |
| Empeoramiento del estado respiratorio |
| Taquipnea |
| Episodios de apnea |
| Cardiomegalia |
| Caída o disminución de presión arterial media |
| Soplo sistólico in crescendo |
| Pulsos pedios y/o palmares saltones |
| Imposibilidad de disminuir oxígeno |
| Dependencia de CPAP o ventilación |
| Acidosis metabólica |
| Hepatomegalia |
| Hipotensión diastólica |
| Aumento de la presión diferencial (presión del pulso) > 25–30 mmH |
CPAP: presión positiva continua a las vías aéreas; DAP: ductus arterioso persistente.
Ecocardiografía en el DAP hemodinámicamente significativo
| Cortocircuito de izquierda a derecha por Doppler |
| Gasto ventricular derecho disminuido en las primeras 24h |
| Bajo flujo en la vena cava superior |
Signos de magnitud importante
|
DAP: ducto arterioso persistente; Qp/Qs: relación flujo pulmonar a flujo sistémico.
La falta de mejoría respiratoria, sin ningún otro signo clínico, en un recién nacido pretérmino que recibe presión positiva continua a las vías aéreas (CPAP) o ventilación mecánica intermitente puede deberse a un DAP-HS visible por ecocardiografía (ECO)17,22–24. El DAP de gran tamaño y con flujo de izquierda a derecha elevado se asocia con serias complicaciones (tabla 3) y, además, incrementa el riesgo de presentación de procesos infecciosos27.
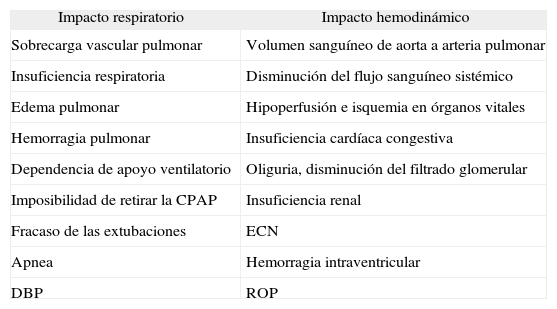
Morbilidades asociadas con el cortocircuito de izquierda a derecha a través del DAP
| Impacto respiratorio | Impacto hemodinámico |
| Sobrecarga vascular pulmonar | Volumen sanguíneo de aorta a arteria pulmonar |
| Insuficiencia respiratoria | Disminución del flujo sanguíneo sistémico |
| Edema pulmonar | Hipoperfusión e isquemia en órganos vitales |
| Hemorragia pulmonar | Insuficiencia cardíaca congestiva |
| Dependencia de apoyo ventilatorio | Oliguria, disminución del filtrado glomerular |
| Imposibilidad de retirar la CPAP | Insuficiencia renal |
| Fracaso de las extubaciones | ECN |
| Apnea | Hemorragia intraventricular |
| DBP | ROP |
CPAP: presión positiva continua a las vías aéreas; DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; ECN: enterocolitis necrosante; ROP: retinopatía de la prematuridad.
Las consecuencias clínicas del DAP-HS se relacionan con el descenso del gasto cardíaco secundario al cortocircuito de izquierda a derecha (tablas 2 y 3). La distribución del flujo sistémico está alterada por la disminución en la presión diastólica y la vasoconstricción arteriolar reactiva por disminución del gasto cardíaco. Esto da como resultado una reducción de la perfusión, que contribuye a la aparición de algunas morbilidades que se asocian con el DAP28–31 (tabla 3).
No siempre es fácil precisar con exactitud si la morbilidad asociada con el DAP se debe al cortocircuito de izquierda a derecha, al tratamiento utilizado para cerrarlo, a la inmadurez propia del recién nacido o a alguna combinación de los anteriores32. Sin embargo, la evolución natural de un DAP-HS sin tomar medidas para cerrarlo o si se demora su cierre es una mayor morbilidad y puede resultar perjudicial33–37.
4Riesgos del DAP-PP. Asociación de DAP-PP con morbilidadesAun en casos en los que el DAP no resulte hemodinámicamente significativo, su presencia conlleva un riesgo asociado de infección endovascular y de tromboembolia38. Los niños prematuros en quienes el DAP se prolonga más de 2 semanas ganan menos peso, tardan más en alcanzar una nutrición enteral completa y requieren más días de ventilación mecánica19. En un estudio de cohortes, los recién nacidos con DAP-PP estuvieron más días recibiendo asistencia respiratoria mecánica y oxígeno, y presentaron una mayor incidencia de displasia broncopulmonar (DBP) grave, retinopatía de la prematuridad (ROP), enterocolitis necrosante (ECN), días de nutrición parenteral, colestasis, osteopenia y desnutrición19,34. La estancia en el hospital también es más prolongada y los paicentes requieren, con mayor frecuencia, oxigenoterapia en el momento del alta7,34,38,39.
5Cuándo tratar un DAP-HS. Evitar que se establezca un DAP-PPLa persistencia del DAP se ha asociado con descompensación aguda y prolongación de la asistencia ventilatoria en múltiples referencias publicadas desde 197240–45. Varios estudios también demuestran una mejoría significativa de la función pulmonar y de parámetros ventilatorios en recién nacidos con SDR tras el cierre del DAP46–49, y las alteraciones cardiovasculares y del flujo sanguíneo cerebral, mesentérico y renal también revierten tras su cierre33,50.
Basándose en la bibliografía revisada, un DAP-HS siempre debe tratarse para evitar de esta forma la aparición de complicaciones que no sólo incrementan la morbilidad, muchas vinculadas a alteraciones importantes del neurodesarrollo, sino que también son potencialmente letales32,51
Los casos con repercusión clínica tratados con inhibidores de la ciclooxigenasa (indometacina e ibuprofeno) evolucionan con menores requerimientos de oxígeno y ventilación mecánica y, por tanto, con un menor riesgo de DBP e incluso con una menor incidencia de ROP52.
La presencia de un DAP podría no ocasionar problemas en algunos prematuros, como ocurre en algunos recién nacidos a término que mantienen el DAP durante varios meses. Sin embargo, la repercusión hemodinámica que el DAP tiene sobre diferentes órganos, más importante cuanto más prematuro y más enfermo esté el recién nacido, obliga a plantear su cierre para evitar la morbilidad asociada. No es fácil definir qué es un recién nacido pretérmino “sano” con DAP. Si un recién nacido pretérmino está en tratamiento con CPAP, o ésta no se le puede retirar, o requiere restricción hídrica o de nutrientes, o requiere oxigenoterapia adicional, no es un recién nacido “sano”. Si en éstos o en otros recién nacidos pretérmino aún más enfermos el DAP no es tratado, existe el elevado riesgo de que el ductus no se cierre y de que se establezca un DAP-PP. Por supuesto, si el recién nacido está conectado a un respirador y empeora o los parámetros no pueden ser disminuidos, la causa puede ser un DAP. Las evidencias de las que se dispone en la actualidad, si bien no son definitivas, indican que en estos recién nacidos con estas situaciones clínicas no debe dejarse abierto el ductus, por el alto riesgo de DAP-PP y por sus potenciales morbilidades asociadas.
En definitiva, un DAP de más de 3 semanas aumenta los riesgos5,12,27,34,36,53–57. Todos los integrantes de este consenso, excepto uno, recomiendan que debe intentar lograrse que un DAP-HS se cierre antes de las primeras 2 semanas de vida, para evitar el DAP-PP. Lo mismo se recomienda frente a un DAP en recién nacidos inmaduros enfermos.
6¿Debe ser dado de alta un recién nacido con DBP grave que requiere oxígeno si tiene un DAP-PP/DAP-HS? ¿A quién? ¿Por qué?La persistencia del DAP-PP puede asociarse con problemas serios, como ya se ha comentado. Si un recién nacido con DAP-PP y DBP requiere oxígeno no es posible saber qué parte de la gravedad clínica se debe a la contribución del cortocircuito ductal. En esta circunstancia, la evaluación detallada con eco-Doppler es imprescindible. Si el DAP es de un tamaño superior a 1,5mm y/o existe indicación de que se trata de un DAP-HS, el recién nacido no debe ser dado de alta hasta resolver este problema (probablemente con necesidad de cirugía antes del alta, aunque se realice en otra institución). El grupo de consenso no recomienda la práctica de dar el alta sin haber obtenido el cierre de un DAP-HS.
7Infección, inflamación y DAPLa persistencia del DAP se ha relacionado con infección e inflamación. Esto es fácil de entender si se tiene en cuenta que las prostaglandinas circulantes se elevan significativamente durante la infección o la sepsis neonatal. Por esta razón, el ductus puede reabrirse o no responder al tratamiento con inhibidores de la ciclooxigenasa58. Además, en el recién nacido pretérmino con sepsis y DAP-HS existe una asociación muy significativa con el desarrollo de DBP con odds ratio (OR) o “razón de momios” (RM) elevada, de 48,3 (intervalo de confianza [IC], de 6,3 a más de 100)59.
Por otro lado, la presencia de bajas concentraciones de cortisol en la primera semana de vida se ha asociado con inflamación pulmonar y DAP en recién nacidos de muy bajo peso al nacer60. Esto sugiere que la insuficiencia suprarrenal temprana contribuye a la asociación de DAP e inflamación pulmonar con evolución respiratoria adversa. Sin embargo, la causalidad en esta asociación no ha sido demostrada. Por otro lado, el uso de esteroides prenatales y las bajas dosis posnatales afectan a la respuesta del DAP, con mayor eficacia del tratamiento farmacológico posnatal60–62.
Todos estos datos demuestran que la modulación de la respuesta inflamatoria podría tener un papel en el tratamiento del DAP. Sin embargo, en el momento actual, debido a su riesgo, no puede recomendarse interferir en el equilibrio inflamatorio-antiinflamatorio en el período neonatal.
8Equilibrio hidroelectrolítico, diuréticos, nutrición y DAP8A¿Las infusiones de volumen y el volumen total en ml/kg/día, aumentan la prevalencia de DAP en el recién nacidos de muy bajo peso?Los recién nacidos pretérmino necesitan del aporte hidrocalórico parenteral y deben permanecer bajo un estricto control individual de su equilibrio hidroelectrolítico para que se produzca un equilibrio negativo de agua y peso en los primeros días de vida. Estos niños suelen tener un exceso de pérdidas insensibles y un riñón inmaduro para manejar excesos o déficit de líquidos63,64.
Al nacer, el recién nacido se encuentra con un volumen de líquidos expandido en relación con su requerimiento extrauterino y esto es mayor cuanto menor sea la edad gestacional64. La disminución del exceso de volumen permite una mejor función pulmonar, pero una pérdida excesiva de líquidos puede llevar a deshidratación, fallo renal, hiperpotasemia y muerte65.
En numerosos estudios se ha sugerido calcular el volumen de líquidos por kilo y por día de acuerdo con unas tablas dependiendo del peso, la edad gestacional y el empleo de fototerapia. Esto resulta inadecuado en muchos recién nacidos y, además, la fototerapia no aumenta necesariamente las pérdidas insensibles. Por ello, se recomienda individualizar el aporte hídrico intentando administrar cada día la cantidad fisiológica requerida para cada recién nacido. Algunos autores han recomendado diferentes pautas del aporte hidroelectrolítico en distintos estudios66–68 como, por ejemplo, perder un 3–5 % de peso diario, hasta un 15 % del peso de nacimiento, comenzar con un aporte de 50ml/kg/día el primer día y aumentar gradualmente según el volumen urinario, el descenso de peso y el cálculo de pérdidas insensibles, o bien aportar de 60–80ml/kg/día en los primeros 3 días de vida66–68.
En un estudio realizado hace tres décadas69, se encontró un asociación entre la presencia de DAP y un mayor aporte diario de líquidos en recién nacidos de menos de 2.000g en tratamiento con ventilación mecánica a causa del SDR. Poco después70, un estudio retrospectivo halló una asociación entre el exceso de líquidos y DAP, con mayor riesgo de DBP. Un estudio aleatorizado realizado en 1980 en 170 recién nacidos con pesos al nacer comprendidos entre 501 y 2.000 g71 compara el aporte de líquidos “alto” frente al “bajo”. El riesgo de DAP, de insuficiencia cardíaca congestiva y de ECN fue mayor en el grupo de “alto” volumen.
Los principales resultados de un metaanálisis de la colaboración Cochrane72,73 fueron que la estrategia de restringir el aporte hídrico en prematuros disminuye significativamente el peso con respecto al del nacimiento y con ello desciende el riesgo de DAP, ECN y muerte. El menor riesgo relativo de presentar un DAP fue de 0,40 (IC, 0,26-0-63). Además, se encontró una tendencia hacia la disminución de DBP. En resumen, la recomendación más prudente en la actualidad es evitar infusiones en “bolo” de solución fisiológica, iniciar los líquidos de “mantenimiento” con un volumen de 60–80ml/kg/día y realizar una evaluación individual y frecuente del volumen urinario, del peso y del sodio plasmático, así como una estimación según cálculos de las pérdidas insensibles de agua cada 8, 12 y 24h (según el grado de inmadurez y la enfermedad) para individualizar el aporte. El objetivo es lograr un equilibrio hídrico negativo con un descenso del peso del 2-3 % por día (un 12-15 % en los primeros 5–7 días), ajustando el aporte de líquidos según la evidencia médica y las necesidades basales individuales.
Por todos los datos anteriores, el grupo de consenso recomienda la cuidadosa restricción hídrica en prematuros basándose en un estricto balance hídrico (relacionando entradas y salidas de líquidos, la modificación del peso y calculando las pérdidas insensibles en forma individual y frecuente), de tal modo que se administre la cantidad fisiológica requerida y no más. Esto implica que durante las primeras horas se puede comenzar con 60–75ml/kg/día y que las infusiones de volumen (“agua y sal”) deben ser usadas muy excepcionalmente, y sólo cuando exista una clara evidencia de hipovolemia, hecho muy infrecuente en los primeros de días de vida en estos recién nacidos. El aporte de líquidos necesario en cada niño debe ser individual, basándose en cálculos individuales de pérdidas insensibles y en la determinación del sodio sérico. Con esta práctica se esperaría una reducción en la mortalidad y en los casos de DAP, DBP, ECN y hemorragia intraventricular (HIV).
8BVolumen de líquidos (ml/kg/día) cuando existe DAP en los primeros días o semanas de vidaNo existen estudios que refieran el tratamiento hídrico en casos con DAP-HS. Muy probablemente, el objetivo de balance hídrico negativo en estos recién nacidos es más beneficioso que lo comunicado en los estudios generales referidos en el apartado 8A anterior. Como hemos visto, el DAP puede ocasionar oligoanuria; la indometacina también puede hacerlo. Desde hace ya muchos años se recomienda disminuir el volumen unos 20ml/kg/día, no sólo por el propio DAP sino también cuando se está usando indometacina16,71. Por tanto, en el recién nacido con DAP confirmado debe mantenerse un equilibrio estricto (entre ganancias y pérdidas urinarias, y pérdidas insensibles), disminuyendo el aporte hídrico para evitar a toda costa el exceso hídrico y el aumento de peso. El exceso hídrico puede ser ocasionado con un volumen de 130ml/kg/día, pero también con uno de 70ml/kg/día si no existen pérdidas insensibles y el volumen urinario es de 24ml/kg/día (1ml/kg/h), por ejemplo. Esto es de suma importancia para disminuir posibles complicaciones por edema y exceso de agua corporal.
8CUso de diuréticos para tratar el DAP. ¿La furosemida aumenta su prevalencia?El uso de furosemida podría incrementar la prevalencia de DAP, debido a su acción inhibidora de las prostaglandinas72–75.
Resulta importante señalar que los diuréticos no forman parte del tratamiento de DAP, aunque algunos autores sugieren su administración si existen datos radiológicos de edema pulmonar. Otros autores han recomendado el uso de furosemida posterior a cada dosis de indometacina, con la finalidad de evitar los efectos adversos de este fármaco sobre el riñón72,73,75. Sin embargo, la furosemida incrementa la producción de prostaglandinas en el riñón y, por tanto, la respuesta del conducto al tratamiento farmacológico para su cierre con inhibidores de la prostaglandina (indometacina e ibuprofeno) podría minimizarse según los estudios aleatorizados. Además, no se ha realizado ningún estudio que demuestre un beneficio importante ni beneficio alguno a largo plazo. En una revisión sistemática se ha indicado que no existe suficiente evidencia que justifique el uso de furosemida en prematuros tratados con indometacina75.
Además de que la furosemida aumenta la prevalencia de la permeabilidad del conducto y puede inhibir el efecto de la indometacina para cerrarlo, su utilización induce riesgos metabólicos, hídricos, electrolíticos, renales y de hipoacusia76. Por tanto, sobre la base de la bibliografía de la que se dispone y en la opinión de este consenso, no puede recomendarse usar diuréticos, y menos furosemida, a esta edad gestacional y posnatal.
9Nutrición por vía enteralDiferentes cuestiones se plantearon al abordar este tema. Entre ellas, si debe alimentarse al neonato cuando hay DAP y DAP-HS, cuál es el volumen más adecuado, o si se le debe alimentar mientras se está tratando farmacológicamente el cierre del DAP.
El grupo SIBEN de consenso consideró relevantes los siguientes puntos:
- 1.
Los estudios que evalúan los efectos de la alimentación en recién nacidos con ductus arterioso y/o con tratamiento médico para el DAP no comunican suficientes evidencias para obtener conclusiones adecuadas.
- 2.
Ningún estudio aleatorio que ha investigado el uso y las respuestas a indometacina o a ibuprofeno detalla un protocolo de alimentación o de no alimentación y, por tanto, no se puede saber si los recién nacidos incluidos en los estudios estaban siendo alimentados o no por vía oral.
- 3.
Aun cuando exista evidencia de que el ibuprofeno, a diferencia de la indometacina, no alteraría el flujo vascular mesentérico, la comparación del tratamiento farmacológico con indometacina e ibuprofeno no demostró diferencias en cuanto a la incidencia de complicaciones gastrointestinales de dichos fármacos77–80. El tratamiento farmacológico del DAP con indometacina disminuye el flujo mesentérico, por lo que representa un riesgo de complicaciones gastrointestinales. El ibuprofeno, sin embargo, no tiene estos efectos28. Si bien no se han demostrado diferencias en las complicaciones gastrointestinales como la ECN7,78,81–85, son necesarios estudios que evalúen más adecuadamente estos efectos y complicaciones, no sólo la ECN.
Con esta incertidumbre, y sin evidencia sólida en la bibliografía, el grupo de consenso considera que se podrían realizar las siguientes recomendaciones en la actualidad para el recién nacido de extremo bajo peso, intentando realizar un enfoque de riesgos y beneficios potenciales:
- 1.
Estimulación enteral trófica (con leche materna). Existen evidencias de cambios citológicos en las células gastrointestinales con apoptosis que llevarían a ECN en prematuros con DAP-HS, sobre todo en presencia de sepsis86–88. Sería entonces más prudente no introducir nutrientes en el intestino. Por otro lado, se han descrito ventajas de iniciar precozmente la estimulación enteral trófica y no parece conveniente mantener al recién nacido sin estimulación trófica por mucho tiempo. Se recomienda comenzar con estimulación enteral trófica precozmente después del nacimiento (antes de 24–48h), administrando 10–15ml/kg/día como máximo cada 4–6h, sin avanzar volúmenes. Para decidir cómo continuar con el avance de la nutrición enteral, nuestras recomendaciones se basarían en el diagnóstico precoz del DAP, de su tamaño y de su repercusión hemodinámica.
- 2.
Si se diagnostica un DAP de tamaño pequeño, que no presenta repercusión hemodinámica ni cortocircuitos significativos mediante eco-Doppler, podría continuarse con estimulación enteral trófica o aumentar los volúmenes con cautela (10–15ml/kg/día), hasta que se resuelva el problema.
- 3.
En los casos en los que existen dudas o cuando definitivamente hay un DAP-HS la recomendación es no alimentar por vía enteral durante 48–72h hasta que se resuelva el problema. La duda persiste si es conveniente continuar o interrumpir la estimulación enteral trófica. Parece prudente interrumpirla si además de DAP-HS hay sepsis y si existe un grado importante de desnutrición intrauterina.
- 4.
Debido a las alteraciones en el flujo mesentérico77,79,80, si el niño es tratado con indometacina intravenosa la recomendación es no alimentar por vía enteral durante 48–72h hasta que se resuelva el problema. Si el niño estaba siendo alimentado previamente, es recomendable suspender la alimentación al menos 4h antes del inicio de la terapia (la duda continúa sobre si es conveniente continuar o interrumpir la estimulación enteral trófica).
- 5.
El ibuprofeno podría tener ventajas por su menor efecto negativo sobre el flujo mesentérico, pero aún no existen evidencias definitivas sobre las ventajas clínicas en el tracto gastrointestinal si se compara con el uso de indometacina89–91. Por esta razón, recomendaríamos no alimentar, ya que los riesgos parecen ser más dependientes del DAP-HS.
- 6.
Una vez que se ha estabilizado y/o cerrado el DAP, podría realimentarse al niño con leche materna de preferencia, comenzando a las 24–48h de terminado el tratamiento y vigilando de forma estricta la capacidad de tolerancia92. El aumento debe ser gradual y con cautela (< 20ml/kg/día).
- 7.
El volumen total a aportar será el que requiera el niño para compensar sus pérdidas según estricto balance hídrico.
El consumo de oxígeno es, en general, elevado cuando existe DAP-HS. Esto se debe al empeoramiento de la función pulmonar por aumento de la permeabilidad pulmonar y al consiguiente edema pulmonar y aumento de la presión hidrostática, que da como resultado una disminución de la distensibilidad pulmonar. Además, hay que tener en cuenta la repercusión por la insuficiencia cardíaca congestiva secundaria al cortocircuito izquierda a derecha. Esto resulta en un mayor consumo metabólico y de oxígeno, y puede ocasionar acidosis metabólica o mixta con la consiguiente lesión celular y también reducción de la producción de surfactante44,93–97. Al estar elevado el catabolismo y el consumo de oxígeno con DAP-HS, se puede inferir que los requerimientos calóricos estarían elevados y/o que reulta difícil satisfacer adecuadamente las necesidades nutricionales.
11Crecimiento y perímetro cefálico con exposición prolongada al DAP-HSNo existe en la actualidad una respuesta definitiva. El tratamiento con cierre del DAP-HS mejora la insuficiencia cardíaca, el tiempo de ventilación mecánica, el consumo de oxígeno, la reducción de la mortalidad, y mejora el crecimiento y el neurodesarrollo del prematuro21,98–101. En un estudio reciente realizado en dos centros de dos países diferentes34, los resultados demuestran que el DAP-HS de más de 3 semanas de duración se asocia, entre otras cosas, con alteraciones del crecimiento ponderal y del perímetro cefálico, y con mal estado nutricional, lo que puede ocasionar consecuencias negativas a largo plazo.
12El volumen de nutrición enteral de al menos 150ml/kg/día es alcanzado más tardíamente en recién nacidos afectados con exposición prolongada-persistente al DAP-HSEl DAP, especialmente cuando coexiste con sepsis, es un factor de riesgo para la intolerancia alimentaria. En un estudio de recién nacidos de menos de 28 semanas de gestación, el intervalo de tiempo entre el comienzo de la alimentación y el establecimiento de “alimentación completa” fue mayor en los recién nacidos con sepsis y en los recién nacidos con DAP30. Con este último, debido al riesgo aumentado de insuficiencia cardíaca, ECN y riesgo de muerte cuatro veces mayor en prematuros con DAP-HS, en la práctica clínica en general se restringen los volúmenes alimentarios. Si esto se hace en forma prolongada lleva a un insuficiente aporte calórico y a déficit nutricional, que puede asociarse con efectos adversos potenciales a largo plazo, que aún no han sido bien estudiados. El grupo de consenso de forma uniforme recomienda que cuando existan limitaciones para nutrir por la presencia de un DAP-HS persistente, que puede afectar el crecimiento del recién nacido, no debe abusarse de los volúmenes enterales ni parenterales y debe cerrarse el DAP para aportar una adecuada nutrición enteral que no repercuta en el desarrollo del recién nacido lo antes posible.
13Aportes intravenosos, alimentación parenteral y DAP-HSEl DAP-HS se asocia con un aumento del consumo metabólico y con el riesgo de ECN. La exposición prologada lleva a los médicos a no alimentar por vía enteral o a aumentar muy lentamente los volúmenes. El aporte proteico y calórico se realiza entonces mediante nutrición parenteral. Como se ha mencionado30,34, hay más días de infusión venosa y de nutrición parenteral cuanto más perdura el DAP.
14Alteraciones metabólicas-nutricionales y exposición prolongada al DAP-HSEste tema no ha sido estudiado con detalle en ningún estudio aleatorizado de los que se dispone pero, en los resultados mencionados7,19,34,38,39, se observa una diferencia significativa en estas variables de importancia clínica. Además de la mal nutrición y del inadecuado crecimiento del perímetro cefálico, la osteopenia es ocho veces más frecuente y la hiperbilirrubinemia directa 10 veces más frecuente en los recién nacidos con DAP-PP.
15Tratamiento médico-farmacológico del DAPLa decisión clínica de tratar el DAP debe ser individualizada, según la edad gestacional, la condición respiratoria y el tamaño del recién nacido102. Es decir, debemos saber “quién” es el recién nacido, cuál es la significación hemodinámica y sus consecuencias potenciales, y los riesgos de desarrollar un DAP-PP.
15A¿Qué fármaco debe usarse? ¿Es preferible la indometacina o el ibuprofeno?La “preferencia” debería establecerse tras evaluar todos los aspectos estudiados en el consenso, incluyendo costes y disponibilidad local o regional. Algunos grupos están evaluando los efectos sobre la hemodinámica cerebral y planeando estudios clínicos para evaluar las ventajas gastrointestinales y/o renales. En este apartado vamos a analizar la efectividad de ambos fármacos para lograr el cierre del DAP y algunas de sus repercusiones basándonos en bibliografía publicada hasta el momento (tabla 4).
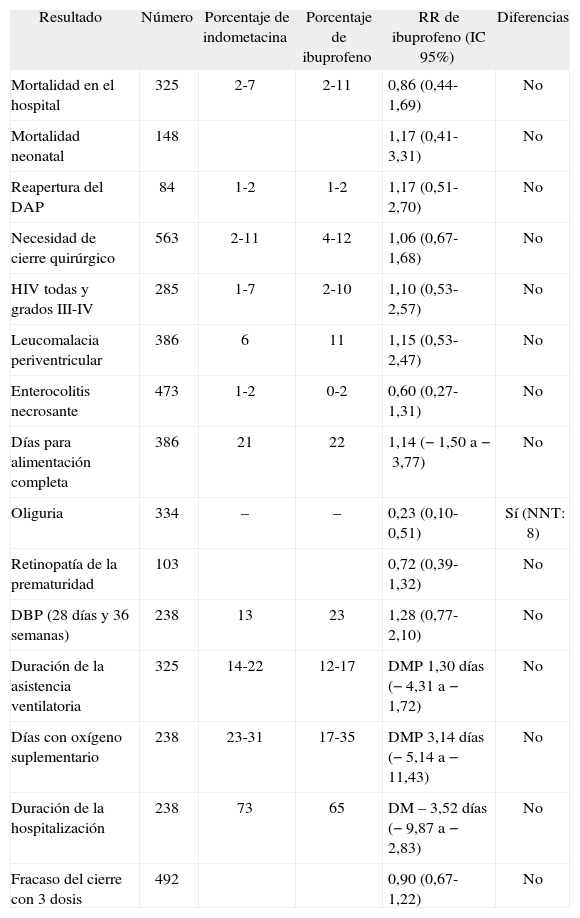
Comparación entre ibuprofeno e indometacina*
| Resultado | Número | Porcentaje de indometacina | Porcentaje de ibuprofeno | RR de ibuprofeno (IC 95%) | Diferencias |
| Mortalidad en el hospital | 325 | 2-7 | 2-11 | 0,86 (0,44-1,69) | No |
| Mortalidad neonatal | 148 | 1,17 (0,41-3,31) | No | ||
| Reapertura del DAP | 84 | 1-2 | 1-2 | 1,17 (0,51-2,70) | No |
| Necesidad de cierre quirúrgico | 563 | 2-11 | 4-12 | 1,06 (0,67-1,68) | No |
| HIV todas y grados III-IV | 285 | 1-7 | 2-10 | 1,10 (0,53-2,57) | No |
| Leucomalacia periventricular | 386 | 6 | 11 | 1,15 (0,53-2,47) | No |
| Enterocolitis necrosante | 473 | 1-2 | 0-2 | 0,60 (0,27-1,31) | No |
| Días para alimentación completa | 386 | 21 | 22 | 1,14 (−1,50 a −3,77) | No |
| Oliguria | 334 | – | – | 0,23 (0,10-0,51) | Sí (NNT: 8) |
| Retinopatía de la prematuridad | 103 | 0,72 (0,39-1,32) | No | ||
| DBP (28 días y 36 semanas) | 238 | 13 | 23 | 1,28 (0,77-2,10) | No |
| Duración de la asistencia ventilatoria | 325 | 14-22 | 12-17 | DMP 1,30 días (−4,31 a −1,72) | No |
| Días con oxígeno suplementario | 238 | 23-31 | 17-35 | DMP 3,14 días (−5,14 a −11,43) | No |
| Duración de la hospitalización | 238 | 73 | 65 | DM – 3,52 días (−9,87 a −2,83) | No |
| Fracaso del cierre con 3 dosis | 492 | 0,90 (0,67-1,22) | No |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; DMP: ??; HIV: hemorragia intraventricular; IC: intervalo de confianza; NNT: número necesario de pacientes a tratar; RR: riesgo relativo.
Basado en cuatro metaánalisis (referencias bibliográficas 37, 78, 91, 138), y en 12 ensayos clínicos (referencias bibliográficas 7, 31, 81, 82, 84, 99, 100, 102–104, 287).
Como base de referencia para esta comparación utilizamos dos metaanálisis. Uno incluyó nueve estudios clínicos aleatorizados con un total de 566 pacientes37 y otro incluyó 11 estudios clínicos aleatorizados (los nueve anteriores más dos trabajos más), con un total de 648 pacientes78. Los 11 ensayos realizados entre 1995 y 2005 y utilizados en los metaanálisis se exponen en las citas bibliográficas7,28,81,82,84,85,99-101,103,104.
En todos los casos, el diagnóstico de DAP se realizó mediante ecocardiografía. El objetivo principal de la mayoría de los estudios fue evaluar la tasa de cierre ductal tras el tratamiento farmacológico recibido con indometacina frente a ibuprofeno, excepto en 4 estudios28,99–101 que valoraron principalmente los efectos hemodinámicos de las dos intervenciones y secundariamente informaron sobre el cierre del DAP. Otros efectos valorados de forma secundaria fueron la mortalidad, la necesidad de ligadura quirúrgica, la tasa de reapertura tras el tratamiento farmacológico, las complicaciones y la evolución clínica. Las tasas de cierre del DAP se comunicaron después de una o tres dosis de ibuprofeno o indometacina y los principales resultados se exponen a continuación78.
Fracaso del cierre del DAP después de administrar ibuprofeno o indometacina. El fracaso del cierre depende de varios factores, entre ellos la edad posnatal del inicio del tratamiento médico. En términos generales, con tratamiento precoz se puede lograr el cierre del DAP a los 9 días de vida hasta en un 90 % de los casos, mientras que con tratamiento tardío el éxito se encuentra comprendido entre un 50 y un 66 %. Según la enfermedad subyacente y la edad gestacional, el fracaso puede ser de alrededor del 30 % con una edad gestacional inferior a las 28 semanas y del 10 % con 29 semanas o más. Cuando se inicia el tratamiento a los 3,1 ± 0,5 días el éxito es mucho mayor que cuando se comienza entre 7 y 14 días o más tarde, cuando el fracaso puede ser de hasta el 66%7,19.
Todos los estudios del metaanálisis7,28,81,82,84,85,99–101,103,104 (n = 648) comunicaron este resultado. Ningún estudio individual encontró diferencias estadísticamente significativas en el fracaso del cierre del DAP si se usan indometacina o ibuprofeno; tampoco hubo diferencias en el metaanálisis (RR típico 0,96; IC 95 %, 0,74-1,26).
Los resultados secundarios comparando indometacina frente a ibuprofeno se resumen en la tabla 4. Esta tabla se basa en un artículo reciente78 y en la extensa bibliografía7,28,81,82,84,85,99–101,103,104. En resumen, la única diferencia encontrada es que el ibuprofeno produce oliguria mucho menos frecuentemente que la indometacina. En relación con el uso profiláctico, la indometacina disminuye la HIV, lo que se expondrá posteriormente. Este hallazgo no se ha documentado con el ibuprofeno.
La tasa de fracaso y/o de reapertura oscila alrededor del 25–30 % y es mayor con una edad gestacional inferior a 28 semanas y con un peso al nacer inferior a los 1.000g. Por otro lado, el éxito de una segunda serie o ciclo es de sólo el 30–40 %. La tasa de cirugía varió entre el 2 y el 12 % en este metaanálisis.
15BEficacia de ibuprofeno/indometacina de acuerdo con la edad gestacional, el peso al nacer y la edad posnatalComo se ha descrito anteriormente, cuanto menores son el peso al nacer y la edad gestacional más elevada es la incidencia de DAP105–108. Así, la mayoría de los estudios aleatorizados prospectivos sobre los inhibidores de la ciclooxigenasa para el tratamiento de DAP incluyen a recién nacidos de menos de 33 semanas de gestación. En general, cuanto más inmaduro es el recién nacido más difícil es lograr el cierre ductal con tratamiento farmacológico7. Se ha comunicado hasta un 80 % de efectividad entre 27 y 29 semanas, con una mayor incidencia de fracaso a menor edad gestacional109. A la vez, cuando la edad posconcepcional/gestacional es de más de 33–34 semanas, la efectividad de los inhibidores de la ciclooxigenasa disminuye de forma importante, ya que la capacidad del ductus arterioso de responder a la prostaglandina E2 (PGE2) disminuye a medida que aumentan la edad gestacional y la edad posnatal. Los datos demuestran que si el tratamiento se inicia precozmente en la vida posnatal (días 2 y 4 de vida), es mayor la efectividad para lograr el cierre ductal y para prevenir la insuficiencia cardíaca y el deterioro clínico110. La variabilidad en la farmacocinética y en las concentraciones séricas máximas del ibuprofeno apoyan que es más beneficioso iniciar el tratamiento entre los 2 y los 5 días de vida111. Se ha realizado un estudio112 con el objetivo de establecer la eficacia de la indometacina en cursos cortos o prolongados en las distintas edades gestacionales. El estudio no es concluyente y no podemos hacer recomendaciones al respecto, ya que no se dispone de la mayoría de los datos requeridos.
La recomendación de este grupo de consenso de forma uniforme es usar uno de los dos fármacos estudiados y aprobados y no demorar el inicio del tratamiento de un DAP-HS. Si está presente se recomienda tratarlo entre los 2 y los 5 días de vida, ya que esto aumenta las posibilidades de éxito y disminuye la posibilidad de requerir cirugía. En relación con recién nacidos de mayor edad gestacional (> 32–33 semanas) o posnatal (> 14–21 días) el grupo considera que, si bien la posibilidad de respuesta es muy baja, cada centro debe individualizar en esos casos según el cuadro clínico y las posibilidades quirúrgicas locales.
16Preparados de indometacina e ibuprofeno y otros inhibidores de la ciclooxigenasaEn Iberoamérica es fundamental conocer el coste y la disponibilidad de la indometacina y del ibuprofeno, los problemas potenciales de la vía oral y los riesgos de usar preparados “similares” o no aprobados o no estudiados.
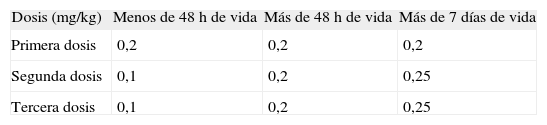
IndometacinaDosis y velocidad de infusión de indometacina. Las dosis del fármaco se exponen en la tabla 5. Si bien el laboratorio recomienda su administración en 30 min113, esta infusión y el bolo producen disminución del flujo sanguíneo cerebral (FSC), durante por lo menos 90min. Existe acuerdo del consenso en que no debe infundirse indometacina en bolo. La mayoría de expertos está de acuerdo en recomendar un tiempo de administración mínimo de 30min y hasta de 1h. Dos miembros discrepan; uno sostiene que 30min es un tiempo suficiente y otro que la indometacina debe ser administrada en 1h.
Dosis de indometacina intravenosa*
| Dosis (mg/kg) | Menos de 48h de vida | Más de 48h de vida | Más de 7 días de vida |
| Primera dosis | 0,2 | 0,2 | 0,2 |
| Segunda dosis | 0,1 | 0,2 | 0,25 |
| Tercera dosis | 0,1 | 0,2 | 0,25 |
Preparación de la indometacina. Si se utiliza 1ml de diluyente (solución estéril de cloruro sódico al 0,9 % o agua destilada), la concentración es de 1mg/ml (0,1mg en 0,1ml). Si se utilizan 2ml para diluir, la concentración final es de 1mg/2ml (0,05mg en 0,1ml). La preparación diluida debe ser administrada inmediatamente y el remanente debe ser descartado. La indometacina puede prolongar la vida media de digoxina, amikacina y gentamicina114–122 y es incompatible con aminoácidos, gluconato cálcico, dobutamina, dopamina y gentamicina. Es compatible con furosemida, insulina, cloruro potásico y bicarbonato de sodio123.
En Argentina, un estudio124 refirió que la concentración de iondometacina alcanzada tras dos diluciones estándar del producto argentino no se correlacionaba con la dosis real indicada. Esto demostró los riesgos de adaptar formas farmacéuticas de adultos para el uso neonatal. En Brasil se importa Indocid® de EE.UU. y Bélgica. En El Salvador se dispone sólo de cápsulas Indocid de Merck de 50mg.
Indometacina por vía oral. Los estudios publicados de efectividad y farmacocinética de INDO oral están realizados en países donde la disponibilidad de la forma EV no existe o es inconstante125–129.
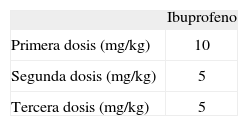
IbuprofenoEl ibuprofeno administrado por vía intravenosa (no oral) tiene una efectividad igual en el cierre del DAP (tabla 4). La dosis se expone en la tabla 6. El ibuprofeno desplaza la unión de la bilirrubina con la albúmina. Con trometanol se han descrito algunos casos de hipertensión pulmonar asociada130. La forma L-lisina puede prolongar la vida media de la amikacina.
Dosis de ibuprofeno intravenoso*
| Ibuprofeno | |
| Primera dosis (mg/kg) | 10 |
| Segunda dosis (mg/kg) | 5 |
| Tercera dosis (mg/kg) | 5 |
En EE.UU. la marca comercializada es Neoprofen® (concentración de 10mg/ml y se presenta en frasco ampolla de 2ml). En Europa es Pedea® (concentración de 5mg/ml en frasco ampolla de 2ml). En Canadá no está disponible. En Argentina, el fármaco se comercializa como Supragesic® (Laboratorios Beta) intravenoso, asociado a dextropropoxifeno. Requiere diluciones en solución fisiológica para alcanzar concentraciones de 10mg/ml.
Se han comunicado tres casos de hipertensión pulmonar grave tras la administración profiláctica de ibuprofeno (en las primeras 6h de vida) con la fórmula preparada con trometanol130, y en un recién nacido pretérmino a quien se le administró la fórmula con L-lisina131. Podría parecer que la forma con lisina sería más segura.
Ibuprofeno oral. En Brasil no se comercializa el ibuprofeno parenteral, pero existen más de 20 presentaciones de ibuprofeno oral, con concentraciones que varían entre 20 y 200mg/ml. No se usa en este país el ibuprofeno oral para el tratamiento del DAP. En El Salvador, sólo existe la presentación oral de este fármaco. Estudios de pequeño tamaño han sugerido que el ibuprofeno oral tiene una eficacia similar a la de la indometacina33,124,130–134. Sin embargo, los estudios carecen de rigor, debido al escaso número de pacientes estudiados. Ocho estudios (cinco no aleatorizados)126–128,134,135 coinciden en la efectividad similar del ibuprofeno oral y el intravenoso. Un informe136 comunica la perforación intestinal en dos recién nacidos pretérmino de menos de 30 semanas y 1.250g con ibuprofeno oral.
Contraindicaciones para el uso de indometacina o ibuprofenoLa presencia de insuficiencia renal, oligoanuria grave y creatinina superior a 2,5mg/dl son contraindicaciones. Quizá, si la repercusión renal del DAP ha sido significativa el ibuprofeno puede ser una elección de menor riesgo. La plaquetopenia inferior a 25.000 es otra contraindicación, ya que estos fármacos inhiben la función plaquetaria. Según la situación clínica, puede optarse por transfundir plaquetas al administrar el tratamiento. La evidencia de hemorragia activa es también una contraindicación para la administración de estos fármacos. Sin embargo, no se ha demostrado empeoren la gravedad de una HIV preexistente. En casos de ECN, la mayoría de los médicos no utiliza estos medicamentos88,89,91,137,138.
Otros fármacos similaresEl sulindaco oral139 parece ser eficaz en el cierre del DAP con menos efectos renales (número de pacientes 16, todos con peso > 1.750g). Requiere ser metabolizado en el hígado, donde es transformado en el metabolito sulfito activo. Otro antiinflamatorio no esteroideo es el naproxeno. Se han comunicado tres casos sobre el uso prenatal de naproxeno140–142 y cierre del ductus precoz con hipertensión pulmonar grave en los recién nacidos tratados. No se conoce su utilidad en recién nacidos.
Recomendaciones del consensoLa recomendación es que en cada región de cada país los médicos conozcan con detalle el fármaco que debe utilizarse por vía intravenosa, y usen el más efectivo, mejor preparado y con menor posibilidad de error en su preparación, es decir, deben administrarse los fármacos y preparados por la vía intravenosa que hayan sido bien estudiados y aprobados específicamente para el tratamiento del DAP en recién nacidos pretérmino. Con el desacuerdo de sólo uno de los miembros del consenso, no se recomienda el uso de indometacina por vía oral, ya que la evidencia es escasa o nula. El uso oral de ibuprofeno no puede ser recomendado en este momento por este grupo de consenso SIBEN (salvo con una abstención). Este consenso tampoco puede recomendar fármacos conocidos, pero con sales y excipientes no estudiados. Los fármacos no estudiados o las sales y excipientes agregados a fármacos estudiados pueden ocasionar más efectos adversos que beneficios. Finalmente, en uniformidad, este consenso no puede recomendar el uso de sulindaco ni de naproxeno.
17Tratamiento: edad de inicio y repetición de ciclos terapéuticosLas dosis e intervalos más referidos para la indometacina se exponen en la tabla 5, aunque existen estudios con intervalos cada 24 h28,99. Un solo estudio con una dosis de 0,1mg/kg100 y un estudio con dosis de 0,2-0,25mg/kg101.
Cada dosis debe administrarse en infusión lenta. Superar los 30–60min parece limitar algunos de los efectos negativos en el flujo orgánico sanguíneo143,144. El inmediato efecto constrictor de la indometacina es variable, pero puede medirse durante 2h después de la primera dosis145. El ductus está a menudo cerrado cuando se administra la segunda dosis145. Se ha usado vigilancia ecocardiográfica para limitar la duración del tratamiento con indometacina sin efectos adversos en las tasas de cierre146,147. Si se dispone de una amplia vigilancia ecocardiográfica, puede ser posible administrar tratamientos más cortos o de menos dosis, dependiendo de la respuesta individual evidenciada por ecocardiograma148. Sin embargo, esto requiere de nuevas tecnologías y disponibilidad de expertos, lo que no es fácil de lograr. Por tanto, este grupo de consenso no puede recomendar la administración de menos dosis de indometacina que las mencionadas en la tabla 5. Las dosis del ibuprofeno se exponen la tabla 6100,104.
¿Cuándo tratar?Se trata de un tema sin resolver y faltan datos que de forma clara nos conduzcan a emitir una recomendación universal. En general hay cuatro aproximaciones, siempre usando las tres dosis de un curso terapéutico completo:
Indometacina profiláctica. La administración profiláctica de indometacina (< 6–24h de vida) es útil para disminuir la HIV149–152 y reduce la incidencia de DAP, pero no DBP. Una revisión de la colaboración Cochrane138 sobre 19 estudios con 2.872 recién nacidos tratados con indometacina durante menos de 24h demuestra que la incidencia de DAP se reduce muy significativamente, al igual que la necesidad de su tratamiento quirúrgico, además de reducir en un 35 % la presencia de hemorragia pulmonar grave. Pese a que el DAP se encuentra implicado en la patogenia y se asocia con DBP, aparentemente la indometacina profiláctica podría incrementar en 1,5 veces (IC, 1,05-2,15) el riesgo de desarrollar DBP153,154. Además, el análisis de los autores de estos trabajos reveló que la indometacina profiláctica incrementa la necesidad de administrar oxígeno adicional a partir del tercer día hasta, por lo menos, el séptimo día de edad posnatal, y disminuye los volúmenes urinarios en los primeros 4 días de vida, lo que dificulta la pérdida de peso esperada al finalizar la primera semana de vida153,154.
Tratamiento precoz. Este punto se refiere al tratamiento iniciado cuando el DAP “comienza” a ser sintomático o es aún clínicamente asintomático, dirigido al tratamiento presintomático. Evans sugiere realizar un ecocardiograma (ECO) en las primeras 6h de vida a todo recién nacido de menos de 28 semanas y de 28–30 semanas con factores de riesgo (como ausencia de corticoides prenatales, SDR y asfixia perinatal) e iniciar tratamiento si el diámetro del DAP es mayor de 2,0mm. Como se menciona en este artículo, los resultados de más de 7 ensayos clínicos demuestran que buscar el DAP por ECO a menos de 3 días de vida o iniciar tratamiento inmediatamente a los primeros signos, sin esperar una sintomatología florida, da como resultado menos DAP, menos cirugía, menos DAP-PP y la inexistencia de diferencias en DBP y ECN102.
Enfoque terapéutico con signos clínicos claros presentes. Si se inicia entre los días 2 y 5 hay más éxito terapéutico, y se previenen la insuficiencia cardíaca y el deterioro clínico110.
Tratamiento tardío. Varios estudios155 demuestran que hay más persistencia del DAP (56–60 %) cuanto más tardío es el inicio del tratamiento médico.
Este grupo de consenso se inclina por el tratamiento precoz del DAP y no puede recomendar el uso profiláctico uniforme de inhibidores de la ciclooxigenasa para disminuir el DAP, ya que esto podría exponer a muchos recién nacidos a fármacos no necesarios. Quizás en unidades que no tengan acceso a la cirugía y que no puedan trasladar a los niños que la requieran, podría ser conveniente considerar el uso profiláctico en un grupo limitado de pacientes con alta incidencia de DAP y DAP-PP (no se trata aquí sobre las potenciales ventajas de la indometacina profiláctica para tratar la HIV, lo que se expondrá posteriormente).
¿Cuándo administrar otros ciclos si el primero fracasa? ¿Cuándo administrar la primera dosis del segundo curso? ¿Se usa o no un tercer curso?Lamentablemente no existe información basada en la evidencia para responder a estas preguntas. Una aproximación adecuada podría ser repetir un segundo ciclo de tres dosis de indometacina o ibuprofeno en el caso de fracaso de un primer ciclo (no se produce el cierre del DAP) o en el de “reapertura” del ductus unos días después de haberse documentado su cierre. Sólo debe administrarse un segundo ciclo terapéutico si el ductus sigue abierto, es sintomático y no existen contraindicaciones. Si hay contraindicaciones clínicas para un segundo ciclo y el DAP sigue abierto y sintomático con alteraciones hemodinámicas, se deberá recurrir a la cirugía. Un tercer ciclo de tratamiento no parece adecuado por la baja probabilidad de éxito, pero es utilizado como un “último recurso” antes de la cirugía en algunos pocos casos en algunos centros en niños sin contraindicaciones.
¿En quién puede recomendarse o utilizarse un curso “prolongado”? ¿Cuáles son las dosis para el denominado “curso prolongado”? ¿Cuáles son sus ventajas y desventajas?En relación con la indometacina, no se han detectado diferencias entre los cursos cortos habituales y los prolongados, en relación con la eficacia (cierre del ductus, reapertura o necesidad de nuevo tratamiento o cirugía)154. Por otro lado, hace ya algunos años se comunicó que administrar dosis algo más bajas que las habituales utilizadas durante más tiempo (0,1mg/kg cada 24h durante 5–7 días) podría ser efectivo en recién nacidos que no hubiesen respondido a un ciclo habitual de indometacina107,108,156. Sin embargo, pude parecer que el curso prolongado se asocia con una mayor incidencia de enterocolitis y de alteraciones en la función renal (oliguria e incremento de creatinina)156. No existen datos definitivos en la bibliografía para recomendar una pauta o un esquema terapéutico para el uso de indometacina en forma “prolongada”102,156.
En el caso del ibuprofeno, no existe ningún dato relacionado con el tratamiento “más prolongado”. Una preocupación en niños y en recién nacidos es su vía metabólica y su potencial para causar lesiones hepáticas graves con concentraciones plasmáticas elevadas. Por tanto, este fármaco no debe usarse de una forma diferente a la mencionada anteriormente.
18Tasa de “no respuesta al tratamiento médico”La tasa de ausencia de respuesta al tratamiento médico es muy variable en la bibliografía, cercana al 30 %. Los datos publicados varían entre un 10 y un 56%157,158, dependiendo del fármaco utilizado, de la edad posnatal al iniciar el tratamiento, de la dosis usada, del intervalo y del número de series o ciclos (uno o dos o más series)102,112,159,160. Los datos individuales de cada trabajo refieren tasas de fracaso en el cierre del DAP con tratamiento médico que varían entre tasas bajas (10-13 %), en muy pocos trabajos, y tasas de fracaso más frecuentemente comunciadas, entre el 21 y el 34 %. Las tasas altas son del 43–45 % y hasta del 50 % en recién nacidos remitidos para su tratamiento12,20,35,59,88,90,102,112,138,157,160–174. Citamos tres estudios de interés: un estudio con una tasa de fracaso de sólo un 1,5 % con dosis alta de indometacina164, un estudio en el que el 56 % de los recién nacidos de menos de 28 semanas de edad gestacional no tuvieron respuesta a un segundo ciclo terapéutico con indometacina y requirieron ligadura quirúrgica19, y otro estudio en el que la tasa de no respuesta al primer ciclo de indometacina en recién nacidos de menos de 1.000g fue del 30 %, y administrando dos series de indometacina, del 21%175.
19Cirugía del DAP-HS¿Cuándo hay que intervenir quirúrgicamente?Un porcentaje variable de recién nacidos no responde y se les realiza una intervención quirúrgica para cerrar el DAP. La necesidad de la cirugía es variable, según todos los datos comentados anteriormente (8-14 %). Se debe indicar cirugía tras el fallo o la falta de respuesta del DAP-HS al tratamiento médico. También se realizará cirugía cuando existan contraindicaciones para el tratamiento médico del DAP-HS. Sin embargo, algunos autores han considerado la realización de cirugía en recién nacidos de muy bajo peso al nacer que presentan un DAP de gran tamaño, con cortocircuito de izquierda a derecha muy significativo y grave alteración hemodinámica y respiratoria por evaluación clínica y de la ecocardiografía12,20,35,59,90,102,112,157,159–161,163,164,169,171,176.
En un estudio retrospectivo de 931 recién nacidos de menos de 1.500g, 156 fueron tratados con indometacina o con ligadura quirúrgica primaria165, y la mortalidad fue 13 % en el grupo tratado con indometacina y del 24 % en el quirúrgico. La bibliografía demuestra que el grupo tratado con ligadura quirúrgica después del tratamiento médico, en comparación con el grupo de tratamiento médico que no requiere cirugía, presenta una mayor necesidad de ventilación prolongada, mayores concentraciones de oxígeno y una mayor incidencia de DBP32,51,177. Además, se ve incrementado el riesgo para de presentación de la ROP grave y de problemas neurosensoriales en recién nacidos de muy bajo peso51. No es fácil diferenciar si esto sucede a causa de la cirugía o por el tiempo de exposición al DAP-HS o a un DAP-PP. Asimismo, no se sabe qué les hubiese pasado a esos recién nacidos si no se hubiese cerrado el DAP de forma quirúrgica. En mandriles prematuros la cirugía del DAP produce efectos perjudiciales sobre la función pulmonar y el crecimiento pulmonar54.
Obviamente, lo mejor es no realizar ninguna operación en el recién nacido y no se encuentran ventajas en proceder a la ligadura quirúrgica sin haber intentado antes el tratamiento médico, salvo en casos de ECN o de contraindicaciones absolutas12. La recomendación de este consenso, con dos integrantes en desacuerdo, es proceder a la cirugía sin mayores demoras en casos de contraindicaciones para el tratamiento médico y cuando han fracasado dos (o hasta tres) series terapéuticas (cursos o ciclos) y el DAP sigue siendo HS, para evitar así un DAP-PP.
Riesgos de esperar más de 3 semanas con un DAP abierto e intervenir quirúrgicamente después de 3 semanas si el recién nacido recibe asistencia respiratoria mecánica (ARM)/CPAP/oxígenoNo se han realizado estudios controlados al respecto y no se sabe si alguna vez los habrá. Algunas publicaciones refieren que después de 3 semanas de exposición a un DAP pueden producirse insuficiencia cardíaca congestiva, hipertensión pulmonar, deterioro de la función pulmonar y disminución del crecimiento alveolar, con mayor riesgo de DBP y mayor mortalidad35,110,119,155,169,170,176. Cuando hay DAP-HS, realizando la cirugía antes de la tercera semana de vida se consigue someter al paciente a menos días de apoyo ventilatorio, a menos días para alcanzar la alimentación oral total, y se logra un mayor peso a las 36 semanas de gestación35. Los datos sugieren que un DAP-PP presenta riesgos importantes en diversos aspectos para el recién nacido.
¿Dónde y cómo realizar la técnica quirúrgica? ¿En la unidad o en el quirófano? ¿Utilizar clip o ligadura? ¿Toracoscopia o toracotomía?La unidad de cuidados intensivos neonatales (UCIN) es un buen escenario para realizar la cirugía del DAP en recién nacidos inestables y de muy bajo peso al nacer, sin aumentar los riesgos de infección o de otras complicaciones. Se obtienen mejores resultados con la cirugía en la UCIN. La principal desventaja de la sala de operaciones es el traslado neonatal, como así también un mayor riesgo de hipotermia, problemas con las vías centrales o los tubos de drenaje pleural, y la dislocación de los tubos endotraqueales. Otra ventaja potencial de la cirugía en la UCIN es la continuidad del cuidado neonatal por el equipo que intervien junto con el anestesista, el control de la oxigenoterapia y la posibilidad de utilizar técnicas no convencionales de asistencia respiratoria mecánica (ARM) (p. ej., alta frecuencia)35,178–184.
Algunos estudios demuestran que la toracoscopía videoasistida (Video-assisted thoracic surgery) cerrando el DAP con clips o con “clamps” es tan eficaz y más segura que la toracotomía convencional. Esta técnica puede ser usada en ductus de tamaño menor a 9mm, pero la experiencia en recién nacidos de muy bajo peso es limitada. Sea por toracoscopia o por toracotomía, la aplicación de clips es utilizada con éxito desde hace varios años. Esta técnica produce menor tiempo operatorio y menos morbilidad, si se compara con la ligadura clásica185–190. La incidencia de hemorragias intraoperatorias es inferior frente a la ligadura clásica187. La incidencia de ductus residual con la aplicación de clips es del 0%187 frente a la ligadura clásica, en la que es del 3 al 5 %182. Por esta razón, este grupo de consenso, salvo dos integrantes, recomienda que los cirujanos sean expertos en el uso del clip y lo utilicen para cerrar el DAP quirúrgicamente. La toracoscopia puede ser una buena técnica de uso universal en el futuro174,191–195 con un menor coste196,197.
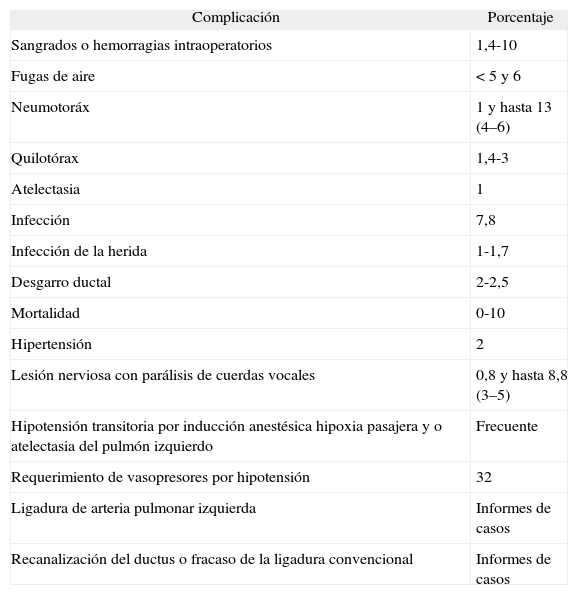
Incidencia de las complicaciones de la cirugíaExiste un amplio rango de complicaciones causadas por la cirugía del DAP descritas en la bibliografía (tabla 7). Citando algunos ejemplos, se han referido un 26% de complicaciones intraoperatorias y un 57 % de complicaciones postoperatorias198, lo que contrasta con un 5% de complicaciones intraoperatorias y un 6 % de complicaciones postoperatorias199. Para la mayoría de los autores, las complicaciones son raras y la mortalidad operatoria se asocia generalmente con otras complicaciones de la prematuridad39,200,201.
Complicaciones de la cirugía del DAP
| Complicación | Porcentaje |
| Sangrados o hemorragias intraoperatorios | 1,4-10 |
| Fugas de aire | < 5 y 6 |
| Neumotoráx | 1 y hasta 13 (4–6) |
| Quilotórax | 1,4-3 |
| Atelectasia | 1 |
| Infección | 7,8 |
| Infección de la herida | 1-1,7 |
| Desgarro ductal | 2-2,5 |
| Mortalidad | 0-10 |
| Hipertensión | 2 |
| Lesión nerviosa con parálisis de cuerdas vocales | 0,8 y hasta 8,8 (3–5) |
| Hipotensión transitoria por inducción anestésica hipoxia pasajera y o atelectasia del pulmón izquierdo | Frecuente |
| Requerimiento de vasopresores por hipotensión | 32 |
| Ligadura de arteria pulmonar izquierda | Informes de casos |
| Recanalización del ductus o fracaso de la ligadura convencional | Informes de casos |
Basado en las referencias citadas en el texto: 12, 12, 202–207, 288, 289.
Tanto la morbilidad como las complicaciones asociadas con la cirugía del DAP se describen en la tabla 7, tras realizar una extensa revisión de la bibliografía12,36,39,157,159,165,180,182,186,187,194,198,199,202–207
Por tanto, por unanimidad, este consenso llega a la conclusión de que lo mejor, obviamente, es no tener que recurrir a la cirugía del DAP. Para ello, hasta que exista un fármaco que posea un 100 % de efectividad y un riesgo mínimo o nulo, deben maximizarse las prácticas que disminuyen la incidencia de DAP y las que aumentan las probabilidades de respuesta al tratamiento médico. A la vez, hasta que exista el fármaco ideal, parece más perjudicial o de riesgo que la cirugía no realizarla y permitir que exista un DAP hemodinámica y clínicamente significativo de forma persistente y prolongada.
20ECN y perforaciones intestinales con DAP y con tratamientoEs objeto de debate si existe una asociación del DAP con ECN, o si el DAP tiende a aumentar el riesgo de ECN. Los estudios epidemiológicos sugieren que sí la hay208,209. Esto se debería a la baja distribución del flujo sanguíneo por baja presión diastólica y vasoconstricción. Alrededor de 70 % de los prematuros de 28 semanas de edad gestacional o menos necesitan de tratamiento del DAP (clínico o quirúrgico). Si el DAP no es tratado se aumenta el riesgo de ECN210.
Asimismo, hay polémica sobre si la ECN se relaciona con la administración de inhibidores de la ciclooxigenasa, que disminuyen el flujo sanguíneo mesentérico55,211. Sin embargo, si se analiza adecuadamente la bibliografía actual, no se demuestra que la indometacina utilizada como se recomienda aumente el riesgo de ECN. Los estudios epidemiológicos realizados en miles de recién nacidos prematuros no han encontrado esta asociación208,209, pero sí la asociación de ECN con DAP y no con la administración de indometacina. Más importante aún, el estudio prospectivo aleatorizado controlado con placebo Trial of Indomethacin Prophylaxis in Preterms (TIPP) demuestra que la incidencia de ECN no es mayor en el grupo tratado96,153.
Por otro lado, el tratamiento prolongado con la indometacina aumenta el riesgo de ECN112 y el uso de indometacina asociado con hidrocortisona también incrementa el riesgo de ECN103. Como se ha mencionado anteriormente, no existen evidencias para que se use la furosemida conjuntamente con la indometacina210, y esta práctica produce mayores riesgos (v. anteriormente).
En relación con las “perforaciones intestinales aisladas” (sin ECN), se estima que no se produce un aumento significativo de su incidencia en relación con el DAP88.
Se han descritos casos de “perforación aislada” durante el uso de indometacina, pero no se observó un aumento de la frecuencia en ninguno de los estudios con tratamiento controlado con placebo. Muchos investigadores creen que se necesitan más estudios controlados con placebo y aleatorizados para que se confirme la asociación entre perforación aislada e indometacina210,212 (los esteroides sí podrían estar asociados con perforación aislada).
El ibuprofeno, por otro lado, al no ser un inhibidor selectivo de la ciclooxigenasa, lleva a un menor compromiso vascular y no reduce el flujo mesentérico. Además, el ibuprofeno puede tener un efecto citoprotector en el tracto intestinal210. Sin embargo, como se ha mencionado, no existen evidencias de que sea diferente a la indometacina en cuanto a la ECN (v. tabla 4). Se cree que podría ser mejor, pero esto aún no ha sido demostrado de forma clara213. Lo que sí se ha demostrado es que el ibuprofeno no aumenta la ECN ni la perforación aislada33,89,91. En algunos estudios, incluso en la base de datos Cochrane, tampoco se detectó un aumento de la incidencia de “perforación aislada” con el uso de ibuprofeno profiláctico160. Finalmente, no existen descripciones de una mayor incidencia de ECN o de perforación aislada cuando se usan otros fármacos asociados con el ibuprofeno, a diferencia de lo que sucede con la indometacina.
21DAP, tratamiento médico y sistema nervioso centralLa gravedad de complicaciones como HIV e hipoxia cerebral tiene una correlación positiva con el retraso mental214. La circulación cerebral en el recién nacido pretérmino es un sistema de baja resistencia, en el cual el flujo sanguíneo diastólico es un componente importante. Esto, conjuntamente con la deficiente autorregulación cerebral propia del niño pretérmino, explicaría la elevada incidencia de HIV (57,5 %) en recién nacidos con DAP-HS215–217. Entre otros problemas descritos con presencia de DAP con repercusión hemodinámica se incluyen el desarrollo de hemorragia cerebelar, con más riesgo de retraso mental: 6,95 (IC, 2,34-20,64)218 y cuatro veces más riesgo de muerte (IC, 1,12-14,51)168. Se analizan a continuación éstos y otros aspectos.
Efectos del DAP-HS y/o del DAP-PP sobre el cerebroDiferentes estudios han evaluado la repercusión del DAP-HS clínicamente “silencioso” en el desarrollo o extensión de HIV o leucomalacia periventricular (LPV) en el cerebro del niño prematuro138,160,216,217,219–222. El DAP se asoció estadísticamente con la presencia o con la extensión de la HIV en algunos estudios216,221, pero no en otros217,219,222. En un estudio221, la normalización del flujo a la vena cava superior (VCS) como indicador indirecto del flujo sanguíneo cerebral (FSC), coincidió con la aparición de HIV tardía, lo que apoyaría la teoría de la isquemia-reperfusión en la etiopatogenia de la HIV. Estudios observacionales también apoyan la asociación entre DAP y lesión isquémica217,219,222, con una relación significativa entre bajo flujo y resultados adversos como muerte, HIV, ECN y alteraciones del neurodesarrollo a los 3 años de vida32,216,217,222. El bajo flujo de la VCS en las primeras 24h de vida se asoció con discapacidad, y por cada incremento del flujo de 10ml/kg/min, la probabilidad de muerte o discapacidad se reducen en un 28%223.
En ensayos clínicos aleatorizados sobre el uso profiláctico de indometacina se describe una disminución de la incidencia de DAP (sintomático o asintomático) y de HIV138,160,220. Estos efectos beneficiosos con el uso profiláctico de indometacina se abordan con detalle más adelante141, lo que no se ha encontrado en los metaanálisis que evalúan el uso precoz (presintomático) de indometacina220 o el uso profiláctico de ibuprofeno160. Esto muy posiblemente obedezca a un efecto de la indometacina sobre la perfusión cerebral, independiente de su efecto sobre el DAP.
Efecto del cortocircuito de izquierda a derecha en la circulación cerebral por medio de ecografía DopplerEn general, la presencia de un cortocircuito izquierda derecha ductal se asocia con modificaciones en la velocidad del FSC, principalmente durante la diástole214,221,224–227 y con un aumento del índice de pulsatilidad214,224,226 o de resistencia225. Estos hallazgos se correlacionan, además, con los cambios del flujo en la aorta descendente (flujo retrógrado)214, con los cambios en el componente diastólico de la presión arterial sistémica (relación directa)226 y con el tamaño del DAP214. Un estudio ha puesto de manifiesto una relación inversa entre flujo de la VCS y el diámetro del DAP221. Todo esto sería consecuencia del secuestro sanguíneo de la circulación sistémica hacia la circulación pulmonar. Aunque son estudios de pequeño tamaño y la valoración de la perfusión cerebral es semicuantitativa, los hallazgos son concordantes en todos los estudios. A pesar de la disminución de la velocidad de FSC debida al DAP, no se observó disminución alguna de la actividad eléctrica cortical228.
¿Efectos diferentes de indometacina e ibuprofeno en el cerebro? ¿Prevención de HIC?Efectos de la indometacina sobre la hemodinámica cerebral. La administración de indometacina produce cambios sustanciales en la hemodinámica cerebral de forma inmediata a aquélla. Esto ha sido evaluado en estudios clínicos realizados en niños prematuros por eco-Doppler107,113,229–236, por NIRS (por sus siglas en inglés: Near Infra Red Spectroscopy)144,237–239 o por ambos métodos238, y también en animales neonatales240,241. Esencialmente, la administración de indometacina produce cambios en la hemodinámica y oxigenación cerebral que concuerdan con la disminución de la perfusión cerebral113,144,229–239 que persiste en el tiempo234. Los hallazgos son controvertidos, sin embargo, no lo son en cuanto al efecto diferencial de la administración en bolo frente a la infusión lenta107,113,144,230. Parece que el efecto de la indometacina sobre la reducción de la perfusión cerebral podría ser más precoz en el bolo que en la infusión lenta114, si bien no existen diferencias en el efecto global o en la duración de éste si el período de observación es más prolongado114,147, pero el período de observación fue corto en dos estudios (30 y 60min)108,224. Administrando cada dosis durante más de 30–60min parecen limitarse algunos de los efectos negativos sobre el flujo sanguíneo. No habría diferencias significativas entre una infusión de 30 o de 60 min242.
El efecto de la indometacina en los vasos cerebrales parece ser directo145 e independiente de potenciales cambios en el metabolismo de los prostanoides235. La administración precoz (< 12h) de indometacina para el tratamiento del DAP de gran tamaño (> 1,6mm) no produce a la hora de la administración cambios en el diámetro ductal ni en el flujo a la VCS. Además, la administración de indometacina atenúa la respuesta vascular fisiológica al CO2144,233 y la disminución del FSC se acompaña de un incremento de la extracción fraccionada de oxígeno, manteniéndose intacta la tasa metabólica cerebral de oxígeno240. La administración de indometacina como tocolítico no parece tener efectos sobre la circulación cerebral del feto243,244. En otros grupos de edad y en animales de experimentación, este fármaco controla la presión intracraneal en el traumatismo craneoencefálico245,246 y el edema cerebral de la encefalopatía hepática247,248.
Efectos del ibuprofeno sobre la hemodinámica cerebral. En modelos experimentales neonatales el ibuprofeno aumenta la capacidad de autorregular el FSC249, protege la función neuronal en el estrés oxidativo250 y no afecta a la vasorreactividad de la circulación cerebral al CO2251. En un estudio clínico aleatorizado y ciego sobre la profilaxis del DAP en prematuros, el ibuprofeno no tuvo efectos sobre la perfusión y la oxigenación cerebrales252. La administración de ibuprofeno para el cierre del DAP tampoco ha demostrado tener efectos sobre la circulación cerebral en estudios experimentales253 o clínicos99,101.
Administración profiláctica de ibuprofeno y HIV. En un metaanálisis sobre el tratamiento profiláctico del DAP con ibuprofeno160, se incluyeron cuatro ensayos90,164,169,176. Sólo uno de ellos tiene como variable principal de evaluación la HIV grave176. Se incluyen 672 niños prematuros y no se observan efectos positivos del tratamiento preventivo del DAP con ibuprofeno sobre la mortalidad precoz, en la HIV grave ni en LPV. No existen datos sobre el neurodesarrollo. En un estudio posterior, multicéntrico, para la prevención de la HIV254, el uso profiláctico de ibuprofeno tampoco fue positivo.
Administración profiláctica y precoz de indometacina. Se abordan en este apartado algunos aspectos específicos relacionados con el cerebro. En un modelo experimental neonatal de hipotensión hemorrágica, la profilaxis con indometacina disminuyó el FSC basal y evitó el aumento del FSC tras la reposición volémica, observándose una reducción significativa de la HIV255.
El metaanálisis sobre los estudios publicados acerca del uso profiláctico de indometacina para reducir la morbimortalidad asociada con el DAP y la HIV en niños prematuros138 incluye 16 ensayos publicados en revistas con revisión por pares96,149–152,175,256–265, con un total de 2.872 recién nacidos. La indometacina profiláctica reduce significativamente la presencia de HIV grave (grados 3 y 4), RR acumulado = 0,66 (0,53-0,82). No existen evidencias de diferencias en cuanto a mortalidad o en el riesgo de alteración en el neurodesarrollo a los 18 meses de edad. Los análisis secundarios parecen sugerir que sí se mejoran los resultados en los recién nacidos de sexo masculino y la información reciente a más largo plazo sugiere efectos beneficiosos en ambos sexos266–269.
Los hallazgos pueden dar lugar a interpretaciones diferentes. Una podría ser que la HIV grave no es un buen marcador o estimador del neurodesarrollo ulterior. Otra podría apuntar hacia un posible efecto lesivo directo de la indometacina, ya que disminuye la HIV pero no mejora los resultados. Por otro lado, algunos autores pueden sostener que la indometacina profiláctica es segura, al haberse encontrado que no aumenta la incidencia de alteraciones del neurodesarrollo a largo plazo. Además, como se ha mencionado anteriormente, existe una diferencia en la respuesta según el sexo y parece haber mejoría en el seguimiento y la evaluación en la edad escolar o adolescente266–268. El tema no está definitivamente resuelto y la cuestión es si con una mejor selección de la población a tratar se disminuiría el número de pacientes expuestos de forma innecesaria a los potenciales efectos colaterales de la indometacina, limitando el uso a aquellos casos que potencialmente pudieran beneficiarse.
El metaanálisis sobre los ensayos clínicos acerca del tratamiento precoz (presintomático) del DAP con indometacina220 incluye tres estudios270–272 con un total de 97 pacientes incluidos. No evidenció efecto alguno sobre la mortalidad o HIV. El neurodesarrollo a largo plazo no ha sido comunicado.
Otros aspectos sobre los efectos de indometacinaibuprofeno (en modelos experimentales animales)Son muchos los estudios realizados en animales273–279, pero su análisis escapa al objetivo de este artículo. En resumen, el ibuprofeno reduce el tamaño del infarto de forma comparable a como lo haría la hipotermia, el efecto de la indometacina sobre la hemodinámica no estaría relacionado con el sistema de los prostanoides, es independiente del sistema parasimpático y parece mediado por la vasopresina y los opiodes. La indometacina, además, protege a las neuronas atenuando el estrés oxidativo y la lesión por reperfusión.
22Aspectos de la ecocardiografía en el DAP22A¿Cuándo hacer la primera ECO? ¿A quién?Algunos aspectos de este tema se han mencionado con anterioridad. Basándose en la evidencia actual, este grupo de consenso recomienda (con algunas dudas y precauciones de tres miembros) realizar una ECO precoz (entre las 24 y las 72h de vida) en recién nacidos de 1.500g o menos sintomáticos, en recién nacidos de menos de 28 semanas y en recién nacidos de 28–30 semanas con alto riesgo, para evaluar el tamaño y el grado de cortocircuito. Es recomendable realizar ECO siempre antes del tratamiento médico.
La gran mayoría de los estudios han demostrado que el DAP que se cierra “espontáneamente” lo hace en forma relativamente precoz e incluso en las primeras 48–72h de vida. En un 30-40 % o más de los recién nacidos de menos de 1.500g, el DAP permanece abierto y ocasiona síntomas clínicos20,23,24,280.
22B¿Cuándo debe repetirse la ECO?El enfoque es variable. En los recién nacidos que han sido tratados médicamente la recomendación sería documentar el cierre del DAP o el fracaso del tratamiento por medio de ecocardiografía detallada, sobre todo en los recién nacidos más pequeños y en los que presentan síntomas, aunque no sean definitivamente claros pero sí atribuibles al DAP como, por ejemplo, necesidad de CPAP, oxígeno, respirador, o la imposibilidad de retirarlos. Por supuesto, la ECO debe hacerse en todo los casos con persistencia de síntomas clínicos claros y/o sospecha radiológica después de tratamiento farmacológico.
El enfoque es algo empírico, de sentido clínico, apoyado en forma indirecta en los trabajos publicados que refieren la incidencia de fallo o fracaso del tratamiento farmacológico.
22C¿Tratamiento médico sin ECO? ¿En qué casos?En ningún caso, excepto en presencia de síntomas clínicos y radiológicos, y cuando no se dispone de ecocardiograma ni de cardiólogo pediatra.
La sensibilidad de los síntomas clínicos es apenas de un 30 a un 50 % en los primeros 5 días de vida3–5,17. Además, si bien es extremadamente infrecuente, existe el riesgo de cerrar farmacológicamente el ducto arterioso en presencia de una cardiopatía congénita dependiente del ducto no detectada clínicamente. Por otro lado, de existir este raro problema en un recién nacido de 500–800g o incluso de 1.000g, es muy poco probable que en la actualidad se pueda ofrecer una solución por medio de cirugía cardíaca en la inmensa mayoría de las unidades neonatales.
El trabajo reciente de Vanhaesebrouck ha comunicado muy buenos resultados con tratamiento conservador; aunque la muestra es reducida para poder hacer recomendaciones definitivas, aumenta la duda sobre tratamiento sin confirmación280. El grupo de consenso reconoce que en la realidad latinoamericana muchas unidades neonatales tienen dificultades para acceder a la confirmación diagnóstica con ecografía en algunas horas del día o, lamentablemente, tienen mucha dificultad en realizar una ECO adecuada. En estos casos y cuando es clara la clínica de un DAP-HS, hay acuerdo consensuado en que se debe intentar cerrar el DAP.
En situaciones como ésta, sin embargo, el problema es que el recién nacido puede estar ya muy afectado y/o la respuesta a los inhibidores de prostaglandinas ser menos efectiva. El debate, entonces, es qué hacer si no se dispone de ECO. El grupo de consenso, salvo por dos abstenciones, se cree que puede ser de importancia iniciar tratamiento cuando existen algunos signos, lo antes posible sin esperar que existan signos clínicos floridos.
22DECO: ¿por parte de neonatología o de cardiología pediátrica?La tendencia hacia el entrenamiento de los neonatólogos en ECO está tomando fuerza281–284. Hay varios argumentos a favor de que la realicen los neonatólogos bien entrenados: el acceso inmediato a la evaluación hemodinámica, la valoración de la transición circulatoria en niños enfermos, y la evaluación de disfunción miocárdica, DAP, hipertensión pulmonar y detección de taponamiento cardíaco de forma inmediata y frecuente. Además, evita demoras innecesarias para la evaluación cardíaca y tendría una mejor relación coste/beneficio. Las razones en contra son: interpretación errónea, por omisión o por equivocación, las implicaciones legales de los errores y el potencial abuso de su utilización.
23Coste-efectividad del tratamientoEstimación del coste de no tratar el DAP hemodinámicamente significativoNo existe ningún estudio farmacoeconómico sobre este tema que pueda ofrecer una respuesta precisa al respecto del coste de no tratar el DAP-HS en relación con los días de administración de oxigeno, ARM, líquidos parenterales, hospitalización, si se compara con el DAP tratado u operado. Los siguiente puntos de este proceso de consenso se basan en la bibliografía citada y en especial en algunos artículos de los que se puede llegar a inferir algún dato al respecto36,162,170,174,280,285,286.
Según lo analizado por este grupo de consenso SIBEN, la rapidez del tratamiento del DAP-HS (cuando los primeros signos clínicos aparecen o cuando se documenta mediante ECO) con medidas generales e inhibidores de la ciclooxigenasa o con ligadura quirúrgica (cuando hay fallo terapéutico), disminuye la frecuencia de enfermedad pulmonar crónica y de ECN, la duración de la ventilación mecánica y tal vez los días de administración de oxígeno y de estancia hospitalaria. Asimismo, parece que al prevenir la existencia de un DAP-PP durante más de 2–3 semanas, las diferencias son aún mayores. Si esto es realmente así, el beneficio económico sería muy significativo.
Sin embargo, el grupo desea señalar que existe un estudio retrospectivo168 que incluyó sólo a 65 recién nacidos con DAP significativo que se cerró con tratamiento médico y 33 recién nacidos en quienes permaneció abierto debido a imposibilidad de realizar la cirugía por ubicación geográfica. En este grupo la mortalidad fue mayor, pero la morbilidad no fue peor. Tras ajustar los grupos por edad gestacional y puntuación de riesgo clínico, no hubo diferencias significativas en la duración de la ventilación, días de estancia hospitalaria e incidencia de NEC y de HIC grave en los recién nacidos que no eran operados por no disponer de este recurso.
Este tema aún debe ser cuidadosamente estudiado. Debe saberse que si bien no se produjo un aumento de morbilidad, la mortalidad fue mayor. Sería de interés realizar un estudio controlado aleatorizado de muy cuidadoso diseño y de tamaño muestral adecuado en regiones medianas y pequeñas con UCIN que tienen escasa o nula disponibilidad de cierre quirúrgico, comparando la mortalidad y morbilidad con o sin ligadura quirúrgica en pacientes en quienes se intentó sin éxito el cierre farmacológico, ya sea de forma profiláctica o terapéutica.
CONCLUSIONESEste primer consenso SIBEN, integrado por un grupo de neonatólogos de 16 países iberoamericanos condujo a una participación activa y colaboradora, y mejoró la educación de todos los miembros participantes. La tarea finaliza con esta recomendación de consenso sobre todos los aspectos clínicos relacionados con el DAP. Los participantes consideran que este proceso servirá de base para consensos futuros de SIBEN y que puede ser de utilidad como un modelo para disminuir la disparidad de los cuidados y la brecha entre los conocimientos y el cuidado clínico. De esta manera podrán mejorarse los resultados en ésta y en otras áreas del mundo.
Basándonos en la revisión de la bibliografía y en la presentación y discusión de los integrantes del grupo de consenso SIBEN, se resumen a continuación las recomendaciones por consenso de los aspectos clínicos.
AAporte hídrico y administración de furosemida en relación con el DAP en recién nacidos prematuros- 1.
Es necesaria una estrategia de restricción hídrica en el prematuro extremo, induciendo un equilibrio hídrico negativo y pérdida de peso en los primeros 5–7 días de edad posnatal. No hacerlo aumenta la aparición de morbilidad importante.
- 2.
Las infusiones de volumen (soluciones cristaloides) pueden dar lugar a exceso hídrico y sódico, conducir a equilibrio positivo de líquidos y empeorar los resultados importantes y la morbimortalidad. Por ello no deben usarse sin indicación precisa, y muy infrecuentemente se justifica su uso.
- 3.
El equilibrio positivo de líquidos y el volumen total (ml/kg/día) excesivo aumentan la prevalencia de DAP en el recién nacido pretérmino.
- 4.
Restringir el aporte de agua en niños prematuros disminuye significativamente el riesgo de DAP, ECN y muerte. Esta restricción debe ser cuidadosa, evitando la deshidratación.
- 5.
Debe monitorizarse estrictamente el balance hídrico, incluyendo ganancias, diuresis, cálculo de pérdidas insensibles, peso corporal y electrolitos plasmáticos (especialmente sodio).
- 6.
El recién nacido pretérmino debe perder al menos un 10-12 % del peso de nacimiento durante los 5–7 primeros días de vida, pero no mucho más de un 15 %.
- 7.
Un volumen aconsejable para iniciar en el primer día es de 60 a 80ml/kg/día y modificar siempre de acuerdo con el equilibrio hídrico y las necesidades individuales.
- 8.
En la actualidad, la bibliografía demuestra que no es necesario ni recomendable aumentar 10–20ml/kg/día sistemáticamente porque se indique fototerapia.
- 9.
Se debe intentar no exceder los 140–150ml/kg/día durante los primeros 5–7 días de vida en los recién nacidos con un mayor riesgo de presentar DAP. En algunos casos pudiera ser “definitivamente” necesario; sólo debe hacerse si se mantiene un equilibrio hídrico negativo (pérdidas insensibles exageradas, diuresis elevada, importante descenso de peso).
- 10.
Cuando se ha diagnosticado DAP: no administrar un volumen excesivo (intentar, según el equilibrio, mantener por debajo de 110–120ml/kg/día). Al administrar indometacina puede producirse oliguria. Según el equilibrio hídrico, se debe estar atento a reducir las ganancias en todo caso que sea necesario.
- 11.
No debe administrarse furosemida en los primeros 7–10 días de vida en recién nacidos prematuros. No es necesario administrar furosemida cuando se administra indometacina. Esta práctica no conlleva beneficios y conduce a alteraciones metabólicas, hidroelectrolíticas y mayor riesgo de DAP.
- 1.
Se podría o no mantener la estimulación enteral trófica mínima.
- 2.
A la espera de estudios más concluyentes, lo mejor sería no alimentar por vía enteral mientras se mantenga la inestabilidad hemodinámica secundaria al DAP-HS y durante el tratamiento médico.
- 3.
Apoyar con nutrición parenteral, para evitar el catabolismo.
- 4.
Una vez que se ha estabilizado y/o cerrado el DAP podría realimentarse a las 24–48h de terminada la terapia, utilizando leche materna de preferencia, vigilando la buena tolerancia.
- 1.
Indometacina o ibuprofeno intravenosos, tres dosis a las dosis e intervalos mencionados en las tablas. La infusión no debe ser en bolo, y se recomienda entre 30 y 60min.
- 2.
El ibuprofeno es tan efectivo como la indometacina. Un estudio aleatorizado publicado después del consenso confirma este punto290.
- 3.
Inicio precoz del tratamiento, una vez realizado el diagnóstico (1–4 días).
- 4.
No puede recomendarse el uso sistemático de indometacina-ibuprofeno profilácticos para DAP (salvo casos excepcionales, como se contempla en el texto).
- 5.
Evitar la presencia de un DAP-HS-PP. Todos los integrantes de este consenso menos uno recomiendan que se debe intentar lograr que un DAP-HS se cierre antes de las primeras 2 semanas de vida (o como máximo antes de 3 semanas), para evitar el DAP-PP.
- 6.
Tandas de tratamiento médico si no se ha producido el cierre con la primera serie: 2–3, según cuadro clínico y posibilidades quirúrgicas.
- 7.
Indicaciones de cirugía (el clip es preferible): contraindicación de tratamiento médico y fracaso terapéutico, evitando el DAP-PP hemodinámicamente significativo durante más de 3 semanas.
- 8.
El grupo de consenso no recomienda la práctica de dar el alta sin haber obtenido el cierre de un DAP-HS.
Este documento de Consenso Clínico fue elaborado en un extenso proceso en el que participaron más de 30 neonatólogos de 16 países de Iberoamérica, siguiendo pautas científicas claras. Es obvio que algunos de los aspectos clínicos sobre el DAP no están aún claramente definidos. Podrán quedar resueltos en el futuro, y para ello debemos estar muy atentos. Si bien en algunos temas no pudimos llegar a saber cuál es la “práctica perfecta”, el documento será de utilidad para que algunas prácticas erróneas o perjudiciales se eliminen a lo largo y a lo ancho de la región. El objetivo final de SIBEN es la difusión masiva de este documento de consenso, para colaborar así a disminuir la brecha existente entre el conocimiento y las acciones de los médicos en su práctica neonatal, lo que disminuiría la diversidad innecesaria en el cuidado neonatal y aumentaría la posibilidad de mayor uniformidad en los cuidados. Esto tendrá muy importantes posibilidades de redundar en beneficio de muchos recién nacidos del área.
Integrantes del primer consenso clínico SIBEN 2007Directores e investigadores principales: Dres. Sergio G. Golombek y Augusto Sola. Líderes de opinión/expertos invitados: Dres. Ronald Clyman y Bart van Overmeire. Miembros del grupo de consenso (en orden alfabético por país). Argentina: Gustavo Goldsmit, Diego Natta, Guillermo Zambosco; Brasil: Ernani Miura, José Maria Pérez, Clovis Weissheimer; Colombia: Hernando Baquero, Jorge García Harker; Costa Rica: Ada Nydia Oviedo Barrantes; Chile: Mónica Morgues, José Luis Tapia; Cuba: Fernando Domínguez; El Salvador: Miguel Majano; España: Fernando Cabañas, Adelina Pellicer; EE.UU.: Hernán Cruz (Texas), Carlos Fajardo (Arizona), Marta Rogido (New Jersey); México: Lourdes Lemus, Arturo Vargas Origel; Paraguay: José María Lacarruba; Perú: Mario Lee, Julio Tresierra; Portugal: Hercília Guimaraes; Uruguay: Raúl Bustos, Daniel Borbonet; Venezuela: José Lugo Perales.
La empresa Ovation Pharmaceuticals donó fondos para educación a SIBEN para apoyar este grupo de consenso. La Sociedad Española de Neonatología facilitó un aula durante 5h durante el Congreso en Granada. Ninguno de los participantes tiene conflictos de intereses con los fabricantes de los fármacos mencionados.
Agradecemos profundamente la tarea y la colaboración del Dr. Ron Clyman en este grupo de consenso.
Los dos primeros autores contribuyeron de forma igual en la realización y redacción de este trabajo.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas