No existen datos actuales de prevalencia de infección de orina (ITU) en niños menores de 2 años con fiebre elevada en nuestro medio. Se realizó este estudio para evaluar la prevalencia puntual de ITU en niños menores de 2 años con fiebre elevada en urgencias.
MétodoEstudio prospectivo, multicéntrico, observacional incluyendo niños con fiebre a los que se realizó análisis de orina para descartar ITU en un periodo de un año en siete servicios de urgencia pediátricos españoles. Se incluyeron niños menores de un año y niñas menores de 2 años con fiebre sin focalidad > 39°C y sin antibioterapia previa. El diagnóstico de ITU se basó en la presencia de leucocituria y urocultivo positivo.
ResultadosUn total de 1675 pacientes fueron incluidos. Doscientos sesenta niños (15,5%, 95% IC 13,8-17,3) fueron diagnosticados de ITU. La prevalencia puntual de ITU fue 32,9% (95% IC 26,6-39,9) en lactantes febriles menores de 6 meses y 19,3% (95% IC 16,1-22,9) en lactantes febriles menores de 12 meses. La prevalencia puntual de ITU fue 13% (95% IC 10,8-15,6) en niños menores de 2 años con fiebre de menos de 24 horas de evolución versus 17,5% (95% IC 15,2-20,1) en aquellos con más horas de evolución de fiebre (p = 0,014).
ConclusionesLa prevalencia puntual de ITU en niños con fiebre sin focalidad > 39°C en nuestro medio es superior a la referida previamente, especialmente en lactantes varones <6 meses y lactantes mujeres <12 meses. Nuestros resultados sugieren que los pediatras deben buscar de forma estrecha ITU en niños menores de 2 años con fiebre sin causa >39°C.
There is no current data on the prevalence of urinary tract infection (UTI) in infants and toddlers with high fever. We conducted this study to assess the point prevalence of UTI in children aged less than 2 years presenting with high fever to the emergency department.
MethodWe conducted a prospective, multicentre, observational study including febrile children aged less than 2 years in whom urinalysis was performed to rule out UTI over a 1-year period in seven paediatric emergency departments in Spain. Boys younger than 1 year and girls younger than 2 years of age were eligible for the study if they had a rectal temperature greater than 39°C, were not taking antibiotics, and there was no identifiable source of fever. The diagnosis of UTI was based on the presence of leukocyturia and positive urine culture results.
ResultsWe included a total of 1675 patients. Two hundred sixty infants (15.5%; 95% CI, 13.8-17.3) received a diagnosis of UTI. The point prevalence of UTI was 32.9% (95% CI, 26.6-39.9) in febrile boys aged less than 6 months and 19.3% (95% CI, 16.1-22.9) in febrile girls aged less than 12 months. The point prevalence of UTI was 13% (95% CI, 10.8-15.6) in children with a duration of fever of less than 24hours, compared to 17.5% (95% CI, 15.2-20.1) in those with a longer duration of fever (p = 0.014).
ConclusionsThe point prevalence of UTI in infants and toddlers with fever without source greater than 39°C was higher in our study compared to previous studies of UTI prevalence, especially in male infants aged less than 6 months and female infants aged less than 12 months. Our findings suggest that clinicians need to carefully assess for UTI in infants with unexplained fever greater than 39°C.
Las infecciones del tracto urinario (ITU) son el tipo más común de infección bacteriana grave en lactantes que se presentan con fiebre sin foco (FSF). Se han desarrollado varios protocolos de acción para evaluar a niños menores de 2 años con FSF e identificar a aquellos que tienen una infección de orina1–3 La prevalencia global de ITU en niños menores de 2 años con FSF es aproximadamente del 5%4–9. No obstante, esta prevalencia no es homogénea y puede variar con la edad, el sexo, la raza, la temperatura corporal y el estado de circuncisión. Por ejemplo, se detectan ITU en proporciones altas de niñas febriles menores de 24 meses y de lactantes febriles menores de 12 meses.
Los niños menores de 2 años diagnosticados de ITU requieren un manejo especial. Casi todos los niños menores de 2 años febriles con este diagnóstico tienen afectación del parénquima renal, lo que puede causar problemas de salud a largo plazo, tales como hipertensión y función renal disminuida. El riesgo de disfunción renal es mayor en los niños menores de 2 años, y el diagnóstico en este grupo puede suponer un reto para los clínicos. Los signos y síntomas de ITU suelen ser inespecíficos, y el diagnóstico definitivo requiere la investigación de una muestra de orina no contaminada obtenida mediante sondaje vesical o punción suprapúbica10,11. El diagnóstico correcto es importante para poder identificar, evaluar y tratar a niños con riesgo de desarrollar ITU y cicatrices renales y para evitar el sobrediagnóstico y tratamiento innecesario en niños sin riesgo11,12. No obstante, aún hay discrepancias entre las guías de práctica clínica en cuanto a cómo identificar a los niños menores de 2 años con FSF en los que hay que excluir una ITU en los servicios de urgencias pediátricas (SUP)1,2,13–18. Casi todas las guías recomiendan la realización de un análisis de orina en niños menores de 2 años con una temperatura rectal de 39°C o superior.
Actualmente no hay datos disponibles sobre la prevalencia de ITU en niños menores de 2 años con fiebre alta en el entorno de los SUP. Esta información podría ser de ayuda a los médicos para decidir qué niños requieren pruebas diagnósticas complementarias13.
El objetivo de nuestro estudio era determinar la prevalencia puntual de ITU en lactantes menores de 12 meses y niñas menores de 24 meses con FSF de 39°C o superior ingresados en SUP españoles.
Material y métodosDiseño del estudio y pacientesEstudio prospectivo multicéntrico observacional en niños menores de 2 años febriles en los que se realizó análisis de orina para excluir ITU durante un período de un año (octubre 2013-septiembre 2014) en 7 SUP españoles. Para calcular la prevalencia puntual en cada grupo etario, se dividió a los participantes en 5 subgrupos: niños menores de 3 meses, de 3 a 6 meses, de 6 a 12 meses, de 12 to 18 meses y de 18 a 24 meses de edad.
Criterios de inclusiónEl estudio incluyó a:
- •
Lactantes menores de 12 meses con FSF de más de 39°C en los que se realizó análisis de orina para excluir ITU.
- •
Niñas menores de 24 meses con FSF de más de 39°C en los que se realizó análisis de orina para excluir ITU.
Antes de incluir a los pacientes en el estudio, se obtuvo el consentimiento informado de sus padres o cuidadores.
Criterios de exclusiónSe excluyó a pacientes por los siguientes motivos:
- •
Pacientes febriles con leucocituria derivados al SUP por su pediatra para excluir ITU.
- •
Pacientes tratados con antibióticos en las 72 horas precedentes a la visita de urgencias.
- •
Rechazo a participar de padres/tutores.
Todos los niños menores de 2 años incluidos en el estudio fueron sometidos a una evaluación rutinaria por el médico de urgencias consistente en anamnesis (incluyendo el triángulo de evaluación pediátrica) y exploración física. También se realizaron pruebas rutinarias de laboratorio, incluyendo análisis de orina y urocultivo a partir de muestras obtenidas mediante sondaje vesical o punción suprapúbica. Se realizó un cribado inicial de ITU por medio de tira reactiva.
DefinicionesSe definió fiebre sin foco como una temperatura rectal o axilar de 38°C (100,4°F) o superior, medida en el domicilio o en el SUP, en ausencia de catarro u otras manifestaciones respiratorias (tales como taquipnea) o diarrea en niños menores de 2 años con exploración física normal. Se definió análisis de orina positivo como la detección de trazas o niveles mayores de esterasa leucocitaria y/o nitritos en la tira reactiva. Se definió infección del tracto urinario como el crecimiento de un único patógeno conocido en urocultivo de muestra recogida por punción suprapúbica, o de más de 10 000 unidades formadoras de colonias (UFC)/ml en urocultivo de una muestra recogida mediante sondaje vesical, o de más de 100 000UFC/ml en urocultivo de muestras obtenidas «al acecho» o a mitad de la micción asociado a alteraciones en el análisis de orina. Se consideraron patógenos reconocidos los siguientes microorganismos: Citrobacter freundii, Citrobacter koseri, Enterobacter aerogenes, Enterobacter cloacae, Enterococcus faecalis, Enterococcus faecium, Escherichia coli (E. coli) productora de betalactamasas de espectro extendido, Klebsiella pneumoniae (K. pneumoniae), Klebsiella oxytoca, Proteus mirabilis (P. mirabilis) y Streptococcus agalactiae.
Recogida de datosAntes de comenzar el estudio, un miembro del equipo investigador central (MG) distribuyó un cuestionario electrónico por correo electrónico entre los investigadores designados en cada servicio de urgencias participante para confirmar la comprensión del texto y la capacidad para llevar a cabo el proceso de recolección de datos en todos los centros, y para verificar la claridad de la documentación. El investigador principal atendió todas las dudas concernientes a la recolección de datos con objeto de asegurar la precisión de los datos recogidos. Los pacientes susceptibles de participar en el estudio fueron identificados por los médicos de urgencias, que recogieron datos demográficos, clínicos y de manejo: edad, sexo, antecedentes personales, tratamiento administrado antes de la visita a urgencias, tiempo de evolución de la fiebre, síntomas, exploración física, pruebas complementarias, diagnóstico, tratamiento administrado, estancia hospitalaria y evolución de los pacientes. Para cada paciente incluido, los investigadores de cada hospital completaron un cuestionario electrónico en Google Drive y lo enviaron al investigador principal. Además, todos los meses, cada uno de los investigadores designados en los servicios de urgencias completó un cuestionario electrónico adicional resumiendo el número de niños menores de 2 años atendidos, el número de niños menores de 2 años febriles atendidos, el número de niños menores de 2 años con fiebre superior a 39°C evaluados mediante análisis de orina y el número de niños menores de 2 años excluidos, así como las razones de su exclusión. Para obtener datos de calidad era necesario reclutar a un mínimo del 80% de los pacientes que cumplían los criterios de inclusión.
Análisis estadísticoEl tamaño muestral se estimó en base a los datos de prevalencia de ITU reportados en el metaanálisis publicado por Shaik et al.13. Para conseguir una precisión del 2,0% en la estimación de proporciones con un intervalo de confianza (IC) asintótico normal bilateral de 95%, asumiendo una prevalencia global de ITU del 7,3% en niños menores de 2 años con FSF y una prevalencia del 8,0% en niños menores de 24 meses con FSF, calculamos que sería necesario incluir un mínimo de 650 niños menores de 2 años menores de 12 meses y 707 niños menores de 24 meses en el estudio. En base a dicha estimación, los números que estimamos que había que reclutar en realidad para compensar unas pérdidas de seguimiento esperadas del 10,0% eran 723 y 786, respectivamente.
El análisis estadístico se realizó con el paquete estadístico SPSS Statistics para Windows versión 22 (IBM; Armonk, Nueva York, Estados Unidos). Las variables cuantitativas se expresaron como medias, IC y desviaciones estándar, mientras que las categóricas se expresaron como frecuencias absolutas y porcentajes. Las variables continuas se compararon por medio de la prueba t de Student y las categóricas mediante la prueba χ2 test y el test exacto de Fisher. El nivel de significación estadística se estableció en p < 0,05. Las prevalencias puntuales se presentan como porcentajes con sus intervalos de confianza correspondientes. Los datos se analizaron con el software Stata 12 (Stata Corporation; College Station, Tejas, Estados Unidos).
El Comité Ético del País Vasco aprobó el protocolo de estudio. Se obtuvo el consentimiento informado de los padres o tutores de los niños. El estudio fue promovido por la Red de Investigación de la Sociedad Española de Urgencias de Pediatría (RISEUP-SPERG).
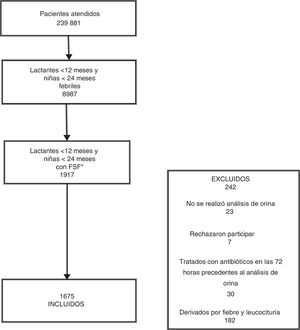
ResultadosDescripción de la muestra de estudioDurante el año de seguimiento, se registraron 239 881 episodios en las 7 SUP participantes, incluyendo 8987 (3,7%) en lactantes febriles menores de 12 meses y niñas febriles menores de 24 meses. En 1917 de estos casos, el paciente presentó con FSF superior a 39°C. La muestra final incluyó a 1675 niños menores de 24 meses. El flujo de los pacientes en el estudio se presenta en la figura 1.
La edad media de los 1675 niños incluidos en el estudio fue de 10 ± 5,5 meses, con una mediana de 9 meses (niños, 7 meses; niñas, 12 meses); 1086 eran niñas (64,8%). Un total de 1625 niños (97%) estaban previamente sanos, mientras que 42 (2,5%) tenían una enfermedad nefrourológica preexistente y 8 (0,5%) antecedentes personales de enfermedad no nefrourológica. Solo 20 pacientes (1,2%) presentaron con mal aspecto (5 [25%] se diagnosticaron de ITU). Las manifestaciones clínicas fueron fiebre aislada en 1107 casos (66%; mediana, 39,6°C; rango, 39,1°C a 41°C) y fiebre asociada a otro signo o síntoma en el resto (n = 568): vómitos (259; 15,4%), rechazo del alimento (127; 7,5%), irritabilidad (70; 4,1%), orina maloliente (6; 0,3%), dolor abdominal o en el costado (4; 0,2%) u otros (102; 6%). El tiempo de evolución de la fiebre fue de 24 horas o menos en 750 casos (44,8%).
Un total de 301 niños menores de 2 años (17,9%; 95% IC 16,2%-19,9%) recibió un diagnóstico inicial de ITU. Todos presentaron alteraciones en el análisis de orina, con resultados positivos para la esterasa leucocitaria (198; 65,7%); nitritos (13; 4,3%) o ambos (90; 29,9%). De todas las muestras de orina, solo 2 se obtuvieron mediante punción suprapúbica, y el resto mediante sondaje vesical. El urocultivo fue positivo en 279 niños, diagnosticándose ITU en 260 (15,5%; 95% IC, 13,8%-17,3%). En 19 pacientes con urocultivo positivo, los resultados del análisis de orina habían sido normales.
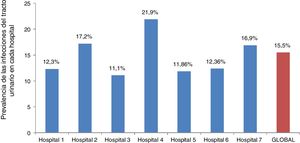
Prevalencia puntual de ITULa prevalencia de ITU fue del 15,7% (95% IC, 13,1-18,9) en el subgrupo de lactantes febriles menores de 12 meses y del 15,37% (95% IC 13,3-17,6) en el subgrupo de niñas febriles menores de 24 meses. La tabla 1 resume la prevalencia de ITU por edad y sexo. La prevalencia de ITU fue del 15% (95% IC, 13,4-16,9) en niños previamente sanos en comparación con 33,3% (95% IC, 20,9-48,5) en niños febriles con enfermedad nefrourológica preexistente (P = 0.002). La tabla 2 presenta la prevalencia puntual de ITU en los niños según la duración de la fiebre, y la figura 2 la prevalencia puntual en cada hospital.
Prevalencia puntual de las infecciones del tracto urinario (ITU) en niños menores de 2 años estratificada por edad y sexo
| Edad en meses | Niños | Niñas | |||
|---|---|---|---|---|---|
| n | ITU | n | ITU | p | |
| 0-3 | 60 | 26 | 35 | 8 | |
| 43,3% (31,5-55,9) | 22,8% (11,8-39,2) | 0,07 | |||
| 3-6 | 128 | 36 | 94 | 20 | |
| 28,1% (21-36,4) | 21,2% (14,1-30,6) | 0,31 | |||
| 6-12 | 401 | 31 | 404 | 75 | |
| 7,7% (5,4-10,7) | 18,5% (15-22,6) | < 0,001 | |||
| 12-18 | - | - | 331 | 37 | |
| 11,1% (8,1-15) | - | ||||
| 18-24 | - | - | 222 | 27 | |
| 12,1% (8,4-17,1) | - | ||||
Datos expresados como frecuencias absolutas (n) y porcentajes (%) con intervalos de confianza del 95%.
Prevalencia puntual de las infecciones del tracto urinario (ITU) en en niños menores de 2 años febriles estratificada por la duración de la fiebre
| Edad | Fiebre < 24 horas | Fiebre > 24 horas | p | ||
|---|---|---|---|---|---|
| n | UTI | n | UTI | ||
| Total de niños | 751 | 98 | 924 | 162 | |
| 13% (10,8-15,6) | 17,5% (15,2-20,1) | 0,014 | |||
| < 12 meses | 523 | 84 | 599 | 112 | |
| 16% (13,1-19,4) | 18,6% (15,7-22) | 0,27 | |||
| > 12 meses | 228 | 14 | 325 | 50 | |
| 6,1% (3,6-10,1) | 15,3% (11,8-19,7) | 0,001 | |||
Datos expresados como frecuencias absolutas (n) y porcentajes (%) con intervalos de confianza del 95%.
El patógeno aislado con mayor frecuencia fue E. coli (256; 91%). Otros patógenos aislados en los pacientes fueron: especies de Enterococcus (8; 3%), K. pneumoniae (6; 2%), P. mirabilis (4; 1,4%), especies de Citrobacter (2; 1%), especies de Enterobacter (2; 1%) y especies de Pseudomonas (2; 1%). Hubo 8 casos de bacteriemia secundaria a ITU (todos asociados a E. coli), todos ellos en niños previamente sanos con apariencia normal.
Dos tercios de los niños diagnosticados de ITU (172; 66,2%) se manejaron en servicios ambulatorios. Casi un quinto de los niños menores de 2 años previamente sanos menores de 3 meses con resultados normales del análisis de orina diagnosticados de ITU fueron ingresados en planta (18,8%; 95% IC, 13,6-24,7). Nueve pacientes (5,2%) volvieron al SUP por persistencia de los síntomas; ninguno de ellos exhibió deterioro clínico, aunque 2 de ellos fueron ingresados.
DiscusiónEn el presente estudio prospectivo multicéntrico de niños menores de 2 años febriles evaluados por FSF superior a 39°C en 7 SUP, se encontró una prevalencia puntual de ITU del 15,5% superior a la reportada en estudios previos, especialmente en lactantes menores de 6 meses y lactantes menores de 12 meses. Una diferencia entre nuestro estudio y trabajos previos es que solo incluimos niños con fiebre alta. Otros patrones epidemiológicos, tales como diferencias en la prevalencia puntual según la edad, el sexo, las manifestaciones clínicas y los microorganismos aislados en urocultivo o hemocultivo, fueron similares a los descritos previamente en niños diagnosticados de ITU.
Varios estudios previos han analizado la prevalencia de ITU. Dichos estudios han reportado tasas globales de ITU en niños con FSF en base a la anamnesis y la exploración física de aproximadamente el 5%7,19,20. En una revisión con metaanálisis de 14 estudios, Shaikh et al.13. encontraron una prevalencia combinada de ITU ligeramente mayor del 7% (95% IC, 5,5–8,4) en niños febriles de ambos sexos menores de 24 años, con o sin síntomas adicionales de ITU. En varones, la prevalencia fue mayor en los 3 primeros meses de vida, con una tendencia descendiente a partir de esta edad, mientras que en niñas la prevalencia fue mayor en los 12 primeros meses9,13. Aunque las diferencias por sexo y por edad observadas en nuestro estudio fueron consistentes con los hallazgos de estudios epidemiológicos previos sobre las ITU, las prevalencias puntuales encontradas en cada grupo etario fueron superiores en comparación con las publicadas en la literatura8,21. Nuestro estudio encontró la prevalencia puntual más alta en los varones febriles menores de 3 meses, diagnosticándose ITU en el 43% de ellos. Nuestros hallazgos son consistentes con los de la serie de estudios realizados por Bachur21, Zorc et al.22, que encontraron que la fiebre alta (temperatura rectal > 39°C) y la ausencia de circuncisión estaban asociadas a un riesgo superior de ITU. La ausencia de circuncisión22 se ha identificado como un factor de riesgo significativo para el desarrollo de ITU y su impacto parece ser mayor en niños pequeños23–27. Aunque en nuestro estudio no documentamos el estado de circuncisión, debido a factores culturales la mayoría de la población que atendemos no está circuncidada, lo que podría explicar la alta prevalencia puntual registrada en niños menores de 2 años varones.
Estudios previos13 han propuesto criterios para la elaboración de reglas de predicción clínica que podrían ayudar a los médicos a seleccionar a los pacientes en los que se debería recoger muestras de orina para análisis o cultivo. Nuestros hallazgos sugieren que los clínicos han de evaluar la posibilidad de ITU rigurosamente en todos los lactantes menores de 12 meses y en todas las niñas menores de 24 meses con FSF superior a 39°C. Dadas las altas prevalencias puntuales objetivadas en nuestro estudio, sería razonable recoger una muestra de orina en niños menores de 2 años con FSF y temperaturas inferiores a 39°C. Es necesario considerar factores adicionales, tales como el sexo, el tiempo de evolución de la fiebre, los antecedentes de UTI o las enfermedades nefrourológicas preexistentes para excluir ITU en niños menores de 2 años febriles. La duración de la fiebre no se ha descrito en la literatura médica como un factor a considerar en el diagnóstico diferencial de ITU en niños menores de 2 años febriles manejados en urgencias. En el presente estudio, la prevalencia puntual de ITU fue mayor en niños con fiebre de mayor duración, especialmente aquellos mayores de un año. Aunque son necesarios estudios adicionales para confirmar esta asociación, consideramos que este factor debería ser tenido en cuenta en la evaluación de niños menores de 2 años febriles.
La definición de ITU en niños menores de 2 años febriles continúa siendo controvertida, y las diferencias entre las definiciones aplicadas podrían explicar la variabilidad de las prevalencias reportadas por distintos autores. En nuestro estudio, el diagnóstico de ITU se basó en los resultados cuantitativos del urocultivo así como en la presencia de piuria y/o bacteriuria. De este modo, nuestra definición de ITU es más restrictiva que la empleada en la mayoría de los estudios previos, que por lo general solo requerían un análisis de orina positivo7,8,10. Nuestro enfoque está en consonancia con la guía más reciente de la American Academy of Pediatrics, que define la ITU como el crecimiento de más de 50 000UFC/ml de una única bacteria en urocultivo asociado a resultados positivos de la tira reactiva o el examen microscópico de orina. Estos criterios reducen la probabilidad de sobrediagnóstico de ITU en niños menores de 2 años con bacteriuria asintomática o muestras contaminadas. En contraposición a las recomendaciones propuestas por la American Academy of Pediatrics con respecto a las ITU, pero en línea con otros autores14,18,28,29, optamos por aplicar un punto de corte prudencial de 10 000UFC/ml para considerar un urocultivo positivo con objeto de evitar el diagnóstico erróneo de casos reales de ITU. Hay factores, como por ejemplo ciertos métodos de recogida de muestras, que llevan a un recuento bacteriano bajo. Una proporción considerable de niños menores de 2 años con recuentos de entre 10 000 y 50 000UFC/ml en urocultivo y sin alteraciones en el análisis de orina pueden tener bacteriuria asintomática, por lo que consideramos los resultados del análisis de orina para intentar diferenciar la infección aguda y la bacteriuria asintomática en niños menores de 2 años con recuentos bacterianos bajos en urocultivo14,30,31.
Aunque urocultivo cuantitativo se considera el patrón oro para el diagnóstico de ITU, por desgracia este método suele requerir un período de hasta 48 horas para la obtención de resultados. El análisis de orina mediante tira reactiva es una opción más atractiva en el entorno de urgencias, ya que es más barato, rápido y fácil de realizar e interpretar que el análisis microscópico o el urocultivo. No obstante, el análisis de orina no puede sustituir al urocultivo para demostrar la presencia de ITU, y ha de emplearse en conjunción con el cultivo. Aunque el análisis de orina mediante tira reactiva permite obtener resultados con rapidez, se han planteado dudas con respecto a su uso en niños menores de 2 años32–34. En el presente estudio, 19 niños menores de 2 años con resultados positivos de urocultivos de muestras recogidas de forma estéril y sin piuria se clasificaron como posibles casos de ITU. Por lo tanto, estos pacientes no se incluyeron en el cálculo de la prevalencia global de ITU. En España todavía hay una heterogeneidad considerable en el manejo de pacientes con resultados normales del análisis mediante tira reactiva y urocultivo positivo. Algunos autores han propuesto que los pacientes sin alteraciones en el análisis de orina y con urocultivo positivo pueden tener bacteriuria asintomática y que la fiebre en estos pacientes podría deberse a una infección viral35. Una vez disponibles los resultados del urocultivo, el manejo de estos pacientes ha de individualizarse.
Nuestro estudio tiene varias limitaciones. En primer lugar, no alcanzamos el tamaño muestral calculado inicialmente para el grupo de niños menores de 2 años varones, aunque conseguimos reclutar al 85% del número requerido, por lo que es posible que los resultados sean representativos de la población total. En segundo lugar, al haber incluido exclusivamente a niños menores de 2 años con FSF superior a 39°C, puede que hayamos sobreestimado la prevalencia puntual de ITU en la población de niños menores de 2 años febriles. Aun así, consideramos que la prevalencia puntual de ITU descrita en nuestro estudio puede ser útil para los médicos de urgencias que emplean este punto de corte de manera rutinaria para excluir estas infecciones. En tercer lugar, el estudio no incluyó a todos los niños menores de 2 años con FSF superior a 39°C manejados en los hospitales participantes, ya que solo se necesitaba un mínimo del 80% del total para llevar a cabo el estudio. Es posible que nuestro estudio incluyese a pacientes con un riesgo mayor de contraer una ITU, lo que habría resultado en la sobreestimación de la prevalencia puntual de ITU. En cualquier caso, consideramos que la tasa de reclutamiento del 80% de los niños menores de 2 años que cumplían los criterios de inclusión minimizaría los efectos del sesgo muestral y que la alta prevalencia puntual encontrada en nuestro estudio sería atribuible a otros factores ya mencionados. Por último, si bien se aplicó una definición específica de FSF, esta es a fin de cuentas una definición subjetiva que, por tanto, puede variar entre distintos hospitales. Ello podría limitar la aplicabilidad de nuestros resultados a otros entornos de salud en los que se utilicen distintos criterios diagnósticos. En cualquier caso, cabe destacar que todas las prevalencias puntuales registradas en los distintos hospitales participantes fueron similares y próximas a la prevalencia global.
La prevalencia puntual encontrada en nuestro estudio en niños menores de 2 años con FSF de más de 39°C fue mayor en comparación con estudios previos sobre la prevalencia de ITU, especialmente en lactantes menores de 6 meses y niñas menores de 12 meses. Nuestros hallazgos sugieren que los clínicos han de realizar una evaluación detallada de ITU en todos los lactantes menores de 12 meses y las niñas menores de 24 meses con FSF de más de 39°C.
La prevalencia puntual en niños menores de 2 años menores de 12 meses fue mayor en las niñas. Por el contrario, en el grupo de menores de 3 meses, la prevalencia puntual en varones fue el doble de la observada en niñas de la misma edad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- •
Ana Isabel Fernández Lorente. Hospital Universitario Basurto.
- •
Laura Minguell Domingo. Hospital Universitari Arnau de Vilanova.
- •
María Amalia Pérez Sáez. Hospital Universitario Zumárraga.
- •
Mireya Orio Hernández. Hospital del Tajo.
- •
Verónica García González. Hospital Universitario Cabueñes.
- •
Victoria Trenchs Sainz de la Maza. Hospital Universitari Sant Joan de Deu.